2. 400016 重庆,重庆医科大学: 药学院,分子医学与肿瘤研究中心
2. Molecular Medicine and Cancer Research Centre, Chongqing Medical University, Chongqing, 400016, China
原发性肝细胞癌(hepatocellular carcinoma,HCC)是世界上发病率第六、病死率第四的癌症[1]。在亚洲有60%的HCC与乙型肝炎病毒(hepatitis B virus,HBV)有关,慢性感染HBV的患者发生HCC的风险比未感染患者高10~100倍[2]。乙型肝炎病毒X(hepatitis B virus X,HBx)作为HBV转录的重要蛋白,可以参与多种影响细胞周期、细胞凋亡和癌症进程的信号转导途径[3-4]。HBx在HCC的发生发展中起重要的作用,但其中的机制尚未清楚。
COX-2作为一种诱导酶,可被多种因子诱导表达,如促炎因子、生长因子以及多种促癌因子[5]。过表达的COX-2可以刺激癌细胞增殖、抑制凋亡、促进血管生成并增加转移能力,在肝癌的发生发展中扮演了重要的角色[6]。但HBx能否通过诱导COX-2过表达导致癌症尚不清楚。本课题组前期已经建立了可以表达HBx的肝前体细胞HBx-EGFP-14-19,并通过肝门静脉将细胞注射入小鼠体内,构建了可以长期稳定表达HBx的动物模型[7],在对其进行常规饲养360 d后发现部分小鼠有肝癌产生。据此,本研究拟通过监测HBx在致癌过程中COX-2及其下游因子VEGF不同时期表达的变化,为进一步说明HBx基因在肝癌发生发展过程中的生物学作用机制和寻找合适的抗癌药物靶点奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 细胞与小鼠永生化小鼠肝前体细胞14-19由美国芝加哥大学分子肿瘤研究中心的馈赠。昆明(KM)小鼠来自于重庆医科大学动物实验中心,代养于无特殊病原体级代养室。
1.1.2 主要试剂无双抗DMEM高糖培养基购于HyClone公司;FBS牛胎血清购于CELL BOX公司;细胞培养用青-链霉素(双抗)购于碧云天公司;总RNA提取试剂盒购于北京康为世纪公司;反转录试剂盒购于Vazyme公司;SYBR实时荧光定量试剂盒购于Bimake公司;BCA试剂盒购于碧云天公司;HBx抗体购于Abcam公司;GAPDH抗体和Cox-2抗体购于Cell Signaling Technology公司;VEGF抗体购于博奥森公司;Bax抗体购于Bioworld公司;BAD抗体、Bcl-2抗体购于Abways公司;CDK4抗体和CyclinD1抗体购于万类生物科技有限公司;脱脂奶粉购于BD公司;SDS-PAGE凝胶配置试剂盒购于雅酶公司;ECL显影液购于Advansta公司;Celecoxib购于MCE公司。
1.2 方法 1.2.1 细胞复苏及培养将储存于液氮中的小鼠肝前体细胞14-19、EGFP-14-19和HBx-EGFP-14-19细胞取出并复苏于含有10%血清和1%双抗的DMEM高糖培养基中,置于37 ℃,5% CO2的培养箱中培养,待细胞长至80%以上,进行传代、冻存以及后续实验。
1.2.2 动物模型的构建及分组将45只KM小鼠[雄性,体质量(20±2)g]随机分成3组(n=15):生理盐水组,EGFP-14-19组及HBx-EGFP-14-19组。小鼠于术前1 d断水断食,麻醉小鼠后用酒精将其腹部消毒,剑突下2 cm剪一条纵向小口使肝脏暴露,找到肝门静脉,轻挑起并用血管夹夹闭远端,于近端分别将200 μL生理盐水、EGFP-14-19和HBx-EGFP-14-19细胞悬液(5×105细胞悬浮于200 μL PBS中)缓慢注入,待完全止血后缝合腹腔。术后于30、90、180、360 d处死小鼠,收取肝脏组织,一部分放于液氮冻存,一部分浸泡于4%多聚甲醛中。
另取15只KM小鼠,从肝门静脉注射200 μL HBx-EGFP-14-19细胞悬液(5×105细胞悬浮于200 μL PBS中),于术后180 d利用随机法将小鼠分成3组(n=5):空白对照组,羧甲基纤维素钠(CMC-Na)组以及Celecoxib组。采用灌胃的方法给予空白对照组0.9 mL生理盐水,给予CMC-Na组0.9 mL 10% CMC-Na,给予Celecoxib组0.9 mLCox-2选择性抑制剂Celecoxib(60 mg/kg溶于10%CMC-Na),1次/d,共给药10 d,于末次给药48 h后处死,收取肝脏组织。
1.2.3 免疫组化将新鲜肝脏组织浸泡于4%多聚甲醛48 h固定后,石蜡包埋切片。按照S-P说明书操作,于200倍光镜下观察并拍照。
1.2.4 HE染色组织切片脱蜡后进行常规染色,用中性树脂封片,于200倍光镜下采集图片。
1.2.5 反转录-聚合酶链反应(RT-qPCR)用总RNA提取试剂盒收取各细胞株及小鼠肝脏组织的RNA,按照反转录试剂盒说明逆转RNA成cDNA并稀释10倍。采用10 μL SYBR Green体系配制检测液,每组各3孔,实验至少重复3遍。引物序列见表 1。采用2-△△Ct法计算目标基因的相对表达量。
| 基因 | 序列 |
| GAPDH | 上游:5′-TGACCTCAACTACATGGTCTACA-3′ |
| 下游:5′-CTTCCCATTCTCGGCCTTG-3′ | |
| HBx | 上游:5′-CCCAACTCCTCGTTCACGGTGGTCTC-3′ |
| 下游:5′-GAGACCACCGTGAACGAGGAGTTGGG-3′ | |
| COX-2 | 上游:5′-CAATGGGCTGGAAGACATATCA-3′ |
| 下游:5′-GCCAGGGCTGAACTTCGAA-3′ | |
| VEGF | 上游:5′-CTCGCAGTCCGAGCCGGAGA-3′ |
| 下游:5′-GCAGCCTGGGACCACTTGGC-3′ | |
| Bad | 上游:5′-CTCCGAAGGATGAGCGATGAG-3′ |
| 下游:5′-CTCCTTGTCTACGCTTTCCAC-3′ | |
| Bax | 上游:5′-TGCAGAGGATGATTGCTGAC-3′ |
| 下游:5′GAGGAVTCCAGCCACAAAGA-3′ | |
| Bcl-2 | 上游:5′-ATCTCCCTGTTGACGCTCT-3′ |
| 下游:5′-CATCT-TCTCCTTCCAGCCT-3′ | |
| Cyclin D1 | 上游:5′-GCGTACCCTGACACCAATCTC-3′ |
| 下游:5′-ACTTGAAGTAAGATACGGAGGGC-3′ | |
| CDK4 | 上游:5′-TCAGCACAGTTCGTGAGGTG-3′ |
| 下游:5′-TCCATCAGCCGTACAACATTG-3′ |
1.2.6 蛋白质印记实验(Western blot)
取适量小鼠肝脏组织置于液氮中碾碎,加入预混合好的裂解液(RIPA ∶PMSF ∶磷酸酶抑制剂=100 ∶1 ∶2),细胞则直接加入预混合好的裂解液,都于冰上裂解30 min,每10 min混匀1次,使其充分裂解,4 ℃,12 000 r/min离心10 min取上清,用BCA试剂盒测得蛋白浓度后按照1 ∶4的比例加入蛋白上样缓冲液,100 ℃煮15 min使之充分变性。10% SDS-PAGE凝胶电泳至胶底部后,250 mA将蛋白转印至PVDF膜上,脱脂奶粉封闭2 h后洗涤孵育一抗(4 ℃过夜),然后洗涤孵育二抗(室温2 h),再使用ECL显影液显影。
1.3 统计学分析采用SPSS 21.0统计软件,数据以x±s表示,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 细胞株中HBx鉴定Western blot和RT-qPCR结果显示HBx仅在HBx-EGFP-14-19细胞中呈特异性表达(P < 0.01,图 1),而在14-19以及EGFP-14-19细胞中则无表达。表明HBx在细胞内转染成功,且可以长期表达。
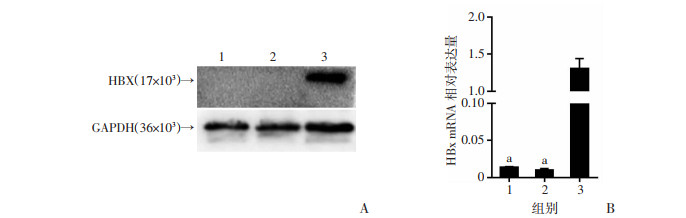
|
| A: Western blot检测细胞中HBx的蛋白表达; B: RT-qPCR检测3种细胞HBx mRNA的表达(n=3,x±s);1: 14-19细胞组; 2: EGFP-14-19细胞组; 3: HBx-EGFP-14-19细胞组; a: P < 0.01,与HBx-EGFP-14-19细胞组比较 图 1 肝前体细胞株中HBx的鉴定 |
2.2 小鼠肝脏中HBx的鉴定
为了验证动物模型是否建立成功,利用Western blot检测小鼠肝脏组织中HBx的表达,结果显示与生理盐水、EGFP-14-19组相比,HBx-EGFP-14-19组小鼠在30、90、180和360 d均有HBx表达(图 2A)。RT-qPCR结果与Western blot结果一致(P < 0.01,图 2B)。利用免疫组化法检测小鼠肝脏组织中HBx蛋白的表达,结果显示HBx-EGFP-14-19组小鼠肝脏组织30、90、180、360 d均见HBx的阳性染色(图 2C),而生理盐水、EGFP-14-19组小鼠则无阳性染色。以上结果表明HBx可在小鼠肝脏组织中长期稳定表达,动物模型构建成功。
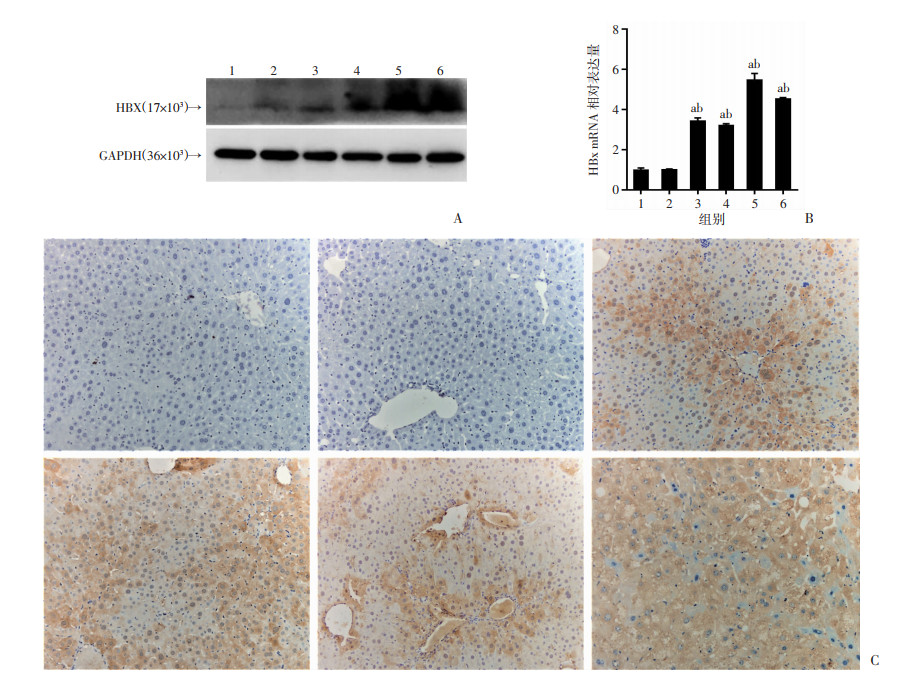
|
| A: Western blot检测各组小鼠肝脏组织HBx的蛋白表达; B: RT-qPCR检测各组小鼠肝脏组织HBx mRNA的表达(n=3,x±s);C: 免疫组化法(S-P)检测小鼠肝脏组织HBx蛋白的表达;1:生理盐水组; 2: EGFP-14-19组; 3~6: 分别为30、90、180、360 d的HBx-EGFP-14-19组; a: P < 0.01,与生理盐水组比较;b: P < 0.01,与EGFP-14-19组比较 图 2 小鼠肝脏组织中HBx的鉴定 |
2.3 小鼠肝脏组织肿瘤的鉴定
在处死360 d HBx-EGFP-14-19小鼠时发现有部分小鼠肝脏组织表面有肿瘤生成,可见结节状肿块突起于肝脏组织表面(图 3A),行HE染色在镜下观察,发现与正常肝组织相比,肿瘤组织的肝小叶结构消失,细胞异型性明显,癌细胞分化程度高(图 3B、C)。
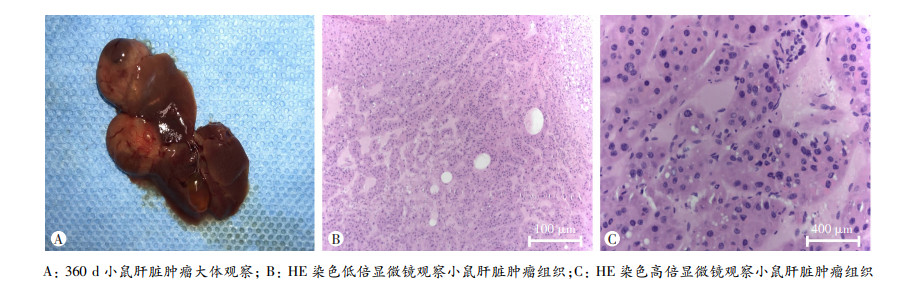
|
| A: 360 d小鼠肝脏肿瘤大体观察; B: HE染色低倍显微镜观察小鼠肝脏肿瘤组织;C: HE染色高倍显微镜观察小鼠肝脏肿瘤组织 图 3 小鼠肝脏组织肿瘤的鉴定结果 |
2.4 HBx对小鼠肝脏细胞凋亡周期的影响
取180 d HBx-EGFP-14-19小鼠肝脏组织,利用Western blot检测凋亡和周期相关因子的表达,结果显示与生理盐水、EGFP-14-19组相比,180 dHBx-EGFP-14-19小鼠的肝脏组织促凋亡因子Bax和Bad的表达水平降低,而抗凋亡因子Bcl-2表达水平升高(图 4A);细胞周期因子CyclinD1和CDK4的表达水平增加(图 4B),mRNA表达水平与Western blot表达水平一致(图 4C~G,P < 0.05)。表明HBx可抑制小鼠肝脏细胞凋亡并加速细胞周期进程。
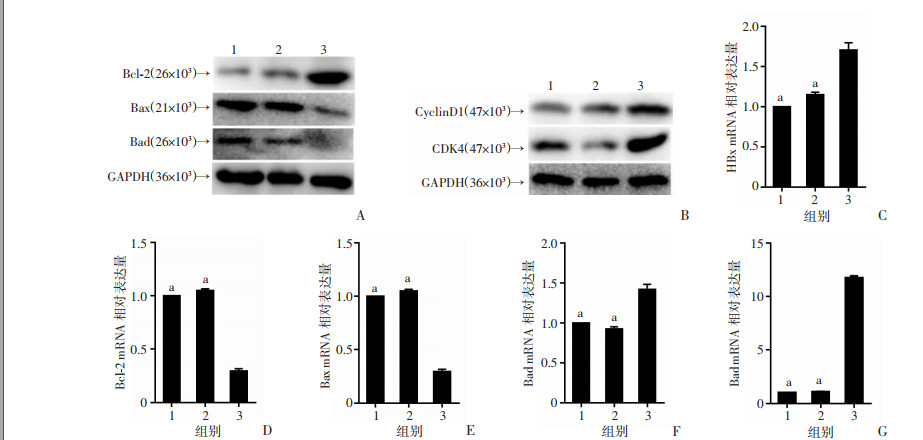
|
| A: Western blot检测小鼠肝脏细胞中Bcl-2、Bax和Bad的蛋白表达;B: Western blot检测小鼠肝脏细胞中CyclinD1和CDK4的蛋白表达;C~G分别为RT-qPCR法检测小鼠肝脏细胞中Bcl-2、Bax、Bad、CyclinD1和CDK4 mRNA的表达;1: 生理盐水组; 2: EGFP-14-19组; 3: HBx-EGFP-14-19-180d组; a: P < 0.01,与HBx-EGFP-14-19-180 d组比较 图 4 HBx对小鼠肝脏细胞凋亡周期的影响(n=3,x±s) |
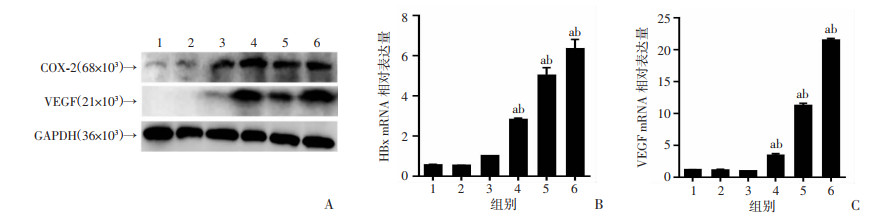
2.5 小鼠感染HBx后不同时期COX-2以及VEGF的表达情况
Western blot检测小鼠感染HBx后30、90、180和360 d COX-2及VEGF蛋白质的表达,结果显示小鼠感染HBx后COX-2和VEGF的表达量持续增高(图 5A),mRNA表达水平与蛋白质一致(P < 0.01,图 5B、C)。表明HBx在体内可长期激活COX-2及其下游因子VEGF。
|
| A: Western blot检测COX-2及VEGF的蛋白表达; B、C: 分别为小鼠肝脏组织中COX-2、VEGF mRNA的表达;1: 生理盐水组; 2: EGFP-14-19组; 3~6: 分别为30、90、180、360 d的HBx-EGFP-14-19组; a: P < 0.01,与生理盐水组比较;b: P < 0.01, 与EGFP-14-19组比较 图 5 小鼠感染HBx后不同时期COX-2及VEGF的表达(n=3,x±s) |
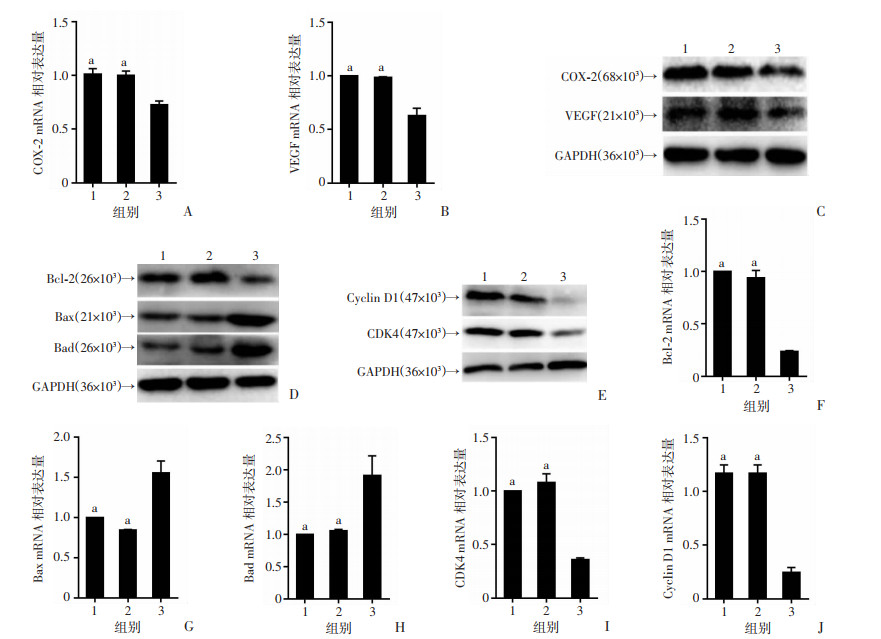
2.6 COX-2选择性抑制剂Celecoxib对小鼠肝脏组织凋亡以及周期因子的影响
为进一步探讨HBx抑制小鼠肝脏组织凋亡及加速周期进程和COX-2之间的关系,给予180 d HBx-EGFP-14-19组小鼠COX-2抑制剂Celecoxib,对照组给予生理盐水或10% CMC-Na。结果表明Celecoxib组COX-2及VEGF mRNA与蛋白的表达均显著下降(P < 0.05,图 6A~C);Western blot结果表明与生理盐水组和CMC-Na相比,celecoxib组促凋亡因子Bax和Bad蛋白表达水平上升,抗凋亡因子Bcl-2蛋白表达水平降低(图 6D);细胞周期因子Cyclin D1和CDK4的蛋白表达水平下降(图 6E),RT-qPCR结果与Western blot结果一致(P < 0.01,图 6F~J)。
|
| A、B分别为RT-qPCR检测给予小鼠Celecoxib后肝脏中COX-2、VEGF mRNA的表达;C: Western blot检测给予小鼠Celecoxib后肝脏中COX-2、VEGF的蛋白表达;D、E分别为Western blot检测给予小鼠Celecoxib后肝脏中Bcl-2、Bax、Bad、CDK4和cyclinD1的蛋白表达;F~G分别为RT-qPCR检测给与小鼠Celecoxib后肝脏中Bcl-2、Bax、Bad、CDK4和cyclinD1的mRNA表达1:HBx-180 d-空白对照组; 2: HBx-180 d-CMC-Na组:3: HBx-180 d-Celecoxib组; a: P < 0.01,与HBx-180 d-Celecoxib组比较 图 6 COX-2选择性抑制剂Celecoxib对小鼠肝脏组织凋亡以及周期因子的影响(n=3,x±s) |
3 讨论
HBx被认为是一种病毒复制所必需的高度保守的多功能蛋白[8],参与了细胞存活、细胞周期进程、DNA修复、蛋白降解以及多种信号通路的调节[9],其通过破坏宿主细胞的正常生理机制来促进肝癌的发生[10]。但HBx导致肝癌的作用机制尚不明确。
近年来对于HBx的研究多在癌细胞或转基因小鼠上进行,本研究将转染了HBx的细胞通过肝门静脉注射进KM小鼠体内,建立了可以长期稳定表达HBx且具有正常免疫系统的动物模型,并在无其他因素影响下生成肿瘤,相比于癌细胞或转基因HBx小鼠,本研究的动物模型更加接近自然的感染状态,在此动物模型上我们可以观察HBx在体内致癌不同时期的作用。
COX-2作为一种诱导酶,是合成前列腺素的关键酶[11-12]。大多数组织不表达COX-2,它是对炎症因子、生长因子、血管生长因子和肿瘤启动子的应答而诱导产生的,在致癌和癌症发展过程中起重要作用[13-15]。研究表明COX-2在多种癌症中高表达,例如结肠癌[16]、乳腺癌[17]、肺癌[18]等,而降低COX-2的表达则可以抑制肿瘤的发生发展[19]。有研究显示COX-2可以通过EP2和Wnt/β-catenin信号通路传导激活YAP及其下游因子,磷酸化AKT来加速肝癌细胞增长;COX-2还可以通过磷酸化AKT和ERK促进HCC细胞的迁移和侵袭。但COX-2抑制剂塞布来昔可逆转COX-2对YAP、AKT以及ERK的作用,抑制肝细胞的增殖、迁移和侵袭,阻止HCC的形成[20-22]。诱发新血管形成或增加血管生成能力是恶性肿瘤的关键标志,血管内皮生长因子VEGF是最被认可的血管生成刺激剂之一,可促进肿瘤生长[21]。有研究表明COX-2可促进VEGF的表达,是血管生成环境的重要调节剂[22-23],抑制COX-2可抑制血管的生成[24]。可见COX-2在肝癌的发生发展中起重要作用。刘凯歌等[25]在HBx阳性患者以及转染了HBx的肝癌细胞中发现COX-2表达增加;CHENG等[26]发现转染了HBx的肝癌细胞可以激活COX-2的转录;这些结果也证明了HBx可以激活COX-2的表达,为HBx致癌机制提供了新的思路。
本研究结果显示,HBx在体内可使COX-2的表达增加,使小鼠肝脏组织细胞凋亡被抑制,周期进程被加速,在给予COX-2选择性抑制剂塞来昔布后,HBx对小鼠肝脏细胞凋亡和周期的影响被逆转,这些结果说明在HBx致癌的过程中可能通过上调COX-2的表达来抑制细胞凋亡,加速细胞进程,从而导致HCC的发生;结果还表明小鼠肝脏组织中VEGF的表达增加,使用塞来昔布后VEGF的表达降低,这一结果说明HBx可通过COX-2上调VEGF的表达,从而促进血管的生成,为癌细胞的发生发展提供条件;以上结果揭示了在HBx导致肝癌的发生发展过程中,通过异常过表达COX-2参与到细胞凋亡以及血管生成中。近年来有研究证明COX-2抑制剂有降低癌症发生的作用[20-24],所以抑制COX-2的过表达可作为早期治疗肝癌的药物靶点。本研究为进一步了解HBx的生物学功能提供了实验依据,为诊断早期肝癌提供了新的思路,也为今后治疗HBV相关肝癌提供了新的策略。
| [1] |
GIANNINI E G, AGLITTI A, BORZIO M, et al. Overview of immune checkpoint inhibitors therapy for hepatocellular carcinoma, and the ITA.LI.CA cohort derived estimate of amenability rate to immune checkpoint inhibitors in clinical practice[J]. Cancers (Basel), 2019, 11(11): E1689. DOI:10.3390/cancers11111689 |
| [2] |
OMATA M, CHENG A L, KOKUDO N, et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update[J]. Hepatol Int, 2017, 11(4): 317-370. |
| [3] |
YEN C J, YANG S T, CHEN R Y, et al. Hepatitis B virus X protein (HBx) enhances centrosomal P4.1-associated protein (CPAP) expression to promote hepatocarcinogenesis[J]. J Biomed Sci, 2019, 26(1): 44. DOI:10.1186/s12929-019-0534-9 |
| [4] |
LING L R, ZHENG D H, ZHANG Z Y, et al. Effect of HBx on inflammation and mitochondrial oxidative stress in mouse hepatocytes[J]. Oncol Lett, 2020, 19(4): 2861-2869. DOI:10.3892/ol.2020.11404 |
| [5] |
刘晨晨, 张振玉. COX-2与肝癌的关系研究进展[J]. 胃肠病学和肝病学杂志, 2015, 24(9): 1039-1042. LIU C C, ZHANG Z Y. Relationship between COX-2 and hepatocellular carcinoma[J]. Chin J Gastroenterol Hepatol, 2015, 24(9): 1039-1042. DOI:10.3969/j.issn.1006-5709.2015.09.002 |
| [6] |
DESAI S J, PRICKRIL B, RASOOLY A. Mechanisms of phytonutrient modulation of cyclooxygenase-2 (COX-2) and inflammation related to cancer[J]. Nutr Cancer, 2018, 70(3): 350-375. DOI:10.1080/01635581.2018.1446091 |
| [7] |
刘梦楠, 张婷, 刘洁, 等. 感染HBVx的肝前体细胞的小鼠体内稳定表达模型构建[J]. 基因组学与应用生物学, 2017, 36(4): 1318-1324. LIU M N, ZHANG T, LIU J, et al. Construction of stable expression model for hepatic progenitor cells infected with HBVx in mice[J]. Genom Appl Biol, 2017, 36(4): 1318-1324. DOI:10.13417/j.gab.036.001318 |
| [8] |
YANG M H, CHEN M, MO H H, et al. Utilizing experimental mouse model to identify effectors of hepatocellular carcinoma induced by HBx antigen[J]. Cancers, 2020, 12(2): 409. DOI:10.3390/cancers12020409 |
| [9] |
LI Y, JIANG M J, LI M S, et al. Compound Phyllanthus urinaria L inhibits HBV-related HCC through HBx-SHH pathway axis inactivation[J]. Evid-Based Compl Alt, 2019, 2019: 1635837. DOI:10.1155/2019/1635837 |
| [10] |
TIAN Y, YANG W, SONG J, et al. Hepatitis B virus X protein-induced aberrant epigenetic modifications contributing to human hepatocellular carcinoma pathogenesis[J]. Mol Cell Biol, 2013, 33(15): 2810-2816. DOI:10.1128/mcb.00205-13 |
| [11] |
LU S C, ZHONG J H, TAN J T, et al. Association between COX-2 gene polymorphisms and risk of hepatocellular carcinoma development: a meta-analysis[J]. BMJ Open, 2015, 5(10): e008263. DOI:10.1136/bmjopen-2015-008263 |
| [12] |
谢华红, 张勇. 环加氧酶2(COX-2)在乙型肝炎病毒相关性肝癌组织中高表达且与乙型肝炎病毒X(HBx)蛋白表达呈正相关[J]. 细胞与分子免疫学杂志, 2018, 34(10): 919-923. XIE H H, ZHANG Y. COX-2 was highly expressed in hepatitis B virus associated hepatocellular carcinoma, and was positively correlated with the expression of hepatitis B virus X (HBx) protein[J]. Chin J Cell Mol Immunol, 2018, 34(10): 919-923. DOI:10.13423/j.cnki.cjcmi.008692 |
| [13] |
DESAI S J, PRICKRIL B, RASOOLY A. Mechanisms of phytonutrient modulation of cyclooxygenase-2 (COX-2) and inflammation related to cancer[J]. Nutr Cancer, 2018, 70(3): 350-375. DOI:10.1080/01635581.2018.1446091 |
| [14] |
ZHANG Z F, ZHENG F F, YU Z L, et al. XRCC5 cooperates with p300 to promote cyclooxygenase-2 expression and tumor growth in colon cancers[J]. PLoS ONE, 2017, 12(10): e0186900. DOI:10.1371/journal.pone.0186900 |
| [15] |
PUNGANURU S R, MADALA H R, MIKELIS C M, et al. Conception, synthesis, and characterization of a rofecoxib-combretastatin hybrid drug with potent cyclooxygenase-2 (COX-2) inhibiting and microtubule disrupting activities in colon cancer cell culture and xenograft models[J]. Oncotarget, 2018, 9(40): 26109-26129. DOI:10.18632/oncotarget.25450 |
| [16] |
XU F, LI M X, ZHANG C, et al. Clinicopathological and prognostic significance of COX-2 immunohistochemical expression in breast cancer: a meta-analysis[J]. Oncotarget, 2017, 8(4): 6003-6012. DOI:10.18632/oncotarget.13990 |
| [17] |
YOKOUCHI H, KANAZAWA K. Revisiting the role of COX-2 inhibitor for non-small cell lung cancer[J]. Transl Lung Cancer Res, 2015, 4(5): 660-664. DOI:10.3978/j.issn.2218-6751.2015.04.03 |
| [18] |
NASRY W, RODRIGUEZ-LECOMPTE J, MARTIN C. Role of COX-2/PGE2 mediated inflammation in oral squamous cell carcinoma[J]. Cancers, 2018, 10(10): 348. DOI:10.3390/cancers10100348 |
| [19] |
XU G, WANG Y, LI W, et al. COX-2 forms regulatory loop with YAP to promote proliferation and tumorigenesis of hepatocellular carcinoma cells[J]. Neoplasia, 2018, 20(4): 324-334. DOI:10.1016/j.neo.2017.12.004 |
| [20] |
LENG J, HAN C, DEMETRIS A J, et al. Cyclooxygenase-2 promotes hepatocellular carcinoma cell growth through Akt activation: evidence for Akt inhibition in celecoxib-induced apoptosis[J]. Hepatology, 2003, 38(3): 756-768. DOI:10.1053/jhep.2003.50380 |
| [21] |
TAI Y, ZHANG L H, GAO J H, et al. Suppressing growth and invasion of human hepatocellular carcinoma cells by celecoxib through inhibition of cyclooxygenase-2[J]. Cancer Manag Res, 2019, 11: 2831-2848. DOI:10.2147/cmar.s183376 |
| [22] |
PENG Y L, WANG Y, TANG N, et al. Andrographolide inhibits breast cancer through suppressing COX-2 expression and angiogenesis via inactivation of p300 signaling and VEGF pathway[J]. J Exp Clin Cancer Res, 2018, 37(1): 248. DOI:10.1186/s13046-018-0926-9 |
| [23] |
GUNGOR H, ILHAN N, EROKSUZ H. The effectiveness of cyclooxygenase-2 inhibitors and evaluation of angiogenesis in the model of experimental colorectal cancer[J]. Biomed Pharmacother, 2018, 102: 221-229. DOI:10.1016/j.biopha.2018.03.066 |
| [24] |
XU L, STEVENS J, HILTON M B, et al. COX-2 inhibition potentiates antiangiogenic cancer therapy and prevents metastasis in preclinical models[J]. Sci Transl Med, 2014, 6(242): 242ra84. DOI:10.1126/scitranslmed.3008455 |
| [25] |
刘凯歌, 邵小莉, 谢华红, 等. 乙型肝炎病毒X蛋白和环氧合酶-2与乙型肝炎相关肝癌微血管生成和转移的关系及其可能机制[J]. 中华肝脏病杂志, 2010, 18(11): 831-836. LIU K G, SHAO X L, XIE H H, et al. The expression of hepatitis B virus X protein and cyclooxygenase-2 in hepatitis B virus-related hepatocellular carcinoma: correlation with microangiogenesis and metastasis, and what is the possible mechanism[J]. Chin J Hepatol, 2010, 18(11): 831-836. DOI:10.3760/cma.j.issn.1007-3418.2010.11.010 |
| [26] |
CHENG A S L, YU J, LAI P B S, et al. COX-2 mediates hepatitis B virus X protein abrogation of p53-induced apoptosis[J]. Biochem Biophys Res Commun, 2008, 374(2): 175-180. DOI:10.1016/j.bbrc.2008.06.098 |




