2. 400016 重庆,重庆医科大学: 附属第一医院呼吸与危重症医学科
2. Department of Respiratory and Critical Care Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
结核病是一种由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起的高度传染性慢性疾病,仍是世界范围内的一个重大公共卫生问题[1]。目前,临床上对于结核病的治疗有效率仅为55%,其中耐药菌株不断增多、细菌生物被膜形成是临床治疗进展缓慢的主要原因[2-4]。生物被膜由胞外基质和微菌落共同组成,其表面含有密集的孔隙和通道,以此促进营养物质在膜内的分布和传递。除此之外,生物被膜还可以避免MTB因外界刺激受到损伤,是MTB长期栖居的场所,也是导致结核病治疗周期长的原因之一。
左氧氟沙星(levofloxacin,LVFX)是临床上广泛使用的广谱、高效的抗感染药物,也是结核病治疗的二线药物[5]。然而,LVFX广泛入血会对机体产生不同程度的毒副反应。聚乳酸羟基乙酸(PLGA)是由乳酸和羟基乙酸聚合而成的高分子材料,因其生物相容性、可降解性等特性在药物递送领域得到了广泛应用。已有研究报道低频低强度超声(low frequency and low intensity ultrasound,LFLIU)联合载药纳米粒处理细菌及其生物被膜,可有效杀菌并破坏生物被膜结构,达到治疗细菌感染目的[6-9]。
MTB的生长极其缓慢,且具有高度传染性,实验研究要求条件高。卡介苗(Bacille Calmette-Guerin, BCG)与MTB具有相似的生长特性与细胞壁结构,其细胞膜表面均富含脂阿拉伯甘露聚糖(ManLAM)成分[10]。因此,BCG常被选作研究MTB特性的生物模式菌。
本实验通过制备载左氧氟沙星PLGA-PEG纳米粒,以BCG为研究对象,建立成熟BCG生物被膜模型,探讨LFLIU联合LVFX-NPs对生物被膜的损伤效果,为临床结核病的治疗提供新的参考依据。
1 材料与方法 1.1 材料 1.1.1 菌株BCG(批次号:S20013057)购自成都生物产品研究所。
1.1.2 主要试剂与仪器7H9肉汤培养基,EDC/NHS,OADC增菌液,吐温-80,甘油,左氧氟沙星,结晶紫,细胞膜红色荧光探针(DiI),Calcofluor White Stain(CFW),甲基四氮盐(XTT),甲萘醌,死活菌染料SYTO9 /PI,上述试剂均购自美国Sigma公司;聚乳酸-羟基乙酸共聚物聚乙二醇羧基(PLGA-PEG-COOH),购自济南岱罡生物科技有限公司;紫外分光光度计(UV-2600 SHIMADZU,日本);马尔文激光粒度仪(Zeta SIZER 3000HS,美国);低频低强度超声设备(频率:42 kHz,换能器直径:45 mm,重庆);激光共聚焦显微镜(Nikon,日本);流式细胞仪(Beckman Coulter, 美国)。
1.2 方法 1.2.1 BCG生物被膜模型建立根据将冻存的BCG菌液接种于含10% OADC增菌液,0.2%甘油及0.05% 吐温-80的7H9肉汤培养基中,置于37 ℃摇床中以180 r/min的转速培养3周至BCG菌液的OD600=1.0后,离心收集菌体,用单纯7H9培养基重悬。取重悬后的BCG菌液,按1 ∶100比例用7H9培养基稀释后加至6孔板中(每孔6 mL菌液),放置37 ℃恒温孵箱中静置培养12 d形成成熟生物被膜[11]。
1.2.2 LVFX-NPs的制备及其物理特性采用改良的双乳化法制备载左氧氟沙星纳米粒(LVFX-NPs),具体步骤如下[12]:首先,称取40 mg PLGA-PEG-COOH,溶于2 mL三氯甲烷中,40 ℃加热15 min后加入200 μL LVFX溶液,冰浴条件下利用超声(100 W)乳化2 min(5,5 s)后加入4% PVA溶液,再次用超声(100 W)辐照5 min(5,5s)形成复乳,加入8 mL 2%异丙醇溶液。然后,室温条件下将复乳用磁力搅拌器(150 r/min)搅拌2 h至有机溶剂完全挥发。离心,清洗,收集LVFX-NPs。最后,用PBS吹散LVFX-NPs沉淀,放入低温冷冻真空干燥机中干燥36 h,4 ℃冰箱保存备用。其中,将LVFX溶液换成DiI溶液,其他步骤不变,即可获得红色荧光标记的PLGA-PEG纳米粒(DiI-NPs)。
取少量纳米粒加蒸馏水稀释,用显微镜观察纳米粒形态,马尔文激光粒度仪检测其粒径及Zeta电位,并用下列公式计算纳米粒的载药率(DL)和包封率(EE)。
DL=(纳米粒中LVFX含量/载LVFX纳米粒总量)×100%
EE=(纳米粒中LVFX量/LVFX总投入量)×100%
1.2.3 超声辐照LVFX-NPs称取20 mg LVFX-NPs溶于3 mL PBS中,用声强为0.67 W/cm2 的超声(Ultrasound, US)辐照5 min后,将样品转移至透析袋中,将透析袋放至含25 mL PBS的烧杯中,在37 ℃条件下以100 r/min转速摇动烧杯使杯中溶液均匀。在预定的时间点(0、2、4、8、10、12、24、48、60、72 h)取出2 μL透析液,用紫外可见分光光度计在波长290 nm处测量LVFX的光密度值D(290)。累积LVFX释放量用下面公式进行计算。
LVFX累积释放量=(PBS溶液中LVFX量/LVFX-NPs中的LVFX总量)×100%
1.2.4 LVFX对BCG生物被膜的最低杀菌浓度(MBC)测定取100 μL稀释好的BCG菌液(D600=1.0)加至96孔板中,用封口胶将孔板密封防止菌液蒸发,放至37 ℃孵箱培养,12 d生物被膜形成后,加入用7H9培养基按照二倍稀释法稀释的LVFX溶液(0~512 μg/mL),每个浓度重复5孔,以不加药物的7H9培养基溶液作为阳性对照组,置于37 ℃恒温孵箱中培养24 h。24 h后,用XTT法测量LVFX抑制50% BCG生物被膜活性(MBC50)的最低药物浓度(即光密度值相对于阳性对照组下降50%以上的最低浓度)。
1.2.5 实验分组及辐照方式获得成熟BCG生物被膜后,分为6组:对照组(Control)、超声组(US)、LVFX组(LVFX)、载LVFX纳米粒组(LVFX-NPs)、超声联合LVFX组(US+LVFX)、超声联合载LVFX纳米粒组(US+LVFX-NPs),每组重复3个样本。用PBS轻轻洗去粘附在生物被膜表面的浮游菌,对照组加入1 mL PBS溶液,实验组按要求分别加入1 mL LVFX或LVFX-NPs溶液,其中LVFX浓度均为256 μg/mL。选用频率为42 kHz,强度为0.67 W/cm2的LFLIU对相应实验组辐照5 min,完成辐照后继续在37 ℃孵箱中培养24 h。
1.2.6 XTT及结晶紫染色检测生物被膜活性将不同方式处理后6孔板中的生物被膜反复吹散,移入96孔板中,再分别加入100 μL提前配制的XTT-甲萘醌溶液,37 ℃避光孵育2 h后,用酶标仪在490 nm测量其光密度值D(490),生物被膜的活性(%)等于实验组D490/对照组D490。
不同方式处理生物被膜之后,轻轻吸取上清液,每孔加入100 μL甲醇固定15 min,吸出甲醇后自然风干,再加入1% 结晶紫溶液染色10 min。然后,吸出结晶紫,用无菌PBS多次清洗至溶液无色,加入无水乙醇在37 ℃孵箱中溶解结晶紫,用酶标仪在570 nm处检测光密度值[13]。
1.2.7 SYTO9 /PI观察生物被膜损伤效果不同方式处理生物被膜后,用PBS轻轻冲洗,各加入100 μL荧光染料SYTO9/PI避光孵育30 min,其中SYTO9将生物被膜中的活菌标记为绿色荧光,而PI则能透过死菌呈红色荧光。30 min后,PBS轻轻洗去多余染料,激光共聚焦显微镜观察生物被膜损伤效果。
1.2.8 流式细胞仪检测细菌内活性氧(ROS)含量使用活性氧试剂盒(DCFH-DA)检测细菌内的活性氧含量,DCFH-DA本身不带荧光,可以自由穿过细胞膜,进入细胞膜后被脂酶水解为不能通过细胞膜的DCFH,而DCFH可以和细胞内ROS反应生成有荧光的DCF物质,通过检测DCF的荧光强度即可得到细胞内的ROS含量。根据1.2.5处理细菌生物被膜后,将不同组的生物被膜从孔板内吸出,分别加入DCFH-DA溶液(10 μmol/L),30 min后,用流式细胞仪检测荧光强度。
1.2.9 激光共聚焦显微镜观察超声对生物被膜的渗透作用将300 μL荧光DiI纳米粒(DiI-NPs,红色荧光)加至含成熟生物被膜的6孔板中,分为DiI-NPs和US+DiI-NPs组,US+DiI-NPs组用0.67 W/cm2的LFLIU辐照5 min,置于37 ℃孵箱中培养24 h,随后加入CFW荧光染料(蓝色荧光)标记生物被膜1 min,再用无菌PBS轻轻洗去多余染料及未渗透进的纳米粒。激光共聚焦显微镜以3 μm为间距逐层扫描生物被膜,分别观察DiI-NPs在生物被膜中的渗透情况,并用Image J软件进行红色荧光定量分析。
1.3 统计学分析采用SPSS 20.0统计学软件进行单因素方差分析,以x±s表示,检验水准α=0.05。
2 结果 2.1 制备了物理特性良好的LVFX-NPs共聚焦显微镜下可见制备的荧光纳米粒(DiI-NPs) 均匀分布(图 1A),电镜下LVFX-NPs形态呈球形,大小均一,分散度良好,未出现粘连、聚集现象(图 1B、C)。粒度仪检测得到LVFX-NPs粒径为(254.90±9.78)nm,电位为(-17.83±0.74)mV(图 1D、E)。通过紫外分光光度计检测LVFX-NPs中的LVFX含量,标准回归曲线方程为:y=0.003x+0.009 3,R2=0.997 3(其中y表示LVFX浓度,x表示吸光度),计算得出LVFX-NPs的载药率及包封率分别为(3.50±0.51)%、(67.00±2.69)%。
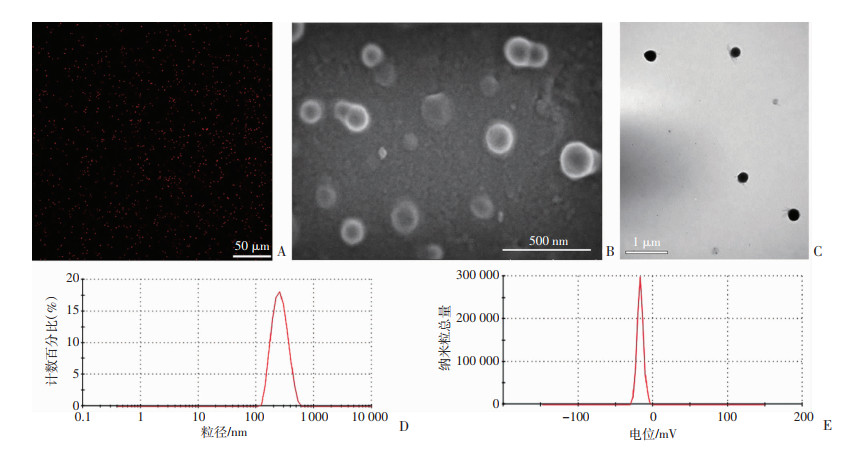
|
| A:激光共聚焦显微镜观察DiI-NPs(×400);B:扫描电镜观察LVFX-NPs;C:透射电镜观察LVFX-NPs;D:LVFX-NPs的粒径分布图;E:LVFX-NPs的电位分布 图 1 纳米粒的基本特性 |
2.2 LFLIU能有效促进LVFX-NPs内的LVFX释放
实验结果显示,经超声辐照后的LVFX-NPs释放的LVFX含量显著高于未经超声处理组,并在72 h后释放量趋于稳定(图 2)。72 h时,未经超声辐照的LVFX-NPs的药物释放量为43.03%,而超声辐照后LVFX-NPs的药物释放量为64.47%。结果显示超声可能破坏纳米粒外壳,促进药物释放,导致累积释放率增加。
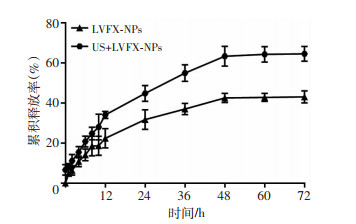
|
| 图 2 超声辐照前后LVFX-NPs中LVFX的释放曲线 |
2.3 LVFX对BCG生物被膜的MBC测定
采用XTT法测量LVFX抑制BCG生物被膜活性(MBC)的最低药物浓度,利用GraphPad Prism 5.0绘制拟合曲线。结果如图 3所示,可以发现BCG生物被膜的活性随着药物浓度增加而降低,其中MBC50=147.1 μg/mL,表明LVFX抑制50% BCG生物被膜活性的浓度为147.1 μg/mL。
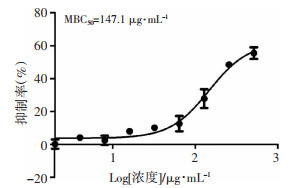
|
| 图 3 LVFX对BCG生物被膜的杀菌浓度测定 |
2.4 超声联合LVFX-NPs对生物被膜协同杀菌
不同方式处理生物被膜后的XTT检测结果如图 4A所示,与对照组相比,生物被膜经超声联合LVFX-NPs处理后的活性明显降低(P<0.05),同时超声联合载药纳米粒的BCG生物被膜活性低于US+LVFX组(P<0.05),证明了超声联合载药纳米粒杀菌的优越性。结晶紫染色结果与XTT检测结果相一致(图 4B),US+LVFX-NPs组的生物被膜量最低,表明超声联合LVFX-NPs对生物被膜有显著的抗菌作用。
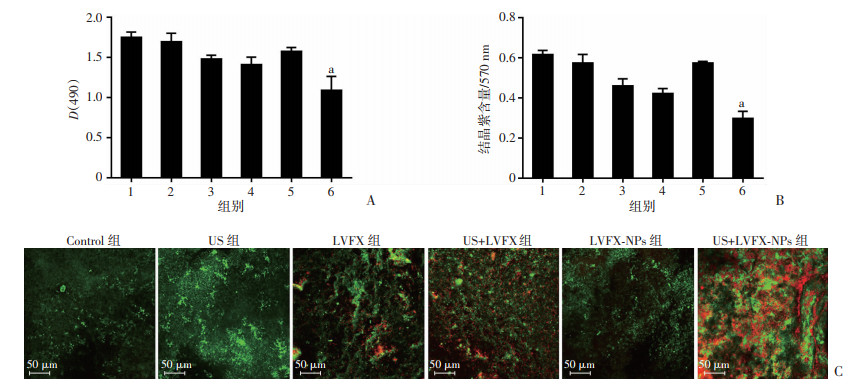
|
| 1:Control组;2:US组;3:LVFX组;4:US+LVFX组;5:LVFX-NPs组;6:US+LVFX-NPs组;a: P<0.05,与Control组比较 A:XTT法检测生物被膜活性;B:结晶紫染色检测生物被膜量;C:激光共聚焦显微镜定性观察生物被膜中的死活菌含量 图 4 不同方式处理BCG生物被膜后的活性变化 |
激光共聚焦显微镜定性观察SYTO9/PI染色BCG生物被膜中的死活菌变化,结果如图 4C所示,Control、US、LVFX、LVFX-NPs组均以绿色荧光为主,说明存在大量活菌,而与US+LVFX组相比,US+LVFX-NPs组有大量红色荧光,绿色荧光较少,说明活菌数量较少,证实超声联合LVFX-NPs对BCG生物被膜的杀菌效果优于其他实验组。
2.5 超声促进细菌内ROS的产生流式细胞仪分析不同方式处理BCG生物被膜后的菌内ROS含量变化。活性氧试剂盒DCFH-DA可以和菌内ROS反应产生带荧光物质。图 5结果显示,与对照组相比,LVFX经超声辐照后的荧光强度增加,而超声联合LVFX-NPs组的荧光强度显著高于US+LVFX组,表示LVFX-NPs经超声辐照后产生的ROS明显高于US+LVFX组,具有统计学差异(P<0.05),说明超声联合LVFX-NPs可以有效增加菌内的ROS含量,从而对细菌造成氧化损伤。

|
| A:流式细胞仪检测不同方式处理BCG后ROS含量曲线;B:定量分析ROS含量 1:Control组;2:US组;3:LVFX组;4:US+LVFX组;5:LVFX-NPs组;6:US+LVFX-NPs组;a: P<0.05,与Control组比较 图 5 不同方式处理细胞内ROS含量变化 |
2.6 超声对纳米粒的促渗作用
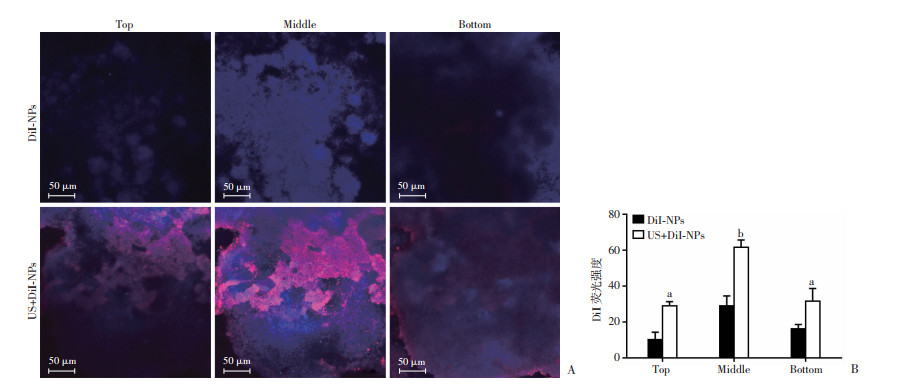
图 6结果显示了不同方式处理后的荧光纳米粒DiI-NPs在生物被膜中的渗透及分布情况,通过激光共聚焦显微镜观察生物被膜顶层(TOP)、中间层(Middle)和底层(Bottom)的荧光纳米粒沉积情况,并用Image J软件定量分析不同层的荧光强度(图 6B)。如图 6A所示,有少量DiI-NPs在生物被膜不同层次间聚集,经过超声辐照后,同样时间内聚集在生物被膜内的DiI-NPs数量显著增加,表明超声可有效破坏生物被膜结构,促进纳米粒进入生物被膜内部产生杀菌作用。
|
| A:激光共聚焦显微镜分别观察有无超声辐照后的生物被膜中不同层间的纳米粒聚集情况红色代表荧光强度;B:统计结果 a: P<0.01,与未经US辐照的DiI-NPs荧光强度比较; b: P<0.001,与未经US辐照的DiI-NPs荧光强度比较 图 6 激光共聚集观察超声处理生物被膜后不同层间的纳米粒变化 |
3 讨论
据估计,约有17亿人(占世界人口的23%)患有潜伏性结核感染,在其一生中极有可能患上活动性结核病[1]。目前,临床对耐药结核病的治疗方案是使用4种一线药物联合治疗6个月,但是疗效并不显著,甚而形成更为耐药的生物被膜结构[14]。生物被膜是指一种附着于无活力的或活组织表面的、由其自身产生的细胞外基质包裹的有结构的菌细胞群体,是阻止抗菌药物有效进入菌体的天然屏障。所以,有研究者认为探究可在较短时间内有效清除生物被膜的治疗方式,有利于结核病的控制[15]。
LFLIU是一种无创性、低成本和最低诱发微生物耐药性可能的治疗手段。前期研究证实,LFLIU联合载抗生素纳米系统治疗耐药性细菌时可取得显著的抗菌效果,并推测其主要机制是超声空化引起的声呐穿孔,而纳米粒的存在不仅降低了游离药物的毒副作用,还充当空化核降低了声空化的阈值[16-17]。
ROS主要通过破坏细胞内的DNA、脂质及蛋白质来达到杀菌目的。大量研究表明,基于ROS产生机制治疗细菌性感染疾病有良好效果[18-19]。同时,纳米粒的存在增强了空化效应,使细菌细胞被膜的通透性增加,导致进入菌内的药物增多,从而产生更多的ROS物质。本研究使用DCFH-DA检测不同方式处理BCG生物被膜后其菌内的ROS含量,实验结果证实超声联合LVFX-NPs组产生大量ROS。而由XTT法及结晶紫染色检测生物被膜活性和激光共聚焦显微镜观察生物被膜的死活菌含量结果可知,超声联合LVFX-NPs的抗菌效果优于其联合药物组,生物被膜活性明显降低,说明ROS对BCG生物被膜产生了损伤。
MTB生物被膜结构如此复杂,药物难以进入生物被膜发挥抗生素作用是其难治性的根本原因。图 6实验结果显示,超声辐照后可以促进纳米粒进入生物被膜。由此合理推断,超声促进LVFX-NPs渗透进入生物被膜,从而提高了生物被膜中的药物含量达到抗生物被膜作用。
综上,本研究成功制备了LVFX-NPs,并证实了体外超声联合LVFX-NPs治疗生物被膜感染的可行性,下一步计划建立生物被膜感染SD大鼠模型,探究超声联合LVFX-NPs对BCG生物被膜体内感染的治疗效果,为临床耐药结核病的治疗提供一种新的思路。
| [1] |
WHO. Global tuberculosis report 2019[M]. Geneva: World Health Organization, 2019: 1-297.
|
| [2] |
MEREDITH H R, SRIMANI J K, LEE A J, et al. Collective antibiotic tolerance: mechanisms, dynamics and intervention[J]. Nat Chem Biol, 2015, 11(3): 182-188. DOI:10.1038/nchembio.1754 |
| [3] |
DALTON J P, UY B, PHUMMARIN N, et al. Effect of common and experimental anti-tuberculosis treatments on Mycobacterium tuberculosis growing as biofilms[J]. Peer J, 2016, 4: e2717. DOI:10.7717/peerj.2717 |
| [4] |
PANG X, XIAO Q C, CHENG Y, et al. Bacteria-responsive nanoliposomes as smart sonotheranostics for multidrug resistant bacterial infections[J]. ACS Nano, 2019, 13(2): 2427-2438. DOI:10.1021/acsnano.8b09336 |
| [5] |
KOH W J, LEE S H, KANG Y A, et al. Comparison of levofloxacin versus moxifloxacin for multidrug-resistant tuberculosis[J]. Am J Respir Crit Care Med, 2013, 188(7): 858-864. DOI:10.1164/rccm.201303-0604oc |
| [6] |
LI S M, ZHU C, FANG S Y, et al. Ultrasound microbubbles enhance human β-defensin 3 against biofilms[J]. J Surg Res, 2015, 199(2): 458-469. DOI:10.1016/j.jss.2015.05.030 |
| [7] |
DONG Y, LI J, LI P, et al. Ultrasound microbubbles enhance the activity of vancomycin against Staphylococcus epidermidis biofilms in vivo[J]. J Ultrasound Med, 2018, 37(6): 1379-1387. DOI:10.1002/jum.14475 |
| [8] |
FU Y Y, ZHANG L, YANG Y, et al. Synergistic antibacterial effect of ultrasound microbubbles combined with chitosan-modified polymyxin B-loaded liposomes on biofilm-producing Acinetobacter baumannii[J]. Int J Nanomed, 2019, 14: 1805-1815. DOI:10.2147/ijn.s186571 |
| [9] |
YANG M, DU K, HOU Y, et al. Synergistic antifungal effect of amphotericin B-loaded poly(lactic-Co-glycolic acid) nanoparticles and ultrasound against Candida albicans biofilms[J]. Antimicrob Agents Chemother, 2019, 63(4). DOI:10.1128/aac.02022-18.DOI:10.1128/aac.02022-18 |
| [10] |
SUN X M, PAN Q, YUAN C H, et al. A single ssDNA aptamer binding to mannose-capped lipoarabinomannan of Bacillus Calmette-Guérin enhances immunoprotective effect against tuberculosis[J]. J Am Chem Soc, 2016, 138(36): 11680-11689. DOI:10.1021/jacs.6b05357 |
| [11] |
SOLOKHINA A, BONKAT G, KULCHAVENYA E, et al. Drug susceptibility testing of mature Mycobacterium tuberculosis H37Ra and mycobacterium smegmatis biofilms with calorimetry and laser spectroscopy[J]. Tuberculosis, 2018, 113: 91-98. DOI:10.1016/j.tube.2018.09.010 |
| [12] |
XI J, DA L, YANG C, et al. Mn2+-coordinated PDA@DOX/PLGA nanoparticles as a smart theranostic agent for synergistic chemo-photothermal tumor therapy[J]. Int J Nanomedicine, 2017, 12: 3331-3345. DOI:10.2147/ijn.s132270 |
| [13] |
TRIVEDI A, MAVI P S, BHATT D, et al. Thiol reductive stress induces cellulose-anchored biofilm formation in Mycobacterium tuberculosis[J]. Nat Commun, 2016, 7: 11392. DOI:10.1038/ncomms11392 |
| [14] |
WHO. Global tuberculosis report 2018[M]. Geneva: World Health Organization, 2018: 1-277.
|
| [15] |
ANIL K O, GRAHAM F H. Biofilms of Mycobacterium tuberculosis: new perspectives of an old pathogen[M]//PERE-JO AN C. Understanding tuberculosis—deciphering the secret life of the bacilli. 181-192: InTech Open, 2012. DOI: 10.5772/30303.
|
| [16] |
TUDELA I, SÁEZ V, ESCLAPEZ M D, et al. Simulation of the spatial distribution of the acoustic pressure in sonochemical reactors with numerical methods: a review[J]. Ultrason Sonochem, 2014, 21(3): 909-919. DOI:10.1016/j.ultsonch.2013.11.012 |
| [17] |
DONG Y, SU H, JIANG H, et al. Experimental study on the influence of low-frequency and low-intensity ultrasound on the permeability of the Mycobacterium smegmatis cytoderm and potentiation with levofloxacin[J]. Ultrason Sonochem, 2017, 37: 1-8. DOI:10.1016/j.ultsonch.2016.12.024 |




