2. 210023 南京, 南京中医药大学中医药文献研究所本草文献研究室;
3. 210028 南京, 南京中医药大学附属中西医结合医院肿瘤科
2. Research Office of Herbal Literature, Institute of Literature in Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing, Jiangsu Province, 210023;
3. Department of Oncology, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing, Jiangsu Province, 210028, China
丹参酮ⅡA是丹参的活性成分之一,具有十分广泛的药理学作用,对心肌损伤、肿瘤、炎症等均有抑制作用[1]。很多研究已经证实,丹参酮ⅡA能够抑制肿瘤细胞的增殖并促进细胞凋亡,但是对其通过何种机制影响肿瘤进展还不十分明确[2]。很多研究表明,丹参酮ⅡA能够影响下游基因的表达参与肿瘤进展,如丹参酮ⅡA通过调控miR-122影响食道癌进展;在肝癌中发现丹参酮Ⅱ通过调控YAP参与肝癌细胞凋亡[3-4]。lncRNA是一种与人类多种疾病有关的长链非编码RNA,参与影响细胞增殖、凋亡等过程[5]。肿瘤中lncRNA表达谱发生改变,并且这些lncRNA可以通过充当miRNA海绵影响肿瘤细胞恶性生长和凋亡[6]。lncRNA JPX是一个在肺癌、卵巢癌中高表达的调节因子,其能够促进肿瘤细胞的生长,对肿瘤的进展有诱导功能[7-8]。前期的预实验结果显示,JPX和miR-378有互补结合位点。miR-378有抑制结直肠癌细胞增殖的作用,是一个肿瘤抑制因子[9]。本实验探讨JPX调控miR-378参与丹参酮ⅡA诱导结肠癌细胞凋亡的分子机制,为阐明丹参酮ⅡA抗肿瘤分子网络提供参考。
1 材料与方法 1.1 材料结肠癌SW620、HCT-116、SW480细胞购自通派(上海)生物科技有限公司;正常结肠上皮NCM460细胞购自上海联迈生物工程有限公司;丹参酮ⅡA购自上海纯优生物科技有限公司;pcDNA3.1-JPX、pcDNA3.1由和元生物技术(上海)股份有限公司构建;miR-378 mimics、mimics control、miR-378 inhibitor、inhibitor control由广州复能基因有限公司构建;Bax抗体、Bcl-2抗体购自上海雅吉生物科技有限公司。
1.2 qRT-PCR检测结肠癌细胞中JPX表达收集结肠癌SW620、HCT-116、SW480细胞和正常结肠上皮NCM460细胞,在细胞内添加TRIzol分别提取各细胞中的总RNA,以超微量紫外分光光度计检测RNA的浓度以及纯度。然后用Fementas进行逆转录反应,取2 μg的RNA,添加1 μL的Oligo(dT),然后添加ddH2O至12 μL,放在65 ℃孵育5 min,然后将样品置于冰上保存。在上述混合液中添加4 μL的5×反应缓冲液、2 μL的dNTP、1 μL的RNA酶抑制剂、1 μL的逆转录酶,放在42 ℃反应60 min,72 ℃反应5 min,将cDNA放在-20 ℃中保存。用荧光定量PCR试剂盒进行PCR检测,反应的体系配制如下;1 μL的上游引物、1 μL的下游引物、10 μL的2×FastStart Universal SYBR Green Master、1 μL的cDNA模板,然后放在50 ℃孵育2 min,95 ℃孵育10 min,95 ℃孵育15 s,一共40个循环。根据每个反应得到的Ct值,按照2-△△Ct法计算JPX的表达水平。引物为GAPDH上游: 5′-TCAAGAAGGTGGTGAAGCA-3′,下游:5′-AGG-TGGAGGAGTGGGTGT-3′;JPX上游: 5′-GCACCACCA-GGCTTCTGTAAC-3′,下游: 5′-GGGCATGTTCATTAA-TTGGCCAG-3′。
1.3 CCK-8检测细胞增殖选取生长状态良好的结肠癌SW620细胞,接种到96孔板中,细胞数为3×104个/mL,根据实验要求分别将细胞分成对照组和丹参酮ⅡA组,对照组细胞添加0 μg/mL的丹参酮ⅡA细胞培养液培养细胞,丹参酮ⅡA组细胞添加浓度梯度为1、2、4、8、16 μg/mL的丹参酮ⅡA细胞培养液培养细胞,细胞在37 ℃的培养箱中培养48 h后,将培养板取出,然后吸取10 μL的CCK-8添加到每个孔中,在震荡仪上反应混合1 min。继续将培养板置于37 ℃的培养箱中结合2 h。将培养板放在酶标仪中,以450 nm的波长测定细胞光密度值D(450)。将对照组细胞存活率设置为100%,分析其余细胞存活率变化。
1.4 实验分组处理结肠癌SW620细胞分成:对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA+vector组、丹参酮ⅡA+JPX组。对照组处理方法同1.3,丹参酮ⅡA组为用含有4 μg/mL的丹参酮ⅡA细胞培养液培养的细胞(丹参酮ⅡA对结肠癌SW620细胞半数抑制浓度约为4 μg/mL)。vector组、丹参酮ⅡA+vector组细胞分别用转染阴性对照载体pcDNA3.1的细胞,JPX组、丹参酮ⅡA+JPX组细胞分别用转染JPX过表达载体pcDNA3.1-JPX的细胞。丹参酮ⅡA+vector组、丹参酮ⅡA+ JPX组细胞分别在转染后12 h,给予4 μg/mL的丹参酮ⅡA细胞培养液处理。对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA +vector组、丹参酮ⅡA+JPX组细胞培养48 h后,按照1.3中CCK-8方法检测细胞增殖变化。
1.5 平板克隆实验检测细胞克隆形成能力将对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA+vector组、丹参酮ⅡA+JPX组细胞按照每个平皿内添加300个细胞种植到细胞培养皿中,然后置于37 ℃、5% CO2的培养箱中培养13 d。肉眼可见细胞克隆团,添加4%的多聚甲醛固定,然后用吉姆萨染色,干燥后在显微镜下观察计数克隆形成团数目。
1.6 流式细胞术检测细胞凋亡对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA+vector组、丹参酮ⅡA+JPX组细胞培养48 h后,添加胰蛋白酶将细胞消化,收集细胞,在细胞内分别添加冰预冷以后的PBS溶液反复洗涤2次,最后添加300 μL的结合缓冲液制备单细胞悬浮液。吸取5 μL的Annexin V-FITC溶液添加到细胞内,在室温中结合20 min。然后添加5 μL的PI染色液,在室温中继续反应20 min。用流式细胞仪检测之前需要再添加200 μL的结合缓冲溶液。
1.7 Western blot检测Bax、Bcl-2蛋白表达对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA+vector组、丹参酮ⅡA+JPX组细胞培养48 h后,用RIPA裂解溶液将细胞总蛋白提取,采用BCA方法测定蛋白的浓度。在蛋白样品中添加等量体积的上样缓冲液,放在100 ℃的水浴中变性5 min。按照常规配制方法制备10%的分离胶以及5%的浓缩胶,观察胶凝固以后,添加电泳缓冲液。每个孔中吸取30 μg的蛋白样品上样,接通电源,设置90 V的电压电泳30 min,此时可以观察到溴酚蓝染料快要进入分离胶,把电压调整到120 V继续电泳。将凝胶取出并放在转移缓冲液中,同时将NC膜也置于转移缓冲液中浸泡20 min。在100 V的电压条件下转膜50 min。将NC膜取下,浸泡在TBST溶液中洗涤3次,然后将NC膜放在已经配制好的含有5%脱脂奶粉的TBST封闭液中,在室温、20 r/min摇床孵育1 h。然后将NC膜继续用TBST洗涤3次,再放在按照1 ∶1000稀释之后的一抗反应液中,在脱色摇床上4 ℃过夜。将NC膜取出,TBST洗涤3次。放在1 ∶4 000稀释以后的二抗孵育袋中,在室温、20 r/min摇床孵育1 h。以ECL方法显色。根据目的条带的灰度值,以GAPDH作为内参,分析目的蛋白的表达变化。
1.8 JPX靶基因预测以及鉴定生物信息学软件starbase预测JPX的靶基因,结果显示JPX和miR-378有互补结合位点,然后利用荧光素酶报告系统鉴定二者的靶向关系。将JPX-MUT(含有JPX结合位点突变以后的荧光素酶报告载体)、JPX-WT(含有JPX结合位点的荧光素酶报告载体)和miR-378 mimics(miR-378组)、mimics control(miR-NC组)、miR-378 inhibitor(Anti-miR-378组)、inhibitor control(Anti-NC组)共转染到结肠癌SW620细胞,培养48 h后,用荧光素酶活性检测试剂盒检测荧光素酶活性变化。对照组、丹参酮ⅡA组、vector组、JPX组、丹参酮ⅡA+vector组、丹参酮ⅡA+JPX组细胞培养48 h以后,按照1.2(qRT-PCR法,miR-378内参为U6)方法检测miR-378表达水平。U6上游: 5′- CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACG-AATTTGCGT-3′;miR-378上游: 5′-GGGACTGGACTT-GGAGTCA-3′; 下游: 5′-GTGCGTGTCGTGGAGTCG-3′。
1.9 miR-378对丹参酮ⅡA调控JPX影响细胞增殖、克隆和凋亡的作用检测在结肠癌SW620细胞中将pcDNA-JPX、mimics control和pcDNA-JPX、miR-378 mimics共转染,然后用含有4 μg/mL的丹参酮ⅡA细胞培养液培养,记为丹参酮ⅡA+JPX+miR-NC组和丹参酮ⅡA+JPX+miR-378组,将inhibitor control、miR-378 inhibitor分别转染到结肠癌SW620细胞中,然后用含有4 μg/mL的丹参酮ⅡA细胞培养液培养记为丹参酮ⅡA+Anti-NC组、丹参酮ⅡA+Anti-miR-378组。丹参酮ⅡA+Anti-NC组、丹参酮ⅡA+Anti-miR-378组、丹参酮ⅡA+JPX+miR-NC组、丹参酮ⅡA+JPX+miR-378组细胞培养48 h后,按照1.3(CCK-8法)、1.5(平板克隆实验)、1.6(流式细胞术)、1.7(Western blot)中方法分别检测细胞增殖、克隆、凋亡和Bax、Bcl-2蛋白表达水平。
1.10 统计学分析用SPSS 21.0统计软件分析实验数据,计量资料用x±s表示,两组数据间比较用t检验,多组差异比较用单因素方差,检验水准α=0.05。
2 结果 2.1 结肠癌细胞中JPX表达上调结肠癌SW620、HCT-116、SW480细胞中JPX表达水平升高,与正常结肠上皮NCM460细胞相比,差异具有统计学意义(P<0.05)。结肠癌SW620细胞中JPX表达水平升高,与结肠癌HCT-116、SW480细胞相比,差异具有统计学意义(P<0.05,图 1)。JPX在结肠癌细胞中高表达,选用表达水平最高的结肠癌SW620细胞用于后续实验。
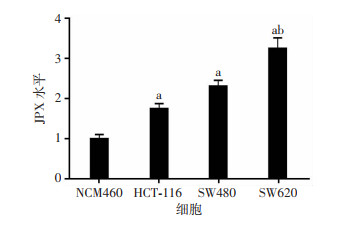
|
| a:P<0.05,与NCM460比较;b:P<0.05,与HCT-116、SW480比较 图 1 结肠癌SW620、HCT-116、SW480细胞和正常结肠上皮NCM460细胞中JPX水平 |
2.2 丹参酮ⅡA对结肠癌SW620细胞增殖和JPX表达影响
与对照组(0 μg/mL的丹参酮ⅡA处理)相比,1、2、4、8、16 μg/mL的丹参酮ⅡA处理后的结肠癌SW620细胞增殖能力降低,JPX水平降低(P<0.05,图 2)。4 μg/mL的丹参酮ⅡA处理后的结肠癌SW620细胞存活率接近50%,选择4 μg/mL的丹参酮ⅡA作后续研究。
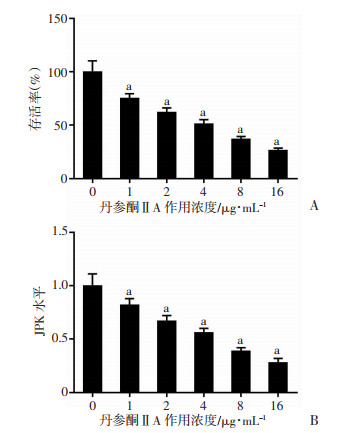
|
| a:P<0.05,与0 μg/mL(对照组)比较 A:结肠癌SW620细胞存活率;B:结肠癌SW620细胞中JPX水平 图 2 丹参酮ⅡA处理后结肠癌SW620细胞存活率和JPX水平 |
2.3 JPX逆转丹参酮ⅡA对结肠癌SW620细胞增殖和凋亡影响
与对照组比较,丹参酮ⅡA组结肠癌SW620细胞细胞存活率、克隆形成数目均降低,细胞凋亡率升高,细胞中Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低(P<0.05)。与vector组比较,JPX组结肠癌SW620细胞存活率、克隆形成数目均升高,细胞凋亡率降低,细胞中Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高(P<0.05)。与丹参酮ⅡA+vector组比较,丹参酮ⅡA+JPX组结肠癌SW620细胞存活率、克隆形成数目均升高,细胞凋亡率降低,细胞中Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高(P<0.05,图 3,表 1)。上调JPX逆转丹参酮ⅡA对结肠癌SW620细胞增殖、克隆抑制作用和凋亡诱导作用。
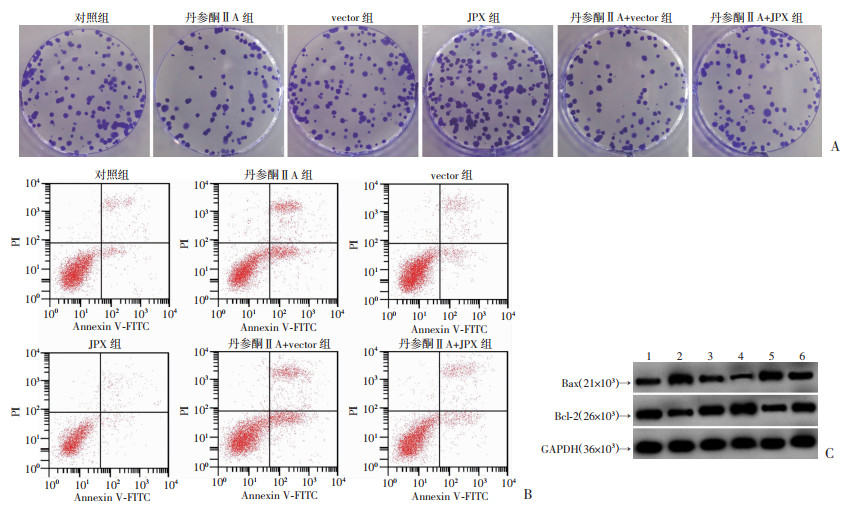
|
|
A:平板克隆实验检测结果;B:流式细胞术检测结肠癌SW620细胞凋亡;C:Western blot检测Bax、Bcl-2蛋白表达 1:对照组; 2:丹参酮ⅡA组; 3:vector组; 4:JPX组; 5:丹参酮ⅡA+vector组; 6:丹参酮ⅡA+JPX组 图 3 上调JPX对丹参酮ⅡA处理的结肠癌SW620细胞克隆、凋亡变化和Bax、Bcl-2蛋白表达变化的影响 |
| 组别 | JPX水平 | 存活率(%) | 克隆形成数目 | 凋亡率(%) | Bax蛋白 | Bcl-2蛋白 |
| 对照组 | 1.00±0.11 | 100.00±9.85 | 121.47±11.65 | 6.85±0.58 | 0.45±0.03 | 0.76±0.06 |
| 丹参酮ⅡA组 | 0.58±0.07a | 50.23±4.51a | 65.17±6.81a | 17.68±1.52a | 0.86±0.08a | 0.46±0.05a |
| vector组 | 0.99±0.08 | 97.62±10.54 | 120.78±12.95 | 6.79±0.47 | 0.46±0.05 | 0.77±0.07 |
| JPX组 | 2.15±0.23b | 156.21±12.05b | 207.39±15.43b | 1.36±0.11b | 0.23±0.03b | 0.95±0.09b |
| 丹参酮ⅡA+vector组 | 0.57±0.06 | 48.75±3.65 | 68.13±7.76 | 16.35±1.42 | 0.83±0.07 | 0.44±0.06 |
| 丹参酮ⅡA+JPX组 | 1.13±0.12c | 88.69±7.81c | 99.71±8.24c | 10.20±1.02c | 0.53±0.06c | 0.74±0.05c |
| F值 | 194.789 | 198.635 | 211.838 | 388.714 | 181.584 | 90.743 |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| a: P<0.05, 与对照组比较;b: P<0.05, 与vector组比较;c: P<0.05, 与丹参酮ⅡA+vector组比较 | ||||||
2.4 JPX和miR-378互为靶向关系
生物信息学软件结果显示,JPX和miR-378有互补结合位点,miR-378 mimics和JPX-WT共转染以后的细胞荧光素酶活性降低,miR-378 inhibitor和JPX-WT共转染以后的细胞荧光素酶活性升高(图 4)。表明JPX和miR-378互为靶向关系。
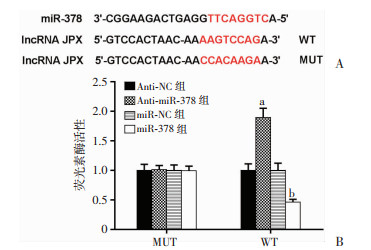
|
| A:JPX和miR-378结合位点示意图;B:荧光素酶报告系统鉴定二者的靶向关系 a:P<0.05,与Anti-NC组比较;b:P<0.05,与miR-NC组比较 图 4 JPX和miR-378互为靶向关系 |
2.5 丹参酮ⅡA调控JPX影响结肠癌SW620细胞中miR-378表达
与对照组比较,丹参酮ⅡA组结肠癌SW620细胞中miR-378表达水平升高(P<0.05)。与vector组比较,JPX组结肠癌SW620细胞中miR-378表达水平降低(P<0.05)。与丹参酮ⅡA+vector组比较,丹参酮ⅡA+JPX组结肠癌SW620细胞中miR-378表达水平降低(P<0.05,图 5)。丹参酮ⅡA上调结肠癌SW620细胞中miR-378表达水平,丹参酮ⅡA调控JPX影响结肠癌SW620细胞中miR-378表达。
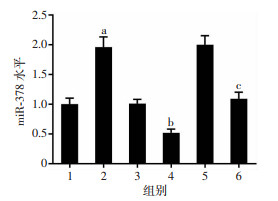
|
| 1:对照组; 2:丹参酮ⅡA组; 3:vector组; 4:JPX组; 5:丹参酮ⅡA+vector组; 6:丹参酮ⅡA+JPX组;a:P<0.05,与对照组比较;b:P<0.05,与vector组比较;c:P<0.05,与丹参酮ⅡA+vector组比较 图 5 上调JPX对丹参酮ⅡA处理的结肠癌SW620细胞中JPX表达水平影响 |
2.6 miR-378对丹参酮ⅡA调控JPX影响结肠癌SW620细胞增殖、克隆和凋亡的逆转作用
与丹参酮ⅡA+Anti-NC组比较,丹参酮ⅡA+Anti- miR-378组结肠癌SW620细胞存活率、克隆形成数目均升高,细胞凋亡率降低,细胞中Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高(P<0.05)。与丹参酮ⅡA+JPX+ miR-NC组比较,丹参酮ⅡA+JPX+miR-378组结肠癌SW620细胞存活率、克隆形成数目均降低,细胞凋亡率升高,细胞中Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低(P<0.05,图 6、表 2)。下调miR-378逆转丹参酮ⅡA对结肠癌SW620细胞增殖、克隆抑制以及凋亡促进作用,上调miR-378逆转JPX对丹参酮ⅡA影响结肠癌SW620细胞增殖、克隆和凋亡作用。
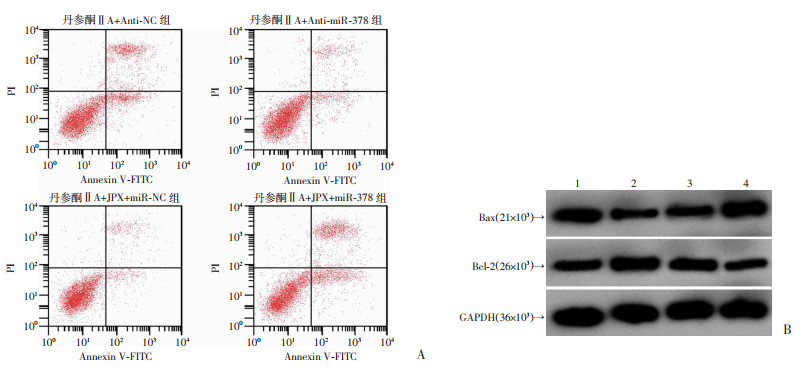
|
| A:检测结肠癌SW620细胞凋亡变化;B:Western blot检测Bax、Bcl-2蛋白表达 1:丹参酮ⅡA+Anti-NC组;2:丹参酮ⅡA+Anti-miR-378组;3:丹参酮ⅡA+JPX+miR-NC组;4:丹参酮ⅡA+JPX+miR-378组 图 6 miR-378对丹参酮ⅡA调控JPX影响结肠癌SW620细胞凋亡和Bax、Bcl-2蛋白表达的作用 |
| 组别 | 存活率(%) | 克隆形成数目 | 凋亡率(%) | Bax蛋白 | Bcl-2蛋白 |
| 丹参酮ⅡA+Anti-NC组 | 100.00±10.82 | 66.82±5.10 | 18.56±1.46 | 0.87±0.07 | 0.48±0.04 |
| 丹参酮ⅡA+Anti-miR-378组 | 178.25±13.20a | 95.87±7.73a | 9.40±1.33a | 0.50±0.05a | 0.86±0.09a |
| 丹参酮ⅡA+JPX+miR-NC组 | 186.45±16.64 | 100.23±11.50 | 10.89±1.09 | 0.54±0.04 | 0.85±0.06 |
| 丹参酮ⅡA+JPX+miR-378组 | 114.20±13.36c | 62.34±5.84c | 19.64±1.77c | 0.90±0.10c | 0.46±0.04c |
| F值 | 93.163 | 54.250 | 119.519 | 84.932 | 119.577 |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| a: P<0.05, 与丹参酮ⅡA+Anti-NC组比较;b: P<0.05, 与丹参酮ⅡA+JPX+miR-NC组比较 | |||||
3 讨论
丹参是我国传统中药,有祛瘀止痛、凉血、活血的作用,在心血管系统疾病中发挥重要作用[10]。丹参酮ⅡA是从丹参中提取出来的脂溶性物质,其也是丹参中的重要活性成分,具有十分广泛的药理学作用,对炎症、细菌感染、氧化损伤等均有十分显著的改善功效[1]。丹参酮ⅡA有抗肿瘤作用,目前已经发现其在多数肿瘤如卵巢癌、肝癌、肺癌、胃癌等进展中发挥抑制作用[11]。在结肠癌中的研究表明,丹参酮ⅡA体外抑制肿瘤细胞生长并诱导细胞凋亡[2]。本研究发现,丹参酮ⅡA处理以后的结肠癌细胞增殖和克隆能力下降,细胞凋亡率升高,这说明丹参酮ⅡA有抗结肠癌作用,这与以前的研究结果相一致。
丹参酮ⅡA抗肿瘤机制复杂,目前尚未完全阐明丹参酮ⅡA通过何种分子机制影响肿瘤生长[12]。以前有研究表明,丹参酮ⅡA通过作用于miRNA、信号转导通路发挥作用。lncRNA是一种在人体组织中表达十分广泛的调控因子,与胚胎发育、细胞凋亡、组织生长等关系密切[13]。lncRNA参与参与肿瘤的进展,其可以通过与miRNA互补结合影响miRNA的表达[14]。我们的研究发现,丹参酮ⅡA处理后的结肠癌细胞中JPX表达水平下降,丹参酮ⅡA机制可能与JPX有关。既往研究表明,JPX是一个和肿瘤进展有关的lncRNA,已知其在卵巢癌中高表达,JPX促进卵巢癌细胞生长[7]。在肺癌中也发现JPX可能是一个肿瘤促进因子,JPX能够减少细胞凋亡[8]。Bax和Bcl-2均属于Bcl-2蛋白家族成员,其也是目前发现的与细胞凋亡关系最为密切的Bcl-2蛋白家族成员,Bax具有诱导细胞凋亡的作用,Bcl-2具有抑制细胞凋亡的作用,Bax和Bcl-2表达水平的比值直接影响细胞凋亡水平[15]。本研究发现,JPX在结肠癌细胞中表达上调,并且上调JPX促进肿瘤细胞增殖、克隆,减少细胞凋亡,促进促凋亡蛋白Bax表达,抑制抗凋亡蛋白Bcl-2的表达,JPX在结肠癌进展中可能发挥促进作用。另外,本研究还发现,上调JPX可以逆转丹参酮ⅡA对结肠癌细胞增殖、克隆的抑制作用和凋亡诱导作用,说明丹参酮ⅡA通过调控JPX影响结肠癌进展。
lncRNA在生理和病理过程中的作用机制十分复杂,其能够通过碱基互补的方式影响miRNA的表达,进而调控细胞的生物学行为[16]。本研究发现,JPX和miR-378互为靶向关系,并且上调JPX靶向抑制miR-378的表达,丹参酮ⅡA上调结肠癌细胞中miR-378的表达,丹参酮ⅡA可能通过JPX靶向调控miR-378发挥作用。miR-378是一个具有广泛作用的小分子RNA,与肥胖、肝纤维化、心肌肥厚等病理变化有关,是人类多种疾病发生的重要调控因子[17-19]。以前的研究表明,miR-378在肿瘤生长中有关键功能[20]。miR-378通过调控MAPK信号通路抑制前列腺癌细胞的生长[21]。miR-378具有阻碍结肠癌细胞恶性增殖的作用,并且其作用机制与靶向下调SDAD1有关[9]。本研究发现,下调miR-378逆转丹参酮ⅡA对结肠癌细胞增殖、克隆和细胞凋亡的作用,而且上调miR-378逆转JPX对丹参酮ⅡA影响结肠癌细胞增殖、克隆和细胞凋亡功能。这说明丹参酮ⅡA通过JPX靶向miR-378参与结肠癌进展。
综上,JPX靶向miR-378可能是丹参酮ⅡA诱导结肠癌细胞凋亡的机制,丹参酮ⅡA通过下调JPX靶向促进miR-378表达抑制结肠癌细胞生长,诱导细胞凋亡,为研究丹参酮ⅡA抗肿瘤机制提供了资料。目前对丹参酮ⅡA调控JPX/miR-378通过何种靶向机制影响下游相关基因或蛋白表达还不明确,在以后实验中会进行探讨。
| [1] |
刘璐, 张丽娟, 闵瑶, 等. 丹参酮ⅡA药理作用的研究进展[J]. 吉林医药学院学报, 2020, 41(3): 212-214. LIU L, ZHANG L J, MIN Y, et al. Research progress on pharmacological action of tanshinone Ⅱ a[J]. J Jilin Med Coll, 2020, 41(3): 212-214. DOI:10.13845/j.cnki.issn1673-2995.2020.03.023 |
| [2] |
LI N, YANG L, ZHANG B, et al. Tanshinone ⅡA effects on ovarian cancer cell line[J]. J Pharm Pharmacol, 2018, 70(10): 1369-1377. DOI:10.1111/jphp.12961 |
| [3] |
XUE J, JIN X, WAN X, et al. Effects and mechanism of tanshinone Ⅱ A in proliferation, apoptosis, and migration of human colon cancer cells[J]. Med Sci Monit, 2019, 25: 4793-4800. DOI:10.12659/msm.914446 |
| [4] |
MA L, JIANG H, XU X, et al. Tanshinone ⅡA mediates SMAD7-YAP interaction to inhibit liver cancer growth by inactivating the transforming growth factor beta signaling pathway[J]. Aging(Albany NY), 2019, 11(21): 9719-9737. DOI:10.18632/aging.102420 |
| [5] |
QIAN X, ZHAO J, YEUNG P Y, et al. Revealing lncRNA structures and interactions by sequencing-based approaches[J]. Trends Biochem Sci, 2019, 44(1): 33-52. DOI:10.1016/j.tibs.2018.09.012 |
| [6] |
WANG W L, LOU W Y, DING B S, et al. A novel mRNA-miRNA-lncRNA competing endogenous RNA triple sub-network associated with prognosis of pancreatic cancer[J]. Aging, 2019, 11(9): 2610-2627. DOI:10.18632/aging.101933 |
| [7] |
LI J, FENG L, TIAN C, et al. Long noncoding RNA-JPX predicts the poor prognosis of ovarian cancer patients and promotes tumor cell proliferation, invasion and migration by the PI3K/Akt/mTOR signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(23): 8135-8144. DOI:10.26355/eurrev_201812_16505 |
| [8] |
PAN J C, FANG S, TIAN H H, et al. lncRNA JPX/miR-33a-5p/Twist1 axis regulates tumorigenesis and metastasis of lung cancer by activating Wnt/β-catenin signaling[J]. Mol Cancer, 2020, 19(1): 9. DOI:10.1186/s12943-020-1133-9 |
| [9] |
ZENG M, ZHU L, LI L, et al. miR-378 suppresses the proliferation, migration and invasion of colon cancer cells by inhibiting SDAD1[J]. Cell Mol Biol Lett, 2017, 22: 12. DOI:10.1186/s11658-017-0041-5 |
| [10] |
郝若林. 丹参的研究进展[J]. 医学食疗与健康, 2020, 18(18): 204-205. HAO R L. Research progress of Salvia miltiorrhiza[J]. Med Dietother Health, 2020, 18(18): 204-205. |
| [11] |
刘展艳, 吴玉华. 丹参酮Ⅱa抗肿瘤作用的研究进展[J]. 湖南中医杂志, 2016, 32(12): 164-166. LIU Z Y, WU Y H. Research progress on anti-tumor effect of tanshinone Ⅱ a[J]. Hunan J Tradit Chin Med, 2016, 32(12): 164-166. |
| [12] |
梁柯, 唐晨野, 郭晓, 等. 丹参酮ⅡA抗肿瘤作用机制及抗膀胱癌的研究进展[J]. 浙江中西医结合杂志, 2018, 28(8): 714-717. LIANG K, TANG C Y, GUO X, et al. Anti-tumor mechanism and anti bladder cancer research progress of tanshinone Ⅱ a[J]. Zhejiang J Integr Tradit Chin West Med, 2018, 28(8): 714-717. DOI:10.3969/j.issn.1005-4561.2018.08.038 |
| [13] |
HUANG Y. The novel regulatory role of lncRNA-miRNA-mRNA axis in cardiovascular diseases[J]. J Cell Mol Med, 2018, 22(12): 5768-5775. DOI:10.1111/jcmm.13866 |
| [14] |
BHAN A, SOLEIMANI M, MANDAL S S. Long noncoding RNA and cancer: a new paradigm[J]. Cancer Res, 2017, 77(15): 3965-3981. DOI:10.1158/0008-5472.can-16-2634 |
| [15] |
ZHENG Q, WANG B, GAO J, et al. CD155 knockdown promotes apoptosis via AKT/Bcl-2/Bax in colon cancer cells[J]. J Cell Mol Med, 2018, 22(1): 131-140. DOI:10.1111/jcmm.13301 |
| [16] |
WU Y, LU X, SHEN B, et al. The therapeutic potential and role of miRNA, lncRNA, and circRNA in osteoarthritis[J]. Curr Gene Ther, 2019, 19(4): 255-263. DOI:10.2174/1566523219666190716092203 |
| [17] |
ZHANG T, HU J, WANG X, et al. MicroRNA-378 promotes hepatic inflammation and fibrosis via modulation of the NF-κB-TNFα pathway[J]. J Hepatol, 2019, 70(1): 87-96. DOI:10.1016/j.jhep.2018.08.026 |
| [18] |
徐露莲. hsa-miR-378的生物信息学特征及其在人脂肪细胞中的表达调控规律[D]. 南通大学, 2013. XU L L. Bioinformatics characteristics of hsa-mir-378 and its expression regulation in human adipocytes[D]. Nantong Univ, 2013. |
| [19] |
YUAN J, LIU H, GAO W, et al. MicroRNA-378 suppresses myocardial fibrosis through a paracrine mechanism at the early stage of cardiac hypertrophy following mechanical stress[J]. Theranostics, 2018, 8(9): 2565-2582. DOI:10.7150/thno.22878 |
| [20] |
赵蕾, 鹿松, 赵淑萍, 等. miR-378高表达增强宫颈癌细胞的放射敏感性初步研究[J]. 中华放射肿瘤学杂志, 2016, 25(10): 1123-1124. ZHAO L, LU S, ZHAO S P, et al. Preliminary study on high expression of mir-378 enhancing radiosensitivity of cervical cancer cells[J]. Chin J Radiat Oncol, 2016, 25(10): 1123-1124. DOI:10.3760/cma.j.issn.1004-4221.2016.10.022 |
| [21] |
CHEN Q G, ZHOU W, HAN T, et al. MiR-378 suppresses prostate cancer cell growth through downregulation of MAPK1 in vitro and in vivo[J]. Tumour Biol, 2016, 37(2): 2095-2103. DOI:10.1007/s13277-015-3996-8 |




