心肌致密化不全(left ventricular noncompaction,LVNC)是一种以心室内突出的肌小梁和众多深陷的小梁隐窝为特征的遗传性心肌病,是发病率仅次于扩张型心肌病和肥厚型心肌病的第3大最常见的心肌病[1]。临床症状有明显异质性,心律失常、心力衰竭和栓塞事件是常见临床症状,严重者可导致猝死[2],因此该病成为临床诊治的焦点及难点,但其病因及发病机制尚不明确。已有研究报道数十个疾病相关的易感基因,包括与肌小节、离子通道和线粒体相关的基因[3],但这些基因对疾病的解释度仅为20%~30%,大多在西方人群发现且功能验证手段局限,因此其遗传机制需要进一步深入。
细胞骨架是细胞的重要组成成分,主要由微管、微丝和中间丝组成,微管主要参与细胞形态的维持,微丝与细胞的活动性及信号蛋白的运输密切相关[4],中间丝协助细胞分裂等生理活动。除维持细胞基本形态外,骨架可以感知、整合和传输细胞内和细胞外信号[5]。而细胞极性是指细胞的结构或物质分布形成轴性梯度而产生不对称极的特性,其在细胞分化、细胞迁移、细胞分裂以及组织器官的形成等众多生物学过程中起着关键性的作用,极性复合物被输送到细胞顶底端并与细胞膜锚定是细胞极性形成的物质基础,该过程由细胞骨架系统介导,因此细胞骨架和细胞极性共同参与肌小梁的排列与压实,同时与心肌细胞非致密化的表现密切相关[5-7]。因此细胞骨架和极性与LVNC发生逐渐被关注。
易感基因的功能验证是阐述临床疾病发生机制的主要工具,但临床人体标本涉及伦理问题难以获取,模型动物表型不稳定,因此寻找良好疾病模型成为LVNC的研究热点及难点。本研究成功构建LVNC患者来源的iPSCs细胞系并诱导分化为心肌细胞,且这些细胞携带疾病相仿的遗传背景[8],因此iPSCs成为研究人类LVNC发生的良好模型。本研究在前期基础上,聚焦iPSCs构建及心肌细胞分化的过程,检测成熟心肌细胞中细胞骨架形态及相关蛋白表达的变化,并初步探讨其发生的可能机制,为LVNC的发生探索新的研究方向。
1 材料与方法 1.1 主要试剂基质胶、消化液、PGM1培养基、心肌诱导分化试剂盒、心肌消化液和纯化培养基均购自北京赛贝公司;1640基础培养基购自Sigma公司;血清替代物购自Thermo公司;抗体Oct4、Sox2、SSEA4、TRA1-81、cTnT、α-actinin、par6、vinculin均购自Abcam公司,抗体F-actin、α/β-tubulin、RhoA均购自CST公司;荧光二抗购自塞维尔谷歌生物公司;细胞裂解液及Western blot相关试剂均购自碧云天公司;磷酸酶抑制剂和蛋白酶抑制剂均购自美国Roche公司。
1.2 iPSCs细胞培养及分组采用课题组前期成功构建的LVNC患者来源的iPSCs和正常组iPSCs细胞系(分别记为疾病组和正常组)[8],使用PGM1培养基和干细胞消化液进行培养、传代。用免疫荧光技术对两组细胞干性基因标志物Oct4、Sox2、SSEA4、TRA1-81进行染色鉴定以证明其多能潜在分化能力。
1.3 iPSCs诱导培养选取融合度达到90%的细胞进行诱导分化,使用分化完全培养基培养Ⅰ、Ⅱ、Ⅲ连续培养48 h后,每2天更换1次分化完全培养基Ⅲ,无更多跳动时进行纯化接种,培养至第30天时收集细胞[8]。
1.4 转录组测序将成熟的心肌细胞刮下进行转录组测序(疾病组与对照组均设置3个生物学重复)并分析结果,此部分委托诺和致源公司协助完成。
1.5 电镜观察iPSC-CMs超微结构将不少于106细胞数量的心肌细胞刮下,置于2 mL EP管以200×g离心3 min,弃掉上清液,用2 mL戊二醛电镜固定液固定于EP管中,4 ℃储存,送重庆医科大学电镜室进行检测。
1.6 免疫荧光检测iPSC-CMs细胞骨架蛋白及极性蛋白改变用4%多聚甲醛室温固定细胞15 min,0.5%Triton X-100打孔5 min后,5% BSA室温封闭0.5 h,PBS 5 min清洗3次,用一抗(α/β-tublin、F-actin、par6、vinculin,1 ∶200) 4 ℃孵育过夜,复温后PBS 5 min洗涤3次,荧光二抗(1 ∶250)37 ℃避光静置1 h。避光条件下用PBS洗涤3次后,DAPI 37 ℃孵育15 min,封片后在荧光倒置显微镜下观察并拍照。
1.7 Western blot检测RhoA表达用Lysis buffer和蛋白酶抑制剂、磷酸酶抑制剂、PMSF配制细胞裂解液,刮取心肌细胞,冰上振荡30 s、静置3 min,反复4~5次,4 ℃ 16 000×g离心14 min后取上清,使用考马斯亮蓝测蛋白浓度,用12%的SDS-PAGE电泳分离,105 V电转90 min,5%BSA封闭30 min,一抗(1 ∶1 000)于4 ℃孵育过夜,TBST洗3次后,二抗室温孵育1 h,TBST洗3次后显影。
1.8 统计学分析采用SPSS 22.0统计软件进行统计学分析,数据结果均用x±s表示,两组之间采用独立样本t检验或Mann-Whitney U检验。
2 结果 2.1 iPSCs细胞系的鉴定与分化将正常组和疾病组iPSCs进行培养,可见细胞呈克隆团块生长(图 1A),免疫荧光检测显示干细胞表面标志物Sox2、Oct4、SSEA4、TRA1-81表达阳性(图 1B),提示两组iPSCs均处于胚胎多能干性状态,具有向三胚层分化的潜能。将iPSCs定向向心肌细胞分化,随着分化的进行,细胞由圆形逐渐向杆状转换,聚集增厚,持续诱导至第11~13天可看到心肌细胞形成网状结构并开始搏动(图 1A),用免疫荧光对心肌细胞进行检测,结果显示心肌表面标志物α-actinin、cTnT表达呈阳性(图 1C),提示iPSCs成功诱导分化为心肌细胞。
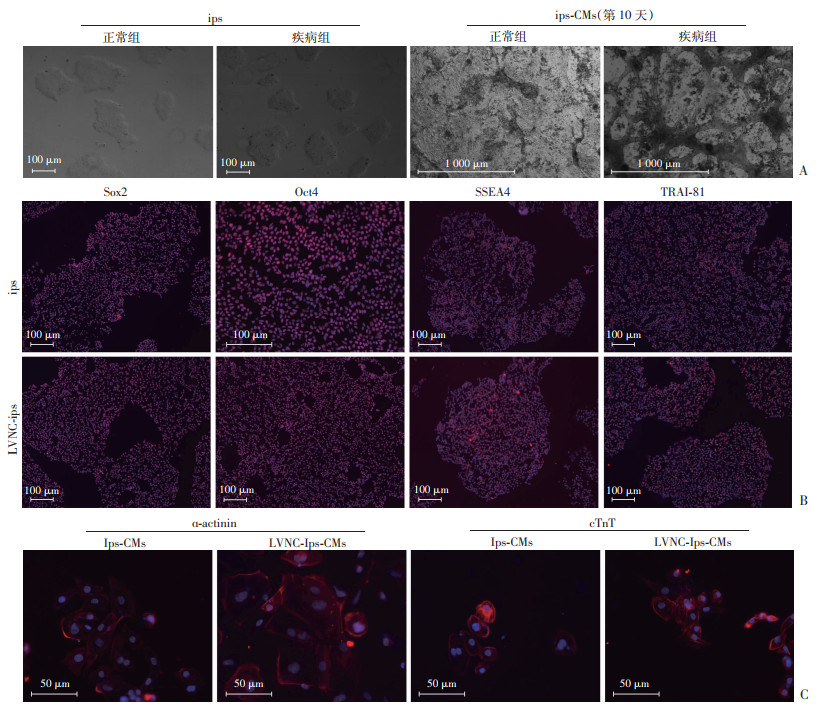
|
| A:iPSCs细胞培养;B:iPSCs细胞干性标志物检测红色示Sox2、Oct4、SSEA4、TRA1-81,蓝色示细胞核;C:iPSCs细胞诱导心肌细胞心肌标志物检测红色示α-actinin、cTnT,蓝色示细胞核 图 1 iPSCs细胞系的鉴定与分化 |
2.2 转录组测序
测序共得到差异表达基因2 991个,其中1 647个基因表达被上调,1 344个基因表达被下调,在确定差异表达基因后对其进行富集分析,对表达下调的差异基因进行GO分析时,在分子功能(Molecular Function)部分发现有大量数据与细胞骨架有关,与微管连接(tubulin binding)相关的差异基因高达53个,与微管蛋白连接(microtubule binding)相关的差异基因有33个,对细胞组成(cellular component)的分析显示46个差异基因与微管组分改变有关,25个差异基因与微管组织中心部分(microtubule organizing center part)有关,有24个差异基因与微管相关复合物(microtubule associated complex)有关(图 2B)。而上调基因的GO分析也提示有许多差异基因与细胞间连接(cell-cell junction)、细胞顶端部分(apical part of cell)、细胞黏附介体活性(cell adhesion mediator activity)等有关(图 2C),同时对差异基因进行Reactome富集分析,气泡图结果显示,两组在Rho GTPase Cycle通路差异明显(图 2A)。这些结果提示差异基因与细胞骨架密不可分,且疾病组细胞骨架的生长发育以及细胞连接等正常生理过程可能通过Rho GTPase Cycle通路进行调控。
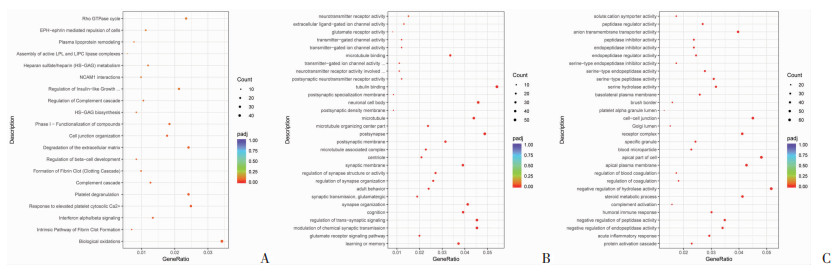
|
| A:Reactome富集分析;B:表达下调差异基因GO富集分析;C:表达上调调差异基因GO富集分析 图 2 转录组测序结果 |
2.3 LVNC-iPSC-CMs超微结构改变
将诱导分化第30天的iPSCs送检,透射电镜结果显示,正常组心肌细胞内可看到整齐排列的肌节、Z线及H带,而疾病组心肌细胞中可见胞内结构紊乱,肌节排列无序,Z线不平行,H带与肌丝位置关系混乱(图 3),提示LVNC源性iPSC-CMs存在细胞骨架异常。
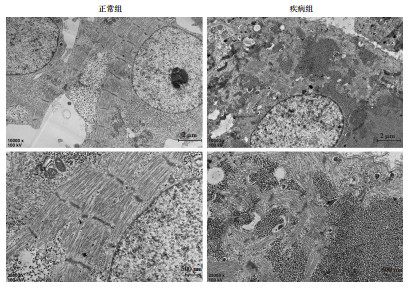
|
| 图 3 电镜观察两组iPSC-CMs超微结构变化 |
2.4 LVNC-iPSC-CMs微管微丝相关蛋白及极性蛋白发生改变
为进一步观察细胞骨架蛋白与极性蛋白的变化情况,用免疫荧光法检测两组心肌细胞α/β-tublin、F-actin、vinculin及par6的表达。共聚焦显微镜结果显示,ɑ/β-tublin荧光染色在胞内呈散在分布,多见于细胞核与细胞膜(图 4),采用Mann-Whitney U检验分析两组荧光强度,结果显示患者组明显低于正常组[n=62,(226.4±65.1),P < 0.01,Z=-3.451],提示其微管稳定性降低;疾病组心肌细胞F-actin边缘清晰,四周边缘及胞膜处可见明显浓聚,而胞质内排列稀疏(图 5),采用两独立样本t检验统计分析结果显示患者组整体荧光强度低于正常组[n=62,(236.4±33.2),P < 0.001],vinculin沿F-actin排列,正常组vinculin分布可见明显细胞轮廓,且在细胞中均匀分布,而疾病组vinculin于细胞膜处较浓聚,细胞质分布较少,有明显分布不均(图 5),采用Mann-Whitney U检验统计得到患者组平均荧光强度低于正常组[n=57,(137.2±35.9),Z=-3.852,P < 0.001];极性蛋白par6散在分布于细胞核及胞质(图 6),采用Mann-Whitney U检验结果显示疾病组较正常组相比平均荧光强度上调[n=64,(-132.7±43.5),Z=-3.148,P < 0.01],提示细胞极性发生改变。

|
| 红色示ɑ/β-tublin,蓝色示细胞核 图 4 免疫荧光检测两组心肌细胞α/β-tublin的表达 |

|
| 绿色示vinculin,红色示F-actin,蓝色示细胞核 图 5 免疫荧光检测两组心肌细胞F-actin、vinculin的表达 |

|
| 红色示par6,蓝色示细胞核 图 6 免疫荧光检测两组心肌细胞par6的表达 |
2.5 LVNC-iPSC-CMs中RhoA的变化
为探讨两组心肌细胞中细胞骨架和极性变化的潜在机制,用Western blot技术分别对两组诱导分化的心肌细胞进行灰度值检测,采用两独立样本t检验结果显示疾病组RhoA蛋白表达水平显著上调[n=18,(11 280±3 813),P < 0.01,图 7],结合转录组reactome富集分析初步提示Rho GTPase Cycle通路中关键蛋白RhoA的表达增高与疾病组细胞骨架和极性变化有关。
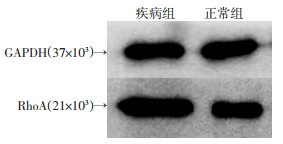
|
| 图 7 Western blot检测两组心肌细胞RhoA蛋白表达水平 |
3 讨论
心肌致密化不全是一种多基因遗传病,临床症状重,缺乏有效治疗手段,病因及发病机制不详。目前已发现许多与该病相关的基因,大多研究集中在肌小节方面,而在细胞骨架和极性相关领域的研究成果较少。CHERIAN等[9]发现细胞骨架调控心肌细胞膜上的n-钙黏着蛋白,由均匀分布转向基底膜侧点状分布,从而触发了肌小梁的分层,JIMÉNEZ-AMILBURU等[10]在斑马鱼模型中发现极性蛋白复合物组分Crb2a的缺乏可以造成肌小梁分层失败。DURBIN等[11]在Shroom3敲除的小鼠中发现左心室不致密样的改变,而该小鼠在心脏发育过程中出现了平面细胞极性(planar cell polarity,PCP) 信号通路传导改变、细胞骨架破坏。这表明了细胞骨架、极性与LVNC之间存在某种联系,而具体机制需要进一步探索。
本研究采用LVNC患者iPSCs诱导的心肌细胞模型,对两组的测序结果进行分析,GO富集分析显示,下调的多个差异基因与微管中心组织部分和微管相关复合物有关,而上调的多个差异基因则提示其与细胞间连接、极性及细胞黏附介体活性密切相关,表明疾病组细胞骨架改变受到多个突变位点的调控;Reactome富集分析显示两组在Rho GTPase Cycle通路差异明显。同时在电镜下观察到细胞骨架排列紊乱,在荧光显微镜下发现α/β-tublin表达下调,提示微管稳定性降低,F-actin及vinculin表达下调,且vinculin分布不均,F-actin是微丝的主要组成成分,vinculin沿肌动蛋白丝排列,可将其与跨膜受体连接,两者形成稳定复合物以保证胞间连接及分子活动的正常进行,并在调节细胞粘附,运动性和力传递中起关键作用[14]。同时Vinculin将细胞骨架固定在细胞外基质上,而细胞外基质在胎儿心脏发育的致密化过程中起促进作用[15-16]。而极性蛋白par6表达上调,提示细胞极性发生改变,以上结果明确了LVNC疾病来源的iPSC-CMs存在骨架及极性相关蛋白的表达及分布差异。
有研究表明许多调控因素可以影响细胞骨架及极性,例如VEGF通路、PCP通路、Rho通路等[17-19],其中Rho GTPase的活性改变可以影响Rho通路,调节心血管系统发育。Rho GTPase是一个信号蛋白家族,具体有RhoA、Rac、Cdc42等,LAWSON等[20]发现Rho GTPases通过不同的GDP-GTP结合状态调控Rho/ROCK通路,进而调节细胞内肌动蛋白骨架的聚合和解聚,参与细胞增殖、分化、迁移等功能,而Rho/ROCK可调控极性蛋白复合物的组成及分布[21-23]。本研究结合转录组通路预测结果,利用Western blot技术检测到疾病组Rho通路关键蛋白RhoA表达水平显著上调,提示疾病细胞骨架的改变可能与Rho/ROCK通路相关。
因此初步推测,LNVC患者的多基因突变可能通过上调Rho/ROCK通路关键蛋白RhoA的表达来降低微管稳定性,影响细胞骨架发育、形成及排列,导致骨架相关蛋白F-actin表达降低、vinculin降低且分布不均,对其形成稳定复合物及参与细胞黏附和胞间连接等生物过程造成不利影响,同时微管运输极性蛋白par6异常,导致极性复合物的组成及定位错误,难以维持正确的顶端-基底极性,随着心肌细胞不断分化,肌小梁排列及压实异常,最终导致心肌致密化不全的发生。而课题组后续将挖掘细胞骨架及极性和信号通路的关键基因,通过挽救实验观察LVNC的表型变化,明确具体的疾病发生机制,最终寻找疾病新的生物学标志物和干预靶点,为该病的遗传咨询、早期预防、个体化防治和靶向药物开发提供理论基础。
| [1] |
LIU Y, CHEN H, SHOU W. Potential common pathogenic pathways for the left ventricular noncompaction cardiomyopathy (LVNC)[J]. Pediatr Cardiol, 2018, 39(6): 1099-1106. DOI:10.1007/s00246-018-1882-z |
| [2] |
UEDA Y, KAMIYA C A, NAKANISHI A, et al. Cardiomyopathy phenotypes and pregnancy outcomes with left ventricular noncompaction cardiomyopathy[J]. Int Heart J, 2018, 59(4): 862-867. DOI:10.1536/ihj.17-336 |
| [3] |
TOWBIN J A. Left ventricular noncompaction: a new form of heart failure[J]. Heart Fail Clin, 2010, 6(4): 453-69. DOI:10.1016/j.hfc.2010.06.005 |
| [4] |
SVITKINA T M. Ultrastructure of the actin cytoskeleton[J]. Curr Opin Cell Biol, 2018, 54: 1-8. DOI:10.1016/j.ceb.2018.02.007 |
| [5] |
STRUTT H, LANGTON P F, PEARSON N, et al. Retromer controls planar polarity protein levels and asymmetric localization at intercellular junctions[J]. Curr Biol, 2019, 29(3): 484-491. DOI:10.1016/j.cub.2018.12.027 |
| [6] |
WU M. Mechanisms of trabecular formation and specification during cardiogenesis[J]. Pediatr Cardiol, 2018, 39(6): 1082-1089. DOI:10.1007/s00246-018-1868-x |
| [7] |
JIMÉNEZ-AMILBURU V, RASOULI S J, STAUDT D W, et al. In vivo visualization of cardiomyocyte apicobasal polarity reveals epithelial to mesenchymal-like transition during cardiac trabeculation[J]. Cell Rep, 2016, 17(10): 2687-2699. DOI:10.1016/j.celrep.2016.11.023 |
| [8] |
刘奥怡, 张蕾, 龚梦嘉, 等. 心肌致密化不全患者特异性诱导多潜能干细胞及心肌样细胞的构建[J]. 第三军医大学学报, 2019, 41(24): 2401-2408. LIU A Y, ZHANG L, GONG M J, et al. Generation of induced pluripotent stem cells and cardiomyocyte-like cells from a patient with left ventricular noncompaction[J]. J Third Mil Med Univ, 2019, 41(24): 2401-2408. |
| [9] |
CHERIAN A V, FUKUDA R, AUGUSTINE S M, et al. N-cadherin relocalization during cardiac trabeculation[J]. Proc Natl Acad Sci USA, 2016, 113(27): 7569-7574. DOI:10.1073/pnas.1606385113 |
| [10] |
JIMÉNEZ-AMILBURU V, STAINIER D Y R. The transmembrane protein Crb2a regulates cardiomyocyte apicobasal polarity and adhesion in zebrafish[J]. BioRxiv, 2018. DOI:10.1101/398909.DOI:10.1101/398909 |
| [11] |
DURBIN M D, O'KANE J, LORENTZ S, et al. SHROOM3 is downstream of the planar cell polarity pathway and loss-of-function results in congenital heart defects[J]. Dev Biol, 2020, 464(2): 124-136. DOI:10.1016/j.ydbio.2020.05.013 |
| [12] |
FALEY S L, NEAL E H, WANG J X, et al. iPSC-derived brain endothelium exhibits stable, long-term barrier function in perfused hydrogel scaffolds[J]. Stem Cell Rep, 2019, 12(3): 474-487. DOI:10.1016/j.stemcr.2019.01.009 |
| [13] |
BUIKEMA J W, WU S M. Untangling the biology of genetic cardiomyopathies with pluripotent stem cell disease models[J]. Curr Cardiol Rep, 2017, 19(4): 1-7. DOI:10.1007/s11886-017-0842-1 |
| [14] |
COOLEY J, WHITAKER S, SWEENEY S, et al. Cytoskeletal polarity mediates localized induction of the heart progenitor lineage[J]. Nat Cell Biol, 2011, 13(8): 952-957. DOI:10.1038/ncb2291 |
| [15] |
PARRA-ACERO H, HARCET M, SÁNCHEZ-PONS N, et al. Integrin-mediated adhesion in the unicellular holozoan Capsaspora owczarzaki[J]. Curr Biol, 2020, 30(21): 4270-4275. DOI:10.1016/j.cub.2020.08.015 |
| [16] |
CHENG F, MIAO L, WU Q, et al. Vinculin b deficiency causes epicardial hyperplasia and coronary vessel disorganization in zebrafish[J]. Development, 2016, 143(19): 3522-3531. DOI:10.1242/dev.132936 |
| [17] |
DAVEY C F, MOENS C B. Planar cell polarity in moving cells: think globally, act locally[J]. Development, 2017, 144(2): 187-200. DOI:10.1242/dev.122804 |
| [18] |
CAPUANA L, BOSTRÖM A, ETIENNE-MANNEVILLE S. Multicellular scale front-to-rear polarity in collective migration[J]. Curr Opin Cell Biol, 2020, 62: 114-122. DOI:10.1016/j.ceb.2019.10.001 |
| [19] |
AMIN F, AHMED A, FEROZ A, et al. An update on the association of protein kinases with cardiovascular diseases[J]. Curr Pharm Des, 2019, 25(2): 174-183. DOI:10.2174/1381612825666190312115140 |
| [20] |
LAWSON C D, RIDLEY A J. Rho GTPase signaling complexes in cell migration and invasion[J]. J Cell Biol, 2018, 217(2): 447-457. DOI:10.1083/jcb.201612069 |
| [21] |
DUMAN J G, MULHERKAR S, TU Y K, et al. Mechanisms for spatiotemporal regulation of Rho-GTPase signaling at synapses[J]. Neurosci Lett, 2015, 601: 4-10. DOI:10.1016/j.neulet.2015.05.034 |
| [22] |
ZHANG L, WRANA J L. Regulation of Rho GTPases from the lateral sides of migrating cells[J]. Small GTPases, 2018, 9(4): 345-348. DOI:10.1080/21541248.2016.1234430 |
| [23] |
POLGAR N, FOGELGREN B. Regulation of cell polarity by exocyst-mediated trafficking[J]. Cold Spring Harb Perspect Biol, 2018, 10(3). DOI:10.1101/cshperspect.a031401 |




