乳腺癌是临床上常见的恶性肿瘤之一,其发病率和致死率均在世界女性疾病前列[1],其中在我国30~40岁女性恶性肿瘤患者中,乳腺癌病死率高居第1位[2],同时发病率有逐年上升的趋势,目前已有每年超30万的新增乳腺癌患者[3]。尽管近年来医疗技术水平得到了一定的发展,在临床上针对乳腺癌的治疗也有了进步,但目前乳腺癌患者仍面临着预后效果差或是费用较高的问题,因此,不断开展乳腺癌相关药物研究来寻求能逆转或增强癌细胞抗肿瘤作用的药物具有重要的意义。柴胡皂苷D是从柴胡中分离出来的药理活性最强三萜皂苷之一,研究表明,其可以抑制癌细胞的增殖,并促进癌细胞的凋亡[4]。已有研究证实,柴胡皂苷D对包括乳腺癌、宫颈癌、肝癌在内的诸多癌症均有一定的抗癌活性[5]。JAK酪氨酸蛋白激酶-信号传导和转录激活因子(janus kinase-signal transducers and activators of transcription, JAK-STAT) 信号通路是细胞因子信号传导的重要途径,JAK2/STAT3信号通路在多种肿瘤发展过程中扮演者重要角色[6]。本研究旨在探讨柴胡皂苷D通过JAK2/STAT3信号通路对细胞增殖和凋亡影响。
1 材料与方法 1.1 实验材料实验细胞:人乳腺癌细胞株MCF-7,由中国科学院(上海)细胞库提供。药物:柴胡皂苷D(上海阿拉丁试剂公司,纯度≥98%,货号S114050)。实验试剂及材料:RPMI1640由GIBCO公司提供,AnnexinV-FITC/PI试剂盒由美国BD公司提供;兔抗磷酸化JAK2(p-JAK2)、兔抗磷酸化STAT3(P-STAT3)、HRP标记的山羊抗兔IgG、兔抗GADPH均由美国Bioword公司提供;兔抗鼠Ki-67由Santa Cruz公司提供;MTT由Sigma-Aldrich公司提供;HERAcell 240i CO2恒温细胞培养箱由美国Thermo Forma公司提供;SE300型蛋白质电泳仪,由美国Hoefer公司提供;TE22型蛋白质转膜仪由美国Hoefer公司提供;GBOX型凝胶成像系统、流式细胞仪FACSAriaTM及分析软件均由美国BD公司提供。
1.2 实验方法 1.2.1 细胞培养将MCF-7人乳腺癌细胞株进行常规复苏后置于6孔板中培养,培养液为RPMI1640,其中含10 %胎牛血清、100 U/mL链霉素、100 U/mL青霉素,再置于37℃、5% CO2饱和湿度的细胞培养箱中孵育,每2天进行1次传代。
1.2.2 MTT法测定细胞增殖取对数生长期的MCF-7细胞以2 000 μL/孔接种于96孔板,待细胞贴壁后每孔加入0、5、10、20 μmol/L的柴胡皂苷D,即为对照组、低剂量组、中剂量组、高剂量组,每组6个复孔,培养12、24、36、48、60、72 h后每孔加入5 mg/mL MTT 20 μL,继续孵育4 h,弃去培养基,每孔加二甲基亚砜150 μL/孔,在摇床上低速振荡10 min,置酶标仪于490 nm测定各孔的光密度值D(490),光密度值越高则意味着细胞活力越高,细胞活力越高则表明细胞增殖能力越强。
1.2.3 流式细胞仪测定细胞凋亡取对数生长期的各组MCF-7细胞,同1.2.2处理分组后,培养48 h后,收集细胞,经预冷的磷酸缓冲盐溶液(PBS)漂洗后,重悬收集细胞,并用PBS洗涤3次。加入Annexin V-FITC混匀,在室温条件下避光染色20 min,再加入碘化丙啶(PI),室温避光染色,在1 h内使用流式细胞仪检查荧光强度,观察各组细胞的凋亡情况。
1.2.4 免疫组织化学细胞分组同上。在培养48 h后,采用离心机以2 000 r/min离心10 min,弃悬液,用10%中性甲醛固定并离心后得到细胞团,加入等体积预胶化淀粉并将其混匀,置于包埋盒中固定、脱水,具体步骤为10%中性甲醛5 min、80% 乙醇10 min、90% 乙醇10 min、95%乙醇25 min、100%乙醇Ⅰ20 min、100%乙醇Ⅱ 25 min、二甲苯Ⅰ10 min、二甲苯Ⅱ10 min、石蜡Ⅰ20 min、石蜡Ⅱ40 min,其他与制作组织标本步骤一致。石蜡标本行切片、常规烤片脱蜡水化处理,置于0.01 mol/L柠檬酸钠缓冲液,用微波加热进行抗原修复。浸泡在含3%的H2O2的去离子水中10 min,加山羊血清工作液封闭15 min后,加入对应一抗(JAK2和STAT3抗体,工作浓度均为1 ∶50)于4 ℃冰箱孵育过夜,用PBS冲洗后加即用型生物素标记的二抗,室温孵育15 min,经PBS冲洗后加新配置的DAB溶液显色,水洗、苏木精复染、脱水、封片,最后用显微图像分析系统分析处理,JAK2和STAT3均用积分光密度值(integrated optical density,IOD)表示。以PBS替代一抗作为染色的阴性对照。
1.2.5 Western blot检测JAK2/STAT3通路蛋白及ki-67蛋白细胞分组同上。处理24 h后,胰酶消化收集细胞,提取总蛋白并测定浓度。根据Western blot试剂盒说明书进行,每孔加入50 μg蛋白溶液进行电泳分离后转膜,5%脱脂奶粉封闭,采用兔抗人单克隆一抗(JAK2、STAT3和Ki-67,工作浓度1 ∶300)孵育过夜,之后用TBST洗涤后,加入HRP标记的山羊抗兔二抗,孵育2 h后进行成像,以β-actin为内参,用Bandscan 5.0软件进行半定量分析。根据内参标准计算目标条带相对值,判断蛋白相对表达量。
1.3 统计学分析采用SPSS 22.0统计软件进行数据分析,符合正态分布的计量资料采用x±s表示,方差齐的多组均值比较采用单因素方差分析,两两比较行LSD检验,方差不齐的数据比较采用Kruskal-Wallis H检验分析,两两比较Tamhane’s T2检验,检验水准α=0.05。
2 结果 2.1 柴胡皂苷D对MCF-7细胞增殖的影响MTT分析结果显示,对照组、低剂量组、中剂量组和高剂量组MCF-7细胞活力差异有统计学意义(F=5.099、38.908、159.680、234.885、344.866、386.914,P<0.05)。与对照组比较,在12、24、36、48、60、72 h后低剂量组、中剂量组和高剂量组MCF-7细胞活力均显著降低(P<0.05),且低剂量组细胞活力在24、36、48、60、72 h均高于中剂量组和高剂量组(P<0.05),中剂量组细胞活力在24、36、48、60、72 h均高于高剂量组(P<0.05),并且随时间的增加,差异越明显。结果见图 1。

|
| a: P<0.05, 与对照组比较;b: P<0.05, 与低剂量组比较;c: P<0.05, 与中剂量组比较 图 1 MTT分析柴胡皂苷D对各组MCF-7细胞增殖的影响 |
2.2 柴胡皂苷D对MCF-7细胞凋亡的影响
流式细胞术检测结果显示,对照组、低剂量组、中剂量组和高剂量组MCF-7细胞凋亡率比较差异具有统计学意义(χ2=21.609,P<0.05)。与对照组比较,低剂量组、中剂量组和高剂量组的细胞凋亡率均升高(P<0.05),且低剂量组细胞凋亡率均低于中剂量组和高剂量组(P<0.05),中剂量组细胞凋亡率低于高剂量组(P<0.05)。结果见图 2,表 1。
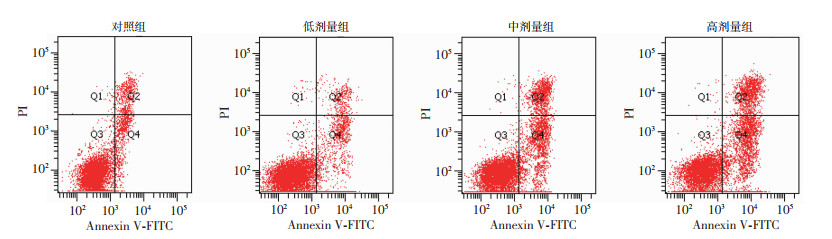
|
| 图 2 流式细胞术检测柴胡皂苷D对各组MCF-7细胞凋亡的影响 |
| 组别 | 细胞凋亡率 |
| 对照组 | 9.73±0.88 |
| 低剂量组 | 13.88±1.08a |
| 中剂量组 | 21.59±1.44ab |
| 高剂量组 | 29.34±1.88abc |
| χ2值 | 21.609 |
| P值 | 0.000 |
| a:P<0.05, 与对照组比较;b: P<0.05, 与低剂量组比较;c: P<0.05, 与中剂量组比较 | |
2.3 柴胡皂苷D对MCF-7细胞JAK2/STAT3通路的影响
免疫组化检测结果显示,对照组、低剂量组、中剂量组和高剂量组MCF-7细胞JAK2、STAT3蛋白相对表达量比较差异具有统计学意义(F=44.343、46.389,P<0.05)。与对照组比较,低剂量组、中剂量组和高剂量组MCF-7细胞JAK2、STAT3表达均降低(P<0.05),且低剂量组细胞JAK2、STAT3表达均高于中剂量组和高剂量组(P<0.05),中剂量组细胞JAK2、STAT3表达均高于高剂量组(P<0.05)。结果见图 3,表 2。

|
| 图 3 各组细胞JAK2、STAT3蛋白表达情况(SABC ×400) |
| 组别 | n | IOD | |
| JAK2 | STAT3 | ||
| 对照组 | 6 | 2.08±0.21 | 1.98±0.20 |
| 低剂量组 | 6 | 1.56±0.17 | 1.43±0.18 |
| 中剂量组 | 6 | 1.16±0.20 | 1.21±0.15 |
| 高剂量组 | 6 | 0.98±0.13 | 0.91±0.10 |
| F值 | — | 44.343 | 46.389 |
| P值 | — | 0.000 | 0.000 |
2.4 柴胡皂苷D对MCF-7细胞JAK2/STAT3通路及Ki-67的影响
Western blot检测结果显示,对照组、低剂量组、中剂量组和高剂量组MCF-7细胞JAK2、STAT3、Ki-67蛋白相对表达量比较差异具有统计学意义(F=25.241、18.102、14.997,P<0.05)。与对照组比较,低剂量组、中剂量组和高剂量组的细胞JAK2、STAT3、Ki-67相对表达量均降低(P<0.05),且低剂量组细胞JAK2、STAT3、Ki-67相对表达量均高于中剂量组和高剂量组(P<0.05),中剂量组细胞JAK2、STAT3、Ki-67相对表达量均高于高剂量组(P<0.05)。结果见图 4,表 3。

|
| 图 4 Western blot检测各组MCF-7细胞JAK2、STAT3蛋白的表达 |
| 对照组 | 6 | 0.94±0.08 | 0.78±0.14 | 0.67±0.18 |
| 组别 | n | JAK2 | STAT3 | Ki-67 |
| 低剂量组 | 6 | 0.78±0.11a | 0.69±0.11a | 0.46±0.14a |
| 中剂量组 | 6 | 0.61±0.08ab | 0.54±0.06ab | 0.31±0.10ab |
| 高剂量组 | 6 | 0.46±0.07abc | 0.39±0.05abc | 0.19±0.08abc |
| F值 | 33.744 | 18.816 | 14.997 | |
| P值 | 0.000 | 0.000 | 0.000 | |
| a:P<0.05, 与对照组比较;b: P<0.05, 与低剂量组比较;c: P<0.05, 与中剂量组比较 | ||||
3 讨论
据美国癌症学会2018年发布的数据[7],乳腺癌新发病例210万,新发死亡病例63万,乳腺癌已成为导致女性患者癌症死亡的首要病因。目前针对乳腺癌的治疗多采用放射治疗和化疗,同时还有手术切除治疗、内分泌治疗和生物治疗等手段,虽然有一定疗效,但或是毒副作用大,或是易产生耐药性而出现复发、转移,或是费用较高,或是不为大多数患者所接受,均会对患者治疗产生一定的心理负担[8]。因此,学界展开了深入研究,以寻求可靠的临床治疗乳腺癌的方法。
柴胡皂苷D是柴胡中最为活跃、药理作用最强的成分之一,具有抗炎、抗纤维化、抗氧化和抗癌等[9],通过抑制细胞增殖、分裂,影响肿瘤基因表达等作用机制而实现诱导肿瘤细胞凋亡[4]。赵炜等[10]认为,柴胡皂苷D可通过抑制钙联蛋白(Calnexin)/钙网蛋白(Calreticulin)循环,促进内质网应激,使得未折叠或折叠错误的蛋白在内质网堆积,实现诱导癌细胞凋亡。王宗明等[11]研究认为,柴胡皂苷D通过负调控mTORC信号通路,诱导癌细胞自噬,进而实现抗肿瘤的目的。本研究采用不同浓度的柴胡皂苷D观察其对乳腺癌MCF-7细胞增殖及凋亡的影响,结果显示,在12、24、36、48、60、72h后对照组MCF-7细胞活力均显著高于低剂量组、中剂量组及高剂量组,且低剂量组细胞活力高于中剂量组,中剂量组高于高剂量组,并且随着时间的增加,差异越加明显;同时Ki-67与肿瘤细胞的增殖密切相关,经Western blot检测各组Ki-67的表达,差异也与MTT结果相同;流式细胞术检测结果显示,对照组MCF-7细胞凋亡率均明显低于低剂量组、中剂量组和高剂量组,且低剂量组细胞凋亡率低于中剂量组,中剂量组低于高剂量组。这一结果与此前罗燕等[12]研究结果相吻合,进一步证实了柴胡皂苷D对乳腺癌细胞增殖有抑制作用,能够促进其凋亡。
有研究[13]表明,JAK2/STAT3信号通路是细胞因子信号传导的重要途径,在恶性肿瘤的发展过程中发挥着关键作用,信号通路尤其是STAT3的过表达与肿瘤的发展密切相关。STAT3作为JAK2的下游信号,能够转导信号至细胞核内,进而诱导目的基因表达、转录,最终实现胞内信号转导[14]。JAK2/STAT3信号通路被持续激活后,癌细胞增殖、迁移和侵袭等活动均得到一定程度影响[15]。有研究[15]表明,抑制JAK2/STAT3信号通路具有抑制肿瘤的效果。本研究通过柴胡皂苷D干预乳腺癌MCF-7细胞,通过细胞免疫组化实验,得不同组别细胞JAK2和STAT3蛋白的表达比较有差异,其中对照组MCF-7细胞JAK2、STAT3表达均显著高于低剂量组、中剂量组和高剂量组,且低剂量组细胞JAK2、STAT3表达高于中剂量组,中剂量组高于高剂量组。后经Western blot实验,各组JAK2、STAT3表达趋势与免疫组化结果一致。提示不同浓度的柴胡皂苷D能够在不同程度上的抑制乳腺癌MCF-7细胞JAK2/STAT3信号通路,进而实现对乳腺癌细胞抑制增殖及促进其凋亡。
综上,柴胡皂苷D能够抑制乳腺癌细胞MCF-7的增殖,促进细胞凋亡,其作用机制可能与JAK2/STAT3通路密切相关。本研究在一定程度上为乳腺癌的临床治疗提供了理论参考。
| [1] |
齐世美, 吕俊, 孟宇, 等. 七叶皂苷钠通过抑制AKT, ERK上游信号SRC活性诱导人乳腺癌MCF-7细胞凋亡[J]. 中国中药杂志, 2015, 40(16): 3267-3272. QI S M, LYU J, MENG Y, et al. Effect of sodium aescinate in inducing human breast cancer MCF-7 cells apoptosis by inhibiting AKT, ERK and upstream signal SRC activity[J]. China J Chin Mater Med, 2015, 40(16): 3267-3272. DOI:10.4268/cjcmm20151628 |
| [2] |
SANTOS J M, HUSSAIN F. Higher glucose enhances breast cancer cell aggressiveness[J]. Nutr Cancer, 2020, 72(5): 734-746. DOI:10.1080/01635581.2019.1654527 |
| [3] |
LAPPANO R, RIGIRACCIOLO D C, BELFIORE A, et al. Cancer associated fibroblasts: role in breast cancer and potential as therapeutic targets[J]. Expert Opin Ther Targets, 2020, 24(6): 559-572. DOI:10.1080/14728222.2020.1751819 |
| [4] |
刘丹, 王佳贺. 柴胡皂苷抗肿瘤作用机制的研究进展[J]. 现代药物与临床, 2018, 33(1): 203-208. LIU D, WANG J H. Research progress on antitumor mechanisms of saikosaponin[J]. Drugs Clin, 2018, 33(1): 203-208. DOI:10.7501/j.issn.1674-5515.2017.01.045 |
| [5] |
刘志华, 王刚, 沈建飞. 柴胡皂苷-D抑制宫颈癌Hela细胞的分子机制研究[J]. 中华中医药学刊, 2016, 34(12): 2931-2934. LIU Z H, WANG G, SHEN J F. Mechanism of saikosaponin-d inhibiting cervical cell hela[J]. Chin Arch Tradit Chin Med, 2016, 34(12): 2931-2934. DOI:10.13193/j.issn.1673-7717.2016.12.031 |
| [6] |
成志勇, 张丽军, 徐倩, 等. JAK-STAT通路在肿瘤发病中的研究进展[J]. 生理科学进展, 2017, 48(2): 127-131. CHENG Z Y, ZHANG L J, XU Q, et al. Research progress of JAK-STAT pathway in tumorigenesis[J]. Prog Physiol Sci, 2017, 48(2): 127-131. DOI:10.3969/j.issn.0559-7765.2017.02.010 |
| [7] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [8] |
邵志敏. 乳腺癌保乳手术的进展与评述[J]. 肿瘤防治研究, 2018, 45(5): 269-273. SHAO Z M. Progress and comment of breast conserving therapy[J]. Cancer Res Prev Treat, 2018, 45(5): 269-273. DOI:10.3971/j.issn.1000-8578.2018.18.0268 |
| [9] |
SHIN J S, IM H T, LEE K T. Saikosaponin B2 suppresses inflammatory responses through IKK/IκBα/NF-κB signaling inactivation in LPS-induced RAW 264.7 macrophages[J]. Inflammation, 2019, 42(1): 342-353. DOI:10.1007/s10753-018-0898-0 |
| [10] |
赵炜, 刘睿, 修俊青, 等. 柴胡皂苷D对人乳腺癌MCF-7细胞株迁移、凋亡及Calnexin/Calreticulin循环的影响[J]. 现代中药研究与实践, 2018, 32(6): 16-19. ZHAO W, LIU R, XIU J Q, et al. Effects of saikosaponin D on migration, apoptosis and calnexin/calreticulin circulation in human breast cancer MCF-7 cell line[J]. Res Pract Chin Med, 2018, 32(6): 16-19. DOI:10.13728/j.1673-6427.2018.06.005 |
| [11] |
王宗明, 王敏, 肖欢智. 柴胡皂苷D通过调控mTORC信号通路诱发肝癌细胞自噬的作用研究[J]. 中国药学杂志, 2018, 53(19): 1652-1657. WANG Z M, WANG M, XIAO H Z. Effect and mechanism of saikosaponin D on autophagy by regulating mTORC pathway in human hepatocellular carcinoma cells[J]. Chin Pharm J, 2018, 53(19): 1652-1657. DOI:10.11669/cpj.2018.19.006 |
| [12] |
罗燕, 蒋益兰, 李勇敏, 等. 柴胡皂苷D对乳腺癌MDA-MB-231细胞增殖、周期及周期相关调控因子表达的影响[J]. 中国中西医结合杂志, 2019, 39(5): 572-576. LUO Y, JIANG Y L, LI Y M, et al. Effects of saikosaponin D on the proliferation, cell cycle and the expressions of cyclins in breast cancer MDA-MB-231 cells[J]. Chin J Integr Tradit West Med, 2019, 39(5): 572-576. DOI:10.7661/j.cjim.20190322.104 |
| [13] |
赵绿翠, 廖科, 李科琼, 等. 吴茱萸碱调控人结肠癌HCT-116细胞中JAK2/STAT3信号通路的机制研究[J]. 中国药理学通报, 2015(10): 1394-1397, 1398. ZHAO L C, LIAO K, LI K Q, et al. Modulatory effect of Evodiamine on JAK2/STAT3 signal pathway in HCT-116 cells[J]. Chin Pharmacol Bull, 2015(10): 1394-1397, 1398. DOI:10.3969/j.issn.1001-1978.2015.10.014 |
| [14] |
赵冀安, 刘文聪, 孙会凤, 等. JAK2/STAT3信号通路在肝细胞性肝癌中表达及意义[J]. 中国普通外科杂志, 2016, 25(1): 83-89. ZHAO J A, LIU W C, SUN H F, et al. Expression of JAK2/STAT3 signaling pathway in human hepatocellular carcinoma and its significance[J]. Chin J Gen Surg, 2016, 25(1): 83-89. DOI:10.3978/j.issn.1005-6947.2016.01.013 |
| [15] |
SPRINGUEL L, RENAULD J C, KNOOPS L. JAK kinase targeting in hematologic malignancies: a sinuous pathway from identification of genetic alterations towards clinical indications[J]. Haematologica, 2015, 100(10): 1240-1253. DOI:10.3324/haematol.2015.132142 |




