2. 550004 贵阳,中国医学科学院成体干细胞转化研究重点实验室
2. Key Laboratory of Adult Stem Cell Translational Research, Chinese Academy of Medical Sciences, Guiyang, Guizhou Province, 550004, China
核糖体蛋白L15(ribosomal protein L15,RPL15)属于真核生物核糖体60S亚基的一个组成部分,分布于细胞质和细胞核内,主要定位于核仁并呈点状分布。RPL15在核仁中的定位有利于核仁结构的形成与维持,也可能参与rRNA的成熟过程[1]。核糖体蛋白除了主要参与蛋白质合成过程外,也可通过参与复制、转录、RNA加工、DNA修复等过程在细胞增殖、凋亡、发育的调控和恶性转化等方面发挥作用。RPL15与多种癌症的发生发展具有相关性。研究表明,RPL15在胃癌、食管癌、结肠癌中过度表达[2],与此相反,在皮肤鳞状细胞癌和胰腺导管腺癌中表达却下调[3]。极光激酶抑制剂Danusertib可通过负性调控RPL15这个下游关键靶位点,引起具有红系分化潜能的K562细胞发生程序性死亡[4]。与此同时,研究表明RPL15基因被证实在先天性纯红细胞再生障碍性贫血(Diamoncl-Blackfan anemia,DBA)患者中存在突变[5]。但目前RPL15基因在红系造血发育疾病发生发展中的机制尚未阐述清晰,进一步深入认识RPL15基因对红系造血发育的作用机制具有重要意义。通过比较发现人与斑马鱼Rpl15蛋白有79%的同源性,更重要的是斑马鱼体外受精、体外发育、胚胎透明及产卵量大等优势,使其成为研究疾病发生发展的良好模式生物。近几年CRISPR/Cas9基因编辑技术因其系统设计简单、成本低廉、快捷高效等优点,在斑马鱼基因编辑领域得到广泛应用[6-7]。因此,本研究选择斑马鱼为研究对象,利用CRISPR/Cas9基因编辑技术对rpl15基因进行敲除,通过测序筛选阳性突变体,观察敲除rpl15斑马鱼的表型变化,初步探讨了敲除rpl15对斑马鱼红系造血发育的影响,为研究rpl15在红系造血疾病发生发展中的作用提供实验基础。
1 材料与方法 1.1 材料 1.1.1 实验动物Tubingen(本课题组饲养)品系野生型斑马鱼,饲养于28.5 ℃恒温自动循环水系统中,光暗周期比为12 h ∶12 h。取雌雄斑马鱼按1 ∶(1~2) 的比例放入产卵缸内,用隔板分隔开,次日光照10 min后拔板,0.5 h后收集受精卵,胚胎置于28.5 ℃恒温培养箱中培养。
1.1.2 试剂质粒pSP6-2sNLS-spCas9由上海交通大学医学院附属瑞金医院上海血液病研究所袁浩博士惠赠;转录试剂盒(MEGAshortscript T7 Transcription kit)、mRNA纯化试剂盒(mirVanaTM miRNA isolation kit)、逆转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)和Cas9蛋白(TrueCutTM Cas9 Protein v2)试剂盒均购自美国Thermo Fisher Scientific公司;T7E1限制性内切酶购自New England Biolabs(NEB)公司;PCR引物、DNA序列及DNA Marker购自Invitrogen公司;PCR试剂盒和普通DNA产物纯化试剂盒购自天根生化科技有限公司;斑马鱼血红蛋白O-dianisidine染色试剂盒、斑马鱼中性粒细胞染色试剂盒购自苏州木芮生物科技有限公司。
1.1.3 仪器超微量分光光度计(NanoDrop one)购自Thermo Fisher Scientific公司;显微注射仪(PLI-100)购自Harvard Apparatus公司;Real-time PCR仪(C1000)购自Bio-Rad公司;体式显微镜(SMZ645)购自Nikon公司。
1.2 斑马鱼rpl15基因敲除 1.2.1 gRNA靶位点及鉴定引物设计根据靶位点预测网站http://crispr.dbcls.jp/预测符合设计条件的rpl15基因的gRNA。随后通过靶位点评估网站http://www.oligoevaluator.com/,在斑马鱼rpl15第一外显子和第三外显子处选取5个没有脱靶且高效的靶位点(表 1)。同时设计各靶序列的鉴定引物。
| 靶位点 | 序列(5′→3′) | 位置 |
| gRNA1 | GGCCTTGTATCCCAGTCTACGGG | 1号外显子上 |
| gRNA2 | GGGAGCGTACAAGTATATGCAGG | 1号外显子上 |
| gRNA3 | ACCAGATAAAGCCCGTAGACTGG | 1号外显子上 |
| gRNA4 | CCAGATAAAGCCCGTAGACTGGG | 1号外显子上 |
| gRNA5 | GGTCCTGAACTCCTACTGGGTGG | 3号外显子上 |
| _:PAM序列 | ||
1.2.2 gRNA的制备
采用PCR产物体外转录的方法合成gRNA。具体方法如下:在选取的靶位点序列前方添加T7启动子序列5′-TAATACGACTCACTATA-3′及识别碱基G,后方添加部分骨架序列5′-GTTTTAGAGCTAGAAATAGC-3′,然后以上述合成pT7-gRNAn (n=1、2、3、4、5) DNA片段作为正向引物(表 2),反向引物为gRNA骨架通用引物PRgRNA:5′-AAAAAAAGCACCGACTCGGT-3′。以pSP6-2sNLS-spCas9质粒作为模板,通过PCR扩增出转录所需DNA片段,PCR反应条件为94 ℃,3 min; 30×(94 ℃,30 s;60 ℃,30 s;72 ℃,1 min);72 ℃,5 min,4 ℃保存。通过琼脂糖凝胶电泳及测序检测PCR产物是否正确,将测序结果正确的PCR产物经纯化回收后,用T7转录试剂盒体外转录gRNA。纯化回收转录的gRNA并进行浓度测定,gRNA原液分装冻存于-80 ℃。
| 靶位点 | 序列(5′→3′) |
| gRNA1 | TAATACGACTCACTATAGGGCCTTGTATCCCAGTCTACGTTTTAGAGCTAG |
| gRNA2 | TAATACGACTCACTATAGGGGAGCGTACAAGTATATGCGTTTTAGAGCTAG |
| gRNA3 | TAATACGACTCACTATAGACCAGATAAAGCCCGTAGACGTTTTAGAGCTAG |
| gRNA4 | TAATACGACTCACTATAGCCAGATAAAGCCCGTAGACTGTTTTAGAGCTAG |
| gRNA5 | TAATACGACTCACTATAGGGTCCTGAACTCCTACTGGGGTTTTAGAGCTAG |
| _:靶位点序列 | |
1.2.3 gRNA有效性的验证
分别将Cas9蛋白(250~300 pg/nL)与gRNA (25~35 pg/nL)等体积混匀后显微注射到单细胞期野生型Tuebingen品系斑马鱼受精卵中。每个gRNA靶点注射200枚斑马鱼单细胞期受精卵,每枚受精卵注射1~2 nL混合物。同时留取100枚注射等量体积DEPC水的同批胚胎作为对照。取受精后小时数(hours post-fertilization, hpf) 为72~96的F0存活胚胎和对照组存活胚胎各10枚,提取各组胚胎基因组DNA。以基因组DNA为模板,采用相应鉴定引物进行PCR反应(表 3),得到的PCR产物进行纯化回收。T7E1酶切检测敲除效率,将发生突变的PCR产物送TA克隆测序,检测每条鱼体细胞主要的突变类型。
| 靶位点 | 引物序列(5′→3′) | 片段大小/bp |
| gRNA1 | 上游: GCATCATGGGAGCGTACAAG | 266 |
| 下游: GAGATCGTAGTGGACCACCC | ||
| gRNA2 | 上游: ATGTCAGAATCGTGGTCGGC | 436 |
| 下游: GAGCCCGATGAAGGGAAGAC | ||
| gRNA3 | 上游: GCATCATGGGAGCGTACAAG | 266 |
| 下游: GAGATCGTAGTGGACCACCC | ||
| gRNA4 | 上游: GCATCATGGGAGCGTACAAG | 266 |
| 下游: GAGATCGTAGTGGACCACCC | ||
| gRNA5 | 上游: GCCATGGCTTCTGTTTACGGT | 345 |
| 下游: CCGCCGATGGTAAGGTGAAA |
1.2.4 斑马鱼突变体的筛选
将有效的gRNA和Cas9蛋白混合物显微注射入野生型(wild type, WT)斑马鱼单细胞期受精卵中,于48~72 hpf在体式显微镜下观察并记录异常表型。用50 mmol/L的NaOH和1 mol/L的Tris-HCL提取单个具有明显突变表型斑马鱼胚胎的基因组,用相应鉴定引物进行PCR反应。扩增产物送测序确认体细胞突变类型。
1.3 rpl15突变体表型的验证 1.3.1 O-dianisidine染色检测斑马鱼体内血红蛋白表达收取48 hpf和72 hpf的野生型及rpl15突变型幼鱼各10尾,采用斑马鱼血红蛋白O-dianisidine染色试剂盒进行检测,具体方法参考试剂盒说明书。
1.3.2 斑马鱼中性粒细胞染色检测斑马鱼体内中性粒细胞生成情况收取72 hpf的野生型及rpl15突变型幼鱼各10尾,采用斑马鱼中性粒细胞染色试剂盒进行检测,具体方法参考试剂盒说明书。
1.3.3 qRT-PCR检测rpl15突变体基因表达收集72 hpf的野生型和rpl15突变型幼鱼各10尾,分别提取总RNA并逆转录成cDNA。针对斑马鱼原始造血干细胞转录因子scl、定向造血干细胞转录因子c-myb、髓系转录因子pu. 1、红系转录因子gata 1、中性粒细胞转录因子mpo、巨噬/单核细胞转录因子l-plastin、淋巴细胞转录因子rag 1、α-globin、热休克蛋白70(heat shock protein 70,hsp 70)、抑癌基因p53和双微染色体2基因(murine double mimute 2,mdm 2)及内参基因gapdh设计qRT-PCR引物(表 4)。
| 待测基因 | 引物序列(5′→3′) | 片段大小/bp |
| p53 | 上游: CCCGGATGGAGATAACTTG | 151 |
| 下游: CACAGTTGTCCATTCAGCAC | ||
| scl | 上游: CTATTAACCGTGGTTTTGCTGG | 145 |
| 下游: CCATCGTTGATTTCAACCTCAT | ||
| c-myb | 上游: GCCCCCAGTATTGCTCACTT | 96 |
| 下游: GCATCGGGCACAGTTTGTTT | ||
| pu.1 | 上游: AGAGCTACAAAGCGTGCAGT | 85 |
| 下游: CCTGGGTCCATGAAATGGCT | ||
| mpo | 上游: GTTTAGCAAGGGTGCGCAAA | 394 |
| 下游: CCTTTTGGCTGAGAAACGGC | ||
| l-plastin | 上游: GAAGCTCTGATCGCTCTGCT | 129 |
| 下游: GTTGTTGATTTTGGGGCATC | ||
| rag1 | 上游: GTATGGGAGACGTCAGCGAG | 237 |
| 下游: CTGCTACCACAGGTCCCAAG | ||
| α-globin | 上游: TGCTCTCTCCAGGATGTTG | 160 |
| 下游: TCCGGCATTAAGGTCATC | ||
| mdm2 | 上游: AAGCAGTGATCCTGAGAGTTC | 157 |
| 下游: ATCCGAAGACTCGCTGTTC | ||
| gata1 | 上游: GTCCAGTTCGCCAAGTTTAC | 97 |
| 下游: GGGTTGTAGGGAGAGTTTAG | ||
| hsp70 | 上游: ACCTCTTCAGGGGAACACTA | 78 |
| 下游: TGTCGTGGATCTGAGCCTTG | ||
| gapdh | 上游: AGGCAGAAGGCGGCAAAC | 124 |
| 下游: AAGACACCAGTAGACTCCACAAC |
1.4 统计学分析
各实验至少重复3次,使用SPSS 21.0统计软件进行单因素方差分析。检验水准:α=0.05。
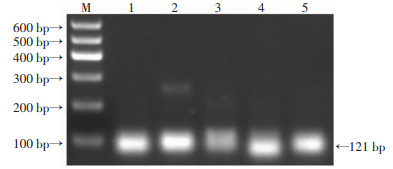
2 结果 2.1 成功制备gRNA琼脂糖凝胶电泳结果显示,成功转录出gRNA1、gRNA2、gRNA3、gRNA4及gRNA5(图 1)。超微量分光光度计测定gRNA1、gRNA2、gRNA3、gRNA4及gRNA5浓度分别为85、101、50、83及76 ng/μL。
|
| M: DNA标准(DL600);1: rpl15-gRNA1;2:rpl15-gRNA2;3:rpl15-gRNA3;4:rpl15 -gRNA4;5:rpl15 -gRNA5 图 1 体外转录合成gRNA |
2.2 分析rpl15 -gRNA5有效性
将gRNA1、gRNA2、gRNA3、gRNA4及gRNA5与Cas9蛋白混合物显微注射到斑马鱼单细胞期受精卵,提取72 hpf胚胎(10枚/组)基因组,并进行鉴定DNA片段的扩增。T7E1酶切纯化后的PCR产物,琼脂糖凝胶电泳结果显示仅有gRNA5有效(图 2A)。同时PCR产物测序结果显示在rpl15 -gRNA5靶位点(黑色框所标注序列)附近出现重叠峰(图 2B),确定rpl15 -gRNA5可有效诱导靶位点发生突变。采用gRNA5和Cas9蛋白混合物批量显微注射斑马鱼单细胞期受精卵,孵育3~5 d收集胚胎提取DNA并利用gRNA5靶位点鉴定引物进行PCR,将扩增产物进行TA克隆测序,筛选出有移码突变的F0代斑马鱼并检测体细胞主要的突变类型,显示靶位点附近有插入、缺失及单个碱基突变(图 2C)。

|
| A: T7E1酶切鉴定gRNA5靶位点发生突变M: DNA标准(DL 600);1:野生型斑马鱼组;2: gRNA5/Cas9蛋白混合物注射组;B: PCR产物测序峰图WT: 野生型斑马鱼组;MU(MIX) : gRNA5/Cas9混合物注射组;黑色方框标记gRNA5靶位点序列;黑色线标记基因组序列开始突变的位置;C: 代表性体细胞突变类型下划线表示靶位点序列;绿色表示PAM序列;黄色表示单个突变后的碱基;蓝色表示插入碱基;红色虚线表示缺失碱基 图 2 测序及T7E1酶切检测gRNA5的作用 |
2.3 筛选出rpl15突变体
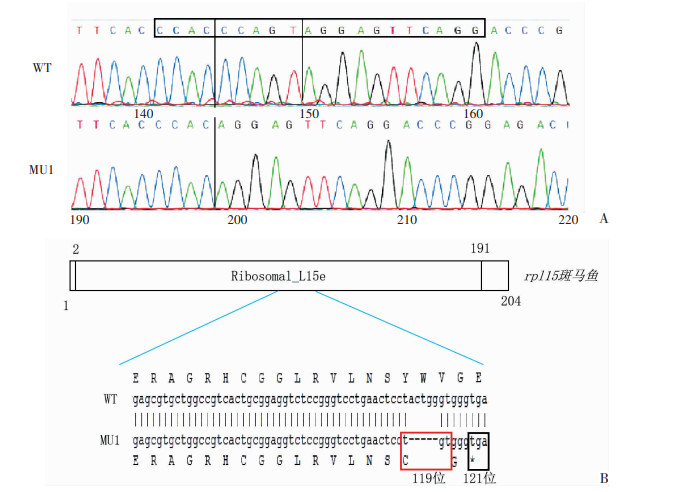
显微注射rpl15 -gRNA5和Cas9蛋白混合物到斑马鱼单细胞期受精卵,提取具有明显异常表型斑马鱼胚胎的基因组并进行PCR,扩增产物送测序。结果显示具有明显异常表型的斑马鱼胚胎均为rpl15基因突变体,其中包括MU1突变体(图 3A)。通过比对氨基酸序列及移码突变在Rpl15蛋白的位置(图 3B),确定MU1突变属移码突变,且突变体只翻译了120个氨基酸,破坏了Rpl15的功能域。以上结果表明通过显微注射rpl15-gRNA5和Cas9蛋白混合物可成功筛选得到rpl15基因突变体。因此,后续将选择具有明显突变表型的斑马鱼胚胎进行相关实验。
|
| A:gRNA5作用靶位点测序结果WT:野生型斑马鱼;MU1:rpl15突变体;黑色方框标记靶位点序列;B:rpl15突变型氨基酸序列及其所在蛋白质序列位置WT:野生型斑马鱼序列;MU1:rpl15突变体序列;红色方框表示第1个产生移码突变的氨基酸是第119位氨基酸;121位氨基酸(终止密码子)表示突变体翻译到这个位点终止,蓝色实线表示移码突变发生在Rpl15蛋白功能结构域中 图 3 斑马鱼rpl15突变体的鉴定 |
2.4 rpl15突变体的表型变化
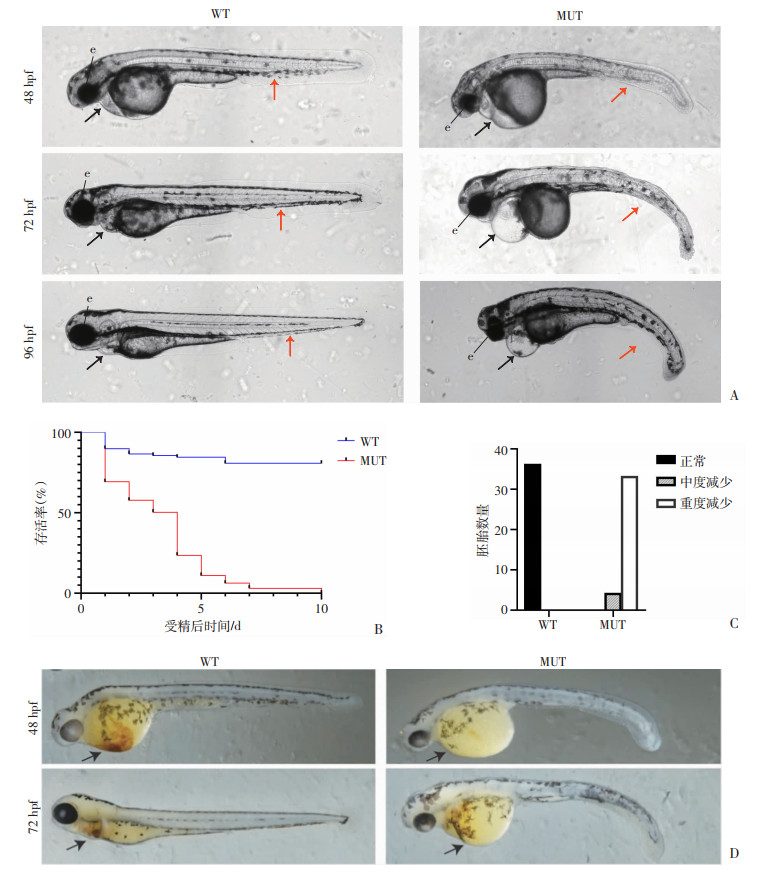
通过对比观察野生型和突变型斑马鱼的发育形态发现,突变型斑马鱼胚胎,在受精后有明显的发育延迟,达到相同的发育时期较野生型斑马鱼晚3~4 h。突变型斑马鱼胚胎于48、72、96 hpf均表现出明显的形态异常,具体包括体长缩短、向腹侧弯曲的尾巴、头部和眼睛较小及心包水肿(图 4A)。约95%的突变型斑马鱼于7~10 d发生死亡(图 4B)。
|
| A:rpl15突变型胚胎48、72及96 hpf表型黑色箭头示“心包水肿”改变部位;红色箭头示尾部弯曲部位;e:眼睛部位;B:突变型胚胎生存曲线;C:72 hpf时突变型和野生型斑马鱼血红蛋白染色结果统计数值表示不同血红蛋白减少程度的胚胎数量,与野生型比较O-dianisidine染色阳性结果程度分为正常(黑色)、中度减少(灰色)和重度减少(白色)3个水平,野生型组斑马鱼O-dianisidine染色均呈正常阳性结果;D:48 hpf和72 hpf突变型及野生型斑马鱼血红蛋白O-dianisidine染色结果黑色箭头示染色结果区域 图 4 rpl15突变对斑马鱼表型影响(×40) |
48 hpf和72 hpf斑马鱼血红蛋白O-dianisidine染色显示,突变型斑马鱼较野生型斑马鱼的血红蛋白染色阳性情况明显减少(图 4C、D)。
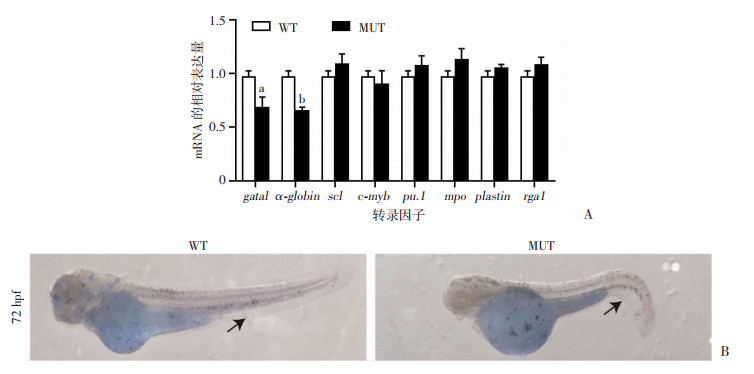
2.5 rpl15突变体造血相关转录因子的变化血红蛋白染色发现rpl15敲除后斑马鱼存在血红蛋白合成减少的现象,通过比较rpl15敲除前后scl、c-myb、pu. 1、gata1、mpo、l-plastin、rag1和α-globin的mRNA水平的表达变化,进一步验证斑马鱼rpl15突变体对红系造血发育的影响是否具有特异性。结果显示,突变型胚胎的gata 1和α-globin的表达水平较野生型胚胎显著下调(P < 0.05,P < 0.01);突变型胚胎的scl、c-myb、pu. 1、mpo、l-plastin和rag 1的表达水平较野生型胚胎差异无统计学意义(P>0.05,图 5A)。斑马鱼中性粒细胞染色结果显示,rpl15突变型胚胎与野生型胚胎染色结果无明显差异(图 5B)。表明rpl15突变体对斑马鱼红系造血发育的损害具有特异性。
|
| A:造血相关转录因子的mRNA水平变化WT:72 hpf的野生型鱼;MUT:72 hpf的rpl15突变型斑马鱼;a:P < 0.05, b:P < 0.01,与野生型比较;B:斑马鱼中性粒细胞染色结果黑色箭头示染色结果阳性区域 图 5 rpl15突变体对斑马鱼造血发育的影响(×40) |
2.6 rpl15突变体红系发育相关分子通路的变化
通过比较rpl15敲除前后gata 1分子伴侣hsp70、p53和mdm2的mRNA水平的表达变化,来分析rpl15突变损害斑马鱼红系发育的相关调控机制。结果显示,突变型胚胎的p53和mdm2的表达水平较野生型胚胎显著增加(P < 0.01,P < 0.05);hsp 70表达显著下调(P < 0.05,图 6)。初步表明p53相关通路及gata1分子伴侣hsp70可能参与了rpl15缺失对斑马鱼红系造血影响的调控。
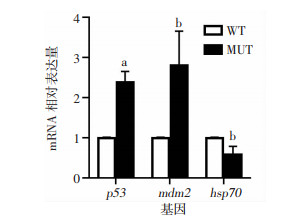
|
| WT: 72 hpf的野生型斑马鱼;MUT:72 hpf的rpl15突变型斑马鱼;a: P < 0.01, b: P < 0.05,与野生型比较 图 6 Real-time PCR检测rpl15突变胚胎p53、mdm2、hsp70的mRNA表达水平 |
3 讨论
人的RPL15基因突变已在先天性纯红细胞再生障碍性贫血患者中被发现。迄今为止几乎所有驱动DBA遗传病变的基因均在核糖体蛋白基因家族中被发现。因此,DBA被认为是一种核糖体疾病。近些年,与DBA疾病相关的核糖体蛋白突变研究在小鼠上陆续开展。目前,利用Cre/loxP系统策略成功构建了条件性敲除Rps19、Rpl11基因的转基因小鼠模型,表现出与DBA患者相似的生长迟缓和贫血的表型[8]。然而,构建转基因小鼠模型存在实验周期长、成本高和不适用于对潜在治疗药物进行高通量筛选的缺点。与小鼠相比,斑马鱼则凭借胚胎透明、易于观察、产卵量大和发育快的优势,使其成为观察早期造血发育和用于大规模筛选潜在治疗药物的理想模型。目前,利用吗啉环修饰的反义寡核苷酸(morpholino,MO)技术下调rps19、rpl5、rpl35A、rps24和rps7基因均较好地重现了DBA表型[9-11]。同时利用CRISPR/Cas9基因编辑技术也成功构建了rpl11、rps9和rps29基因突变的DBA疾病相关斑马鱼模型[12-14]。鉴于rpl15在DBA疾病发生发展中的机制研究仍不明确,且在斑马鱼上rpl15敲除模型的建立仍有空缺,因此本课题致力于研究rpl15对斑马鱼造血的影响,从而进一步探究其在DBA发生发展中的机制作用。
本研究利用CRISPR/Cas9定向基因编辑技术敲除斑马鱼rpl15基因,共设计了5条gRNA,分别与Cas9蛋白共注射到单细胞期斑马鱼受精卵中。结果显示,gRNA5对rpl15具有高效的编辑作用。通过批量显微注射gRNA5/Cas9蛋白混合物到单细胞期斑马鱼受精卵中,成功筛选获得rpl15突变体。其中包括MU1突变型个体,该个体产生了移码突变且提前终止翻译,从而破坏了Rpl15的功能域。研究表明,已建立的DBA疾病相关斑马鱼模型具有头部发育不全、尾巴弯曲、体长缩短、心包水肿和体内血红蛋白合成减少等表型。与之前结果相一致,本研究在rpl15突变体也观察到了相同的表型,而且rpl15突变体表现出了更为严重的心包水肿现象。这与研究报道的人RPL15基因突变的DBA患者出现非常严重的早期胎儿水肿症状一致[15]。此外本研究证实rpl15突变体原始造血干细胞转录因子scl、定向造血干细胞转录因子c-myb、髓系转录因子pu. 1、中性粒细胞转录因子mpo、巨噬/单核细胞转录因子l-plastin及淋巴细胞转录因子rag 1的mRNA表达水平与对照组相比无明显差异,同时中性粒细胞染色也证实rpl15突变型胚胎与野生型胚胎的中性粒细胞生成情况无明显差异,但红系转录因子gata 1和α-globin的mRNA表达水平与对照组相比均显著下调,提示rpl15突变体特异性的损害了斑马鱼红系造血发育。这些结果表明,利用CRISPR/Cas9技术编辑斑马鱼rpl15构建DBA疾病相关斑马鱼模型具有重要意义。
斑马鱼DBA疾病相关模型研究报道证实,核糖体突变体胚胎形态发育异常及贫血表型的形成与p 53通路密切相关。大量研究证实在斑马鱼DBA疾病相关模型中下调p53均可一定程度挽救突变体形态发育上的缺陷。同时研究发现抑制p53的表达可以部分挽救rpl18、rpl11和rps9等突变体中红系造血发育的缺陷[13, 16]。本研究结果显示,rpl15突变体p53和mdm2基因的mRNA水平显著增高。当rpl15发生突变时,会导致游离核糖体蛋白在核仁内累积,从而与mdm2发生结合[17]。在与上述游离核糖体蛋白结合后,Mdm2泛素连接酶的活性受到抑制,而这会激活p53的表达,从而导致相应细胞周期停滞和凋亡的发生[18]。表明p53通路可能在斑马鱼rpl15突变体表型的形成中发挥重要作用。此外研究表明,红系分化过程中HSP70可从细胞质迁移到细胞核,以保护GATA1免受caspase-3介导的分裂,从而正常调控红系分化发育[19-20]。本研究结果显示,rpl15突变体的gata1、hsp70的mRNA水平显著下调。hsp70转录水平的下调可能将导致Gata1受到caspase-3的裂解,从而致使rpl15突变体的红系造血发育受损。
综上所述,本研究发现通过CRISPR/Cas9技术编辑斑马鱼rpl15基因,可以获得具有形态发育异常并伴有贫血表型的突变体。初步认为p 53通路和hsp70可能参与调控rpl15突变体表型的形成,有助于进一步探究rpl15在相关疾病发生、发展中的作用。
| [1] |
DONG Z, JIANG H, LIANG S, et al. Ribosomal protein L15 is involved in colon carcinogenesis[J]. Int J Med Sci, 2019, 16(8): 1132-1141. DOI:10.7150/ijms.34386 |
| [2] |
WANG W, NAG S, ZHANG X, et al. Ribosomal proteins and human diseases: pathogenesis, molecular mechanisms, and therapeutic implications[J]. Med Res Rev, 2015, 35(2): 225-285. DOI:10.1002/med.21327 |
| [3] |
YAN T T, FU X L, LI J, et al. Downregulation of RPL15 may predict poor survival and associate with tumor progression in pancreatic ductal adenocarcinoma[J]. Oncotarget, 2015, 6(35): 37028-37042. DOI:10.18632/oncotarget.5939 |
| [4] |
HE S J, SHU L P, ZHOU Z W, et al. Inhibition of Aurora kinases induces apoptosis and autophagy via AURKB/p70S6K/RPL15 axis in human leukemia cells[J]. Cancer Lett, 2016, 382(2): 215-230. DOI:10.1016/j.canlet.2016.08.016 |
| [5] |
LANDOWSKI M, O'DONOHUE M F, BUROS C, et al. Novel deletion of RPL15 identified by array-comparative genomic hybridization in Diamond-Blackfan anemia[J]. Hum Genet, 2013, 132(11): 1265-1274. DOI:10.1007/s00439-013-1326-z |
| [6] |
刘菁, 梁森, 袁志. CRISPR/Cas9技术敲除faf1基因对斑马鱼软骨及肌节发育的影响[J]. 第三军医大学学报, 2017, 39(17): 1709-1714. LIU J, LIANG S, YUAN Z. Effects of fafl gene knockout by CRISPR/Cas9 on zebrafish cartilage and sarcomere development[J]. J Third Mil Med Univ, 2017, 39(17): 1709-1714. DOI:10.16.16/j.10000-5404.201612182 |
| [7] |
曾婧, 刘晗, 李为, 等. 利用CRISPR/Cas9系统建立斑马鱼Morn3基因敲除模型[J]. 重庆医科大学学报, 2018, 43(11): 1449-1452. ZENG J, LIU H, LI W, et al. Morn3 knockout zebrafish model established by the CRISPR/Cas9 system[J]. J Chongqing Med Univ, 2018, 43(11): 1449-1452. DOI:10.13406/j.cnki.cyxb.001915 |
| [8] |
MORGADO-PALACIN L, VARETTI G, LLANOS S, et al. Partial loss of Rpl11 in adult mice recapitulates diamond-blackfan Anemia and promotes lymphomagenesis[J]. Cell Rep, 2015, 13(4): 712-722. DOI:10.1016/j.celrep.2015.09.038 |
| [9] |
YADAV G V, CHAKRABORTY A, UECHI T, et al. Ribosomal protein deficiency causes Tp53-independent erythropoiesis failure in zebrafish[J]. Int J Biochem Cell Biol, 2014, 49: 1-7. DOI:10.1016/j.biocel.2014.01.006 |
| [10] |
WAN Y, ZHANG Q, ZHANG Z J, et al. Transcriptome analysis reveals a ribosome constituents disorder involved in the RPL5 downregulated zebrafish model of Diamond-Blackfan anemia[J]. BMC Med Genomics, 2016, 9: 13. DOI:10.1186/s12920-016-0174-9 |
| [11] |
UECHI T, KENMOCHI N. Zebrafish models of diamond-blackfan anemia: a tool for understanding the disease pathogenesis and drug discovery[J]. Pharmaceuticals (Basel), 2019, 12(4): 151. DOI:10.3390/ph12040151 |
| [12] |
DANILOVA N, SAKAMOTO K M, LIN S. Ribosomal protein L11 mutation inzebrafish leads to haematopoietic and metabolic defects[J]. Br J Haematol, 2011, 152(2): 217-228. DOI:10.1111/j.1365-2141.2010.08396.x |
| [13] |
CHEN C, HUANG H G, YAN R B, et al. Loss of rps9 in zebrafish leads to p53-dependent Anemia[J]. G3(Bethesda), 2019, 9(12): 4149-4157. DOI:10.1534/g3.119.400585 |
| [14] |
TAYLOR A M, HUMPHRIES J M, WHITE R M, et al. Hematopoietic defects in rps29 mutant zebrafish depend upon p53 activation[J]. Exp Hematol, 2012, 40(3): 228-237. DOI:10.1016/j.exphem.2011.11.007 |
| [15] |
WLODARSKI M W, DA COSTA L, O'DONOHUE M F, et al. Recurring mutations in RPL15 are linked to Hydrops fetalis and treatment independence in Diamond-Blackfan anemia[J]. Haematologica, 2018, 103(6): 949-958. DOI:10.3324/haematol.2017.177980 |
| [16] |
CHEN C, LU M, LIN S, et al. The nuclear gene rpl18 regulates erythroid maturation via JAK2-STAT3 signaling in zebrafish model of Diamond-Blackfan anemia[J]. Cell Death Dis, 2020, 11(2): 135. DOI:10.1038/s41419-020-2331-5 |
| [17] |
CHAKRABORTY A, UECHI T, NAKAJIMA Y, et al. Cross talk between TP53 and c-Myc in the pathophysiology of Diamond-Blackfan anemia: Evidence from RPL11-deficient in vivo and in vitro models[J]. Biochem Biophys Res Commun, 2018, 495(2): 1839-1845. DOI:10.1016/j.bbrc.2017.12.019 |
| [18] |
WANG S, ZHAO Y, AGUILAR A, et al. Targeting the MDM2-p53 protein-protein interaction for new cancer therapy: progress and challenges[J]. Cold Spring Harb Perspect Med, 2017, 7(5): a026245. DOI:10.1101/cshperspect.a026245 |
| [19] |
GASTOU M, RIO S, DUSSIOT M, et al. The severe phenotype of Diamond-Blackfan anemia is modulated by heat shock protein 70[J]. Blood Adv, 2017, 1(22): 1959-1976. DOI:10.1182/bloodadvances.2017008078 |
| [20] |
RIO S, GASTOU M, KARBOUL N, et al. Regulation of globin-heme balance in Diamond-Blackfan anemia by HSP70/GATA1[J]. Blood, 2019, 133(12): 1358-1370. DOI:10.1182/blood-2018-09-875674 |




