淋巴瘤是一种起源于淋巴造血系统的恶性肿瘤,多表现为无痛性淋巴结肿大、发热、消瘦等全身症状[1]。靶向治疗是近几年兴起的淋巴瘤治疗手段,患者治疗效果较好,且不良反应发生率相对较低,然而每种靶向药物只针对特定的患者群体,因此寻找新的治疗靶点具有十分重要的临床意义[2]。神经因子在恶性肿瘤的发生和发展过程中发挥着关键性作用[3]。神经生长因子(nerve growth factor,NGF)在胆管癌和骨肿瘤等恶性肿瘤组织中的表达显著升高,抗NGF治疗能够有效缓解患者临床症状、促进癌细胞的凋亡[4]。NGF信号通路维持着霍奇金淋巴瘤细胞的生存,NGF沉默的霍奇金淋巴瘤细胞凋亡比例显著升高[5]。脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)和Netrin-1是另外两种常见的神经因子[6],BDNF广泛分布于中枢神经系统,可维持神经元的存活和生长,并在一些恶性肿瘤的增殖和侵袭中发挥着促进作用。Netrin-1是Netrin家族成员之一,在神经生长、血管生成和免疫反应中均发挥着强大的调控功能,目前尚未见其与淋巴瘤的相关报道。本研究观察NGF、BDNF和Netrin-1在弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)的表达及作用,以期为淋巴瘤的精准治疗筛选潜在靶点。
1 资料与方法 1.1 研究对象入组患者为2018年5月至2020年5月来重庆医科大学附属第三医院就诊的淋巴瘤初治患者50例。病例纳入标准:年龄18~60岁;病理诊断为弥漫大B细胞淋巴瘤。排除标准:合并慢性阻塞性肺疾病、其他恶性肿瘤、退行性神经病变和自身免疫性疾病等慢性疾病患者;合并脑出血和脑梗死;合并结核、艾滋病和乙肝病毒感染患者;长期酗酒;吸毒。本研究获得重庆医科大学附属第三医院(捷尔医院)伦理委员会的批准(2018-24)和患者的知情同意。按照淋巴瘤国际预后指数(international prognostic index,IPI)将患者分成低危组(评分≤2)和高危组(评分>2)。同时选取本院同期25例慢性淋巴结炎患者活检淋巴组织作为对照组。
1.2 试剂和材料羊血清封闭液、生物素标记二抗、碱性磷酸酶标记的链霉卵白素工作液和苏木精购于北京中杉金桥生物技术有限公司;Ki-67、CD31、NGF、BDNF和Netrin-1一抗购于英国Abcam公司;CD4-PE、CD25-FITC、CD19-APC、IL-10-PE、CD138-APC和LAG-3-PE购于美国BD公司;淋巴细胞分离液购于天津市灏洋生物制品科技有限责任公司。
1.3 免疫组织化学染色检测Ki-67、NGF、BDNF和Netrin-1的表达收集各组患者治疗前的淋巴瘤标本,4%多聚甲醛固定24 h后,进行石蜡切片。梯度脱水后,加入3%过氧化氢。PBS清洗3次,羊血清封闭液封闭30 min后,滴加Ki-67、NGF、BDNF和Netrin-1的一抗,4 ℃冰箱过夜。PBS清洗3次后加入生物素标记二抗,37 ℃孵育1 h。PBS清洗3次后,加入碱性磷酸酶标记的链霉卵白素工作液,37 ℃孵育0.5 h。PBS清洗3次后显色,自来水冲洗,苏木精复染,脱水,透明,封片,之后置于显微镜下观察,采用Image Pro Plus软件检测NGF、BDNF和Netrin-1表达的平均光密度(average optical density,AOD)。
1.4 流式细胞术检测调节性T细胞、B细胞和浆细胞的比例收集各组患者治疗前的外周血3 mL,加入3 mL的生理盐水稀释。之后加入淋巴细胞分离液上层,梯度离心。取中间的白膜层,生理盐水清洗3次后,平均分成3份,加入流式细胞学抗体(1组:CD4-PE和CD25-FITC;2组:CD19-APC和IL-10-PE;3组:CD138-APC和LAG-3-PE),避光室温条件下染色20 min。生理盐水清洗3次后,流式细胞术检测调节性T细胞(regulatory T cell,Treg细胞)、调节性B细胞(regulatory B cell,Breg细胞)和调节性浆细胞(regulatory plasma cell,Preg细胞)的比例。
1.5 统计学分析使用Graphpad Software 5.0统计分析实验数据,数据以x±s表示,多组之间的差异采用单因素方差分析和Bonferronit检验,Spearman法进行组间的相关性分析,P < 0.05认为差异有统计学意义。
2 结果 2.1 各组一般情况对照组共25例,男性10名,女性15名,平均年龄47.05岁,平均体质量65.26 kg。低危组共25例,男性10名,女性15名,平均年龄45.36岁,平均体质量69.26 kg。高危组共25例,男性12名,女性13名,平均年龄47.29岁,平均体质量68.14 kg。对比各组患者的性别、年龄和体质量,差异均无统计学意义(P>0.05)。
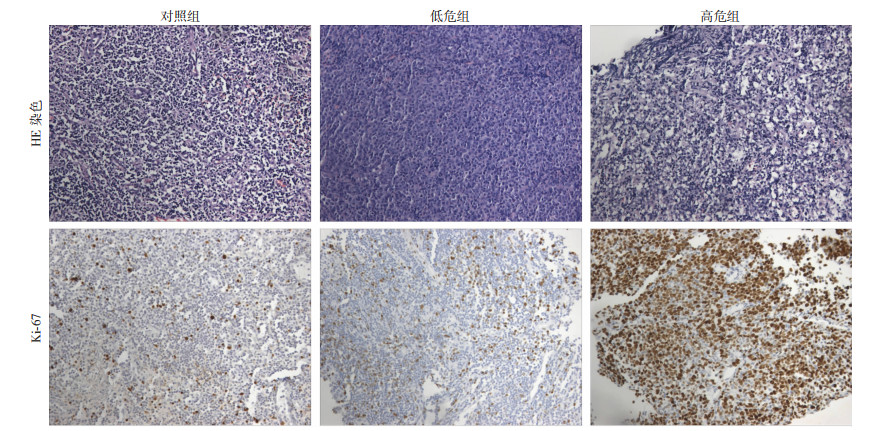
2.2 Ki-67增殖指数的变化免疫组化实验结果显示,低危组Ki-67增殖指数较对照组显著升高(P < 0.05);与低危组比较,高危组Ki-67增殖指数显著升高(P < 0.05),见图 1、表 1。
|
| 图 1 各组淋巴组织HE染色和Ki-67增殖指数的变化(×100) |
| 组别 | n | Ki-67(%) | NGF | BDNF | Netrin-1 |
| 对照组 | 25 | 4.17±0.94 | 17.73±4.43 | 12.67±1.17 | 21.33±2.17 |
| 低危组 | 25 | 23.17±2.66a | 60.70±6.59a | 11.00±1.48 | 45.33±6.68a |
| 高危组 | 25 | 64.17±6.01ab | 213.51±18.31ab | 7.33±0.81 | 175.73±14.16ab |
| a:P < 0.05,与对照组比较;b:P < 0.05,与低危组比较 | |||||
2.3 NGF、BDNF和Netrin-1表达的变化
免疫组化实验结果显示,与对照组比较,低危组NGF和Netrin-1的平均光密度显著升高(P < 0.05),BDNF的平均光密度差异无统计学意义(P=0.399);与低危组比较,高危组NGF和Netrin-1的平均光密度均显著升高(P < 0.05),而BDNF的平均光密度差异无统计学意义(P=0.055)。见图 2、表 1。

|
| 图 2 各组淋巴组织NGF、BDNF和Netrin-1表达的变化(×100) |
2.4 外周血Treg细胞的变化
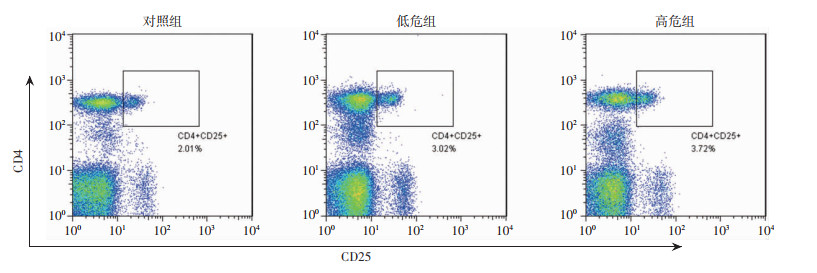
流式细胞术实验结果显示,低危组外周血Treg细胞比例较对照组显著升高(P < 0.05);高危组外周血Treg细胞比例较低危组显著升高(P=0.015)。见图 3、表 2。
|
| 图 3 各组外周血Treg细胞的变化 |
| 组别 | n | Treg比例 | Breg比例 | Preg比例 |
| 对照组 | 25 | 1.97±0.12 | 0.22±0.04 | 0.049±0.006 |
| 低危组 | 25 | 3.07±0.14a | 0.88±0.12a | 0.053±0.010 |
| 高危组 | 25 | 3.72±0.18ab | 1.06±0.10a | 0.054±0.009 |
| a:P < 0.05,与对照组比较;b:P < 0.05,与低危组比较 | ||||
2.5 外周血Breg、Preg细胞的变化
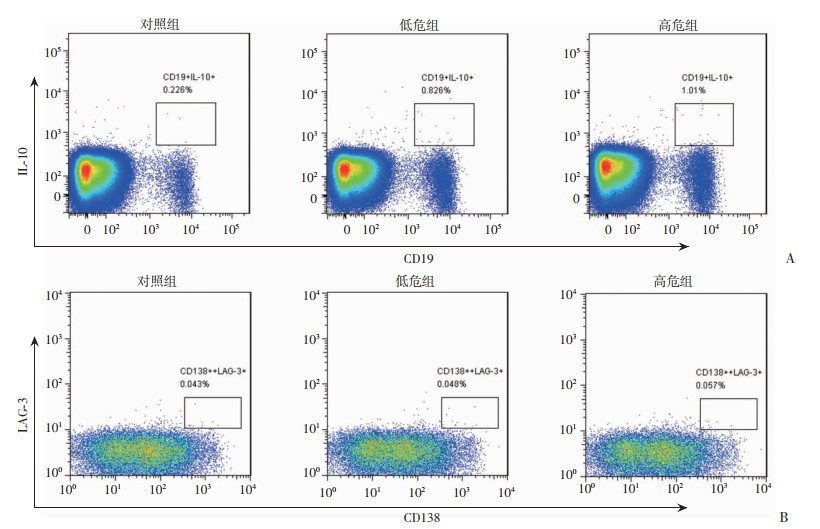
流式细胞术实验结果显示,与对照组比较,低危组和高危组外周血Breg细胞比例均显著升高(P < 0.05);外周血Breg细胞比例在低危组和高危组之间差异无统计学意义。见图 4A、表 2。
|
| 图 4 各组外周血Breg(A)、Preg(B)细胞的变化 |
流式细胞术实验结果显示,与对照组比较,低危组和高危组外周血Preg细胞比例差异均无统计学意义(图 4B、表 2)。
2.6 相关性分析结果显示,NGF与Ki-67增殖指数呈正相关性(r=0.720,P=0.008),而与Treg细胞、Breg细胞和Preg细胞比例均不具有相关性(r=0.514,P=0.087;r=0.221,P=0.491;r=0.119,P=0.712);Netrin-1与Ki-67增殖指数、Treg细胞比例均呈正相关性(r=0.804,P=0.002;r=0.608,P=0.036),而与Breg细胞和Preg细胞比例均不具有相关性(r=0.161,P=0.617;r=-0.088,P=0.787);BDNF与Ki-67增殖指数、Treg细胞、Breg细胞和Preg细胞比例均不具有相关性(r=-0.476,P=0.118;r=-0.562,P=0.057;r=-0.046,P=0.887;r=-0.325,P=0.304)。NGF与Netrin-1表达呈显著正相关性(r=0.944,P < 0.001),而与BDNF的表达不具有相关性(r=-0.251,P=0.431)。
3 讨论近年研究发现,神经生长调节分子在发挥维持神经正常功能和促进神经损伤修复等重要作用的同时,还具有调节免疫、细胞保护和促血管生成等重要功能[7-9]。许多神经生长调节分子在肿瘤表达升高的机制尚不清楚,肿瘤浸润破坏神经引起NGF和Netrin-1的反应性升高、肿瘤自身分泌以及肿瘤微环境等可能是其主要的机制。最新研究发现神经生长调节分子能够促进肿瘤的发生和发展。NGF的受体分为高亲和力受体TrkA和低亲和力受体p75,与正常乳腺组织相比,NGF及TrkA受体在乳腺癌中过度表达,且NGF作为一种旁分泌/自分泌因子促进肿瘤细胞的存活和增殖。NGF与TrkA的过度表达能够增加癌细胞的侵袭率,并且与肿瘤的淋巴结转移、远距离播散、高TNM分期、低分化和低存活率紧密相关[10-12]。本研究发现在淋巴瘤组织中NGF表达显著升高,且与癌细胞的增殖及DLBCL的危险度分层紧密相关。通过检测组织中NGF的表达,可为评估淋巴瘤的分级和预后提供一定的参考。此外,NGF还可调控PI3K/AKT、mTOR、Ras-MAPK和Hoxd1信号通路的表达,而这些通路与肿瘤免疫、肿瘤微环境和肿瘤细胞生物学功能均具有很强的相关性[13-18]。后续进一步明确NGF对恶性肿瘤的作用效果及调控机制,将会大大推动NGF在淋巴瘤靶向治疗中的应用。
Netrin-1是一种轴突导向分子,具有促进神经末梢定向生长的功能。最近的研究发现Netrin-1参与多种恶性肿瘤的发生发展,能促使肿瘤细胞增殖、凋亡和促进血管生成等[19-21]。本研究发现在淋巴瘤组织中Netrin-1表达显著升高,且与癌细胞的增殖水平紧密相关。这说明Netrin-1在淋巴瘤的发生和发展中发挥着重要作用,可作为另一个重要靶点应用于淋巴瘤的精准治疗。Treg细胞是哺乳动物体内重要的免疫抑制细胞,具有强大的抑制细胞免疫和固有免疫反应的功能。本研究结果显示外周血Treg细胞在淋巴瘤人群中显著升高,且与病情严重程度具有一定的相关性。Netrin-1被认为是一种新型的免疫抑制因子,可显著降低患者的抗肿瘤免疫能力。本研究结果证实Netrin-1与Treg细胞比例呈正相关,然而具体的机制还需要进一步深入研究。Breg和Preg细胞是体液免疫重要的免疫调节细胞,本研究显示这两种细胞在不同级别淋巴瘤患者外周血中差异无统计学意义,说明在淋巴瘤发病过程中,Breg和Preg细胞的作用可能并不十分明显。BDNF是广泛存在于中枢神经系统内的一种神经营养因子,多项研究发现BDNF能够促进肿瘤细胞的增殖迁移,并被应用于抗肿瘤治疗[22-24]。然而本研究发现BDNF在淋巴瘤中表达没有显著的变化,说明将BDNF应用于淋巴瘤的靶向治疗中效果可能不是很好。
综上,本研究表明,NGF和Netrin-1在弥漫大B细胞淋巴瘤中表达显著升高,且与其增殖水平紧密相关,Netrin-1与外周血Treg细胞比例呈正相关。这为淋巴瘤的精准治疗提供了新的靶点。
| [1] |
PRIETO PRIETO J C, VALLEJO CASAS J A, HATZIMICHAEL E, et al. The contribution of metabolic parameters of FDG PET/CT prior and during therapy of adult patients with lymphomas[J]. Ann Nucl Med, 2020, 34(10): 707-717. DOI:10.1007/s12149-020-01521-3 |
| [2] |
PEI Y G, WONG J H Y, ROBERTSON E S. Targeted therapies for Epstein-Barr virus-associated lymphomas[J]. Cancers, 2020, 12(9): 2565. DOI:10.3390/cancers12092565 |
| [3] |
JOBLING P, PUNDAVELA J, OLIVEIRA S M, et al. Nerve-cancer cell cross-talk: a novel promoter of tumor progression[J]. Cancer Res, 2015, 75(9): 1777-1781. DOI:10.1158/0008-5472.can-14-3180 |
| [4] |
HONDERMARCK H. Potential role for NGF in breast cancer[J]. Stem Cells, 2000, 18(5): 386-387. DOI:10.1634/stemcells.18-5-386 |
| [5] |
RENNÉ C, MINNER S, KVPPERS R, et al. Autocrine NGFbeta/TRKA signalling is an important survival factor for Hodgkin lymphoma derived cell lines[J]. Leuk Res, 2008, 32(1): 163-167. DOI:10.1016/j.leukres.2007.05.019 |
| [6] |
KOJIMA M, ISHⅡ C, SANO Y, et al. Journey of brain-derived neurotrophic factor: from intracellular trafficking to secretion[J]. Cell Tissue Res, 2020, 382(1): 125-134. DOI:10.1007/s00441-020-03274-x |
| [7] |
BOILLY B, FAULKNER S, JOBLING P, et al. Nerve dependence: from regeneration to cancer[J]. Cancer Cell, 2017, 31(3): 342-354. DOI:10.1016/j.ccell.2017.02.005 |
| [8] |
AZAM S H, PECOT C V. Cancer's got nerve: Schwann cells drive perineural invasion[J]. J Clin Invest, 2016, 126(4): 1242-1244. DOI:10.1172/jci86801 |
| [9] |
GRAMANN T, SCHWAB C, ZUMSTEIN V, et al. Transurethral resection of bladder cancer on the lateral bladder wall without obturator nerve block: extent of adductor spasms using the monopolar versus bipolar technique: a prospective randomised study[J]. World J Urol, 2018, 36(7): 1085-1091. DOI:10.1007/s00345-018-2248-0 |
| [10] |
SUDIGYO D, RAHMAWATI G, SETIASARI D, et al. Transcriptome profile of next generation sequence data related to inflammation on nasopharyngeal carcinoma cases in Indonesia[J]. Asian Pac J Cancer Prev, 2020, 21(9): 2763-2769. DOI:10.31557/apjcp.2020.21.9.2763 |
| [11] |
FAULKNER S, GRIFFIN N, ROWE C W, et al. Nerve growth factor and its receptor tyrosine kinase TrkA are overexpressed in cervical squamous cell carcinoma[J]. FASEB Bioadv, 2020, 2(7): 398-408. DOI:10.1096/fba.2020-00016 |
| [12] |
ISLAM T, MAJUMDER M, BIDKAR A, et al. Nerve growth factor from Indian Russell's viper venom (RVV-NGFa) shows high affinity binding to TrkA receptor expressed in breast cancer cells: Application of fluorescence labeled RVV-NGFa in the clinical diagnosis of breast cancer[J]. Biochimie, 2020, 176: 31-44. DOI:10.1016/j.biochi.2020.06.004 |
| [13] |
JI S J, WU H H, DING X, et al. Increased hippocampal TrkA expression ameliorates cranial radiation-induced neurogenesis impairment and cognitive deficit via PI3K/AKT signaling[J]. Oncol Rep, 2020, 44(6): 2527-2536. DOI:10.3892/or.2020.7782 |
| [14] |
GUDASHEVA T A, LOGVINOV I O, NIKOLAEV S V, et al. Dipeptide mimetics of different NGF and BDNF loops activate PLC-γ1[J]. Dokl Biochem Biophys, 2020, 494(1): 244-247. DOI:10.1134/s1607672920050075 |
| [15] |
SUGITA Y, MASUOKA J, KAMEDA K, et al. Primary central nervous system lymphomas associated with chronic inflammation: diagnostic pitfalls of central nervous system lymphomas[J]. Brain Tumor Pathol, 2020, 37(4): 127-135. DOI:10.1007/s10014-020-00373-z |
| [16] |
ENNISHI D, HSI E D, STEIDL C, et al. Toward a new molecular taxonomy of diffuse large B-cell lymphoma[J]. Cancer Discov, 2020, 10(9): 1267-1281. DOI:10.1158/2159-8290.cd-20-0174 |
| [17] |
MAKITA S, MARUYAMA D, TOBINAI K. Safety and efficacy of brentuximab vedotin in the treatment of classic Hodgkin lymphoma[J]. Onco Targets Ther, 2020, 13: 5993-6009. DOI:10.2147/ott.s193951 |
| [18] |
YANG Z W, ZOU W Y, PAN Y N, et al. PEGylated CuInS2/ZnS quantum dots inhibit neurite outgrowth by downregulating the NGF/p75NTR/MAPK pathway[J]. Ecotoxicol Environ Saf, 2021, 207: 111378. DOI:10.1016/j.ecoenv.2020.111378 |
| [19] |
LI B, SHEN K X, ZHANG J Y, et al. Serum netrin-1 as a biomarker for colorectal cancer detection[J]. Cancer Biomarkers, 2020, 28(3): 391-396. DOI:10.3233/cbm-190340 |
| [20] |
CHAI D, YAN J, LI C, et al. Sevoflurane inhibits neuronal migration and axon growth in the developing mouse cerebral cortex[J]. Aging (Albany NY), 2020, 12(7): 6436-6455. DOI:10.18632/aging.103041 |
| [21] |
LIU J, LI J. PKCα and Netrin-1/UNC5B positive feedback control in relation with chemical therapy in bladder cancer[J]. Eur Rev Med Pharmacol Sci, 2020, 24(4): 1712-1717. DOI:10.26355/eurrev_202002_20346 |
| [22] |
GUERENNE-DEL BEN T, COUDERC V, DUPONCHEL L, et al. Multiplex coherent anti-Stokes Raman scattering microspectroscopy detection of lipid droplets in cancer cells expressing TrkB[J]. Sci Rep, 2020, 10(1): 16749. DOI:10.1038/s41598-020-74021-z |
| [23] |
LI W, ZHAO J, DING K, et al. Catechol-O-methyltransferase gene polymorphisms and the risk of chemotherapy-induced prospective memory impairment in breast cancer patients with varying tumor hormonal receptor expression[J]. Med Sci Monit, 2020, 26: e923567. DOI:10.12659/msm.923567 |
| [24] |
YUE X, WANG Z. Long intergenic non-coding RNA LINC00922 aggravates the malignant phenotype of breast cancer by regulating the microRNA-424-5p/BDNF axis[J]. Cancer Manag Res, 2020, 12: 7539-7552. DOI:10.2147/cmar.s267665 |




