2. 730000 兰州, 兰州大学: 第一医院耳鼻喉头颈外科
2. Department of Otorhinolaryngology, Head and Neck Surgery, First Hospital, Lanzhou University, Lanzhou, Gansu Province, 730000, China
慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)作为耳鼻咽喉科的一种常见疾病,是发生于鼻窦黏膜的慢性炎症性疾病。随着全球发病率的逐渐增加,该病已成为严重的公共健康问题。其中窦口鼻道复合体(ostiomeatal complex, OMC)是前组鼻窦通畅引流的关键因素,其解剖结构异常常导致筛漏斗狭窄,从而阻碍鼻腔通气及粘液排出,是导致慢性鼻窦炎发作的潜在危险因素。其中筛泡直接构成筛漏斗的后上壁,是决定筛漏斗通畅与否的关键性因素。除了解剖异常以外,长期反复的炎症刺激还可累及鼻腔鼻窦骨质,引起骨质增生、吸收和新骨形成等病理改变[1]。
筛窦为蜂窝状结构,因其解剖结构复杂、自身变异大,故又称“筛迷路”,其感染机会相对较高。慢性筛窦炎的发生是多因素导致的,而通过外科鼻内镜手术可清除病变、扩大窦口,改善鼻窦的通畅引流。了解解剖变异的类型及程度有利于术前评估、术中操作及预后。本研究利用鼻部高分辨率螺旋CT及Mimics 21.0医学三维重建软件,探究筛泡和前组筛窦口骨质改变对筛窦黏膜炎症严重程度的影响。
1 资料与方法 1.1 研究对象回顾性分析2017年1月至2020年8月就诊于我院行鼻部高分辨率CT的患者80例(160侧),其中男性48例,女性32例,年龄18~67岁,正常对照组32例(64侧),慢性筛窦炎组48例(96侧),慢性筛窦炎患者均有临床症状,经鼻内镜证实且鼻窦CT扫描显示筛窦黏膜炎性病变,排除了鼻腔占位性病变、鼻中隔偏曲、鼻部手术史及颌面部畸形等。
1.2 方法采用德国西门子64层螺旋CT,患者取仰卧头过伸位,扫描范围为前额部下至下颌骨下,扫描参数:管电压120 kV,管电流20 mA,骨窗窗宽1 500 HU,窗位450 HU,软组织窗窗宽350 HU,窗位50 HU,层厚1 mm,间距0.6 mm。将利用上述方法获得的影像学数据导入Mimics 21.0软件,利用Mimics 21.0软件中的阈值分割工具,选择-1 024~-700 HU的阈值范围,将筛窦与窦腔内气体区分,并应用自动及手动编辑,基于3D补差法逐层修剪或补充完整获得双侧筛窦及筛泡的二维数据,并以不同颜色蒙版标记不同部位的模型。利用软件中的Calculate 3D工具,将得到的二维数据通过运算连接生成三维立体形态,并利用软件中的Smooth工具对三维模型进行平滑处理,得到优化后的双侧筛窦及筛泡三维模型(图 1),查看属性后可得到筛窦及筛泡的相关参数。
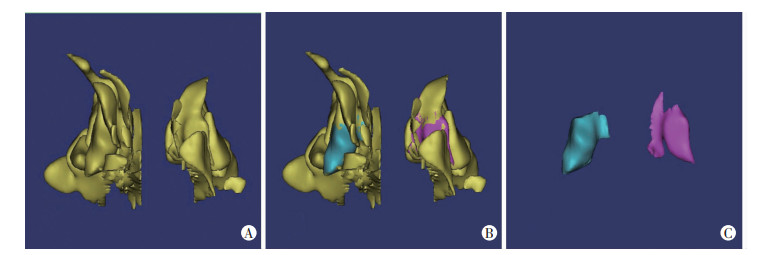
|
| A:重建的双侧筛窦(冠状面);B:重建的双侧筛窦及双侧筛泡,其中紫色为左侧筛泡,蓝色为右侧筛泡;C:重建的双侧筛泡 图 1 经Mimics 21.0软件重建的双侧筛窦及双侧筛泡 |
1.2.1 前组筛窦内软组织厚度
根据一侧前组筛窦内软组织厚度(图 2),将160侧筛窦按评分标准分为0分、1分、2分及3分组。0分组:软组织厚度=0;1分组:0<软组织厚度 < 2 mm;2分组:2 mm≤软组织厚度 < 4 mm;3分组:软组织厚度≥4 mm[2]。
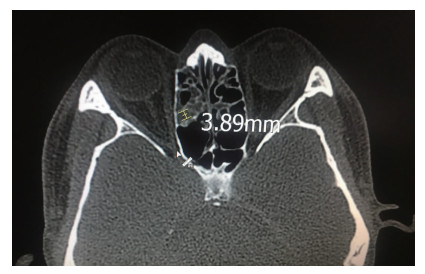
|
| 图 2 前组筛窦内软组织厚度 |
1.2.2 筛泡体积、表面积、上下径、左右径、前后径
运用Mimics 21.0医学三维重建软件重建出筛窦及筛泡三维立体形态,通过软件运算可计算出筛泡的体积及表面积(图 3)。在解剖位以筛泡中心为O点,过O点做3条互相垂直的数轴Ox、Oy、Oz,即x轴(横轴)、y轴(纵轴)、z轴(竖轴),任意两个坐标轴可确定一个平面,可得出3个互相垂直的平面,即xOy面、zOx面、yOz面(图 4),分别计算筛泡最高点及最低点到xOy面的垂直距离,两垂直距离相加即为筛泡的上下径。计算筛泡最内侧点及最外侧点到zOx面的垂直距离,两垂直距离相加即为筛泡的左右径。计算筛泡最前点及最后点到yOz面的垂直距离,两垂直距离相加即为筛泡的前后径。
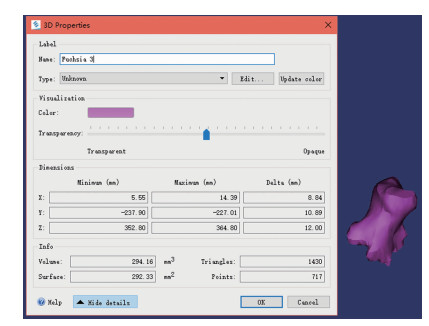
|
| 图 3 运用Mimics 21.0软件计算出筛泡的体积及表面积 |
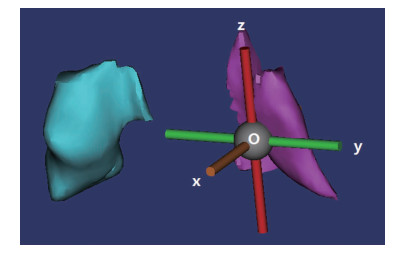
|
| 图 4 以筛泡中心为O点,建立的x轴(横轴)、y轴(纵轴)、z轴(竖轴) |
1.2.3 筛窦流出道直径及横截面积
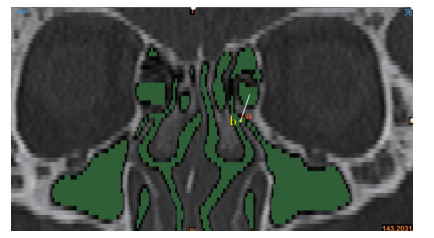
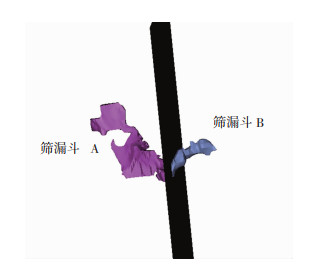
在CT冠状面上经过钩突顶端与筛泡中心做一条连线,此连线经过钩突外侧面和筛泡内侧面有两个交点a和b,两点间连线即为筛漏斗的直径(图 5)。运用Mimics 21.0医学三维重建软件重建出筛漏斗三维立体形态,在CT矢状位上经过筛泡中点取一个平行于yOz面的截面,此截面将筛漏斗分为A和B两部分(图 6),通过软件运算可分别计算出完整筛漏斗、筛漏斗A和筛漏斗B的表面积,即为a、b、c,则筛漏斗的横截面积为(b+c-a)/2。
|
| 白线为经过钩突顶端与筛泡中心的连线,此连线经过钩突外侧面和筛泡内侧面有交点a和b,两点间连线即为筛漏斗的直径 图 5 筛漏斗直径 |
|
| 图 6 筛漏斗横截面 |
1.2.4 筛窦开口周围骨质的CT值
CT值将空气设定为-1 000,而致密骨为+1 000,测量前组筛窦开口周围骨质的CT值,取骨质中央病变处,避开与其他骨交界处,每侧测量3次,取平均值[3]。
1.3 统计学分析采用SPSS 26.0统计软件进行分析。数据进行非参数检验,以中位数(四分位间距)[M(Q)]表示。各组间差异的显著性检验均采用Kruskal-Wallis检验并进行两两比较,对参数间相关性分析采用Spearson相关分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 前组筛窦内软组织厚度根据前组筛窦内软组织厚度,将160侧筛窦分为0分、1分、2分及3分组,其中0分组有65例,1分组有49例,2分组有30例,3分组有16例。
2.2 各组间筛泡体积、表面积、上下径、左右径、前后径的比较分别对样本的筛泡体积、表面积、上下径、左右径、前后径的各分组进行Kruskal-Wallis检验,P值均小于0.01,拒绝原假设,差异具有统计学意义。进行成对比较后可得出,0分组的筛泡相关参数均低于其余各组(P < 0.01),1分组的筛泡相关参数均低于2分组及3分组(P < 0.05),2分组的筛泡相关参数的中位数均低于3分组,但差异无统计学意义。见表 1。
| 组别 | n | 体积/mm3 | 表面积/mm2 | 上下径/mm | 左右径/mm | 前后径/mm |
| 0分组 | 65 | 46.1(62.91) | 78.54(90.34) | 4.33(3.05) | 5.95(3.37) | 5.17(3.14) |
| 1分组 | 49 | 120.76(119.80)a | 159.49(100.88)a | 6.94(2.92)a | 7.92(2.70)a | 7.66(3.64)a |
| 2分组 | 30 | 316.56(130.07)ab | 298.23(109.15)ab | 10.53(5.00)ab | 9.57(3.67)a | 10.04(3.86)ab |
| 3分组 | 16 | 549.61(274.77)ab | 446.31(216.61)ab | 12.20(5.76)ab | 13.04(4.47)ab | 12.07(5.61)ab |
| a:P < 0.01,与0分组比较;b:P < 0.05,与1分组比较 | ||||||
2.3 各组间筛漏斗直径、前组筛窦流出道截面积、筛窦开口周围骨质改变的比较
分别对样本的筛漏斗直径、前组筛窦流出道截面积、筛窦开口周围骨质CT值的各分组进行Kruskal-Wallis检验,P值均小于0.01,拒绝原假设,差异具有统计学意义。进行成对比较后可得出,0分组的筛漏斗直径、前组筛窦流出道截面积均高于其余各组,而筛窦开口周围骨质CT值低于其余各组(P < 0.01),1分组的筛窦开口周围骨质CT值均低于2分组及3分组(P < 0.05),筛漏斗直径和前组筛窦流出道截面积的中位数较其余两组高,但差异无统计学意义。2分组的筛漏斗直径、前组筛窦流出道截面积中位数高于3分组,而筛窦开口周围骨质CT值的中位数低于3分组,但差异均无统计学意义,见表 2。
| 组别 | n | 筛漏斗直径/mm | 前组筛窦流出道截面积/mm2 | 筛窦开口周围骨质的CT值 |
| 0分组 | 65 | 1.16(0.99) | 4.90(5.07) | 81.67(28.67) |
| 1分组 | 49 | 0.82(0.42)a | 2.43(4.55)a | 166.00(73.50)a |
| 2分组 | 30 | 0.68(0.55)a | 2.23(3.38)a | 265.00(138.92)ab |
| 3分组 | 16 | 0.67(0.53)a | 1.55(2.22)a | 420.50(86.17)ab |
| a:P < 0.01,与0分组比较;b:P < 0.05,与1分组比较 | ||||
2.4 筛泡体积与前组筛窦流出道截面积的相关性
Spearman相关系数rs=-0.325,说明筛泡体积与前组筛窦流出道截面积之间存在负相关,即随着筛泡体积的增加,前组筛窦流出道的截面积逐渐降低。筛泡体积与前组筛窦流出道截面积之间的相关关系具有统计学意义(P < 0.01)。
3 讨论筛漏斗是一个三维空间,其内侧是钩突,外侧是眶纸板,上部是上颌骨额突,向上通过半月裂孔与中鼻道相互联系,逐渐延续为前组筛窦及额窦开口,向下发展为上颌窦开口。以筛漏斗为中心邻近区域的结构统称为OMC,OMC是前组鼻窦共同的通畅引流的通道,这个狭窄区域的梗阻是慢性鼻窦炎的重要易患因素。正常的鼻窦通气需要一个通畅的鼻窦口和一个连接鼻窦开口和鼻腔的通畅通道[4]。因此,分别影响筛窦口和半月裂通畅引流的前组筛窦开口周围的骨质改变及筛泡的形态学是本研究的重点。
3.1 筛泡形态学与慢性筛窦炎的关系因筛窦解剖结构的特殊性,筛窦炎的发病率较高,BOLGER等[5]在对202例鼻窦黏膜异常患者的研究中,发现前组筛窦黏膜病变占84.3%,其次为上颌窦病变占77.7%。OMC对中鼻道的引流有重要影响,其中筛漏斗解剖结构是否正常,直接影响前组鼻窦的通气引流,而钩突和筛泡构成筛漏斗的前内下壁和后上壁,因此筛泡的解剖异常如过度气化、黏膜病理改变、肥大等常常使筛漏斗狭窄,从而影响前组筛窦通气引流。其中筛泡过度气化是筛泡最常见的变异,筛泡明显气化可致钩突上缘与筛泡下缘间距和(或)筛泡内缘与中鼻甲外壁间距≤2 mm[6]。KAYGUSUZ等[7]在对99名患者的影像学资料进行回顾性分析时发现31名患者存在筛泡过度气化。为进一步研究筛泡对筛窦通气引流的影响,我们在高分辨率螺旋CT的基础上应用Mimics医学影像学处理软件,通过输入二维的扫描数据重建出精确的三维模型,计算出筛窦及筛泡三维模型的形态学参数。在对160侧筛泡的形态学相关参数的中位数(四方位距)进行分析后可分别得出筛泡体积为108.90 (219.35)mm3,表面积为154.42(192.96)mm2,上下径为6.89(5.44)mm,左右径为7.82(3.97)mm,前后径为7.39(5.10)mm。BANDYOPADHYAY等[4]在对44例患者的OMC进行测量后得出筛泡的平均长、宽、高分别为6.79、6.08和6.61 mm,平均体积为151.97 mm3。
根据前组筛窦内软组织厚度将样本分为0分、1分、2分及3分组,根据SOM等[8]的建议,在CT成像上通常看不到黏膜,因此任何鼻窦黏膜的成像都被认为是异常的,即从可观察到的最小的黏膜增厚到鼻窦完全浑浊都是黏膜异常范围。故本研究中0分组可视为正常对照组,其余各组为慢性筛窦炎组,且病情程度逐渐增加。研究表明各分组的筛泡形态学相关参数中位数逐渐增加,差异均有统计学意义(P < 0.01),说明随着筛泡形态逐渐增大,前组筛窦内软组织厚度逐渐增大,即筛窦炎的严重程度与筛泡的形态有关。通过组间两两比较可知,0分组的筛泡形态学参数与其余各组均具有统计学差异,因此说明与正常对照组相比,慢性筛窦炎组的筛泡体积、径线等明显较大。通过1分组筛泡形态学相关参数的中位数可知,当筛泡形态满足以下条件时,慢性筛窦炎的患病率随之增加:体积≥316.56 mm3,表面积≥159.49 mm2,上下径≥6.94 mm,左右径≥7.92 mm,前后径≥7.66 mm。刘湘燕等[2]报道前组筛窦内软组织厚度随筛泡冠状位截面积增大而增加,表明筛泡大小与前组筛窦炎的发生有关,这也与本研究结果相符。
本研究中各分组的前组筛窦开口的直径和筛漏斗的截面积中位数逐渐减小,差异均有统计学意义(P < 0.01),且0分组的前组筛窦开口的直径和筛漏斗的截面积与其余各组均有统计学差异,说明窦口狭窄和引流通道阻塞会加剧慢性筛窦炎的病情严重程度。而对1分组、2分组及3分组两两比较无统计学差异,考虑为当鼻窦内黏膜增厚及黏液蓄积逐渐加重时,压力作用引起一定程度的窦口扩张,故慢性筛窦炎组的窦口直径和截面积差异不明显。进一步研究筛泡体积与前组筛窦流出道截面积之间存在负相关,即随着筛泡体积的增加,前组筛窦流出道的截面积逐渐降低。筛泡过度气化时巨大的筛泡可阻塞于中鼻道,造成筛漏斗狭窄、筛窦口狭小,影响前组筛窦的通气引流。
3.2 前组筛窦开口周围骨质改变与慢性筛窦炎的关系长期慢性炎症常常累及黏膜下层的骨质,导致鼻窦骨质的炎性改变[9],骨炎是一种非化脓性炎症,其特征是骨膜的增生、吸收骨重塑及之后的新骨形成。LEE等[10]对121例慢性鼻窦炎患者进行研究,发现36%~53%的CRS患者伴有骨炎,其中筛窦是最常见的感染部位(82%),其次为蝶骨(64%)和上颌窦(45%)。尽管组织病理学是诊断骨炎的金标准,但因取材问题在临床上应用受限,故鼻窦CT可以作为诊断和评估鼻窦炎骨质重塑变化的重要方法。本研究为探究前组筛窦口骨质改变对筛窦通畅引流的影响,测量了前组筛窦口周围骨质的CT值,结果显示随着筛窦内软组织厚度的增加,骨质的CT值逐渐增大,慢性筛窦炎组的骨质增生明显大于正常对照组(P < 0.01),而在慢性筛窦炎组中1分组与其余两组有明显差异,可见长期慢性炎症刺激对骨质产生了明显影响,同时增生的骨质也可能进一步影响窦口引流,加剧鼻窦黏膜炎症的发生。以上可能是导致难治性鼻窦炎的原因之一;部分慢性鼻窦炎、鼻息肉患者在经过鼻内镜手术后术区迁延不愈或复发,可能与术中只去除表面增生肥厚的黏膜,忽略了伴有炎性增生的骨质有关,残留的炎性增生骨质会加剧其黏膜表面的炎症反应。因此,在鼻内镜手术中,应在尽可能保留黏膜的情况下将不可逆转的病变黏膜和骨炎骨质清除[11],以减轻术腔炎症反应,提高手术疗效,避免术后复发。另外,慢性鼻窦炎患者鼻窦骨质的炎性改变在容易受累的前组筛窦更明显,并且随着脓性分泌物逐渐蓄积而更加严重,脓性分泌物和窦腔骨炎的形成是慢性筛窦炎持续发展的结果[12]。
综上所述,慢性筛窦炎的易患因素很多,本研究重点探讨影响窦口鼻道复合体通畅引流的两个重要因素:筛泡及窦口骨质变化,二者的结构异常均会对慢性筛窦炎的发病进程产生影响。由于解剖变异或黏膜肥厚导致的窦口鼻道复合体区域狭窄时,可导致窦口阻塞和粘液排出受阻,进而导致鼻窦感染,而当阻塞的引流通道被重新打开时,炎症过程也将被逆转[13]。故功能性鼻窦开放手术主要以解除窦口鼻道复合体的阻塞为主要目的。而对比传统的鼻窦CT,应用三维重建软件对二维图像再处理,可以弥补传统影像学技术的病变部位大小、毗邻结构不清晰,缺乏立体感等不足,利用既有的影像学数据通过计算机处理后获得高质量的三维立体结构,更加能准确反映鼻腔鼻窦形态学结构及与周围各组织空间位置关系,可于术前对患者的病情严重程度有更清晰的认识,有利于外科手术方案设计,减少手术并发症的发生,对鼻腔鼻窦疾病的诊断、治疗、预后及手术风险评估都具有临床意义。
| [1] |
PARK C S, PARK Y S, PARK Y J, et al. The inhibitory effects of macrolide antibiotics on bone remodeling in chronic rhinosinusitis[J]. Otolaryngol Head Neck Surg, 2007, 137(2): 274-279. DOI:10.1016/j.otohns.2007.02.010 |
| [2] |
刘湘燕, 韩德民, 周兵. 鼻鼻窦解剖变异与慢性鼻窦炎的关系[J]. 中华耳鼻咽喉科杂志, 1998, 33(3): 149-152. LIU X Y, HAN D M, ZHOU B. Relationship between anatomic variations of nasal sinus and chronic sinusitis[J]. Chin J Otorhinolaryngol, 1998, 33(3): 149-152. |
| [3] |
成强, 徐林根, 姜辉, 等. 窦口鼻道复合体周围骨质改变的CT评估在老年慢性鼻-鼻窦炎中的意义[J]. 老年医学与保健, 2018, 24(6): 639-642. CHENG Q, XU L G, JIANG H, et al. CT evaluation of bony change aroundostimeatal complex in the elderly with nasalsinusitis[J]. Geriatr Heal Care, 2018, 24(6): 639-642. DOI:10.3969/j.issn.1008-8296.2018.06.022 |
| [4] |
BANDYOPADHYAY R, BISWAS R, BHATTACHERJEE S, et al. Osteomeatal complex: a study of its anatomical variation among patients attending north Bengal medical college and hospital[J]. Indian J Otolaryngol Head Neck Surg, 2015, 67(3): 281-286. DOI:10.1007/s12070-015-0874-z |
| [5] |
BOLGER W E, BUTZIN C A, PARSONS D S. Paranasal sinus bony anatomic variations and mucosal abnormalities: CT analysis for endoscopic sinus surgery[J]. Laryngoscope, 1991, 101(1 Pt 1): 56-64. DOI:10.1288/00005537-199101000-00010 |
| [6] |
郭传超, 毕万利. 多层螺旋CT在窦口-鼻道复合体变异及鼻窦炎的临床应用价值[J]. 医学影像学杂志, 2015(6): 1079-1082. GUO C C, BI W L. The clinical application value of MSCT in the ostiomeatal complex anatomical variations and sinusitis[J]. J Med Imaging, 2015(6): 1079-1082. |
| [7] |
KAYGUSUZ A, HAKSEVER M, AKDUMAN D, et al. Sinonasal anatomical variations: their relationship with chronic rhinosinusitis and effect on the severity of disease-a computerized tomography assisted anatomical and clinical study[J]. Indian J Otolaryngol Head Neck Surg, 2014, 66(3): 260-266. DOI:10.1007/s12070-013-0678-y |
| [8] |
SOM P M. CT of the paranasal sinuses[J]. Neuroradiology, 1985, 27(3): 189-201. DOI:10.1007/bf00344487 |
| [9] |
SETHI N. The significance of osteitis in rhinosinusitis[J]. Eur Arch Otorhinolaryngol, 2015, 272(4): 821-826. DOI:10.1007/s00405-014-3060-0 |
| [10] |
LEE J T, KENNEDY D W, PALMER J N, et al. The incidence of concurrent osteitis in patients with chronic rhinosinusitis: a clinicopathological study[J]. Am J Rhinol, 2006, 20(3): 278-282. DOI:10.2500/ajr.2006.20.2857 |
| [11] |
TELMESANI L M, AL-SHAWARBY M. Osteitis in chronic rhinosinusitis with nasal polyps: a comparative study between primary and recurrent cases[J]. Eur Arch Oto-Rhino-Laryngol, 2010, 267(5): 721-724. DOI:10.1007/s00405-009-1146-x |
| [12] |
邹华, 田鹏. 慢性鼻-鼻窦炎与骨炎[J]. 临床耳鼻咽喉头颈外科杂志, 2015, 29(9): 773-777. ZOU H, TIAN P. Chronic rhinosinusitis and osteitis[J]. J Clin Otorhinolaryngol Head Neck Surg, 2015, 29(9): 773-777. DOI:10.13201/j.issn.1001-1781.2015.09.001 |
| [13] |
AZILA A, IRFAN M, ROHAIZAN Y, et al. The prevalence of anatomical variations inosteomeatal unit in patients with chronic rhinosinusitis[J]. Med J Malaysia, 2011, 66(3): 191-194. |




