近年来,研究发现了一群新的调节性T细胞,即滤泡调节性T细胞(follicular regulatory T cells, Tfr),其伴随着生发中心(germinal center, GC)反应形成。构成GC反应的Tfr细胞,滤泡辅助性T细胞(follicular T helper cells, Tfh)和B细胞的相互作用在抗体、免疫记忆产生中发挥重要功能。其中,Tfh细胞迁移到GC,给同源的B细胞提供必需的生存、增殖和选择信号,促使B细胞经历一系列的反应包括亲和力成熟、类别转换、高频突变,最终产生大量的高亲和力抗体和记忆性B细胞。Tfr细胞与Tfh细胞功能相反,能够负向调控体液免疫的中心轴“Tfh-B细胞-抗体”。Tfr细胞在维持正常体液免疫应答的同时,防止抗体介导的自身免疫性疾病发生。目前研究认为,Tfr细胞来源于胸腺的天然Treg细胞(natural Treg, nTreg)。然而,nTreg细胞如何分化形成Tfr细胞是领域内空白。本述评拟结合文献和本实验室工作,介绍Tfr细胞在GC反应中的作用及其机制。
1 Tfr细胞与生发中心反应Tfh细胞是一类新鉴定的辅助性CD4+T细胞。在引流淋巴组织中,受抗原激活的CD4+T细胞表达趋化因子受体CXCR5,识别并结合源自B细胞的趋化因子配体CXCL13,脱离T细胞区而迁移至B细胞滤泡区,诱导GC的产生。这群CD4+T细胞在上述过程中经由Bcl6转录调控,最终分化发育成Tfh细胞[1-3]。Tfh细胞表达特征性表面分子CXCR5、PD-1和ICOS等[4]。在GC中,Tfh细胞通过ICOS和CD40L等细胞表面分子以及分泌的细胞因子IL-21等,直接作用于抗原特异性B细胞[5]。在Tfh细胞的帮助下,B细胞经历活化、增殖,类别转换,高频突变,最终产生高亲和力的抗体和记忆性B细胞。因此,Tfh细胞在诱导B细胞分泌高亲和力抗体、为机体清除外来病原体、维持体液免疫和控制自身免疫性疾病等过程中扮演十分重要的角色[6]。
新近研究进一步表明,Tfr细胞是一类新发现的调节性T细胞(regulatory T cell, Treg)亚群,其特点是细胞表型与Tfh细胞和Treg细胞均有重叠,不仅表达Tfh细胞的标志物CXCR5、Bcl6、PD-1和ICOS,还表达Treg细胞的标志物CTLA4、GITR和Foxp3。Tfr细胞由胸腺来源的nTreg细胞分化形成,Tfh细胞则由naive CD4+ T细胞分化形成。在功能上,Tfr细胞能够抑制Tfh和B细胞,负反馈调控GC反应,抑制抗体产生[7-9]。细胞因子IL-21、IL-2和IL-6可以负向调控Tfr细胞分化[10-12]。细胞因子IL-21与其受体IL-21R结合,上调转录因子Bcl6,减少CD25表达,从而抑制Tfr细胞分化[10-11]。在流感病毒感染期,高浓度的IL-2能够抑制Tfr细胞反应,当免疫反应消退后,CD25+Treg细胞通过降低CD25表达,上调转录因子Blimp-1表达,上调Bcl6、CXCR5和PD-1分化为Tfr细胞[12]。然而,在生发中心,nTreg细胞如何分化为Tfr细胞的机制尚不清楚;Tfh细胞是否具有负向调控功能,更是领域内研究空白。
2 Tfh细胞新亚群负反馈调节Tfr细胞分化2020年8月21日,我们课题组在Science杂志发表题为“SOSTDC1-producing follicular helper T cells promote follicular regulatory T cell differentiation”的研究论文,明确报道Tfh细胞新亚群——SOSTDC1+Tfh细胞,阐明其通过促进Tfr细胞分化,负反馈调控抗体产生[13]。该研究展示了Tfh细胞新亚群如何调控Tfr分化,从而维持体液免疫稳态,阐释了Tfr细胞分化的新机制。在本研究中,首先为了明确SOSTDC1 (sclerostin domain-containing protein 1)在Tfh细胞中表达[14],我们在国际上建立了Sostdc1EGFP/Bcl6RFP双报告转基因小鼠,结果显示:30% Tfh细胞特异性高表达SOSTDC1,并形成特定的细胞亚型SOSTDC1+Tfh。免疫荧光染色显示SOSTDC1主要由分布在T-B细胞边界区域的Tfh细胞和成纤维网状基质细胞(FRCs)表达(图 1)。随后,我们进一步采用单细胞转录组测序分析揭示了SOSTDC1+ Tfh新亚型是由SOSTDC1-Tfh细胞分化生成。在体外实验中发现SOSTDC1+ Tfh细胞与经典的Tfh细胞功能不同,它不能帮助B细胞产生抗体。
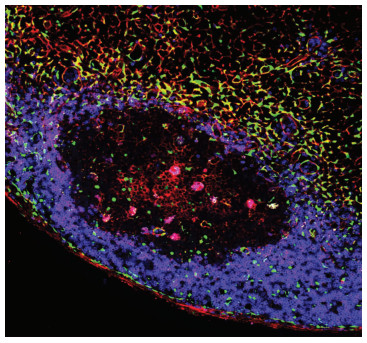
|
| 图 1 SOSTDC1在引流淋巴结的分布 |
SOSTDC1+Tfh细胞的功能是什么?在小鼠的流感病毒感染模型以及KLH特异性抗原免疫模型中,我们发现SOSTDC1缺失增强生发中心反应:伴随着生发中心B细胞数目的增多,Tfr细胞数目明显减少。进一步采用骨髓移植构建嵌合体小鼠,我们发现Tfh细胞来源的SOSTDC1能够促进Tfr细胞分化。为了进一步探究SOSTDC1促进Tfr细胞分化的分子机制,我们通过转录组分析发现,SOSTDC1-Tfh细胞表达大量的WNT配体基因,而SOSTDC1+ Tfh细胞表达拮抗WNT信号的基因。已有研究表明WNT信号能够抑制Treg细胞功能[15-17]。因此,我们推测:缺失SOSTDC1上调WNT/β-catenin信号通路,从而抑制Tfr细胞分化。通过对SOSTDC1缺失情况下的Tfr细胞分析,发现受损Tfr细胞呈现炎性细胞特征:大量表达IL-4、IL-5、IL-6、IL-13以及IL-21等炎性细胞因子,同时Tfr细胞表现为WNT/β-catenin信号通路过度激活,表明Tfh可通过SOSTDC1促进Tfr的分化和功能。我们从nTreg如何分化为Tfr细胞这一领域内开放性问题入手,原创性地证实Tfh细胞的新亚群能够促进Tfr细胞分化,进而负反馈调节生发中心反应,维持体液免疫稳态。
3 问题和展望近期,Tfr细胞分化的作用机制取得了重大进展。但是,许多问题和困惑亟待解答,例如:①Tfr细胞如何调节抗体亲和力成熟和Tfh反应?②Tfr细胞是否调节记忆B细胞的产生、分化或存活?③何种信号驱动Tfr细胞对GC做出响应以及Tfr细胞识别何种抗原?④虽然Tfr细胞可以抑制Tfh和B细胞是清楚的,但它们是如何发挥这些抑制作用仍不清楚。上述问题的解答将有助于促进我们对Tfr细胞的认识、增进对Tfr细胞调控肿瘤以及自身免疫性疾病的理解。
| [1] |
JOHNSTON R J, POHOLEK A C, DITORO D, et al. Bcl6 and blimp-1 are reciprocal and antagonistic regulators of T follicular helper celldifferentiation[J]. Science, 2009, 325(5943): 1006-1010. DOI:10.1126/science.1175870 |
| [2] |
NURIEVA R I, CHUNG Y, MARTINEZ G J, et al. Bcl6 mediates the development of T follicular helpercells[J]. Science, 2009, 325(5943): 1001-1005. DOI:10.1126/science.1176676 |
| [3] |
YU D, RAO S, TSAI L M, et al. The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment[J]. Immunity, 2009, 31(3): 457-468. DOI:10.1016/j.immuni.2009.07.002 |
| [4] |
LIU X, NURIEVA R I, DONG C. Transcriptional regulation of follicular T-helper (Tfh) cells[J]. Immunol Rev, 2013, 252(1): 139-145. DOI:10.1111/imr.12040 |
| [5] |
CROTTY S. Follicular helper CD4 T cells (TFH)[J]. Annu Rev Immunol, 2011, 29: 621-663. DOI:10.1146/annurev-immunol-031210-101400 |
| [6] |
VICTORA G D, NUSSENZWEIG M C. Germinal centers[J]. Annu Rev Immunol, 2012, 30(1): 429-457. DOI:10.1146/annurev-immunol-020711-075032 |
| [7] |
CHUNG Y, TANAKA S, CHU F L, et al. Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germinal center reactions[J]. Nat Med, 2011, 17(8): 983-988. DOI:10.1038/nm.2426 |
| [8] |
LINTERMAN M A, PIERSON W, LEE S K, et al. Foxp3+ follicular regulatory T cells control the germinal center response[J]. Nat Med, 2011, 17(8): 975-982. DOI:10.1038/nm.2425 |
| [9] |
WOLLENBERG I, AGUA-DOCE A, HERNÁNDEZ A, et al. Regulation of the germinal center reaction by Foxp3+ follicular regulatory T cells[J]. J Immunol, 2011, 187(9): 4553-4560. DOI:10.4049/jimmunol.1101328 |
| [10] |
WING J B, KITAGAWA Y, LOCCI M, et al. A distinct subpopulation of CD25- T-follicular regulatory cells localizes in the germinalcenters[J]. Proc Natl Acad Sci USA, 2017, 114(31): E6400-E6409. DOI:10.1073/pnas.1705551114 |
| [11] |
JANDL C, LIU S M, CAÑETE P F, et al. IL-21 restricts T follicular regulatory T cell proliferation through Bcl-6 mediated inhibition of responsiveness to IL-2[J]. Nat Commun, 2017, 8: 14647. DOI:10.1038/ncomms14647 |
| [12] |
BOTTA D, FULLER M J, MARQUEZ-LAGO T T, et al. Dynamic regulation of T follicular regulatory cell responses by interleukin 2 during influenza infection[J]. Nat Immunol, 2017, 18(11): 1249-1260. DOI:10.1038/ni.3837 |
| [13] |
WU X, WANG Y, HUANG R, et al. SOSTDC1-producing follicular helper T cells promote regulatory follicular T cell differentiation[J]. Science, 2020, 369(6506): 984-988. DOI:10.1126/science.aba6652 |
| [14] |
LIU X D, YAN X W, ZHONG B, et al. Bcl6 expression specifies the T follicular helper cell program in vivo[J]. J Exp Med, 2012, 209(10): 1841-1852. DOI:10.1084/jem.20120219 |
| [15] |
VAN LOOSDREGT J, FLESKENS V, TIEMESSEN M M, et al. Canonical Wnt signaling negatively modulates regulatory T cell function[J]. Immunity, 2013, 39(2): 298-310. DOI:10.1016/j.immuni.2013.07.019 |
| [16] |
KEERTHIVASAN S, AGHAJANI K, DOSE M, et al. β-catenin promotes colitis and colon cancer through imprinting ofproinflammatory properties in T cells[J]. Sci Transl Med, 2014, 6(225): 225ra28. DOI:10.1126/scitranslmed.3007607 |
| [17] |
SUMIDA T, LINCOLN M R, UKEJE C M, et al. Activated β-catenin in Foxp3+regulatory T cells links inflammatory environments to autoimmunity[J]. Nat Immunol, 2018, 19(12): 1391-1402. DOI:10.1038/s41590-018-0236-6 |




