我国高原分布广泛,包括西藏、青海、四川西部和新疆南部山地等地区,面积约为250万km2,平均海拔4 000 m以上[1]。青藏高原是我国军事重地,加上高原地区地质灾害活动频繁,一旦战争或灾害发生,大量平原部队或救援人员将迅速进入高原地区执行军事或救援任务[2-3]。缺氧是人类进入高原面临的最大生存考验,如何保障部队官兵或救援人员拥有敏捷的判断力和充足的体力,是确保作业人员战斗力的关键。
随着海拔高度的增加,大气压下降,空气密度减小,大气中氧分压降低,进而导致机体动脉血氧饱和度下降,人体产生缺氧[4]。吸氧能有效改善机体缺氧状态,是预防及治疗急慢性高原病的首要措施[5]。弥散供氧不仅可以满足同一生活环境中的人共同吸氧,而且无需佩戴鼻导管、面罩等束缚性配件,增加吸氧人员活动范围的同时提高了吸氧舒适度,是目前较为理想的高原供氧方式[6]。
为了提升高原地区应急救援住宿保障能力,克服缺氧寒冷环境对作业人员战斗力的影响,我们课题组研发了高原高寒地区弥散供氧住宿方舱装备,并在海拔3 540 m高原某试验场进行实地应用,检验住宿方舱在高原高寒环境下弥散供氧对人体生理学效应的影响,从而探究弥散吸氧的抗缺氧作用,分析阐明产生抗缺氧作用的代谢通路。
1 资料与方法 1.1 研究对象以移居海拔3 540 m高原某地1年以上的10名人员为研究对象,均为男性,年龄(25.60±1.96)岁,身高(173.20±4.64)cm,体质量(68.60±5.95)kg,无高血压、冠心病、呼吸系统疾病史,近期无服用任何药物。本研究经陆军军医大学医学伦理委员会批准(2020第001-02)。按照知情且自愿参加原则,研究对象均已被书面形式告知本次试验的目的和内容,且可以在任何时间无条件放弃参与本次试验,均自愿参加并签署知情同意书。采用自身前后对照方法,以新研发的弥散供氧住宿方舱为实验场所,研究对象在舱内连续弥散式吸氧3 d,2 h/d。
1.2 实验场所弥散供氧住宿方舱研制由国家科技部牵头,万华节能科技集团股份有限公司、北京科技大学、陆军军医大学合作研发。
弥散供氧住宿方舱由住宿方舱和设备方舱组成。住宿方舱主要由舱体、制热系统、供氧系统、新风系统、加湿系统、环境参数控制系统组成,设备方舱主要由制氧系统和发电系统组成。舱体为展收式,收拢状态为20英尺标准集装箱,展开时舱内面积40.5 m2;使用海拔≥3 000 m;使用环境温度-25~46 ℃;舱内制热温度≥13 ℃;制氧机氧气产量1 Nm3/h;产氧浓度≥91%;舱内氧浓度≥23%;住宿方舱工作噪声≤35 dB(A);最大住用人数:20人。弥散供氧住宿方舱展开运行情况如图 1所示。

|
| A: 方舱实地应用示范;B:方舱内部结构布局 图 1 弥散供氧住宿方舱展开运行图 |
1.3 检测方法 1.3.1 仪器与试剂
电子血压计(欧姆龙U30型);脉搏血氧饱和度仪(力新Prince-100H型);气体检测仪(元特SKY6000-Q4-2型);AB Triple TOF 6600质谱仪(AB SCIEX);Agilent 1290 Infinity LC超高压液相色谱仪(Agilent);低温高速离心机(Eppendorf5430R);色谱柱:Waters,ACQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm column;乙腈(Merck, 1499230-935);乙酸铵(Sigma, 70221)。
1.3.2 生理指标检测及舱内弥散供氧浓度检测在静息状态下,使用电子血压计首先对研究对象每天吸氧前室内血压测量1次,再使用脉搏血氧饱和度仪对研究对象吸氧前室内血氧饱和度、脉率进行15 min连续监测,每3 min记录1次。而后进入住宿方舱休息采用弥散供氧方式吸氧,使用脉搏血氧饱和度仪对研究对象血氧饱和度、脉率进行2 h连续监测,每3 min记录1次。吸氧结束时,再测量血压1次。研究对象在住宿方舱内弥散吸氧期间,采用气体检测仪对舱内富氧浓度情况进行检测,每3 min记录1次。
1.3.3 血样采集及处理第1天吸氧前和第3天吸氧结束时,分别对研究对象进行肘静脉采血。每个研究对象采集静脉血6 mL/次,分别装入2个EDTA抗凝管中,3 mL/管。分别在采样当天将血样4 ℃低温保存送至中国人民解放军952医院实验室进行血常规检测,同时制备代谢组检测所需血浆,制备过程为:血样离心8 min,转速为3 500 r/min,取上层血浆装入冻存管中放至-20 ℃冰箱保存。所有血浆样本于次日低温保存空运至重庆,存于陆军军医大学实验室-80 ℃冰箱中,待测。
代谢组学样本处理:代谢组学分析共采用2组血浆样本,状态为液体,每组7份生物学重复样本(因血浆量的问题,有3个样本检测不合格,舍去)。①样本处理:-80 ℃取出样本,4 ℃缓慢溶解后分别取各组样本100 μL,加入400 μL预冷的甲醇乙腈溶液(甲醇∶乙腈=1 ∶1,体积比),涡旋60 s,-20 ℃放置1 h沉淀蛋白,14 000×g,4 ℃离心20 min,取上清冷冻干燥,-80 ℃保存样本待用;样本制备过程中,按上述方法平行制备QC样本。质谱分析时加入100 μL乙腈水溶液(乙腈∶水=1 ∶1,体积比)复溶,涡旋,14 000×g 4 ℃离心15 min,取上清液进样分析。②质控样本(QC)的制备:分别取每个样本10 μL混合用于制备QC。QC用于测定进样前仪器状态及平衡色谱-质谱系统, 并用于评价整个实验过程中系统稳定性。
1.3.4 色谱-质谱分析 1.3.4.1 色谱分析样品采用Agilent 1290 Infinity LC超高效液相色谱系统(UHPLC)HILIC色谱柱进行分离。柱温25 ℃;流速0.3 mL/min;流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈。梯度洗脱程序如下:0~0.5 min, 为95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%;整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性。
1.3.4.2 Q-TOF质谱分析样本检测完毕后, 采用AB Triple TOF 6600质谱仪采集样品的一级、二级谱图。HILIC色谱分离后的ESI源条件如下:辅助气压1(Gas1):60,辅助气压2(Gas2):60,气帘气(CUR):30,源温度:600 ℃,喷雾电压(ISVF):±5 500 V(正负两种模式);TOF MS扫描m/z范围:60~1 000 Da,产物离子扫描m/z范围:25~1 000 Da,TOF MS扫描累积时间0.20 s/光谱,产物离子扫描累积时间0.05 s/光谱;二级质谱采用信息依赖性扫描(IDA)获得,并且采用高感光度模式,锥孔电压(DP):±60 V(正负两种模式),碰撞能量:(35±15)eV,IDA设置如下:排除4 Da之内的同位素,每个周期监测的候选离子:6。
1.4 统计学分析采用SPSS20.0软件进行统计分析。服从正态分布的计量资料以x±s表示,组间比较采用配对样本t检验;不满足正态分布的计量资料以M(Q1, Q3)表示,组间比较采用非参数检验:配对样本Wilcoxon符号秩和检验。P < 0.05为差异有统计学意义。
代谢组检测原始数据经Proteo Wizard转换成mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。代谢物结构鉴定采用精确质量数匹配(< 25 ppm)和二级谱图匹配的方式,检索人类代谢组学数据库(HMDB)、京都基因与基因组百科全书数据库(KEGG)进行鉴定。数据经Pareto scaling预处理后,进行多维统计分析,包括无监督主成分分析(PCA),有监督正交偏最小二乘法判别分析(OPLS-DA)。单维统计分析包括t检验和变异倍数(fold change,FC)分析。根据变量投影重要度(variable importance for the projection,VIP)值>1及t检验P < 0.05作为筛选显著差异代谢物的标准。通过Metabo Analyst 4.0软件进行差异代谢物通路分析。R软件绘制火山图。
2 结果 2.1 生理指标检测及弥散供氧浓度检测结果研究对象在住宿方舱内吸氧期间,住宿方舱弥散供氧浓度分别为第1天(22.85±0.36)%、第2天(22.52±0.76)%、第3天(22.57±1.05)%。
研究对象弥散吸氧后血氧饱和度显著提高、脉搏明显下降,2个指标变化差异有统计学意义(P < 0.01);弥散吸氧前后研究对象舱内与室内血压值比较差异无统计学意义。见表 1。
| 时间 | 指标 | 吸氧前(室内) | 吸氧后(舱内) | P值 |
| 第1天 | 收缩压/mmHg | 111.00(96.75,115.00) | 114.00(99.50,118.50) | 0.072 |
| 舒张压/mmHg | 73.00(65.75,77.50) | 74.50(69.25,76.25) | 0.439 | |
| 脉搏/次·min-1 | 85.80±7.54 | 76.80±9.52 | 0.003 | |
| 血氧饱和度(%) | 89.21±1.95 | 93.09±1.12 | 0.000 | |
| 第2天 | 收缩压/mmHg | 104.30±8.74 | 111.00±7.72 | 0.067 |
| 舒张压/mmHg | 72.10±8.25 | 70.60±7.06 | 0.653 | |
| 脉搏/次·min-1 | 85.83±10.16 | 73.12±11.45 | 0.002 | |
| 血氧饱和度(%) | 89.75±1.22 | 93.39±1.19 | 0.000 | |
| 第3天 | 收缩压/mmHg | 110.20±9.96 | 114.30±13.86 | 0.178 |
| 舒张压/mmHg | 71.20±9.46 | 73.80±11.60 | 0.493 | |
| 脉搏/次·min-1 | 82.67±10.18 | 74.53±8.87 | 0.008 | |
| 血氧饱和度(%) | 90.28±1.85 | 92.35±0.98 | 0.001 |
2.2 代谢组检测结果分析
对代谢组检测数据进行主成分分析(PCA),结果见图 2。由图中可见正、负离子模式数据在t[1]和t[2]维图上吸氧前、吸氧后两组间有明显的分离趋势,说明吸氧后的研究对象血浆代谢谱发生了明显改变。

|
| A:正离子模式;B:负离子模式;S:吸氧后;F:吸氧前 图 2 正、负离子模式PCA得分图 |
采用正交偏最小二乘法判别分析(OPLS-DA)方法建立代谢物表达量与样本类别之间的关系模型,通过计算VIP值辅助差异代谢物筛选。由OPLS-DA得分图可见两组样本在正、负离子模式下均有明显分离趋势,见图 3。说明建立的模型有效,模式质量良好,可用于后续的组间差异代谢物的筛选和分析。采用变异倍数(FC)和t检验单变量分析方法,以FC>1.5且P < 0.05作为标准,筛选出差异代谢物的火山图见图 4。枚红色点为差异代谢物。

|
| A:正离子模式;B:负离子模式;S:吸氧后;F:吸氧前 图 3 正、负离子模式OPLS-DA得分图 |
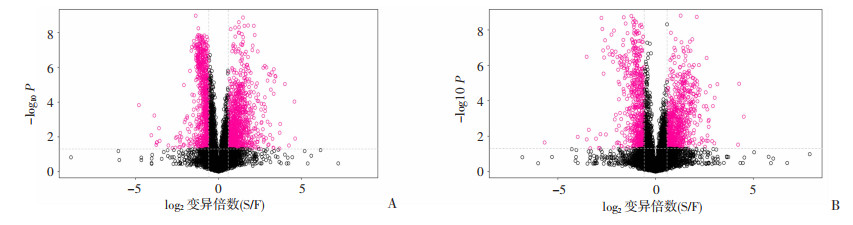
|
| A:正离子模式;B:负离子模式 图 4 正、负离子模式差异代谢物火山图 |
2.3 显著差异代谢物筛选与代谢通路分析
选择同时具有多维统计分析筛选标准VIP>1和单变量统计分析筛选标准P < 0.05的代谢物,作为显著差异代谢物。经HMDB、KEGG等数据库鉴定筛选,共找出44种显著差异代谢物,其中正离子模式下鉴定出18种,负离子模式下鉴定出26种,见表 2。
| 序号 | 代谢物名称 | 离子模式 | VIP | FC | P | m/z | RT/s | HMDB ID |
| 1 | L-缬氨酸 | 正离子 | 1.487 | 2.073 | 0.000 | 159.112 | 261.623 | HMDB0000883 |
| 2 | L-哌啶酸 | 正离子 | 2.934 | 2.527 | 0.000 | 171.112 | 260.875 | HMDB0000070 |
| 3 | L-天冬氨酸 | 正离子 | 1.052 | 0.742 | 0.000 | 134.044 | 448.276 | HMDB0000191 |
| 4 | 次黄嘌呤 | 正离子 | 7.332 | 0.358 | 0.000 | 137.045 | 164.163 | HMDB0000157 |
| 5 | L-苯丙氨酸 | 正离子 | 1.559 | 2.011 | 0.000 | 207.112 | 227.799 | HMDB0000159 |
| 6 | L-正亮氨酸 | 正离子 | 2.866 | 2.145 | 0.000 | 173.128 | 239.132 | HMDB0001645 |
| 7 | L-左旋肉碱 | 正离子 | 15.849 | 1.402 | 0.000 | 162.113 | 351.359 | HMDB0000062 |
| 8 | 2-氨基苯甲酸 | 正离子 | 1.918 | 4.264 | 0.000 | 138.054 | 287.220 | HMDB0001123 |
| 9 | 牛磺酸 | 正离子 | 3.146 | 0.557 | 0.001 | 126.021 | 290.651 | HMDB0000251 |
| 10 | 三乙醇胺 | 正离子 | 2.547 | 2.551 | 0.002 | 150.111 | 146.187 | HMDB0032538 |
| 11 | 1-甲基组氨酸 | 正离子 | 1.292 | 1.750 | 0.005 | 170.091 | 467.174 | HMDB0000001 |
| 12 | D-脯氨酸 | 正离子 | 6.373 | 3.229 | 0.008 | 116.070 | 311.014 | HMDB0003411 |
| 13 | 磷酸腺苷(AMP) | 正离子 | 2.129 | 0.174 | 0.010 | 348.069 | 425.158 | HMDB0000045 |
| 14 | 甘油磷酰胆碱 | 正离子 | 1.256 | 1.308 | 0.014 | 258.108 | 404.280 | HMDB0000086 |
| 15 | L-焦谷氨酸 | 正离子 | 1.753 | 0.600 | 0.019 | 130.049 | 433.012 | HMDB0000267 |
| 16 | L-精氨酸 | 正离子 | 4.562 | 2.153 | 0.029 | 175.119 | 578.670 | HMDB0000517 |
| 17 | 3-甲基组氨酸 | 正离子 | 2.553 | 1.665 | 0.046 | 170.092 | 395.030 | HMDB0000001 |
| 18 | L-组氨酸 | 正离子 | 1.096 | 1.339 | 0.049 | 156.076 | 477.025 | HMDB0000177 |
| 19 | 黄嘌呤 | 负离子 | 1.299 | 0.386 | 0.000 | 151.026 | 216.255 | HMDB0000292 |
| 20 | L-古洛内酯 | 负离子 | 3.444 | 2.892 | 0.000 | 177.040 | 100.386 | HMDB0003466 |
| 21 | 葡萄糖胺 | 负离子 | 1.372 | 2.569 | 0.000 | 160.061 | 377.790 | HMDB0001514 |
| 22 | D-乳酸 | 负离子 | 9.037 | 0.728 | 0.000 | 89.025 | 231.610 | HMDB0001311 |
| 23 | 二氢胸腺嘧啶 | 负离子 | 1.372 | 0.643 | 0.000 | 187.072 | 451.477 | HMDB0000079 |
| 24 | D-苏糖醇 | 负离子 | 1.681 | 1.299 | 0.000 | 143.035 | 291.829 | HMDB0004136 |
| 25 | D-果糖 | 负离子 | 3.692 | 1.753 | 0.000 | 359.118 | 292.348 | HMDB0062538 |
| 26 | D-塔格糖 | 负离子 | 2.735 | 1.268 | 0.000 | 161.045 | 292.195 | HMDB0003418 |
| 27 | D-甘露糖 | 负离子 | 11.402 | 1.372 | 0.000 | 179.057 | 292.323 | HMDB0000169 |
| 28 | 磷酸胆碱 | 负离子 | 1.067 | 1.469 | 0.000 | 242.079 | 381.506 | HMDB0001565 |
| 29 | 棕榈酸 | 负离子 | 1.307 | 0.693 | 0.001 | 255.232 | 217.454 | HMDB0000220 |
| 30 | 3-羟基十二烷酸 | 负离子 | 2.670 | 0.295 | 0.001 | 197.154 | 45.138 | HMDB0000387 |
| 31 | 二羟基丙酮 | 负离子 | 1.212 | 1.333 | 0.001 | 71.013 | 291.488 | HMDB0001882 |
| 32 | 乙酰甘氨酸 | 负离子 | 1.606 | 1.206 | 0.009 | 233.077 | 403.301 | HMDB0000532 |
| 33 | 亚油酸 | 负离子 | 21.852 | 0.627 | 0.014 | 279.233 | 42.505 | HMDB0000673 |
| 34 | 甘油酸 | 负离子 | 1.636 | 2.223 | 0.016 | 105.019 | 308.390 | HMDB0000139 |
| 35 | 柠檬酸盐 | 负离子 | 1.789 | 0.910 | 0.017 | 191.020 | 463.291 | HMDB0000094 |
| 36 | 二十二碳六烯酸 | 负离子 | 6.118 | 0.533 | 0.017 | 327.232 | 41.851 | HMDB0002183 |
| 37 | 尿囊素 | 负离子 | 3.111 | 1.393 | 0.020 | 139.026 | 290.562 | HMDB0000462 |
| 38 | 油酸 | 负离子 | 1.210 | 0.551 | 0.023 | 281.248 | 190.256 | HMDB0000207 |
| 39 | 棕榈油酸 | 负离子 | 7.400 | 0.584 | 0.025 | 253.217 | 43.157 | HMDB0003229 |
| 40 | 牛磺酸 | 负离子 | 2.192 | 0.797 | 0.025 | 124.007 | 289.736 | HMDB0000251 |
| 41 | 2-氧己二酸 | 负离子 | 23.408 | 0.698 | 0.031 | 141.017 | 331.967 | HMDB0000225 |
| 42 | 胸腺嘧啶核糖核苷酸 | 负离子 | 1.045 | 1.189 | 0.032 | 257.077 | 138.581 | HMDB0000884 |
| 43 | L-苏糖酸 | 负离子 | 1.186 | 1.254 | 0.037 | 135.030 | 310.223 | HMDB0000943 |
| 44 | L-谷氨酰胺 | 负离子 | 1.126 | 1.381 | 0.039 | 183.015 | 256.530 | HMDB0000641 |
| m/z为离子质荷比 | ||||||||
将上述44个显著差异代谢物通过Metabo Analyst 4.0进行代谢通路分析,将代谢通路的影响值(pathway impact)界定在0.05,当某一条代谢通路的影响值大于0.05且-log10(P)>1.3时,即认定其为有显著差异的代谢通路。发现主要有4条代谢通路发生显著变化,分别为精氨酸生物合成;组氨酸代谢;丙氨酸、天冬氨酸和谷氨酸代谢;乙醛酸和二羧酸代谢,见图 5。
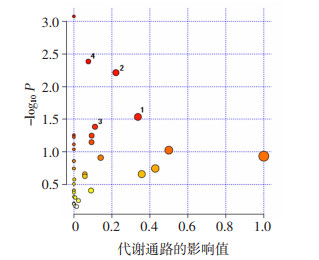
|
| 1:丙氨酸、天冬氨酸和谷氨酸代谢;2:组氨酸代谢;3:乙醛酸和二羧酸代谢;4:精氨酸生物合成 图 5 显著差异代谢物代谢通路分析气泡图 |
3 讨论
高原反应和高原病的发生与高原地区的低氧环境密切相关,补充氧气供应不仅可以缓解由于短期缺氧引起的各种不适,提高人体机能,还可以有效降低高原病的发生[7]。WEST研究表明[8],在高原增加1%的氧浓度,相当于使海拔下降300 m,提高高原室内氧浓度可以有效预防急慢性高原病的发生。本次实验数据显示,满足舱内10人弥散吸氧条件下,住宿方舱弥散供氧2 h,可将舱内氧浓度提高至23%以上,舱内供氧浓度相当于2 000~2 500 m海拔高度水平。研究对象通过舱内弥散吸氧,血氧饱和度水平明显提高、脉率水平显著下降,说明弥散吸氧抗缺氧效果明显,且对心肌有保护作用,能有效缓解高原缺氧环境对机体的影响,上述结果与文献[9-10]报道一致。在高原缺氧寒冷环境作业的人员,不管是高原执行军事任务的官兵,还是灾害救援人员,弥散供氧住宿方舱都有助于高原作业人员保持敏捷的判断力和充足的体力,从而提高人体在高原上的劳动能力和健康水平。
代谢过程不仅为人体的各种生命活动提供能量,代谢过程中形成的中间产物对心血管系统、造血系统以及人体稳态调节都具有重要作用。因此,本研究通过代谢组学技术对弥散吸氧抗缺氧作用的基本机制进行了研究,研究结果表明弥散吸氧主要影响4个代谢通路,分别为:①精氨酸生物合成通路,与其相关的主要代谢物为L-精氨酸、L-天冬氨酸、L-谷氨酰胺;②组氨酸代谢通路,与其相关的主要代谢物为L-组氨酸、1-甲基组氨酸、3-甲基组氨酸、L-天冬氨酸;③丙氨酸、天冬氨酸和谷氨酸代谢通路,与其相关的主要代谢物为L-天冬氨酸、L-谷氨酰胺、柠檬酸盐;④乙醛酸和二羧酸代谢通路,与其相关的主要代谢物为柠檬酸盐、甘油酸、L-谷氨酰胺。
L-精氨酸是人体内功能最多的氨基酸之一,也是体内气体信号分子一氧化氮(NO)的前体物质[11]。L-精氨酸可通过增加血管内皮活性物质NO,保持一氧化氮合酶(nitric oxide synthase,NOS)活性并抑制其磷酸化,降低各种因子在低氧条件下对内皮的损伤,更好的保护内皮[12];同时,L-精氨酸可通过上调低氧诱导因子-1和血管内皮生长因子从而预防应激损伤[13]。本实验发现,与吸氧前比较,研究对象弥散吸氧后L-精氨酸表达显著上调,说明弥散吸氧可有效改善机体内L-精氨酸含量,通过调节L-精氨酸生物合成途径缓解低氧环境对机体的损伤。
L-组氨酸具有抗炎、抗氧化和心脏保护作用[14]。有研究表明,L-组氨酸可以有效降低游离自由基水平[15],抑制活性氧和保留高能磷酸阻止离体心脏缺血再充盈损伤,从而恢复心肌异常,防止心肌损伤。除此之外,心肌缺血时细胞糖酵解作用增强,进而造成乳酸堆积和pH下降;组氨酸及其相关物质可以维持细胞pH稳定,从而维护心肌的正常功能[16]。进一步的研究发现[17-18],L-组氨酸可以调节NF-κB和PPARγ信号传递通路,抑制C-反应蛋白、白介素-6和细胞肿瘤坏死因子α的转录和表达,进而抑制炎症反应。本研究显示,与吸氧前比较,受试者弥散吸氧增加了组氨酸的表达,改善机体组氨酸代谢水平,提高机体抗炎和抗氧化能力。
α-酮戊二酸(α-KG)是一种关键的代谢物,可在ATP产生以及补充TCA循环中间物的过程中发挥作用。其生成以及浓度的调节与谷氨酰胺代谢密切相关。在缺氧或线粒体功能障碍期间,α-KG在线粒体异柠檬酸脱氢酶催化的还原性羧化反应中被转换为柠檬酸。新生成的柠檬酸退出线粒体,它在其中合成脂肪酸和氨基酸,并产生还原剂NADPH[19]。在胞质中,谷氨酰胺贡献其γ(酰胺)氮来合成核甘酸和己醣胺,从而在这个过程中产生谷氨酸。胞质谷氨酸对维持氧化还原反应平衡,并通过产生谷胱甘肽避免细胞出现氧化应激非常关键[20]。天冬氨酸又称天门冬氨酸,是生物体内赖氨酸、苏氨酸、异亮氨酸、蛋氨酸等氨基酸及嘌呤合成前体。研究发现天冬氨酸可作为钾离子、镁离子的载体向心肌输送电解质,从而改善心肌收缩功能,同时降低氧消耗,在冠状动脉循环障碍缺氧时,对心肌有保护作用[21]。天冬氨酸参与鸟氨酸循环,促进氧和二氧化碳生成尿素,降低血液中氮和二氧化碳的量,增强肝脏功能,消除疲劳[22]。本研究结果表明,研究对象接受弥散供氧干预后,代谢产物中天冬氨酸、谷氨酰胺的水平明显升高。因此,我们推测研究对象机体功能的改善以及抗疲劳能力的增强可能与上述代谢通路激活有关。
综上所述,弥散供氧方式吸氧可以有效提高研究对象机体的血氧饱和度、降低脉搏,提高心肺供氧能力,进一步的分子机制研究表明,其对身体机能的改善作用可能通过调节精氨酸生物合成、组氨酸代谢等通路实现。本研究结果可以为进一步提高高原执行军事任务的官兵以及灾害救援人员的后勤保障提供参考。
| [1] |
高钰琪. 高原军事医学[M]. 重庆: 重庆出版社, 2005: 8-10. GAO Y Q. High altitude military medicine[M]. Chongqing: Chongqing Publishing House, 2005: 8-10. |
| [2] |
吴天一. 高原低氧环境对人类的挑战[J]. 医学研究杂志, 2006, 35(10): 1-3. WU T Y. The challenge of high-altitude hypoxia environment to human beings[J]. J Med Res, 2006, 35(10): 1-3. DOI:10.3969/j.issn.1673-548X.2006.10.001 |
| [3] |
吴天一, 李素芝, 侯世科. "援救援者"如何不再现?——玉树地震对高原医学的一个特殊挑战[J]. 医学争鸣, 2014, 5(2): 1-9. WU T Y, LI S Z, HOU S K. "Rescue the rescuers", how may it be prevented?——A special challenge in high altitude medicine during the Yushu Earthquake[J]. Negative, 2014, 5(2): 1-9. DOI:10.3276/j.issn.1674-8913.2014.02.001 |
| [4] |
IMRAY C, BOOTH A, WRIGHT A, et al. Acute altitude illnesses[J]. BMJ, 2011, 343(aug151): d4943. DOI:10.1136/bmj.d5756 |
| [5] |
LUKS ANDREW M, AUERBACH PAUL S, FREER LUANNE, et al. Wilderness medical society clinical practice guidelines for the prevention and treatment of acute altitude illness: 2019 update[J]. Wild Eeviron Med, 2019, 30(4S): S3-S18. DOI:10.1016/j.wem.2019.04.006 |
| [6] |
WEST J B. Improving oxygenation at high altitude: acclimatization and O2 enrichment[J]. High Alt Med Biol, 2003, 4(3): 389-398. DOI:10.1089/152702903769192340 |
| [7] |
LUKS A M, SWENSON E R, BARTSCH P. Acute high-altitude sickness[J]. Eur Respir Rev, 2017, 26(143): 160096. DOI:10.1183/16000617.0096-2016 |
| [8] |
WEST J B. Commuting to high altitude: value of oxygen enrichment of room air[J]. High Alt Med Biol, 2002, 3(2): 223-235. DOI:10.1016/j.finel.2006.06.003 |
| [9] |
LUKS A M, BATARSE R R, WEST J B, et al. Room oxygen enrichment improves sleep and subsequent day-time performance at high altitude[J]. Respir Physiol, 2016, 113(3): 247-258. DOI:10.1016/S0034-5687(98)00068-1 |
| [10] |
LIU G H, LIU X P, QIN Z F, et al. Cardiovascular system response to carbon dioxide and exercise in oxygen-enriched environment at 3800 m[J]. Int J Environ Res Public Health, 2015, 12(9): 11781-11796. DOI:10.3390/ijerph120911781 |
| [11] |
董文倩, 张铭湘. 内源性代谢分子——精氨酸/一氧化氮调节机体生理功能[J]. 生理科学进展, 2012, 43(5): 334-337. DONG W Q, ZHANG M X. Endogenous metabolic molecule——arginine/nitric oxide regulates physiological functions of the body[J]. Prog Physiol Sci, 2012, 43(5): 334-337. DOI:10.3969/j.issn.0559-7765.2012.05.004.issn.0559-7765.2012.05.004 |
| [12] |
MARTINEZ R R, CANUELO A, SILES E, et al. Nitric oxide modulates hypoxia-inducible factor-1 and poly (ADP-ribose) polymerase-1 cross talk in response to hypobaric hypoxia[J]. J Appl Physiol, 2012, 112(5): 816-823. DOI:10.1152/japplphysiol.00898.2011 |
| [13] |
张建新, 李兰芳, 张会欣, 等. L-精氨酸对局灶性脑缺血损伤大鼠脑组织TNF-α、IL-1β及神经元凋亡的影响[J]. 中华麻醉学杂志, 2007, 27(11): 1022-1024. ZHANG J X, LI L F, ZHANG H X, et al. Effect of L-arginine on cerebral TNF-α and IL-1β content and neuronal apoptosis after cerebral ischemic injury in rats[J]. Chin J Anesthesiol, 2007, 27(11): 1022-1024. DOI:10.3760/j.issn:0254-1416.2007.11.019 |
| [14] |
FENG R N, NIU Y C, SUN X W, et al. Histidine supplementation improves insulin resistance through suppressed inflammation in obese women with the metabolic syndrome: a randomised controlled trial[J]. Diabetology, 2013, 56(5): 985-994. DOI:10.1007/s00125-013-2839-7 |
| [15] |
FARSHID A A, TAMADDONFARD E, YAHYAEE F. Effects of histidine and N-acetylcysteine on diclofenac-induced anti-inflammatory response in acute inflammation in rats[J]. Indian J Exp Biol, 2010, 48(11): 1136-1142. DOI:10.1063/1.119360 |
| [16] |
TOSHIO O, MASAHIRO A, YASUMITSU Y. Protective effect of histidine on iron (Ⅱ)-induced hydroxyl radical generation in rat hearts[J]. J Physiol Paris, 1999, 93(3): 213-218. DOI:10.1016/S0928-4257(99)80153-3 |
| [17] |
TRAYHURN P, WOOD I S. Adipokines: inflammation and the pleiotropic role of white adipose tissue[J]. Bri J Nutr, 2004, 92(3): 347-355. DOI:10.1079/BJN20041213 |
| [18] |
AND O A, HISAMATSU T, OKAMOTO S, et al. Dietary histidine ameliorates murine colitis by inhibition of proinflammatory cytokine production from macrophages[J]. Gastroenterology, 2009, 136(2): 564-574. DOI:10.1053/j.gastro.2008.09.062 |
| [19] |
XIAO D, ZENG L, YAO K, et al. The glutamine-alpha-ketoglutarate (AKG) metabolism and its nutritional implications[J]. Amino Acids, 2016, 48(9): 2067-2080. DOI:10.1007/s00726-016-2254-8 |
| [20] |
LUKEY M J, WILSON K F, CERIONE R A. Therapeutic strategies impacting cancer cell glutamine metabolism[J]. Future Med Chem, 2013, 5(14): 1685-1700. DOI:10.4155/fmc.13.130 |
| [21] |
NAIK P, MALATI T, RATNAKAR K S, et al. Cardioprotective effect of magnesium chloride in experimental acute myocardial infarction[J]. Indian J Exp Biol, 1999, 37(2): 131-137. DOI:10.1108/03055720710838489 |
| [22] |
BUTTERWORTH R F, HILGER N, KIRCHEIS G, et al. Efficacy of L-ornithine L-aspartate for hepatic encephalopathy and hyperammonemia in cirrhosis: systematic review and meta-analysis of randomized controlled trials[J]. J Hepatol, 2018, 8(3): 301-313. DOI:10.1016/j.jceh.2018.05.004 |




