胎儿生长受限(fetal growth restriction,FGR)指胎儿体质量低于同孕龄正常体质量的第10百分位数[1], 是导致围生儿病死率升高的主要原因[2], 幸存儿智力落后、神经功能障碍、心脑血管疾病、糖尿病等远期并发症发生率明显增加[3-4], 严重影响人口素质, 给家庭及社会造成严重的经济负担。环状RNA(circular RNA,circRNA)是一种特殊的内源性非编码RNA,具有高稳定性、高保守性以及组织特异性[5]。既往多项研究提示,circRNA参与肿瘤、心脏疾病、子痫前期等多种疾病的发生,可影响细胞增殖、侵袭、迁移及自噬[6-7],目前认为circRNA的作用机制主要是充当mRNA/miRNA的海绵,竞争性的抑制mRNA/miRNA的转录调控[8-9]。关于circRNA在FGR中的研究,有研究报道,hsa_circ_0000848可通过hsa-miR-6768-5p直接调控胎盘滋养细胞的侵袭、迁移及凋亡,参与FGR的发生[10]。本课题组通过全转录组测序对比分析circRNA在FGR及正常妊娠胎盘组织中的表达,发现circVCAN等多个circRNA均有差异性表达。本研究以circVCAN为研究对象,验证其在FGR及正常妊娠胎盘组织中的表达,并通过体外实验初步确定circVCAN对胎盘滋养细胞HTR8/Svneo增殖、侵袭、凋亡及自噬的影响。
1 材料与方法 1.1 材料收集2018年1月~2018年12月在重庆医科大学附属第二医院终止妊娠的FGR及正常孕妇胎盘组织各12例,所选病例均排除妊娠合并慢性高血压、子痫前期、妊娠期糖尿病、妊娠期肝内胆汁淤积症及其他内科合并症。研究对象均签署知情同意书,研究方案获重庆医科大学附属第二医院伦理委员会批准[科伦预审第(2019)070号],符合《赫尔辛基宣言》的伦理准则。HTR8/SVneo滋养细胞由加拿大皇后大学Charles H. Graham博士以及重庆医科大学附属第一医院妇产科漆洪波教授惠赠,传代并保存于重庆医科大学附属第二医院妇产科实验室。实验用品:RPMI1640培养基、Transwell小室购自Corning公司;胎牛血清购自北京赛澳美公司;细胞胰酶消化液、总蛋白提取试剂盒、BCA蛋白定量试剂盒、十二烷基硫酸钠- 聚丙烯酰胺凝胶配制试剂盒购自上海碧云天生物技术有限公司;circRNA反转录及实时定量PCR试剂盒购自复能基因有限公司;助转染试剂transfect-mate、circVCAN干扰质粒(si-circVCAN)以及过表达质粒(ov-circVCAN)购自上海吉玛基因股份有限公司;circVCAN干扰质粒(si-circVCAN)的序列为5′-GGCAGCACACUGGUCG-AAUTT-3′,阴性对照si-NC的序列为5′-UUCUCCG-AACGUGUCACGUTT-3′;过表达质粒(ov-circVCAN)则是将circVCAN的全长编码序列克隆到pcDNA3.1(+)载体中获得,空白pcDNA3.1(+)载体作为阴性对照;TRIzol试剂、RIPA蛋白裂解液、Lipofectamine 2000购均购自美国Invitrogen公司;LC3、ATG5、ATG7抗体购CST生物公司,抗体目录编号分别为LC3:12741T、ATG5:12994T、ATG7:8558T,ECL发光试剂盒购买自美国Millipore公司;EdU试剂盒购自广州锐博生物科技有限公司;Matrigel基质胶购自美国Becton Dickinson公司。
1.2 方法 1.2.1 细胞培养及转染采用RPMI1640完全培养基加入10%胎牛血清复苏、培养HTR8/SVneo滋养细胞,将细胞置于37 ℃和5% CO2的孵育箱中培养,待细胞长至80%~90%左右,用0.25%的胰酶在37 ℃孵育箱中消化90s进行传代。质粒转染实验分组如下:si-NC组(转染circVCAN阴性对照)、si-circVCAN组(转染circVCAN干扰序列)、ov-NC组(转染circVCAN过表达载体阴性对照)、ov-circVCAN组(转染circVCAN过表达载体质粒),每组设置3个复孔,转染前1 d将细胞接种于6孔板中,待细胞融合度达约50%时,按照Transfect-mate助转染试剂及Lipofectamine说明书按步骤进行沉默及过表达转染。
1.2.2 qRT-PCR检测circVCAN表达水平采用TRIzol试剂从组织及细胞中提取总RNA,反转录合成cDNA, 以cDNA为模板,用circRNA实时定量PCR试剂盒进行PCR。内参β-actin序列如下:正义引物:5′-TCAGGTCATCACTATCGGCAAT-3′, 反义引物: 5′-AAA-GAAAGGGTGTAAAACGCA-3′;circVCAN引物序列如下:正义引物:5′-CTGATGGCAGCACACTGGTC-3′, 反义引物:5′-TCATGCACTGGATCTGTTTCTTCAC-3′。每个样品均设3个复孔,实验均重复3次,以β-actin为内参,用2-ΔΔct方法分析基因表达的相对变化。
1.2.3 EdU增殖实验HTR8/SVneo滋养细胞转染48 h后,在24孔板中每孔种入约1×105个细胞,24 h后更换为EdU培养基(细胞培养基按1 000 ∶1的比例稀释EdU试剂A)孵育2 h,然后使用多聚甲醛固定,甘氨酸清洗后用含0.5% Triton X-100的PBS摇床孵育、清洗,随后加入1×Apollo(阿波罗)染色,后用含0.5% Triton X-100的PBS、甲醇及PBS依次清洗,DAPI染色后PBS再次清洗,荧光显微镜计数分析,实验重复3次。
1.2.4 流式细胞仪检测细胞凋亡HTR8/SVneo滋养细胞转染48 h后, 收集约1×106个细胞, 4 ℃预冷的PBS洗2次, 1 000 r/min离心5 min, 用5 00 μL结合缓冲液重悬细胞, 取100 μL细胞悬液于5 mL流式管中, 加入5 μL Annexin V/FITC和10 μL、20 ng/mL PI溶液, 混匀后室温避光孵育15 min, 在反应管中加入400 μL PBS, 采用流式细胞仪FACS分析各组转染细胞凋亡率。
1.2.5 Transwell侵袭实验提前将基质胶置于4 ℃冰箱融解,移液枪、枪头盒等置于-20 ℃预冷,用RPMI1640培养基以9 ∶1的比例稀释基质胶,混匀后每孔取50 μL均匀铺于小室上层,下室加入500 μL完全培养基(含10%胎牛血清),上室加入200 μL无血清RPMI1640培养液,每个小室经计数均匀接种5×104个细胞, 37 ℃、5% CO2条件下培养,24 h后取出小室,PBS清洗3次,用多聚甲醛固定30 min,用棉签拭去上室内侧壁细胞,外侧壁细胞经结晶紫染色20 min后于正置显微镜(200×)下观察并计数,实验重复3次。
1.2.6 Western blot检测自噬相关蛋白表达HTR8/SVneo细胞经转染处理48 h后用裂解液充分裂解提取总蛋白,胎盘组织剪碎用匀浆机裂解后使用裂解液提取总蛋白,用BCA蛋白定量法测定蛋白浓度并调平浓度,加入蛋白上样缓冲液充分混合,沸水煮10 min后冷却备用。制备SDS-聚丙烯酰胺凝胶,每孔上样20 μg,依次电泳、转膜,用5%脱脂奶粉室温封闭2 h,TBST洗膜3次,每次10 min,孵LC3、ATG5、ATG7一抗(稀释比例均为1 ∶1 000)内于4 ℃冰箱过夜,洗膜,室温下孵二抗2 h(稀释比1 ∶1 000),再洗膜后用ECL试剂盒进行显影,ImageJ软件行半定量分析,实验均重复3次。
1.3 统计学分析使用SPSS 22.0统计软件对各数据进行分析,计量资料以x±s表示,非正态分布数据用中位数表示,多组间数据比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 circVCAN在FGR和正常妊娠孕妇胎盘组织中的表达水平CircVCAN在FGR组胎盘组织中的表达量显著高于正常妊娠组(P < 0.01,图 1)。与正常妊娠孕妇相比较,FGR组孕妇平均分娩孕周较正常妊娠组早(P < 0.05),FGR组胎儿出生体质量较正常妊娠组显著减轻(P < 0.01),FGR组胎儿出生身长明显短于正常妊娠组(P < 0.01),FGR组胎盘质量明显轻于正常妊娠组(P < 0.05,表 1)。
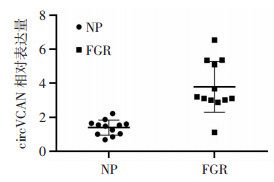
|
| a: P < 0.01, 与NP组比较 图 1 circVCAN在FGR和正常妊娠孕妇胎盘组织中的表达水平 |
| 项目 | NP(n=12) | FGR(n=12) | P值 |
| 年龄 | 29.83±5.15 | 30.17±4.91 | NS |
| 身高/cm | 157.83±3.74 | 157.75±5.15 | NS |
| 体质量/kg | 68.83±3.41 | 68.83±8.54 | NS |
| 增长体质量/kg | 14.67±2.87 | 12.67±5.63 | NS |
| 怀孕次数/次 | 2.08±0.79 | 2.75±1.36 | NS |
| 分娩次数/次 | 0.50±0.67 | 0.25±0.45 | NS |
| 分娩孕周/周 | 38.88±1.09 | 36.39±2.41 | < 0.05 |
| 胎儿出生体重/kg | 3.42±0.24 | 1.98±0.41 | < 0.01 |
| 胎儿出生长度/cm | 50.17±0.83 | 43.83±3.71 | < 0.01 |
| 胎盘质量/kg | 0.50±0.01 | 0.40±0.10 | < 0.05 |
2.2 circVCAN对HTR8/SVneo滋养细胞增殖、凋亡的影响
在HTR8/SVneo细胞中转染circVCAN沉默和过表达质粒后,circVCAN表达分别被成功下调和上调(P < 0.01,图 2A)。与对照组细胞相比较,转染circVCAN干扰质粒的HTR8/SVneo细胞增殖率显著升高(P < 0.01,图 2B、C),而转染circVCAN过表达质粒的HTR8/SVneo细胞增殖率显著降低(P < 0.01, 图 2B、D),细胞凋亡率差异均无统计学意义(P>0.05, 图 2E、F、G)。

|
| a: P < 0.01, 与si-NC组比较;b: P < 0.01, 与ov-NC组比较A: EdU实验检测各组细胞增殖能力(倒置荧光显微镜×100);B: qRT-PCR实验检测各组细胞circVCAN的相对表达量;C、D: 各组细胞增殖率分析;E: 流式细胞仪检测各组细胞凋亡;F、G:各组细胞凋亡率分析 图 2 circVCAN对HTR8/SVneo滋养细胞增殖、凋亡的影响 |
2.3 circVCAN对HTR8/SVneo细胞侵袭的影响
在Transwell实验中,circVCAN沉默组穿过小室的细胞数较对照组明显增多(P < 0.01 图 3A),circVCAN过表达组穿过小室的细胞数较对照组显著减少(P < 0.01, 图 3B),该结果提示circVCAN能抑制HTR8/SVneo细胞侵袭。
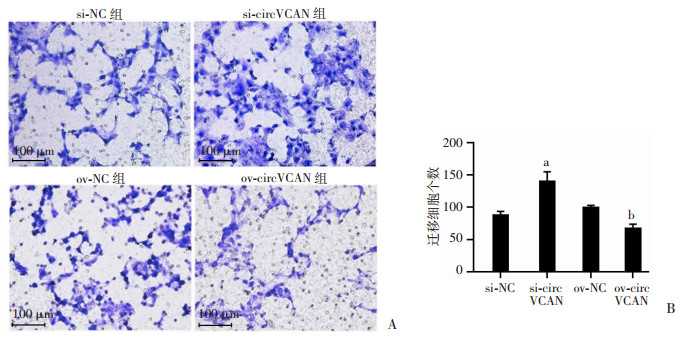
|
| A:Transwell实验检测各组HTR8/SVneo细胞侵袭能力(倒置荧光显微镜×100);B: 侵袭率分析a: P < 0.01与si-NC组比较; b: P < 0.01, 与ov-NC组比较 图 3 circVCAN抑制HTR8/SVneo细胞侵袭 |
2.4 circVCAN促进自噬相关蛋白LC3Ⅱ/LC3Ⅰ、ATG5、ATG7表达
与对照组HTR8/SVneo细胞相比,自噬相关蛋白ATG5、ATG7、LC3Ⅱ/LC3Ⅰ在circVCAN沉默组细胞中的表达均显著降低(P < 0.05 图 4F、G),而在circVCAN过表达组细胞中的表达水平均显著升高(P < 0.05,图 4F、G)。同时,我们观察到,与正常妊娠组相比,FGR组胎盘组织中LC3Ⅱ/LC3Ⅰ、ATG5、ATG7均显著增加(P < 0.05图 4A、B、C、D、E)。这些结果显示,在FGR中,circVCAN可能通过上调自噬相关蛋白ATG5、ATG7的表达而促进自噬过程。
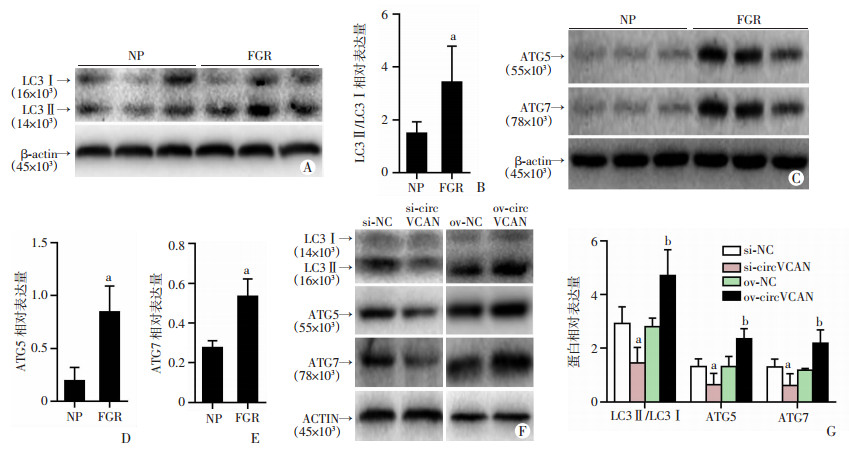
|
| A: Wsetern blot检测正常胎盘组织与FGR胎盘组织中LC3Ⅱ/LC3Ⅰ的相对表达量;B: 半定量结果分析a: P < 0.05, 与NP组比较C: Wsetern blot检测正常胎盘组织与FGR胎盘组织中ATG5、ATG7的相对表达量;D、E: 半定量结果分析a: P < 0.01, 与NP组比较F: Wsetern blot检测circVCAN对各组HTR8/SVneo细胞LC3Ⅱ/LC3Ⅰ、ATG5、ATG7蛋白的影响;G: 半定量结果分析a: P < 0.05, 与si-NC组比较;b: P < 0.05, 与ov-NC组比较 图 4 沉默及过表达circVCAN后对自噬相关蛋白LC3Ⅱ/LC3Ⅰ、ATG5及ATG7表达的影响 |
3 讨论
FGR是一种严重的妊娠期并发症,可能影响胎儿各器官发育,与新生儿成年后认知缺陷、骨质疏松等密切相关[11-12]。FGR的发病机制主要包括氧化应激、免疫失衡、胎盘功能不良等[13]。自噬现象本身存在于正常胎盘中,但在FGR胎盘组织中被过度激活,饥饿和缺氧刺激均可诱导自噬[14]。用DNA甲基化芯片对比分析FGR组与正常组的胎盘组织,发现约有284个不受孕周影响的差异甲基化位点,与自噬、氧化应激反应及激素等信号通路相关[15]。寨卡病毒可通过胎盘屏障进入羊水及胎儿脑组织,损害神经发育导致小头畸形及FGR,而自噬可能参与病毒复制及胎盘转运过程[16-17]。因此,自噬亦可能是FGR发病的关键环节。
circRNA广泛存在于哺乳动物中且具有高度的稳定性和保守性[18],因此是疾病诊断及预后较好的标志物。研究表明,circRNA可能通过调节细胞增殖、侵袭、自噬等参与肝癌、乳腺癌、神经胶质瘤等疾病的发生[19-21], 其中包括circRNA作用于胎盘滋养细胞参与子痫前期发病[22]。
本研究对象circVCAN位于5号染色体chr5:82832825- 82850857区域(circbase),有研究提示circVCAN (hsa_circ_0073237)与神经胶质瘤的放疗耐药性有关,可通过与miR-1183直接结合促进神经胶质细胞的增殖、侵袭、迁移,抑制其凋亡[23]。本研究发现circVCAN在FGR胎盘组织中表达明显升高,FGR组胎盘质量、胎儿出生体质量、身长均较正常妊娠组显著降低,同时,FGR胎盘组织中自噬相关蛋白ATG5、ATG7、LC3Ⅱ/LC3Ⅰ表达水平均显著升高,提示FGR胎盘自噬被促进,这与既往关于FGR的研究一致[13, 24]。进一步体外实验结果显示,circVCAN对HTR8/SVneo细胞凋亡无影响,干扰circVCAN表达能促进HTR8/SVneo细胞增殖及侵袭,而过表达circVCAN能抑制HTR8/SVneo细胞增殖及侵袭。与此同时,我们发现,circVCAN可促进HTR8/SVneo细胞的自噬,其机制可能为通过调节自噬相关蛋白ATG5、ATG7的水平, 从而调节LC3Ⅱ/LC3Ⅰ的表达。上述结果提示,circVCAN可能通过抑制HTR8/SVneo滋养细胞的增殖、侵袭,促进其自噬,从而影响胎盘发育及功能,进而参与FGR的发生。
本研究初步探索了circVCAN在FGR胎盘组织中的表达及其对HTR8/SVneo滋养细胞生物学行为的影响,但涉及的临床病例数较少且未阐明circVCAN的详细作用机制,我们将在后续实验中对此进行深入研究。
| [1] |
SHARMA D, SHASTRI S, FARAHBAKHSH N, et al. Intrauterine growth restriction-part 1[J]. J Matern Fetal Neonatal Med, 2016, 29(24): 3977-3987. DOI:10.3109/14767058.2016.1152249 |
| [2] |
KHAN K S, WOJDYLA D, SAY L, et al. WHO analysis of causes of maternal death: a systematic review[J]. Lancet, 2006, 367(9516): 1066-1074. DOI:10.1016/s0140-6736(06)68397-9 |
| [3] |
THORNTON J G, HORNBUCKLE J, VAIL A, et al. Infant wellbeing at 2 years of age in the Growth Restriction Intervention Trial (GRIT): multicentred randomised controlled trial[J]. Lancet, 2004, 364(9433): 513-520. DOI:10.1016/s0140-6736(04)16809-8 |
| [4] |
GALE C R, MARTYN C N, KELLINGRAY S, et al. Intrauterine programming of adult body composition[J]. J Clin Endocrinol Metab, 2001, 86(1): 267-272. DOI:10.1210/jcem.86.1.7155 |
| [5] |
JECK W R, SORRENTINO J A, WANG K, et al. Circular RNAs are abundant, conserved, and associated with ALU repeats[J]. RNA, 2013, 19(2): 141-157. DOI:10.1261/rna.035667.112 |
| [6] |
李墨林, 陈航, 黄平. 环状RNA circSP3(hsa-circ-0002642)促进肝细胞癌细胞增殖及迁移[J]. 第二军医大学学报, 2019, 40(12): 1330-1336. LI M L, CHEN H, HUANG P. Circular RNA circSP3 (hsa-circ-0002642) promotes proliferation and migration of hepatocellular carcinoma cells[J]. Acad J Second Mil Univ, 2019, 40(12): 1330-1336. DOI:10.16781/j.0258-879x.2019.12.1330 |
| [7] |
DU W W, YANG W, LI X, et al. A circular RNA circ-DNMT1 enhances breast cancer progression by activating autophagy[J]. Oncogene, 2018, 37(44): 5829-5842. DOI:10.1038/s41388-018-0369-y |
| [8] |
WANG K, LONG B, LIU F, et al. A circular RNA protects the heart from pathological hypertrophy and heart failure by targeting miR-223[J]. Eur Heart J, 2016, 37(33): 2602-2611. DOI:10.1093/eurheartj/ehv713 |
| [9] |
DENG N, LEI D, HUANG J, et al. Circular RNA expression profiling identifies hsa_circ_0011460 as a novel molecule in severe preeclampsia[J]. Pregnancy Hypertens, 2019, 17: 216-225. DOI:10.1016/j.preghy.2019.06.009 |
| [10] |
WANG H, ZHANG J M, XU Z Y, et al. Circular RNA hsa_circ_0000848 promotes trophoblast cell migration and invasion and inhibits cell apoptosis by sponging hsa-miR-6768-5p[J]. Front Cell Dev Biol, 2020, 8: 278. DOI:10.3389/fcell.2020.00278 |
| [11] |
WANG Y, FU W, LIU J. Neurodevelopment in children with intrauterine growth restriction: adverse effects and interventions[J]. J Matern Fetal Neonatal Med, 2016, 29(4): 660-668. DOI:10.3109/14767058.2015.1015417 |
| [12] |
GLUCKMAN P D, HANSON M A, COOPER C, et al. Effect of in utero and early-life conditions on adult health and disease[J]. N Engl J Med, 2008, 359(1): 61-73. DOI:10.1056/nejmra0708473 |
| [13] |
TANTBIROJN P, CRUM C P, PARAST M M. Pathophysiology of placenta creta: the role of decidua and extravillous trophoblast[J]. Placenta, 2008, 29(7): 639-645. DOI:10.1016/j.placenta.2008.04.008 |
| [14] |
CURTIS S, JONES C J P, GARROD A, et al. Identification of autophagic vacuoles and regulators of autophagy in villous trophoblast from normal term pregnancies and in fetal growth restriction[J]. J Matern Fetal Neonatal Med, 2013, 26(4): 339-346. DOI:10.3109/14767058.2012.733764 |
| [15] |
HILLMAN S L, FINER S, SMART M C, et al. Novel DNA methylation profiles associated with key gene regulation and transcription pathways in blood and placenta of growth-restricted neonates[J]. Epigenetics, 2015, 10(1): 50-61. DOI:10.4161/15592294.2014.989741 |
| [16] |
CUGOLA F R, FERNANDES I R, RUSSO F B, et al. The Brazilian Zika virus strain causes birth defects in experimental models[J]. Nature, 2016, 9;534(7606): 267-271. DOI:10.1038/nature18296 |
| [17] |
ZHANG Z W, LI Z L, YUAN S. The role of secretory autophagy in zika virus transfer through the placental barrier[J]. Front Cell Infect Microbiol, 2017, 6: 206. DOI:10.3389/fcimb.2016.00206 |
| [18] |
RYBAK-WOLF A, STOTTMEISTER C, GLAŽAR P, et al. Circular RNAs in the mammalian brain are highly abundant, conserved, and dynamically expressed[J]. Mol Cell, 2015, 58(5): 870-885. DOI:10.1016/j.molcel.2015.03.027 |
| [19] |
YU J, XU Q G, WANG Z G, et al. Circular RNA cSMARCA5 inhibits growth and metastasis in hepatocellular carcinoma[J]. J Hepatol, 2018, 68(6): 1214-1227. DOI:10.1016/j.jhep.2018.01.012 |
| [20] |
DU W W, YANG W N, LI X M, et al. A circular RNA circ-DNMT1 enhances breast cancer progression by activating autophagy[J]. Oncogene, 2018, 37(44): 5829-5842. DOI:10.1038/s41388-018-0369-y |
| [21] |
HUANG R R, ZHANG Y, HAN B, et al. Circular RNA HIPK2 regulates astrocyte activation via cooperation of autophagy and ER stress by targeting MIR124-2HG[J]. Autophagy, 2017, 13(10): 1722-1741. DOI:10.1080/15548627.2017.1356975 |
| [22] |
OU Y, ZHU L, WEI X, et al. Circular RNA circ_0111277 attenuates human trophoblast cell invasion and migration by regulating miR-494/HTRA1/Notch-1 signal pathway in pre-eclampsia[J]. Cell Death Dis, 2020, 11(6): 479. DOI:10.1038/s41419-020-2679-6 |
| [23] |
ZHU C, MAO X, ZHAO H. The circ_VCAN with radioresistance contributes to the carcinogenesis of glioma by regulating microRNA-1183[J]. Medicine (Madr), 2020, 99(8): e19171. DOI:10.1097/md.0000000000019171 |
| [24] |
ZHANG L, DENG X R, SHI X, et al. Silencing H19 regulated proliferation, invasion, and autophagy in the placenta by targeting miR-18a-5p[J]. J Cell Biochem, 2019, 120(6): 9006-9015. DOI:10.1002/jcb.28172 |




