2. 400038重庆,陆军军医大学(第三军医大学)军事预防医学系毒理学研究所
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
双酚A(bisphenol A,BPA)是一种广泛使用的工业增塑剂,被用作生产塑料的添加剂、食品和化妆品中的抗氧化剂等[1]。环境是人类接触双酚A的来源之一,但饮食摄入被认为是人类接触的主要途径[2]。作为重要的内分泌干扰物之一,BPA可通过类激素作用破坏正常的内分泌功能[3-4]。已有研究报道双酚A可通过多种细胞信号通路对生物体产生生殖毒性作用[5-6]。流行病学调查数据和实验室研究发现BPA暴露与男性精液质量下降、精子数量减少、生殖器官发育异常、性激素生成紊乱等呈显著正相关[7]。动物研究的大量数据表明:即使在非常低的剂量下,双酚A对雄性生殖系统也有明显的影响[8]。因此,环境中低水平BPA暴露对生殖健康的威胁应引起人们的重视。
比较毒理基因组学数据库(Comparative Toxicogeno-mics Database, CTD)是一个强大的、公开可用的精选数据库。它描述了化学物-基因/蛋白质相互作用、化学物-疾病和基因-疾病之间的关系,旨在促进人们对环境化学品影响人类健康的了解[9-12]。本研究通过CTD数据库筛选与BPA暴露相关的男性泌尿生殖系统疾病及其相关基因,将基因数据与功能和通路数据相结合,采用功能富集的方法探索环境中低剂量BPA影响男性泌尿生殖系统疾病可能涉及的信号通路及潜在机制,并进一步采用不同浓度的BPA处理小鼠精母细胞株GC-2,检测相关通路关键基因的表达水平。本研究将为BPA暴露的实验室研究提供新的思路,并对BPA暴露相关的男性泌尿生殖系统的诊断与治疗提供参考依据。
1 材料与方法 1.1 材料 1.1.1 主要试剂高糖培养基DMEM购于美国Gibco公司;血清为低内毒素胎牛血清;双酚A、二甲基亚砜购于美国Sigma公司;逆转录试剂盒以及2×GoTaqⓇ qPCR GreenMaster Mix购于美国Promega公司;蛋白裂解液、蛋白浓度测定试剂盒以及SDS-PAGE配胶试剂盒购于上海的碧云天公司;抗体PI3K、P53、BCL-2、ACTIN均购于美国Santa Cruz公司。
1.1.2 细胞株小鼠的精母细胞系GC-2购于美国ATCC细胞库。GC-2细胞采用含有5%~10%胎牛血清的DMEM培养基培养,细胞培养箱的培养条件:5%CO2,95%空气,37 ℃恒温,湿度为70%~80%。
1.2 方法 1.2.1 CTD数据库筛选基因以“Chemials”为关键词在CTD数据库搜索化学物“BPA”,检索与BPA相关的“Diseases”,共有5 734条记录。在“Disease category”中选择“Urogenital disease(male)”进行筛选,共筛选出男性泌尿生殖系统疾病记录368条,将这些疾病涉及的1 460个基因组成BPA相关基因集。
1.2.2 基因集生物功能及通路分析将上述基因集用R语言进行GO生物学过程的富集分析以及KEGG代谢途径的富集分析,研究基因集中的基因参与的生物学过程以及信号通路。由于GO和KEGG富集分析的柱状图和气泡图只能显示最显著的富集术语,为了考虑1个基因可能属于多个注释类别的潜在生物学复杂性,用R语言行可视化分析(Enrichment Map、Cnetplot、Pathview等)。Enrichment Map将富集的术语组织成1个网络,其边缘连接重叠的基因集。相互重叠的基因集倾向于聚集在一起,从而易于识别其功能。点越大代表上述基因集中和该生物学过程相关的基因越多。Cnetplot属于Gene-Concept Network,其将基因和生物学途径之间的联系描述为1个网络,可以直观地观察到这些条目涉及的基因以及条目之间的交互基因。Pathview是用于基于通路的数据集成和可视化的工具集,它在相关的通路图上绘制和呈现各种各样的生物数据。使用Pathview将KEGG通路可视化。
1.2.3 细胞染毒将GC-2细胞按2×105/皿接种于10 cm2培养皿中,生长24 h后,进行BPA染毒。BPA粉剂使用二甲基亚砜(DMSO)溶解,配制成浓度为0、20、40、80 mmol/L的储备液,染毒时用含6%~10%胎牛血清的DMEM培养基稀释,使其终浓度为0(DMSO对照组)、20、40、80 μmol/L。染毒72 h后显微镜下观察细胞生长情况并拍照。
1.2.4 提取RNAGC-2细胞染毒72 h后,弃去培养基,每个皿中加入1 mL TRIzol吹打至细胞全部脱落,用无RNA酶的1.5 mL EP管收集并做好标记,涡旋振荡1 min,冰上静置10 min后,各EP管分别加入400 μL三氯甲烷,上下振荡混匀并于冰上静置10 min后,12 000 r/min,4 ℃离心20 min。离心完成后,小心将上清转移到新的1.5 mL EP管中,加入同上清相等体积的4 ℃预冷的异丙醇,混匀后-20 ℃放置1~2 h,12 000 r/min,4 ℃离心20 min,弃去上清可观察到沉淀即为RNA。每管加入75%乙醇(现用现配)1.0 mL,上下轻轻颠倒几次后,12 000 r/min,4 ℃离心20 min。小心弃掉上清,室温倒扣放置10 min左右至乙醇晾干,加入适量超纯水溶解混匀后,测RNA浓度,-80 ℃冰箱低温保存。
1.2.5 RNA逆转录以及实时荧光定量PCR(RT-qPCR)取上述RNA 2 μg用Promega公司的GoScriptTM逆转录试剂盒的两步法逆转录合成cDNA,具体步骤参考内置说明书;将逆转录的cDNA稀释后,使用该公司的qPCR Mix进行RT-qPCR实验(引物序列见表 1)。采用三步法进行扩增,第1步(预变性):95 ℃,40 s;第2步(变性-退火-延伸):95 ℃,40 s进行变性;60 ℃,40 s进行退火;72 ℃,50 s开始延伸;共45个循环;第3步(绘制熔解曲线):72 ℃,5 min。每个样品3个复孔,内参为β-actin,PCR结果使用公式2-△△Ct进行量化分析。
| 基因 | 序列(5′→3′) | 产物长度/bp |
| BCL-2 | 正向:GACTGAGTACCTGAACCGGC | 72 |
| 反向:AGTTCCACAAAGGCATCCCAG | ||
| HIF-1α | 正向:CGCCTCTGGACTTGTCTCTT | 164 |
| 反向:CGACGTTCAGAACTCATCCTATTTT | ||
| JAK | 正向:CGTGTCGCCGGCCAAT | 78 |
| 反向:AGGTTGCCTCCATTTCTGTCA | ||
| P300/CBP | 正向:GGAAAGCCTGCCAAGTTGC | 80 |
| 反向:ACAGTCATGTCGTGTGCAGT | ||
| P53 | 正向:ATTCAGGCCCTCATCCTCCT | 70 |
| 反向:CCATGGCAGTCATCCAGTCT | ||
| PI3K | 正向:CCATTACAAAGAAAGCCGGACTC | 180 |
| 反向:GGGGGCAGTGCTGGTG | ||
| PKC | 正向:CCCCTTGGAATTGTATGAGAGAGT | 131 |
| 反向:AGTCAGAGATATGCAGGCGT | ||
| β-actin | 正向:ACTATTGGCAACGAGCGGTT | 75 |
| 反向:GCCACAGGATTCCATACCCAA |
1.2.6 Western blot检测
h后,弃去培养基,用预冷的PBS洗大皿2次后,加入适量蛋白裂解液裂解细胞,用刮子将细胞刮下并吸入1.5 mL离心管中,12 000 r/min,4 ℃离心0.5 h,上清即为细胞蛋白。使用碧云天蛋白浓度测定试剂盒测蛋白浓度,蛋白变性后于-20 ℃保存。配好胶后,每个样本各取20 μL进行电泳,PVDF膜封闭后,分别加入稀释比为1 :1 000的鼠来源β-catenin抗体、鼠来源PI3K抗体、兔来源P53抗体、兔来源BCL-2抗体,4 ℃孵育10~12 h,TBST洗膜3次,每次10~15 min,室温孵育二抗1 h,TBST洗膜3次,每次10~15 min,最后曝光显影分析各条带。
1.3 统计学分析采用SPSS 25.0统计软件。数据为至少3次实验的平均值,采用t检验分析两组GC-2细胞凋亡率以及各基因在两组间的表达差异。检验水准:α = 0.05。
2 结果 2.1 与BPA有关的男性泌尿生殖系统疾病的基因在CTD数据库中共筛选出与BPA有关的男性泌尿生殖系统疾病相关基因共2 224个,出现次数≥10次的基因分别是ALB(15次)、POMC(14次)、AGT(14次)、TGFB1(13次)、SOD2(12次)、TP53(10次)、REN(10次)、PTGS2(10次)、NOS3(10次)、EDN1(10次)、ACE (10次)。ALB、AGT、TGFB1、SOD2参与细胞的凋亡,提示暴露BPA可能会导致GC-2的凋亡。PTGS2、EDN1与细胞增殖有关,提示这些基因表达的改变可能和GC-2细胞增殖有关。因此,在BPA暴露诱导泌尿生殖系统相关疾病中,上述基因表达的改变可能是关键事件。最后从2 224个基因中筛选出无重复的基因1 460个,组成1个基因集进行下一步的研究。
2.2 BPA相关基因的GO和KEGG分析利用R语言对上述基因集进行GO和KEGG富集分析。从生物学途径(biological processes, BP)、细胞组分(cellular components, CC)、分子功能(molecular function, MF)3个角度对基因的功能进行分析,得到GO条目3 801个(P < 0.05),其中相关的BP有3 391个,CC有159个,MF有251个,其中GO_BP主要和泌尿生殖系统、生殖结构发育、生殖系统发育生物学过程等有关(图 1A)。图 1B列举了KEGG分析中显著性最高的10条通路,包括PI3K-Akt信号通路(P < 0.001)、HIF-1信号通路(P < 0.001)等,提示BPA暴露可能通过上述生物学进程和通路作用于男性泌尿生殖系统。
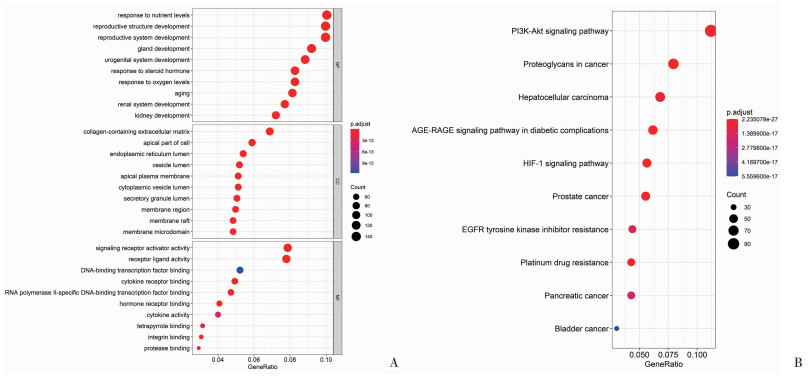
|
| A:显著性前10的GO富集结果;B:显著性前10的KEGG富集结果 图 1 BPA相关基因GO、KEGG富集分析气泡图 |
2.3 BPA相关基因互作网络分析
图 2A显示了不同BP之间的关联度大小,与其他BP关联度较高的几个BP分别是对营养水平的应答、对氧气水平的应答、生殖结构发育、生殖系统发育、泌尿生殖系统发育,进一步提示上述生物学进程在BPA暴露作用于男性泌尿生殖系统中可能发挥重要作用。
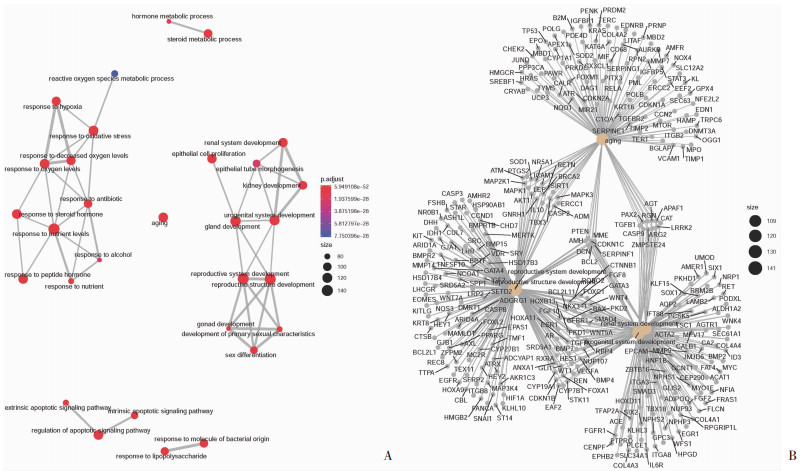
|
| A:Enrichment Map显示GO条目显著性前30的BP之间的关联;B:Cnetplot显示GO条目显著性前5的BP之间的交互基因 图 2 BPA相关基因互作网络分析图 |
Cnetplot分析可以直观地观察到各GO_BP之间的交互基因,见图 2B中交叉部分。从图中可见这5个BP之间有很多交互基因,如BCL-2、PTEN、AMH、DCN、MME、CDKN1C、SERPINF1等,提示这些交互基因可能是BPA作用的关键靶点,并在生殖系统发生、发展中发挥更大的作用。
将图 1B富集分析出来的两条信号通路(HIF-1、PI3K-Akt)使用路径视图可视化选择映射在通路中较为关键的基因。HIF-1信号通路的关键基因为HIF-1α、P300/CBP、PKC,PI3K-Akt信号通路的关键基因为PI3K、JAK、P53、BCL-2。
2.4 BPA染毒72 h各组GC-2细胞镜下形态学观察以及细胞凋亡率建立低剂量BPA染毒GC-2细胞模型:使用终浓度为0、20、40、80 μmol/L BPA处理GC-2细胞72 h。镜下观察结果显示:对照组和低剂量组(20 μmol/L)GC-2细胞形态、大小正常,数量较多,空泡细胞较少(图 3A)。随着BPA剂量的增大,GC-2细胞数量明显减少,出现较多的空泡细胞,高剂量(80 μmol/L)组尤为明显。从图 3B、C可以明显看出各个剂量组细胞的凋亡情况以及细胞存活率,与DMSO对照组相比,凋亡率均明显上升,细胞存活率下降(P < 0.05)。
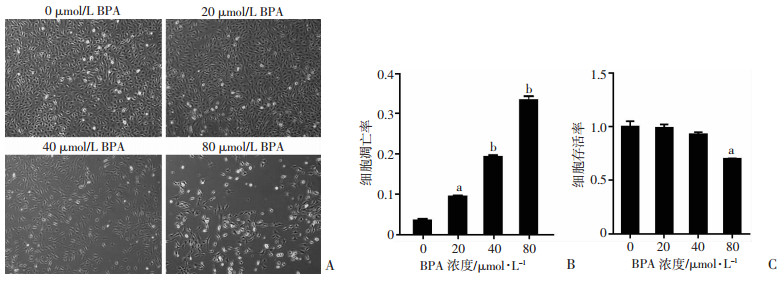
|
|
a:P < 0.05,b:P < 0.001,与0 μmol/L(DMSO对照组)比较
A:细胞形态(光学显微镜×100);B:细胞凋亡率;C:细胞存活率 图 3 不同浓度BPA染毒72 h GC-2细胞凋亡情况 |
2.5 BPA染毒72 h各组GC-2细胞中PI3K-Akt、HIF-1信号通路关键基因mRNA的表达
采用RT-qPCR对PI3K-Akt信号通路的关键基因PI3K、JAK、P53、BCL-2和HIF-1信号通路的关键基因HIF-1α、PKC、CBP在BPA染毒GC-2细胞72 h的mRNA表达进行检测,结果发现:PI3K-Akt信号通路的关键基因PI3K和JAK下调,P53、BCL-2上调(P < 0.01,图 4A)。HIF-1信号通路的关键基因HIF-1α、PKC、CBP并无明显变化(图 4B)。提示BPA可能通过PI3K-Akt信号通路调控GC-2细胞的凋亡。

|
| a:P < 0.05,b:P < 0.01,与0 μmol/L(DMSO对照组)比较 图 4 RT-qPCR检测不同浓度BPA染毒72 h GC-2细胞中PI3K-Akt(A)和HIF-1(B)信号通路关键基因的mRNA表达 |
2.6 BPA染毒72 h各组GC-2细胞中PI3K-Akt信号通路关键基因的蛋白表达
Western blot检测结果(图 5)显示:BPA染毒GC-2细胞72 h后,PI3K和BCL-2的蛋白水平下调(P < 0.05),P53蛋白水平上调(P < 0.05),进一步提示BPA可能通过PI3K-Akt信号通路调控GC-2细胞的凋亡。
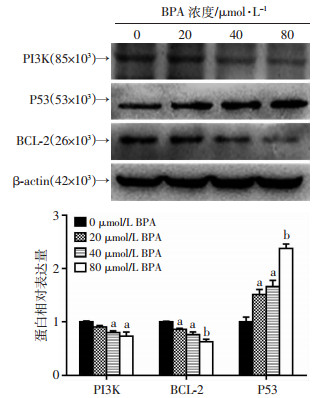
|
| P < 0.05,b:P < 0.01,与0 μmol/L(DMSO对照组)比较 图 5 Western blot检测不同浓度BPA染毒72 h GC-2细胞中PI3K-Akt信号通路关键基因的蛋白表达 |
3 讨论
BPA是人类接触范围最广的化学污染物,涉及到近90%的人群。作为一种常见的内分泌干扰物,BPA对生殖功能的干扰引起了极大的关注[13]。在小鼠中,高剂量BPA暴露会增加流产的概率,而低剂量BPA暴露会对性别分化、大脑发育、免疫系统和行为造成长期的干扰[8]。在人类中,暴露于双酚A会导致糖尿病、心血管疾病、肥胖、精子质量下降,并增加生殖损失的风险[14]。
本研究在传统毒理学的基础上,通过CTD数据库中的“大数据”筛选出和BPA暴露相关的男性泌尿生殖系统疾病以及相关基因。通过GO和KEGG的富集分析,找到两条可能相关的信号通路:HIF-1信号通路及PI3K-Akt信号通路。通过查阅相关研究[15-17]以及可视化分析后分别找到两条通路的关键基因,HIF-1信号通路的关键基因为HIF-1α、CBP、PKC,PI3K-Akt信号通路的关键基因为PI3K、JAK、P53、BCL-2。后续通过实验研究发现BPA染毒GC-2细胞72 h后,细胞数量明显减少,凋亡率随着染毒剂量的增大而上升,并且存在剂量-效应关系。在进一步的实验中,对数据库筛选出的HIF-1以及PI3K-Akt这两条通路进行相关实验验证。
HIF-1信号通路中的关键基因HIF-1α是低氧诱导因子,HIF-1α可通过激活许多编码基因的转录,进而参与如红细胞生成,血管形成,糖、氨基酸、核苷酸的能量代谢,细胞存活、凋亡、分化等生物学效应,使内环境在缺氧条件下维持稳定,以适应缺氧。同时,HIF-1在很多种病理情况下发挥着重要的作用,诱导正常细胞分化为肿瘤细胞。有研究表明将患有精索静脉曲张的大鼠睾丸HIF-1α基因敲除后,生精细胞凋亡明显减少,睾丸生精功能明显改善。HIF-1α可能在精索静脉曲张导致的男性不育的生精过程中起重要作用[15]。但本研究并未发现BPA染毒GC-2细胞72 h后HIF-1信号中关键分子mRNA表达有改变,可能是因为该信号通路主要在缺氧环境下发挥生理作用,而本研究的对象主要是BPA染毒的GC-2细胞而并非缺氧环境。
PI3K-Akt信号通路受多种机制的高度调节,通常与其他信号通路共同发挥作用。PI3K被上游信号通路激活后与Akt和PDK1结合导致Akt的活化。Akt信号传导途径在许多细胞存活途径中起着重要的调节作用,主要是作为细胞凋亡的抑制剂。活化的Akt通过形成磷酸化来改变下游靶分子的活性,进而调节细胞迁移、细胞凋亡、细胞增殖、细胞分化、细胞周期、葡萄糖代谢、蛋白质的合成等。此外,Akt在心脏生长、血管生成、生理性心脏肥大以及病理性心肌肥大等生理病理过程中起着重要作用,是心血管疾病的关键参与者。JAK是一种非受体型的酪氨酸蛋白激酶。JAK-STAT信号通路是由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。本研究中PI3K和JAK表达的下调与细胞凋亡呈正相关关系,PI3K和JAK的激活会抑制细胞凋亡[16-17],这与文献[5-6]报道的结果一致。P53和BCL-2都是凋亡相关蛋白,不同的是P53是促凋亡蛋白,而BCL-2是抑凋亡蛋白[18]。本研究结果显示:P53作为促凋亡蛋白,mRNA和蛋白表达均显著上调;而BCL-2作为一个抑凋亡蛋白,mRNA水平升高,蛋白水平降低,表明BCL-2在BPA致GC-2细胞凋亡过程中在蛋白水平发挥抑凋亡蛋白作用。
本研究采用生物信息学分析与实验研究相结合的方式,利用CTD数据库筛选与BPA毒性相关的基因,辅以实验验证,弥补了以往单一生物信息学分析或传统实验研究方法的局限性。本研究结果提示PI3K-Akt信号通路可能是低剂量BPA诱导GC-2细胞凋亡的重要通路,后续我们将从细胞、动物、人群3个方面对低剂量BPA暴露如何通过调控PI3K-Akt信号通路的关键靶分子导致小鼠精母细胞凋亡的机制进行更深入的探索。
| [1] |
MURATA M, KANG J H. Bisphenol A (BPA) and cell signaling pathways[J]. Biotechnol Adv, 2018, 36(1): 311-327. DOI:10.1016/j.biotechadv.2017.12.002 |
| [2] |
DE TONI L, DE ROCCO PONCE M, PETRE G C, et al. Bisphenols and male reproductive health: from toxicological models to therapeutic hypotheses[J]. Front Endocrinol, 2020, 11: 301. DOI:10.3389/fendo.2020.00301 |
| [3] |
RYU D Y, RAHMAN M, PANG M G. Determination of highly sensitive biological cell model systems to screen BPA-related health hazards using pathway studio[J]. Int J Mol Sci, 2017, 18(9): 1909. DOI:10.3390/ijms18091909 |
| [4] |
RAHMAN M S, PANG M G. Understanding the molecular mechanisms of bisphenol A action in spermatozoa[J]. Clin Exp Reprod Med, 2019, 46(3): 99-106. DOI:10.5653/cerm.2019.00276 |
| [5] |
陈威.双酚A暴露引起青春前期大鼠睾丸中精子发生障碍及PI3K/Akt/FOXO1信号通路介导的凋亡[D].武汉: 华中科技大学, 2017. CHEN W. Bisphenol A exposure induces spermatogenesis disorder and apoptosis mediated by PI3K/Akt/FOXO1 signaling pathway in prepubertal rats[D]. Wuhan: Huazhong University of Science and Technology, 2017. |
| [6] |
梁书秋, 陶亚楠, 李丹, 等. 双酚A对小鼠睾丸间质细胞毒性及miR-203-3p和PI3K/AKT/FOXO1信号通路的影响[J]. 实用药物与临床, 2020, 23(7): 584-588. LIANG S Q, TAO Y N, LI D, et al. Effects of bisphenol A on mouse Leydig cell toxicity and mir-203-3p and PI3K/AKT/FOXO1 signaling pathway[J]. Pract Med Clin, 2020, 23(7): 584-588. DOI:10.14053/j.cnki.ppcr.202007002 |
| [7] |
PERETZ J, VROOMAN L, RICKE W A, et al. Bisphenol A and reproductive health: update of experimental and human evidence, 2007-2013[J]. Environ Heal Perspect, 2014, 122(8): 775-786. DOI:10.1289/ehp.1307728 |
| [8] |
KOIKE E, YANAGISAWA R, WIN-SHWE T T, et al. Exposure to low-dose bisphenol A during the juvenile period of development disrupts the immune system and aggravates allergic airway inflammation in mice[J]. Int J Immunopathol Pharmacol, 2018, 32: 2058738418774897. DOI:10.1177/2058738418774897 |
| [9] |
KOSNIK M B, PLANCHART A, MARVEL S W, et al. Integration of curated and high-throughput screening data to elucidate environmental influences on disease pathways[J]. Comput Toxicol, 2019, 12: 100094. DOI:10.1016/j.comtox.2019.100094 |
| [10] |
DAVIS A P, GRONDIN C J, JOHNSON R J, et al. The comparative toxicogenomics database: update 2017[J]. Nucleic Acids Res, 2017, 45(d1): D972-D978. DOI:10.1093/nar/gkw838 |
| [11] |
DAVIS A P, WIEGERS T C, WIEGERS J, et al. Chemical-induced phenotypes at CTD help inform the predisease state and construct adverse outcome pathways[J]. Toxicol Sci, 2018, 165(1): 145-156. DOI:10.1093/toxsci/kfy131 |
| [12] |
GRONDIN C J, DAVIS A P, WIEGERS T C, et al. Accessing an expanded exposure science module at the comparative toxicogenomics database[J]. Environ Health Perspect, 2018, 126(1): 014501. DOI:10.1289/ehp2873 |
| [13] |
XIE M N, BU P L, LI F J, et al. Neonatal bisphenol A exposure induces meiotic arrest and apoptosis of spermatogenic cells[J]. Oncotarget, 2016, 7(9): 10606-10615. DOI:10.18632/oncotarget.7218 |
| [14] |
EFIMOVA O A, KOLTSOVA A S, KRAPIVIN M I, et al. Environmental epigenetics and genome flexibility: focus on 5-hydroxymethylcytosine[J]. Int J Mol Sci, 2020, 21(9): 3223. DOI:10.3390/ijms21093223 |
| [15] |
ZHAO W, LIU J, WANG D, et al. Effect of silencing HIF-1alpha gene on testicle spermatogenesis function in varicocele rats[J]. Cell Tissue Res, 2019, 378(3): 543-554. DOI:10.1007/s00441-019-03064-0 |
| [16] |
HU X, MA J J, VIKASH V, et al. Thymoquinone augments cisplatin-induced apoptosis on esophageal carcinoma through mitigating the activation of JAK2/STAT3 pathway[J]. Dig Dis Sci, 2018, 63(1): 126-134. DOI:10.1007/s10620-017-4856-8 |
| [17] |
ZHAO X B, QIN Y, NIU Y L, et al. Matrine inhibits hypoxia/reoxygenation-induced apoptosis of cardiac microvascular endothelial cells in rats via the JAK2/STAT3 signaling pathway[J]. Biomed Pharmacother, 2018, 106: 117-124. DOI:10.1016/j.biopha.2018.06.003 |
| [18] |
ZHENG C, LIU T, LIU H, et al. Role of BCL-2 family proteins in apoptosis and its regulation[J]. Curr Protein Pept Sci, 2020, 21(8): 799-806. DOI:10.2174/1389203721666191227122252 |




