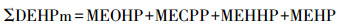邻苯二甲酸酯(phthalates,PAEs)是一类重要的环境污染物,主要包括邻苯二甲酸二(2-乙基)己酯[di(2-ethylhexyl) phthalate,DEHP]、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)等十多种,是一类广泛存在于环境中的化合物[1]。PAEs的代谢产物可以在血液、尿液和精液中检测出来,尿液排泄是PAEs的主要排泄途径之一。PAEs的环境健康危害近年来受到了广泛关注。很多研究发现其对人类和动物的危害,例如DEHP能干扰脂肪代谢[2]、引起肝脏和生殖发育毒性等[3];DBP可以诱导生精细胞的氧化应激和线粒体途径的凋亡[4]。一些研究也发现了PAEs能引起人类男性生殖损害,WANG等[5]发现在不育男性尿液中PAEs代谢产物含量高于对照组男性;BLOOM等[6]发现在普通男性群体中,PAEs代谢产物与精子总数减少有关。由于PAEs具有较强的危害性,多个机构都制定了相应的安全摄入限值。美国环境保护局提出了用于预防人群在终身暴露于PAEs情况下,发生非致痛或非致突变有害效应的危险度低至不能检出的程度的值——参考剂量(reference doses, RfD)。DEHP、DEP、邻苯二甲酸二正丁酯(DnBP)、邻苯二甲酸丁基苄基酯(BBzP)的RfD分别为20、800、100、200 μg/(kg·d)[7-8];欧洲食品安全局发布了对于DEHP和DnBP的每日可容忍摄入量分别为50、10 μg/(kg·d)[9]。我国国家食品安全风险评估专家委员会则参考各组织的安全限值,规定了用于DEHP、DEP、DnBP的健康指导值为50、30、10 μg/(kg·d)[10-11]。目前,安全限值的制定方法主要基于动物实验,缺少人群研究的验证,并且没有充分考虑生殖损害方面的影响。同时,PAEs的暴露对男性生殖损害的人群研究中,主要关注其引起的靶器官功能的损害及机制,很少关注引起生殖健康损害的拐点。因此,采用现有PAEs的安全限值用于保护生殖系统可能存在缺陷,需要从人群的角度出发,探究PAEs在生殖系统是否存在安全限值并验证目前的安全限值是否有效。
本研究检测具有RfD的4种PAEs(DEP、DnBP、DEHP、BBzP)在尿液中的7种代谢产物:monoethyl phthalate (MEP),mono-n-butylphthalate (MnBP), mono(2-ethyl-5-carboxypentyl) phthalate (MECPP), mono (2-ethyl-5-hydroxyhexyl) phthalate (MEHHP), mono (2-ethyl-5-oxohexyl) phthalate (MEOHP), mono(2-ethylhexyl) phthalate (MEHP), monobenzyl phthalate (MBzP),估算人群中PAEs暴露水平,并分析其与精液参数和性激素水平等结局指标的关联,进而采用Joinpoint回归模型分析在PAEs暴露水平与精液参数和性激素的关联中是否存在拐点(阈剂量),并与RfD和健康指导值进行比较,为重新制定参考值提供研究数据。
1 资料与方法 1.1 研究对象本研究的调查人群来源于重庆大学生男性生殖健康研究队列(male reproductive health in Chongqing college students, MARHCS)。MARHCS队列旨在研究环境等因素与男性生殖健康的关系,研究设计和实施的相关细节见前期研究[12]。2013年6月,在重庆大学城地区男性在读大学生中招募志愿者,纳入标准:①禁欲时间为2~7 d;②年龄≥18岁;③在重庆大学城就读的健康男性大学生。排除标准:①患有泌尿生殖系统疾病(附睾炎、睾丸损伤、泌尿生殖系统炎症、睾丸下降不全、精索静脉曲张);②在调查现场由医师诊断的下述任一情况:隐睾、附睾结节、乳腺发育异常、喉结发育异常、阴茎异常、阴毛发育异常;③其他遗传病史或严重疾病。共有796名志愿者符合标准并纳入研究。全部志愿者完成了采集年龄、吸烟、饮酒及禁欲天数信息的调查问卷,同时测量身高和体质量并计算体质量指数(BMI)。本研究通过第三军医大学伦理委员会审查(1.0/2013.4-12),所有志愿者被告知本研究的目的、性质、方法及可能的不良反应等信息并签署知情同意书。
1.2 方法 1.2.1 尿液样本中邻苯二甲酸酯代谢产物的检测用玻璃试管采集志愿者的中段尿样本,并采用高效液相色谱串联质谱(HPLC-MS/MS)法对尿液中PAEs代谢产物(包括MEP、MnBP、MBzP、MEHHP、MECPP、MEOHP、MEHP)的浓度进行检测。该检测委托中国测试技术研究院生物研究所完成。各代谢物检出限分别为MEP:0.33,MnBP:0.63,MBzP:0.09,MEHHP:0.13,MECPP:0.27,MEOHP:0.07,MEHP:0.42,单位:ng/mL。同时采用自动生化检测仪CL8000(Shimazu,日本)测定尿中肌酐浓度用于校正尿浓缩程度对PAEs浓度的影响,从而计算尿液样本中PAEs代谢产物的浓度,结果表示为代谢产物/肌酐浓度[13]。DEHP代谢产物总浓度的计算公式如下。
用WITTASSEK等[14]的方法将肌酐校正后的PAEs代谢产物浓度换算成PAEs原型的暴露量,并与RfD进行比较。
1.2.2 精液参数检测志愿者通过WHO推荐的手淫法采集精液样本。具体的采集与检测步骤见前期研究[15-16]。精液体积采用称量法测量(根据世界卫生组织标准,计1 g=1 mL),随即将精液置于37 ℃恒温孵育箱液化,将液化后的精液混匀并取10 μL置于人类精子专用玻片,采用计算机辅助分析系统(CASA System; Microptic S L, 西班牙)分析报告精子浓度(106/mL)和前向运动(%)。通过将精液体积和精子浓度相乘得到精子总数。另取10 μL精液样本涂片,用无水乙醇固定30 min后,采用Diff-Quick染色法分析精子形态学指标,每张涂片至少观察200个精子,以头部和尾部都正常的精子为正常精子,报告精子正常形态率。为保证结果准确性和同质性,整个精液分析过程都基于《WHO人类精液检验与处理实验室手册》(2010年第5版)的要求,由经过培训的同一名专业技术人员采用同一台经过校正的仪器完成。
1.2.3 血清性激素检测采集志愿者静脉血5 mL,分离得到血清后,交由本校第一附属医院检验科采用全自动免疫分析仪(Bechman Counter Inc, 美国)进行检测,检测方法为微粒子酶促发光法。共检测了6种性激素:雌激素、卵泡刺激素、黄体生成素、泌乳素、孕酮、睾酮。
1.3 统计学分析采用中位数(四分位数)[M(P25,P75)]或例数(%)形式描述数据分布。对于检出率>80%的PAEs代谢产物,分析其与各结局指标(精液参数和性激素水平)的关联。由于精液参数和激素水平是非正态分布的,故进行自然对数变换进行后续分析。将邻苯二甲酸酯代谢产物按照等间距分10组。将污染物暴露水平转换为分组变量是环境流行病学分析的常用方法,有利于减小污染物测量中的随机误差对分析结果的影响,提高分析结果的可靠性。采用最优尺度回归模型分析PAEs与结局指标的关系,并且校正年龄、禁欲天数、BMI、吸烟和饮酒情况。由于本研究中涉及较多个结局指标的分析,为避免多次统计检验导致的假阳性,采用错误发现率方法(false discovery rate,FDR)[17]对P值进行校正。在最优尺度回归模型中发现的有统计学意义的关联,进一步采用Joinpoint回归模型的方法探究此关联中是否存在拐点。上述统计分析使用SPSS 21.0、R 4.0.1以及Joinpoint Regression Program 4.7.0.0软件完成。
2 结果 2.1 人群基本特征796名男性大学生志愿者年龄为20(20,21)岁,禁欲天数为4(3, 6)d。志愿者精子总数、前向运动、正常形态率为:183.6(97.7,300.6)×106、88.5(79.7,94.8)%、8.4(6.4,10.3)%;血清性激素水平分别为雌激素:19.0(10.0,27.0)pg/mL,卵泡雌激素:3.5(2.6,4.7)mIU/mL,黄体生成素:4.0(3.1,5.1)mIU/mL,泌乳素:10.1(8.1,13.7)ng/mL,孕酮:0.5(0.3,0.8)ng/mL,睾酮:4.3(3.5,5.1)ng/mL(表 1)。
| 变量 | 数据分布 |
| 年龄/岁 | 20(20,21) |
| 禁欲时间/d | 4(3,6) |
| BMI/kg·m-2 | |
| < 18.5 | 90(11.3) |
| 18.5~ < 24.0 | 597(75.1) |
| 24.0~ < 28.0 | 87(10.9) |
| ≥28.0 | 21(2.7) |
| 吸烟 | |
| 从不吸烟 | 593(74.7) |
| 已戒烟 | 30(3.8) |
| 吸烟 | 171(21.5) |
| 饮酒 | |
| 不饮酒 | 409(51.6) |
| 已戒酒 | 10(1.2) |
| 饮酒 | 374(47.2) |
| 精子总数(×106) | 183.6(97.7,300.6) |
| 前向运动(%) | 88.5(79.7,94.8) |
| 正常形态率(%) | 8.4(6.4,10.3) |
| 雌激素/pg·mL-1 | 19.0(10.0,27.0) |
| 卵泡刺激素/mIU·mL-1 | 3.5(2.6,4.7) |
| 黄体生成素/mIU·mL-1 | 4.0(3.1,5.1) |
| 泌乳素/ng·mL-1 | 10.1(8.1,13.7) |
| 孕酮/ng·mL-1 | 0.5(0.3,0.8) |
| 睾酮/ng·mL-1 | 4.3(3.5,5.1) |
2.2 PAEs暴露分析
共检测4种具有RfD的PAEs(DEP、DnBP、DEHP、BBzP)的7种代谢产物。除BBzP的代谢产物MBzP的检出率(35.6%)较低外,DEP、DnBP、DEHP的6种代谢产物的检出率分别为MEP(99.6%)、MnBP(100%)、MEHHP(97.3%)、MECPP(99.9%)、MEOHP(97.2%)、MEHP(100%)。由于MBzP的检出率过低,检测结果无法准确定量反映研究人群的暴露水平,因此最终纳入了其余6种代谢产物用于后续的分析。采用“中位数(四分位数)”形式对6种代谢产物进行统计学描述,分别为MEP:7.6(3.2, 21.8)μg/g肌酐、MnBP:16.0(8.3, 32.9)μg/g肌酐、MEHHP:2.8(1.3, 6.0)μg/g肌酐、MECPP:43.5(20.3, 95.6)μg/g肌酐、MEOHP:2.1(1.0, 4.1)μg/g肌酐、MEHP:6.1(3.6, 11.1)μg/g肌酐。DEHP的4种代谢物总浓度(DEHPm)为28.7(15.6, 54.6)μg/g肌酐。
根据PAEs代谢产物浓度推算其3种原型DEP、DnBP、DEHP的暴露水平,分别为:0.1(0.04, 0.3)、1.0(0.6, 2.10)、4.3(2.5, 7.8)μg/(kg·d),与RfD、每日可容忍摄入量和健康指导值进行比较,结果显示:人群中3种PAEs暴露水平高于RfD的比例为DEP: 0、DnBP:0.08%、DEHP:1.60%;高于每日可容忍摄入量的比例为DnBP:2.3%,DEHP:0.6%;高于健康指导值的比例为DEP: 0.2%;DnBP:2.3%;DEHP:0.6%(图 1)。
2.3 PAEs与精液参数及性激素水平的关联分析
DEP的代谢产物MEP与3种精液参数/性激素水平相关,分别是精子前向运动、正常形态率和睾酮水平(P < 0.01);DnBP的代谢产物MnBP与精子前向运动比和正常形态率相关(P < 0.05);DEHP的4种代谢产物与两种性激素水平相关,其中MEHHP与雌激素和孕酮水平相关(P < 0.05),MECPP与雌激素水平相关(P < 0.01),MEOHP与雌激素和孕酮水平相关(P < 0.01),MEHP与雌激素和孕酮水平相关(P < 0.01);DEHP总代谢产物雌激素和孕酮水平相关(P < 0.01,图 2A)。采用FDR法进行多重检验的校正后,除MEHHP与孕酮水平、MnBP与精子前向运动的关联不再有统计学意义,其他12项关联仍然存在(图 2B)。

|
|
结果采用最优回归分析方法得出,校正了年龄、BMI、禁欲天数、吸烟、饮酒等潜在混杂因素,其中具有统计学意义的关联(P < 0.05)以红色标记
A:未经FDR多重检验校正;B:以FDR法进行多重检验校正 图 2 PAEs与精液参数和激素水平的关联分析 |
2.4 PAEs与精液参数及性激素水平关联的阈值分析
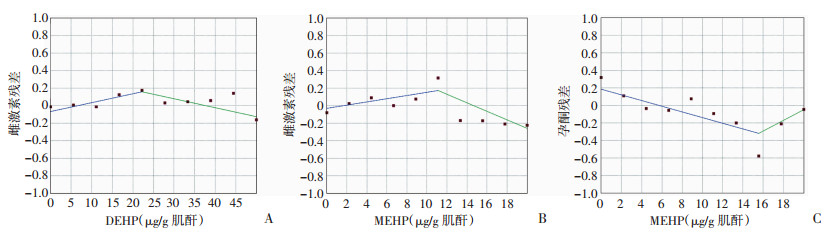
Joinpoint回归模型分析结果显示:随着DEHP总代谢产物浓度的升高,雌激素水平呈现先升高后下降的变化趋势(图 3A),拐点数量为1,出现在DEHP总代谢产物浓度为20~25 μg/g肌酐时(表 2),对应的DEHP日均摄入量为2.9~3.6 μg/(kg·d);MEHP与雌激素的关系同样呈现先升高后下降的趋势,拐点位置出现在8~10 μg/g肌酐时(图 3B),对应的DEHP日均摄入量与前述水平相同[2.9~3.6 μg/(kg·d)];孕酮水平呈现先降低后升高的趋势,拐点位置在14~16 μg/g肌酐,逆推DEHP日均摄入量为5.0~5.8 μg/(kg·d)(图 3C)。上述拐点剂量明显小于RfD[20 μg/(kg·d)],更低于欧洲食品安全局制定的每日可容忍摄入量和中国国家食品安全风险评估专家委员会制定的健康指导值[50 μg/(kg·d)]。
|
|
横坐标为PAEs代谢产物的浓度;纵坐标为经过最优尺度回归校正的性激素水平;校正因素包括年龄、BMI、吸烟、饮酒、禁欲天数 A:DEHP总代谢物与雌激素的关系;B:MEHP与雌激素的关系;C:MEHP与孕酮的关系 图 3 DEHP暴露剂量与雌激素及孕酮关联的拐点分布 |
| PAEs | 结局指标 | P值 | 拐点数量 |
| MEP | 精子前向运动 | 0.826 | 0 |
| 正常形态率 | 0.598 | 0 | |
| 睾酮 | 0.410 | 0 | |
| MnBP | 精子前向运动 | 0.914 | 0 |
| 正常形态率 | 0.726 | 0 | |
| MEHHP | 雌激素 | 0.146 | 0 |
| 孕酮 | 0.473 | 0 | |
| MECPP | 雌激素 | 0.146 | 0 |
| MEHP | 雌激素 | 0.050 | 1 |
| 孕酮 | 0.081 | 1 | |
| DEHPm | 雌激素 | 0.047 | 1 |
| 孕酮 | 0.158 | 0 |
3 讨论
PAEs作为地表污染最广泛的环境毒物,目前其安全限值的制定方法主要是基于动物实验得到的未观察到有害作用的剂量(no observable adverse effect level, NOAEL)或观察到有害作用的最低剂量(lowest observed adverse effect level, LOAEL)除以一定的不确定/安全系数的值,在限值的制定过程中缺少人群研究的验证,并且没有充分考虑生殖损害方面的影响。本研究在796名男性大学生尿液中分析4种具有安全限值的PAEs的代谢产物,结果提示:除BBzP的代谢产物MBzP检出率较低外,其余3种PAEs的6种代谢产物具有较高的检出率,且与多种精液参数和性激素水平存在关联。DEHP与雌激素及孕酮的关联中存在拐点,拐点处暴露水平分别为2.9~3.6、5.0~5.8 μg/(kg·d),明显低于RfD[20 μg/(kg·d)]和中国的健康指导值[50 μg/(kg·d)]。更值得关注的是,大部分PAEs与精液参数和激素水平的关联中并不存在拐点,提示在本研究检测到的较低浓度的PAEs暴露水平下,其对于男性生殖的损害作用已经存在。
相比于普通线性回归模型,最优尺度回归分析的优点在于可以将分类变量的取值进行量化处理,提高回归分析的效能,是一种用于处理有序分类变量的常用回归分析方法。最优尺度回归分析方法本身没有适宜的用于估算样本量的公式,但与先前的阳性结果相比[18-19],本研究的样本量相对较大,且在经过多重检验校正之后,PAEs与结局指标间的关联仍然存在,提示现有的样本量具有足够的统计效能。在PAEs代谢产物与结局指标存在关联的情况下,采用Joinpoint回归模型进行拐点的探究,Joinpoint回归模型是通过将趋势变化分成若干有统计学意义的趋势区段,能探索一般线性回归不能发现的非线性变化趋势,可识别PAEs导致结局指标发生变化的拐点。
本研究发现PAEs与多种精液参数相关,这与其他人群报道相似。例如,WIRTH等[20]报道密歇根州男性尿液中DnBP浓度与精子前向运动呈现负相关;SPECHT等[21]在对589名男性的研究中发现DEHP与雌激素水平相关等。不同之处在于,本研究从评估PAEs引起损害作用的拐点出发,通过逆推引起生殖损害作用的暴露水平并与RfD和健康指导值进行比较,评估现有安全限值的可靠性。此外,其他研究主要以不育男性为研究对象,而本课题的研究对象为健康男性大学生,更能代表普通人群暴露于PAEs产生的影响,且人群内同质性较好,有利于排除职业暴露、受教育程度等混杂因素的影响。PAEs引起精液参数和激素水平紊乱的机制较为复杂。有研究指出:PAEs可通过诱导氧化应激反应抑制睾酮的生成[22];也可通过引起表观遗传修饰(例如甲基化改变)从而引起精子前向运动能力改变[23];还可通过诱导细胞凋亡引起睾丸功能的损害等[24]。本研究发现暴露于PAEs能引起性激素水平的改变,且其剂量-反应关系可能并非简单的线性形式,而是可能存在低剂量兴奋效应,这也与最新的动物和细胞研究发现相似[25]。
综上所述,本研究分析了4种PAEs与精液参数和性激素水平的关联性,除BBzP代谢产物因检出率较低无法进行后续分析外,其余3种PAEs与多种精液参数和性激素水平存在关联。DEHP与性激素水平的关联存在拐点,但对应的暴露水平低于RfD和我国的健康指导值;而其他PAEs在远低于RfD和健康指导值的情况下仍与精液参数和性激素水平相关,且未发现拐点。这提示现有的安全限值可能不足以用于预防PAEs对男性生殖系统产生的影响。
| [1] |
王文枝, 国伟, 孙利, 等. 食品包装材料中DEHP的危害及其在食品中的暴露评估[J]. 食品科技, 2008, 33(4): 166-168. WANG W Z, GUO W, SUN L, et al. The hazard and exposure assessment of DEHP in food contact materials[J]. Food Sci Technol, 2008, 33(4): 166-168. DOI:10.3969/j.issn.1005-9989.2008.04.049 |
| [2] |
CHIANG H C, KUO Y T, SHEN C C, et al. Mono(2-ethylhexyl)phthalate accumulation disturbs energy metabolism of fat cells[J]. Arch Toxicol, 2016, 90(3): 589-601. DOI:10.1007/s00204-014-1446-9 |
| [3] |
KARABULUT G, BARLAS N. Genotoxic, histologic, immunohistochemical, morphometric and hormonal effects of di-(2-ethylhexyl)-phthalate (DEHP) on reproductive systems in pre-pubertal male rats[J]. Toxicol Res, 2018, 7(5): 859-873. DOI:10.1039/c8tx00045j |
| [4] |
ZHANG G, YANG W, JIANG F, et al. PERK regulates Nrf2/ARE antioxidant pathway against dibutyl phthalate-induced mitochondrial damage and apoptosis dependent of reactive oxygen species in mouse spermatocyte-derived cells[J]. Toxicol Lett, 2019, 308: 24-33. DOI:10.1016/j.toxlet.2019.03.007 |
| [5] |
WANG S Y, WANG Y, XIE F Q, et al. Analysis of PAEs in semen of infertile men[J]. Int J Occup Environ Health, 2015, 21(1): 40-48. DOI:10.1179/2049396714y.0000000088 |
| [6] |
BLOOM M S, WHITCOMB B W, CHEN Z, et al. Associations between urinary phthalate concentrations and semen quality parameters in a general population[J]. Hum Reprod, 2015, 30(11): 2645-2657. DOI:10.1093/humrep/dev219 |
| [7] |
STRASSLE P D, SMIT L, HOPPIN J A. Endotoxin enhances respiratory effects of phthalates in adults: Results from NHANES 2005-6[J]. Environ Res, 2018, 162: 280-286. DOI:10.1016/j.envres.2018.01.017 |
| [8] |
JOHNS L E, COOPER G S, GALIZIA A, et al. Exposure assessment issues in epidemiology studies of phthalates[J]. Environ Int, 2015, 85: 27-39. DOI:10.1016/j.envint.2015.08.005 |
| [9] |
SILANO V, BARAT B J, BOLOGNESI C, et al. Update of the risk assessment of di-butylphthalate (DBP), butyl-benzyl-phthalate (BBP), bis(2-ethylhexyl)phthalate (DEHP), di-isononylphthalate (DINP) and di-isodecylphthalate (DIDP) for use in food contact materials[J]. EFSA J, 2019, 17(12): e5838. DOI:10.2903/j.efsa.2019.5838 |
| [10] |
王彝白纳, 蒋定国, 杨大进, 等. 中国居民邻苯二甲酸二丁酯膳食摄入水平及其风险评估[J]. 中国食品卫生杂志, 2016, 28(6): 800-804. WANG Y B N, JIANG D G, YANG D J, et al. Dietary intake and risk assessment of dibutyl phthalate in Chinese population[J]. Chin J Food Hyg, 2016, 28(6): 800-804. |
| [11] |
隋海霞, 蒋定国, 吴平谷, 等. 中国居民邻苯二甲酸二(2-乙基己基)酯膳食摄入水平及其风险评估[J]. 中华预防医学杂志, 2015, 49(3): 218-222. SUI H X, JIANG D G, WU P G, et al. Dietary intake and risk assessment of diethylhexyl phthalate in Chinese populations[J]. Chin J Prev Med, 2015, 49(3): 218-222. DOI:10.3760/cma.j.issn.0253-9624.2015.03.006 |
| [12] |
YANG H, CHEN Q, ZHOU N, et al. Lifestyles associated with human semen quality: results from MARHCS cohort study in Chongqing, China[J]. Medicine (Madr), 2015, 94(28): e1166. DOI:10.1097/md.0000000000001166 |
| [13] |
CHEN Q, YANG H, ZHOU N, et al. Phthalate exposure, even below US EPA reference doses, was associated with semen quality and reproductive hormones: Prospective MARHCS study in general population[J]. Environ Int, 2017, 104: 58-68. DOI:10.1016/j.envint.2017.04.005 |
| [14] |
WITTASSEK M, KOCH H M, ANGERER J, et al. Assessing exposure to phthalates—The human biomonitoring approach[J]. Mol Nutr Food Res, 2011, 55(1): 7-31. DOI:10.1002/mnfr.201000121 |
| [15] |
LIU K, HOU G, WANG X, et al. Adverse effects of circadian desynchrony on the male reproductive system: an epidemiological and experimental study[J]. Hum Reprod, 2020, 35(7): 1515-1528. DOI:10.1093/humrep/deaa101 |
| [16] |
WANG X, CHEN Q, ZOU P, et al. Sleep duration is associated with sperm chromatin integrity among young men in Chongqing, China[J]. J Sleep Res, 2018, 27(4): e12615. DOI:10.1111/jsr.12615 |
| [17] |
BENJAMINI Y, HOCHBERG Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing[J]. J R Stat Soc Series B Stat Methodol, 1995, 57(1): 289-300. DOI:10.1111/j.2517-6161.1995.tb02031.x |
| [18] |
AL-SALEH I, COSKUN S, AL-DOUSH I, et al. The relationships between urinary phthalate metabolites, reproductive hormones and semen parameters in men attending in vitro fertilization clinic[J]. Sci Total Environ, 2019, 658: 982-995. DOI:10.1016/j.scitotenv.2018.12.261 |
| [19] |
THURSTON S W, MENDIOLA J, BELLAMY A R, et al. Phthalate exposure and semen quality in fertile US men[J]. Andrology, 2016, 4(4): 632-638. DOI:10.1111/andr.12124 |
| [20] |
WIRTH J J, ROSSANO M G, POTTER R, et al. A pilot study associating urinary concentrations of phthalate metabolites and semen quality[J]. Syst Biol Reproductive Med, 2008, 54(3): 143-154. DOI:10.1080/19396360802055921 |
| [21] |
SPECHT I O, TOFT G, HOUGAARD K S, et al. Associations between serum phthalates and biomarkers of reproductive function in 589 adult men[J]. Environ Int, 2014, 66: 146-156. DOI:10.1016/j.envint.2014.02.002 |
| [22] |
杨敏, 魏丽, 刘长江. DEHP对大鼠睾丸氧化应激和血清睾酮水平影响[J]. 中国公共卫生, 2017, 33(11): 1599-1602. YANG M, WEI L, LIU C J. DEHP-induced testicular oxidative stress and down-regulated serum testosterone in rats[J]. Chin J Public Heal, 2017, 33(11): 1599-1602. DOI:10.11847/zgggws2017-33-11-15 |
| [23] |
TIAN M P, LIU L P, ZHANG J, et al. Positive association of low-level environmental phthalate exposure with sperm motility was mediated by DNA methylation: a pilot study[J]. Chemosphere, 2019, 220: 459-467. DOI:10.1016/j.chemosphere.2018.12.155 |
| [24] |
KIJIMA K, TOYOSAWA K, YASUBA M, et al. Gene expression analysis of the rat testis after treatment with di(2-ethylhexyl) phthalate using cDNA microarray and real-time RT-PCR[J]. Toxicol Appl Pharmacol, 2004, 200(2): 103-110. DOI:10.1016/j.taap.2004.03.015 |
| [25] |
ZHANG Q, HAO L C, HONG Y. Exposure evaluation of diisononyl phthalate in the adults of Drosophila melanogaster: Potential risks in fertility, lifespan, behavior, and modes of action[J]. Comp Biochem Phys C, 2020, 238: 108847. DOI:10.1016/j.cbpc.2020.108847 |
| [26] |
AXELSSON J, RYLANDER L, RIGNELL-HYDBOM A, et al. Phthalate exposure and reproductive parameters in young men from the general Swedish population[J]. Environ Int, 2015, 85: 54-60. DOI:10.1016/j.envint.2015.07.005 |
| [27] |
HUANG L P, LEE C C, HSU P C, et al. The association between semen quality in workers and the concentration of di(2-ethylhexyl) phthalate in polyvinyl chloride pellet plant air[J]. Fertil Steril, 2011, 96(1): 90-94. DOI:10.1016/j.fertnstert.2011.04.093 |