肥厚性心肌病(hypertrophic cardiomyopathy, HCM)是一种其他原因无法解释的心肌细胞肥厚的遗传性疾病,其特征为心室壁呈不对称性肥厚,常累及室间隔,人群发病率为1/500[1]。静息状态时,有20%~30%的患者会出现显著的跨左心室流出道压差(left ventricular outflow tract gradient,LVOTG≥30 mmHg),运动可诱发这种压差上升70%[2-3]。左心室流出道梗阻患者通常伴随明显的呼吸困难等症状,具有更高的卒中发生率及更多的死亡率[3]。研究表明,减轻跨左心室流出道压差可改善其症状和潜在的预后[4]。
非对称性室间隔肥厚可使左心室流出道狭窄,并且当左心室收缩时通过虹吸作用(射流效应)将二尖瓣前叶吸附使其与室间隔接触出现收缩期前向运动(systolic anterionr movement,SAM),可加重左室流出道梗阻。因此通过减少二尖瓣前叶-室间隔接触区域(SAM区域) 的肥厚是治疗肥厚梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM)的关键。
射频消融被广泛用于治疗心律失常,且已被用于消融HOCM增厚的室间隔[5]。此项技术可通过运用食道超声心动图使肥厚的室间隔可视化,运用电解剖电生理标测系统CARTO引导下消融。近年来心腔内超声(intracardiac echocardiography, ICE)具有可提供高质量的图像优势,已被成功运用于其他(如房颤、房速、室早等)心脏手术中。ICE和CARTO技术具有固有的优势,而CARTOSound©将这两种技术融合在一起。CARTOSound©模块和Soundstar导管将实时ICE图像融合进CARTO标测系统中,同时Soundstar导管的头端搭载有导航传感器,使其在CARTO系统中可视化,射频消融导管在实时的ICE影像中也能显示。并且ICE已被用于酒精化学消融治疗HOCM中,其可清楚地显示SAM区域[6]。本研究重点分析CARTOSound引导下射频消融治疗HOCM的临床效果。
1 资料与方法 1.1 研究对象收集2019年6-12月在本科就诊的经超声心动图证实室间隔明显肥厚梗阻性心肌病患者。研究获得本院伦理委员会批准(2011-29)。纳入标准:①经超声心动图检查提示室间隔厚度≥15 mm;②静息LVOTG≥30 mmHg;③心脏超声可见SAM征(图 1A)。排除标准:①心脏超声提示主动脉瓣中、重度狭窄或主动脉瓣畸形(二叶主动脉瓣);②心功能Ⅳ级(NYHA分级)无法平卧的患者;③不能按时随访及不同意入组的患者。
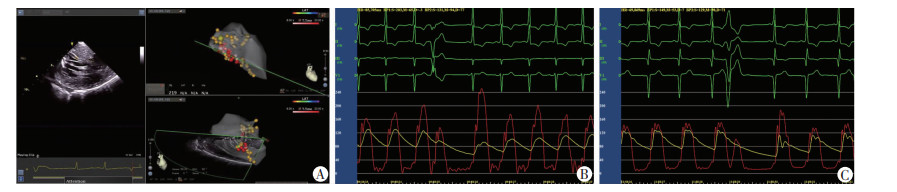
|
| A:ICE实时监测二尖瓣、室间隔及心包等情况三维标测指导下行肥厚的室间隔消融(红点),术中避免损伤正常传导系统(黄点);B:术前跨左心室流出道压力梯度(静息和激发压差);C:消融室间隔后复查跨左心室流出道压力梯度(静息和激发压差)明显缩小 图 1 肥厚型梗阻性心肌病患者在ICE指导下行导管消融 |
1.2 术前准备
术前停用β受体阻滞剂3~5个半衰期。行24 h动态心电图检查了解患者有无间歇性传导阻滞。常规进行实验室检查(包括B型利钠肽,B-type natriuretic peptide,BNP)。
1.3 CARTOSound指导下射频消融患者的手术过程均在局麻下完成,在局麻下经右侧股静脉穿刺1次后放入6F血管鞘,经鞘管送入CS电极,记录CS电图;经左侧股静脉穿刺1次后放入10F血管鞘,经鞘管送入Soundstar导管至右心室流入道,构建右心室、左心室及主动脉模型。再经右侧股动脉穿刺1次后放入8F血管鞘,经鞘管送入消融导管(Biosense Webster)通过主动脉瓣逆向进入左心室。
ICE指导下Soundstar导管进入右心室后,采取心室收缩期起始状态(QRS波群顶点)的右心室、左心室、主动脉窦轮廓的超声影像,并整合到CARTO系统中(图 2),并标记SAM区域的位置。消融导管进入左心室后,可在Soundstar导管构建的左心室模型上直接标测希氏束、左束支、左前分支、左后分支电位,以及这些传导束与SAM区域的位置关系(图 1A),从而设计消融策略。消融采用功率模式(35~40 W,43 ℃),压力5~15 g,每一个消融点消融时间60~90 s(或者AI指数500~600),每个患者共计9~12消融点,整个消融过程中给予冠状窦电极7~8行S1S1 500 ms刺激,密切心电监护以免消融损伤希浦氏传导束,如传导束在SAM区域的位置,则密切关注导管的稳定性(导管贴靠的矢量箭头方向、压力稳定以及消融导管的电位稳定),采用能量及消融时间滴定法消融,如出现传导阻滞或束支传导阻滞则立即停止消融。消融术前及消融术后即刻测量LVOTG的变化。
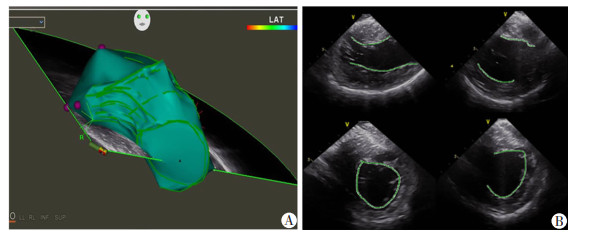
|
| A:构建的左心室三维模型;B:ICE引导下在左心室心内膜面画线(绿线)从而构建三维模型 图 2 Soundstar导管在右心室内旋转进行左心室建模 |
1.4 随访
术后继续服用β受体阻滞剂,出院前行动态心电图检查了解心律情况。出院后3、6个月来院随访,复查心脏超声、BNP及行心功能分级。于2020年6月结束随访,平均随访(5.8±2.2)个月。将消融术后3~6个月心脏超声提示静息状态下LVOTG<30 mmHg或压力阶差减少>50 mmHg分为反应组(6例),反之则为非反应组(5例)。
1.5 统计学分析采用Prism 5.0统计软件进行分析,计量资料符合正态分布的以x±s表示,连续性变量两组间比较采用独立样本t检验;Logistic回归用于确定影响肥厚型梗阻性心肌病患者消融效果的因素。
2 结果 2.1 基本资料纳入研究患者共11例,其中男3例,女8例,年龄44~77(58.36±10.82)岁,BMI (23.49±1.57)kg/m2,BNP(545.3±281.0)pg/mL,室间隔厚度(19.50±2.67) mm,心脏超声提示LVOTG(71.09±31.40)mmHg,其中3例合并阵发性心房颤动,4例合并高血压病,1例合并糖尿病,1例合并高脂血症。1例患者术前心电图提示间歇性完全性左束支阻滞。所有病例的术前纽约心功能分级(NYHA)在Ⅱ~Ⅲ级(2.36±0.20)。其中9例患者服用琥珀酸美托洛尔47.5~71.25 mg,2例患者服用富马酸比索洛尔2.5~5 mg,患者经药物治疗后症状均未得到明显改善。
2.2 射频消融效果 2.2.1 跨左心室流出道压力阶差(LVOTG)消融术后患者腔内即刻静息跨左心室流出道压力阶差为20.00±31.12 mmHg,较术前显著下降(57.09±33.44 mmHg,P=0.01),早搏激发后跨左心室流出道压力阶差为24.09±19.34 mmHg,较术前下降更显著(139.60± 44.52 mmHg,P < 0.01),见图 1B、C。
2.2.2 超声结果经过3个月的随访,心脏超声提示消融术前室间隔厚度与术后相比无明显变化(19.50±2.67 mm vs 18.15±92.84 mm,P=0.35),消融术后3个月静息状态下LVOTG较术前有所下降(52.38±35.76 mmHg vs 71.09±31.40 mmHg),但差异无统计学意义(P=0.28),6个月随访效果相似。
2.2.3 影响消融疗效的可能因素反应组患者室间隔厚度(22.02±0.77 mm)较非反应组(23.89±0.59 mm) 有更薄的趋势,反应组患者左心室直径(46.60±2.16 mm) 较非反应组(49.67±4.37 mm)有更小的趋势,反应组患者BNP(530.5±291.4 pg/mL)较非反应组(563.0±300.9 pg/mL)有更低的趋势,但差异均无统计学意义(P>0.05)。
2.3 安全性分析消融过程中有1例患者(术前间歇性完全性左束支阻滞)出现完全性左束支传导阻滞,术后及随访6个月复查24 h动态心电图仍提示完全性左束支传导阻滞。有1例患者出现假性动脉瘤,通过注射凝血酶后成功封闭破口。
2.4 临床症状改善术后6个月随访患者NYHA明显改善(1.64±0.15 vs 2.36±0.20,P < 0.01),无恶性、心律失常等,3例合并房颤同时环肺静脉消融术后无房颤复发。
3 讨论2014年ESC指南对于室间隔肌肉切除和无水酒精化学消融(alcohol septal ablation,ASA)治疗HOCM做了相同的推荐[7]。但是外科行室间隔肌肉切除需要开胸和体外循环,对于有合并症或高龄患者风险较大[8]。梅奥医学院提出,对于同时合并其他外科情况需要开胸的患者才会选择外科室间隔切除治疗HOCM[9]。
ASA通过向合适的间隔支动脉注入少量的无水酒精(1~3 mL),导致心肌梗死、疤痕形成从而引起室间隔的萎缩[10],成为大多数肥厚梗阻性心肌病患者的选择。但是,若乙醇向非间隔支动脉渗漏,则会造成严重和广泛的心肌坏死,其后果是灾难性的[11]。对于ASA治疗HOCM的大多数研究是以平均数作为结果的数据,但是在一些个体化的结果中,多达三分之一的患者通过症状和跨左心室流出道压力阶差的测量得出不满意的结果[12]。可能是由于酒精梗塞不在SAM区域,左室血流动力学不会发生显著变化。这种治疗方式的效果受限于支配室间隔的间隔支动脉的解剖,5%~15%的患者由于无法找到合适的间隔支动脉而不能接受ASA[13]。而且此种治疗方案引起房室传导阻滞甚至需要植入人工永久性心脏起搏器的风险较高。
射频消融室间隔治疗HOCM是另一种选择,既避免了外科的较大创伤,也不同于ASA。ASA造成的心肌损伤类似心肌梗死,有岛状存活心肌,易导致恶性心律失常[11]。射频消融目前主要有两种方法:食道超声和心腔内超声引导下行室间隔射频消融[14-15]。本研究采用CARTOSound是将心腔内超声与CARTO整合到一起,使用CARTOSound技术可以准确确定消融靶区域。实时的腔内超声图像整合到电解剖标测系统中,可以清楚地显示SAM区域及希浦氏传导系统,可实现精准消融并尽量避免损伤传导束。与另两种方式相比,射频消融室间隔治疗HOCM的组织损伤的体积较小,特别是对于室间隔特别肥厚的患者,消融损伤的体积可能相对更小[14]。在射频消融治疗HOCM的报道中,室间隔厚度减少均较小,只有1~2 mm,提示降低LVOTG可能并不一定需要明显减少室间隔厚度[11]。ROBERT等[14]的研究通过6个月的随访提示射频消融室间隔治疗HOCM可显著改善跨左心室流出道压力阶差。此阳性结果可能与消融过程中使用的能量(50~60 W,60 ℃)更高,消融损伤深度更大有关。西京医院团队[15]的研究结果与此类似,通过6个月的随访,LVOTG也显著下降且室间隔厚度明显变薄,心功能明显改善;他们消融能量从40 W逐渐增加到100 W,且每个点消融持续时间最多可达到12 min,因而损伤深度更大[16]。作者认为虽然射频消融的损伤面积较化学消融及外科手术切除小,但消融定位精确,足够影响到SAM区域,将SAM区域肥厚的心肌进行射频消融后,SAM区域肥厚的心肌变薄,从而可降低跨左心室流出道压力阶差;同时单位心肌的血供增多,且心脏收缩期遇到的后负荷下降,射血量也会增多,从而到达冠状动脉的血量增多,可显著改善心肌供血,心功能改善可能与此相关。
本中心通过随访3~6个月,采用的消融能量是35~40 W,每一个消融点消融时间60~90 s(AI指数500~600),每个患者共计9~12消融点,室间隔厚度与静息状态LVOTG虽均有所改善,但无统计学差异。其可能原因:病例数目较少且随访时间较短,随访比较的是静息状态下LVOTG,缺乏激发状态下LVOTG的数据。但术后NYHA改善、运动耐量增加意味着压差缩小,间接说明损伤SAM区域的心肌细胞对治疗HCM是有效的;通过亚组分析进一步显示室间隔肥厚不严重,左心室直径较小和BNP更低的病人手术效果可能更好。
另外,对于射频消融的途径,仅LAWRENZ等[5]采取经下腔静脉进入右心室侧消融室间隔的方式,本研究采用常规逆行跨主动脉瓣进入左心室侧消融的方式。我们体会,在行射频消融过程中消融导管需要通过主动脉瓣逆行进入左心室,对于室间隔特别肥厚的患者,此项操作难度较大。而且手术中需穿刺股静脉2次,股动脉1次,穿刺血管较多,容易出现血管穿刺并发症,故在操作过程中应小心谨慎,术后密切观察穿刺点情况。
综上所述,本研究采用射频消融治疗肥厚型梗阻性心肌病,随访3~6个月的静息时LVOTG无显著下降,以后可通过改良手术操作的细节、选择合适亚组病例有可能改善手术效果。HCM本身需要综合治理,充分的β受体阻滞剂应用、严密的门诊随访、肥厚的室间隔消融解除/或减轻左心室流出道梗阻都是重要的缓解。因此,选择合适病例,尤其是HCM并发房颤患者,射频消融术不失为一种有用的手段。
| [1] |
SPAZIANO M, SAWAYA F.J, LEFEVRE T. Alcohol septal ablation for hypertrophic obstructive cardiomyopathy: indications, technical aspects, and clinical outcomes[J]. J Invasive Cardiol, 2017, 29(12): 404-410. DOI:10.1016/S0140-6736(16)31321-6 |
| [2] |
MARON M S, OLIVOTTO I, ZENOVICH A G, et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction[J]. Circulation, 2006, 114(21): 2232-2239. DOI:10.1161/circulationaha.106.644682 |
| [3] |
MARON M S, OLIVOTTO I, BETOCCHI S, et al. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy[J]. N Engl J Med, 2003, 348(4): 295-303. DOI:10.1056/nejmoa021332 |
| [4] |
JENSEN M K, PRINZ C, HORSTKOTTE D, et al. Alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy: low incidence of sudden cardiac death and reduced risk profile[J]. Heart, 2013, 99(14): 1012-1017. DOI:10.1136/heartjnl-2012-303339 |
| [5] |
LAWRENZ T B, BORCHERT C, LEUNER M, et al. Endocardial radiofrequency ablation for hypertrophic obstructive cardiomyopathy: acute results and 6 months' follow-up in 19 patients[J]. J Am Coll Cardiol, 2011, 57(5): 572-576. DOI:10.1016/j.jacc.2010.07.055 |
| [6] |
COOPER R M, SHAHZAD A, NEWTON J, et al. Intra-cardiac echocardiography in alcohol septal ablation: a prospective comparative study against trans-thoracic echocardiography[J]. Echo Res Pract, 2015, 2(1): 9-17. DOI:10.1530/erp-15-0002 |
| [7] |
ELLIOTT P M, ANASTASAKIS A, BORGER M A, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2014, 35(39): 2733-2779. DOI:10.1093/eurheartj/ehu284 |
| [8] |
SOLOMON Z, BRETON C, ROWIN E J, et al. Surgical approaches to hypertrophic obstructive cardiomyopathy[J]. Semin Thorac Cardiovasc Surg, 2018, 30(2): 125-128. DOI:10.1053/j.semtc |
| [9] |
CALDERON-ROJAS R, NGUYEN A, NISHIMURA R A, et al. Is there referral bias in outcomes of septal myectomy for hypertrophic cardiomyopathy?[J]. J Thorac Cardiovasc Surg, 2020. DOI:10.1016/j.jtc |
| [10] |
VESELKA J, ANAVEKAR N S, CHARRON P. Hypertrophic obstructive cardiomyopathy[J]. Lancet, 2017, 389(10075): 1253-1267. DOI:10.1016/s0140-6736(16)31321-6 |
| [11] |
陈冉, 蒋志新, 单其俊. 室间隔射频消融术: 治疗梗阻性肥厚型心肌病的新选择[J]. 中华心血管病杂志, 2017, 45(3): 186-189. CHEN R, JIANG Z X, SHAN Q J. Radiofrequency ablation of the ventricular septum: a new option for the treatment of obstructive hypertrophic cardiomyopathy[J]. Chin J Cardiol, 2017, 45(3): 186-189. DOI:10.3760/cma.j.issn.0253-3758.2017.03.004 |
| [12] |
YANG H N, YANG Y, XUE Y H, et al. Efficacy and safety of radiofrequency ablation for hypertrophic obstructive cardiomyopathy: A systematic review and meta-analysis[J]. Clin Cardiol, 2020, 43(5): 450-458. DOI:10.1002/clc.23341 |
| [13] |
CHAN W, WILLIAMS L, KOTOWYCZ M A, et al. Angiographic and echocardiographic correlates of suitable septal perforators for alcohol septal ablation in hypertrophic obstructive cardiomyopathy[J]. Can J Cardiol, 2014, 30(8): 912-919. DOI:10.1016/j.cjca.2014.04.008 |
| [14] |
COOPER R M, SHAHZAD A, HASLETON J, et al. Radiofrequency ablation of the interventricular septum to treat outflow tract gradients in hypertrophic obstructive cardiomyopathy: a novel use of CARTOSound© technology to guide ablation[J]. Europace, 2016, 18(1): 113-120. DOI:10.1093/europace/euv302 |
| [15] |
LIU L W, LI J, ZUO L, et al. Percutaneous intramyocardial septal radiofrequency ablation for hypertrophic obstructive cardiomyopathy[J]. J Am Coll Cardiol, 2018, 72(16): 1898-1909. DOI:10.1016/j.jacc.2018.07.080 |
| [16] |
LIU L, LIU B, LI J, et al. Percutaneous intramyocardial septal radiofrequency ablation of hypertrophic obstructive cardiomyopathy: a novel minimally invasive treatment for reduction of outflow tract obstruction[J]. EuroIntervention, 2018, 13(18): e2112-e2113. DOI:10.4244/EIJ-D-17-00657 |




