缺血再灌注(ischemic reperfusion,I/R)是导致急性肾损伤(acute kidney disease,AKI)的一个常见原因,主要受损部位为肾小管,具有较高的发病率和死亡率,AKI后慢性肾脏病(chronic kidney disease,CKD)的发生率显著升高[1]。尽管在过去10年中,AKI向CKD进展的机制已有大量研究,但有效的治疗策略仍然匮乏。
血管非炎症分子1(vascular noninflammatory molecule-1,Vanin-1)是一种糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定的泛酰巯乙胺酶,是一种重要的氧化应激感受器,高表达于肾脏、肝脏和肠道[2]。BERRUYER等[3]研究发现:Vanin-1基因敲除鼠对氧化应激引起损伤的耐受能力明显增强。而既往已有报道指出:在I/R导致的AKI肾功能恢复过程中,活性氧(reactive oxygen species,ROS)水平持续升高,提示氧化应激损伤持续存在,与此同时,TGF-β表达水平持续升高[4]。TGF-β是公认的促进肾间质纤维化的关键因素之一,肾间质纤维化最终可导致肾功能无法恢复,是AKI走向CKD的主要的病理表现之一。那么,Vanin-1是否可调控I/R后的肾组织TGF-β的表达进而调控肾功能的恢复过程?本课题组通过建立I/R肾损伤模型,下调Vanin-1表达,评估各组小鼠肾组织Vanin-1表达水平、组织损伤严重程度及TGF-β表达水平,以探索Vanin-1在肾缺血再灌注损伤后功能恢复过程中的作用及机制。
1 材料与方法 1.1 实验动物BALB/c野生型小鼠(8周龄),由本院实验动物中心提供,动物实验方案获得本院伦理委员会批准(医研伦审2014第88号)。Vanin-1基因敲除鼠与野生型小鼠杂交,最终获得同窝出生野生型和Vanin-1基因敲除鼠[5],用于实验。
1.2 实验分组、造模及标本采集实验分组:选取8周龄BALB/c野生型、Vanin-1基因敲除雄鼠各12只,体质量22~25 g,采用完全随机法分为假手术组、缺血再灌注组、敲除组、敲除+缺血再灌注组,每组6只。
造模方法:手术组小鼠全麻后仰卧位固定于手术台上,术区备皮,碘酒、75%酒精消毒,行腹部正中切口,暴露双侧肾蒂,血管夹夹闭肾蒂,肾脏由粉红色逐渐变为绛紫色,35 min后松开血管夹,肾脏血供恢复,关腹;敲除+缺血再灌注组处理方法同前;假手术组仅暴露双侧肾蒂;敲除组处理方法同假手术组。术后,小鼠放于保温箱内, 密切观察小鼠生命体征。
标本采集:造模后0、3、14 d,经眼球取血,收集血浆送本院检验科检测血清尿素氮、肌酐,收集尿液及肾组织标本。
1.3 PAS染色明确肾组织损伤程度石蜡标本切片,60 ℃烤片20 min,二甲苯、无水乙醇、95%乙醇、75%乙醇依次脱蜡复水, 清水冲洗5 min, 高碘酸浸染10 min, 清水冲洗5 min,PAS滴染37 ℃ 30 min,清水冲洗5 min,苏木精浸染5 min,清水冲洗5 min,盐酸乙醇分化3 s,清水冲洗5 min,乙醇脱水20 s,二甲苯透明5 min,中性树脂封片。肾脏损伤判定方法:光镜下对皮髓交接区肾小管进行损伤评分。急性损伤评分标准[6]:根据肾小管上皮细胞坏死、刷状缘脱落、管型形成、肾小管扩张占肾小管总数百分比进行评价,0分,无损伤;1分,≤10%;2分,>10%~25%;3分,>25%~45%;4分,>45%~75%;5分,>75%。慢性损伤评分标准[7]:肾小管萎缩、纤维化所占百分比, 0分,无纤维化;1分,< 5%;2分,5%~ < 25%;3分,25%~ < 50%;4分,≥50%。每张切片观察10个连续视野,双盲条件下由实验者和病理医师观察病理变化,取平均值作为衡量肾小管损伤的指标。
1.4 免疫组化检测肾组织Vanin-1表达水平石蜡标本切片,60 ℃烤片20 min,二甲苯、无水乙醇、95%乙醇、75%乙醇依次脱蜡复水,清水冲洗5 min,高压抗原修复,PBS浸泡5 min,山羊血清封闭30 min,PBS浸洗5 min×3次,用免疫组化笔以组织为中心画圈标记,3%过氧化氢36 ℃ 15 min,PBS浸洗5 min×3次,滴加一抗Vanin-1(浓度1∶100),4 ℃盒过夜,次日湿盒置于室温复温30 min,PBS浸洗5 min×3次,滴加二抗,湿盒内37 ℃孵育40 min,PBS浸洗5 min×3次,DAB工作液显微镜下显色,苏木精染液浸泡5 min, 蒸馏水冲洗5 min,盐酸乙醇分化3 s,蒸馏水漂洗5 min,95%~100%乙醇梯度脱水,二甲苯透明,中性树脂封片。
1.5 肾小管上皮细胞的提取及培养参照文献[8]报道的方法,将2~3周龄BALB/c野生型和Vanin-1基因敲除雄性鼠断颈处死,无菌获取双肾,将肾脏皮质与髓质分离,留取肾皮质在培养皿中用组织剪充分剪碎,与低糖DMEM混合后,移入离心管中离心,去除上清,加入胶原酶后,置于37 ℃摇床消化30 min,双重过滤含DMEM溶液的肾皮质,终止液反复冲洗终止消化。将过滤液收集于大培养皿中,反复吹打后离心,去除上清,在细胞沉淀中加入原代培养基,反复吹打后接种,置入37 ℃、5%CO2培养箱孵育,12 h内不宜晃动培养瓶。48 h后首次更换培养基,此后隔天更换1次。按文献[7]报道的方法对肾小管上皮细胞进行鉴定,细胞纯度达90%以上。
1.6 缺氧-复氧细胞模型的建立原代肾小管上皮细胞传代至第2代用于实验,分别设置:对照组、对照+损伤组、敲除组、敲除+损伤组。两损伤组予以缺氧48 h(1%O2,94%N2,5%CO2),复氧24 h(5%CO2,95%空气)后分别收上清和细胞。对照组、敲除组不予任何处理。每组实验重复3次。
1.7 Western blot检测各组肾小管上皮细胞Vanin-1表达水平制备蛋白样品,按照蛋白含量的测定试剂盒步骤检测光密度值(BCA定量),计算蛋白含量和上样量,SDS-PAGE电泳,转膜,5%脱脂牛奶封闭,加入一抗Vanin-1(浓度1∶800,货号:21745-1-AP,Proteintech)或GAPDH一抗(浓度1∶10 000,货号:60004-1-lg),4 ℃过夜,次日室温下TBST脱色,显影液显影。
1.8 ELISA检测各组小鼠尿液及各组肾小管上皮细胞上清TGF-β表达水平利用ELISA试剂盒标准流程(上海恒远生物科技有限公司)检测小鼠尿液和细胞培养上清TGF-β水平。不同血清样品分别加入96孔板中,37 ℃孵育30 min,洗涤液清洗5次后,加入50 μL的酶标试剂,37 ℃孵育30 min,洗涤液清洗5次,每孔加入显色液A 50 μL,再加入显色液B 50 μL,37 ℃避光显色10 min,最后加入终止液50 μL,然后于15 min内利用ELISA检测仪检测。
1.9 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,采用双因素或多因素方差分析,两组多重比较采用Bonferroni法,P < 0.05为差异有统计学意义。
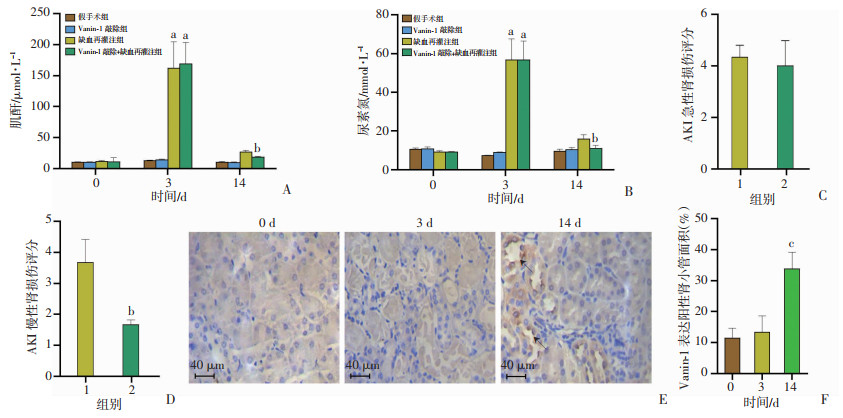
2 结果 2.1 基因敲除Vanin-1可促进I/R肾损伤小鼠肾脏结构和功能恢复I/R损伤后第3天,与假手术组相比,缺血再灌注组、敲除+缺血再灌注组血清肌酐、尿素氮水平明显升高(P < 0.01),PAS染色提示可见大量肾小管上皮细胞坏死、脱落等,但缺血再灌注组、敲除+缺血再灌注组两组小鼠血清肌酐、尿素氮水平无明显差异,PAS染色提示两组肾组织损伤无明显差异。I/R后第14天,敲除+缺血再灌注组血清肌酐、尿素氮恢复速度均明显快于缺血再灌注组(P < 0.05),PAS肾组织慢性损伤评分明显低于缺血再灌注组(P < 0.05,图 1A~D)。免疫组化结果提示:I/R肾损伤第14天,缺血再灌注组肾组织Vanin-1表达明显升高(P < 0.01,图 1E、F), 且主要表达于受损肾小管上皮细胞。
|
|
1:缺血再灌注组;2:敲除+缺血再灌注组;a:P < 0.01,与假手术组比较;b:P < 0.05,与缺血再灌注组比较;c:P < 0.01,与0 d比较 A、B:分别为各组术后不同时间血清肌酐、尿素氮水平;C:损伤后第3天急性肾脏损伤评分;D:缺血再灌注损伤后第14天慢性肾脏损伤评分;E:免疫组化检测缺血再灌注损伤后肾组织Vanin-1表达箭头示Vanin-1表达;F:缺血再灌注损伤后肾组织Vanin-1表达阳性肾小管面积 图 1 基因敲除Vanin-1可促进I/R肾损伤小鼠肾脏结构和功能恢复 |
2.2 Vanin-1可调控I/R肾损伤小鼠尿中TGF-β水平
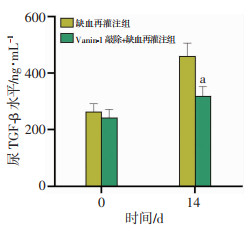
I/R损伤后第14天,敲除+缺血再灌注组尿中TGF-β水平明显低于缺血再灌注组(P < 0.05,图 2), 提示Vanin-1可调节TGF-β分泌。
|
| a:P < 0.05,与缺血再灌注组比较 图 2 Vanin-1敲除I/R肾损伤小鼠尿中TGF-β水平变化 |
2.3 Vanin-1可促进肾小管上皮细胞分泌TGF-β
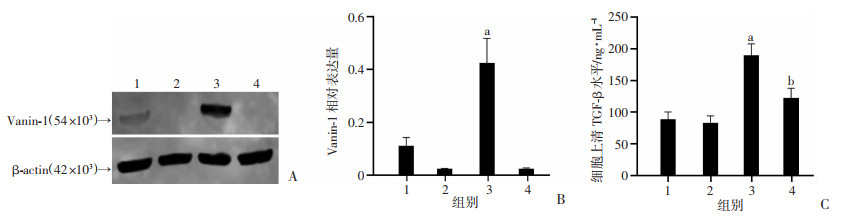
体内实验结果提示Vanin-1可通调控TGF-β分泌,延缓肾脏功能恢复。体外实验结果显示:对照+损伤组肾小管上皮细胞Vanin-1表达明显升高(P < 0.01),对照+损伤组肾小管上皮细胞上清TGF-β水平明显高于敲除+损伤组(P < 0.05,图 3),提示Vanin-1可促进TGF-β表达。
|
|
1:对照组;2:敲除组;3:对照+损伤组;4:敲除+损伤组;a:P < 0.01,与对照组比较;b:P < 0.05,与对照+损伤组比较 A:Western blot检测各组细胞Vanin-1蛋白表达;B:各组细胞Vanin-1相对表达量;C:各组细胞上清TGF-β表达水平 图 3 Vanin-1可促进肾小管上皮细胞分泌TGF-β |
3 讨论
I/R是导致AKI的常见原因,针对AKI,目前主要以对症支持治疗为主,缺乏有效的治疗手段,AKI后的肾脏修复机制是目前肾脏病学者研究的重点。本研究通过血管夹夹闭双侧肾蒂35 min,成功构建了I/R重度肾损伤模型,发现I/R损伤后第14天,小鼠肾组织Vanin-1表达水平明显升高。为进一步明确Vanin-1在I/R后肾脏恢复过程中的作用,本研究利用Vanin-1基因敲除鼠建立I/R肾损伤模型,发现在I/R损伤后第3天,缺血再灌注组与敲除+缺血再灌注组血清肌酐、尿素氮水平无明显差异,PAS染色提示两组肾脏损伤严重程度无明显差异。但到I/R损伤后第14天,敲除+缺血再灌注组血清肌酐、尿素氮水平明显低于缺血再灌注组,PAS提示肾组织慢性化改变明显轻于缺血再灌注组,证明基因敲除Vanin-1可促进I/R损伤后肾脏结构和功能恢复。
Vanin-1是一种在肾、肺、肝脏等组织广泛表达泛酰巯基乙胺酶[1-2],在机体氧化应激反应中发挥着重要的调节作用[9]。目前已有动物实验证实:线粒体功能失调在I/R肾损伤后的9个月里持续存在,功能失调的线粒体可持续产生过量的活性氧,过量ROS产生可导致氧化应激损伤,予以线粒体保护剂可减少ROS产生,减轻氧化应激损伤,进而明显减轻AKI后的间质炎症水平、间质纤维化等[3],提示氧化应激损伤在I/R肾脏损伤后持续存在,且促进了AKI向CKD的进展。既往研究报道Vanin-1是调节氧化应激损伤的关键分子[2]。为进一步明确Vanin-1是否可调控I/R后的肾脏结构和功能恢复,本研究利用Vanin-1基因敲除和野生型小鼠同时建立I/R肾损伤模型,于造模后第3、14天检测肾脏功能及组织损伤严重程度,发现在第3天,缺血再灌注组与敲除+缺血再灌注组肾脏功能和组织损伤严重程度无明显差异,但到第14天,Vanin-1基因敲除鼠肾脏结构和功能损伤较野生型明显降低,提示基因敲除Vanin-1可促进肾脏结构和功能恢复。
有研究报道:Vanin-1可通过减少还原性谷胱甘肽导致ROS产生增多,进而通过脂质过氧化产物4-羟基壬烯醛(4-hydroxy-2, 3-nonenal,HNE)上调TGF-β的表达[10]。而I/R损伤后肾组织TGF-β表达明显上调[11],TGF-β是导致肾小球、肾小管间质纤维化的重要致病因素[14],进而导致正常肾组织结构消失,最终进展为终末期肾脏疾病。为了进一步明确Vanin-1是否也可以通过上调I/R损伤后TGF-β水平延缓肾脏结构和功能恢复,本研究检测各组小鼠尿液中TGF-β水平,发现Vanin-1基因敲除鼠尿中TGF-β水平明显降低,提示Vanin-1可能是通过调控TGF-β分泌调控肾脏结构和功能恢复。在此基础上,本研究细胞实验结果显示:基因敲除Vanin-1可显著降低细胞上清TGF-β表达水平,证明Vanin-1可通过促进肾脏TGF-β表达,延缓肾脏功能恢复。
综上所述,本研究结果提示Vanin-1可通过促进肾小管上皮细胞TGF-β分泌,延缓I/R后肾脏功能恢复。应用Vanin-1抑制剂有望成为预防AKI向CKD进展的有效治疗措施。
| [1] |
SATO Y, TAKAHASHI M, YANAGITA M. Pathophysiology of AKI to CKD progression[J]. Semin Nephrol, 2020, 40(2): 206-215. DOI:10.1016/j.semnephrol.2020.01.011 |
| [2] |
CHEN S Y, ZHANG W X, SUN C, et al. Systemic nanoparticle-mediated delivery of pantetheinase vanin-1 regulates lipolysis and adiposity in abdominal white adipose tissue[J]. Adv Sci, 2020, 7(14): 2000542. DOI:10.1002/advs.202000542 |
| [3] |
BERRUYER C, MARTIN F M, CASTELLANO R, et al. Vanin-1-/- mice exhibit a glutathione-mediated tissue resistance to oxidative stress[J]. Mol Cell Biol, 2004, 24(16): 7214-7224. DOI:10.1128/MCB.24.16.7214-7224.2004 |
| [4] |
SZETO H H, LIU S Y, SOONG Y, et al. Mitochondria protection after acute ischemia prevents prolonged upregulation of IL-1β and IL-18 and arrests CKD[J]. J Am Soc Nephrol, 2017, 28(5): 1437-1449. DOI:10.1681/asn.2016070761 |
| [5] |
CHEN K H, CHEN J, WANG L, et al. Parkin ubiquitinates GATA4 and attenuates the GATA4/GAS1 signaling and detrimental effects on diabetic nephropathy[J]. FASEB J, 2020, 34(7): 8858-8875. DOI:10.1096/fj.202000053r |
| [6] |
CHEN J C, CHEN J K, HARRIS R C. Deletion of the epidermal growth factor receptor in renal proximal tubule epithelial cells delays recovery from acute kidney injury[J]. Kidney Int, 2012, 82(1): 45-52. DOI:10.1038/ki.2012.43 |
| [7] |
GRGIC I, CAMPANHOLLE G, BIJOL V, et al. Targeted proximal tubule injury triggers interstitial fibrosis and glomerulosclerosis[J]. Kidney Int, 2012, 82(2): 172-183. DOI:10.1038/ki.2012.20 |
| [8] |
CHEN J, CHEN K H, FU B Q, et al. Isolation and identification of senescent renal tubular epithelial cells using immunomagnetic beads based on DcR2[J]. Exp Gerontol, 2017, 95: 116-127. DOI:10.1016/j.exger.2017.04.008 |
| [9] |
PITARI G, MALERGUE F, MARTIN F, et al. Pantetheinase activity of membrane-bound Vanin-1: lack of free cysteamine in tissues of Vanin-1 deficient mice[J]. FEBS Lett, 2000, 483(2/3): 149-154. DOI:10.1016/s0014-5793(00)02110-4 |
| [10] |
LENARDUZZI G, SCAVAZZA A, BIASI F, et al. The lipid peroxidation end product 4-hydroxy-2, 3-nonenal up-regulates transforming growth factor beta1 expression in the macrophage lineage: a link between oxidative injury and fibrosclerosis[J]. Faseb J, 1997, 11(11): 851-857. DOI:10.1111/j.1432-1033.1997.00602.x |
| [11] |
ZHOU C, LIU J, GE Y, et al. Remote ischemic preconditioning ameliorates renal fibrosis after ischemia-reperfusion injury via transforming growth factor beta1 (TGF-β1) signalling pathway in rats[J]. Med Sci Monit, 2020, 26. DOI:10.12659/MSM.919185 |




