近年来,我国心血管疾病发病率逐年攀升,尤其是冠状动脉粥样硬化性疾病。尽管经皮冠状动脉腔内成形术、经皮冠状动脉支架植入术等血管介入技术可有效再通梗阻血管,实现血流重建和再灌注,但术中血管机械损伤、支架术后再狭窄,导致患者远期生存率下降[1]。血管机械损伤和支架术后再狭窄的主要病理生理学改变为受损的内皮细胞、浸润炎症细胞等释放大量生长因子和炎症因子,刺激血管平滑肌细胞表型转化和增殖迁移,表型转化主要表现为血管平滑肌细胞收缩型标记分子(如平滑肌肌动蛋白α-SMA、钙调蛋白calponin、结蛋白desmin等)表达下调,合成型标记分子(如波形蛋白Vimentin、骨桥蛋白OPN、基质金属蛋白酶MMP等)表达上调,释放大量细胞外基质,血管中层平滑肌细胞增殖并迁移至内膜,血管内膜增厚,导致血管狭窄和血管重构[2]。
1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)在心血管系统中有着重要作用,参与内皮细胞稳定、血管新生、心肌肥厚、动脉粥样硬化、心脏干细胞归巢、心肌缺血再灌注等病理生理学过程[3-5]。1-磷酸鞘氨醇受体(sphingosine-1-phosphate receptor,S1PR)分为1~5型,在内皮细胞主要表达S1PR1、S1PR2和S1PR3;在血管平滑肌细胞各种亚型中均有表达,主要为S1PR2;在心肌细胞表达S1PR1、S1PR2和S1PR3[6]。S1PR均属G蛋白偶联受体,其引起的细胞内信号转导途径有:①Gi激活Ras/ERK通路,促进细胞增殖;激活PI3K/Akt通路,抑制凋亡;激活PI3K/Rac通路,促进细胞骨架结构重排和迁移。②G12/13激活Rho/ROCK通路,抑制Rac途径,抑制细胞增殖迁移。③Gq激活PLC途径,增加细胞内钙离子浓度[7]。S1PR1主要激活Gi通路,促进细胞增殖、迁移、维持血管内皮屏障、促进正常血管发育;S1PR2激活Gi、G12/13、Gq,抑制细胞增殖、迁移、血管新生,促进血管收缩;S1PR3激活Gi、G12/13、Gq通路,协同S1PR1和S1PR2发挥作用,调节内皮屏障完整性,调节血管舒缩,促进正常血管发育。在血管成熟过程中,血管平滑肌细胞S1PR1表达明显减少,主要表达S1PR2[8]。研究表明,S1PR2抑制血管平滑肌细胞增殖迁移,S1PR2-/-小鼠颈动脉结扎后,新生内膜增厚更加严重[9]。而S1PR1在动脉损伤后血管内膜增生中的作用及具体机制尚不明确。因此,本研究采用导丝损伤诱导小鼠颈动脉内膜增生模型,腺相关病毒过表达S1PR1,观察S1PR1在血管内膜增生中的作用;进一步通过细胞实验,探讨S1PR1在血管平滑肌细胞表型转化、增殖、迁移中的作用及可能机制,为血管内膜增生的治疗提供指导。
1 材料与方法 1.1 实验动物和试剂40只雄性C57BL/6小鼠,SPF级,6~8周龄,购自四川省人民医院实验动物研究所[生产许可证编号SCXK(川)2018-15]。S1P购自美国Sigma公司。AAV2型腺相关病毒(AAV-LacZ和AAV-S1PR1)和腺病毒(Ad-LacZ和Ad-S1PR1)购自汉恒公司。实验相关一抗均购自Abclonal或Proteintech公司。所需金属导丝(0.38 mm in diameter, No. C-SF-15-15)购自美国Bloomington Cook公司。免疫组化及免疫荧光二抗购自碧云天公司。Transwell板购自美国Corning公司。Cell-LightTM EdU染色试剂盒购自中国广州RiboBio公司。
1.2 实验动物分组40只小鼠采用随机数字表法分为4组:①假手术+ AAV-LacZ组(AAV-LacZ),10只,尾静脉注射AAV-LacZ病毒,2周后行假手术(仅切开颈部皮肤,未行颈动脉损伤);②假手术+AAV-S1PR1组(AAV-S1PR1),10只,尾静脉注射AAV-S1PR1病毒,2周后行假手术(仅切开颈部皮肤,未行颈动脉损伤);③导丝损伤+AAV-LacZ组(Injury+AAV-LacZ),10只,尾静脉注射AAV-LacZ病毒,2周后行颈动脉导丝损伤手术;④导丝损伤+AAV-S1PR1组(Injury+AAV-S1PR1),10只,尾静脉注射AAV-S1PR1病毒,2周后行颈动脉导丝损伤手术。各组尾静脉注射1×1011 PFU AAV2病毒液。
1.3 颈动脉导丝损伤术导丝损伤组小鼠3%戊巴比妥钠麻醉(80 mg/kg),消毒后行颈部前正中切口,分离颈外动脉和颈内动脉。结扎颈外动脉,血管夹暂时夹闭颈内动脉和颈总动脉。显微剪于颈外动脉结扎线上方剪一横向小口,插入直径0.38 mm金属导丝进入颈总动脉,旋转进退5~6次后退出导丝。在切口近心端结扎颈外动脉,松开颈内动脉和颈总动脉血管夹,剪断线头,缝合皮肤。假手术组除不插入导丝和旋转进退外,其他操作与导丝损伤组均相同。
1.4 组织学检测颈动脉导丝损伤4周后,取手术侧颈总动脉,固定包埋后行HE染色。免疫组化染色:组织切片脱蜡置水后,柠檬酸钠高温15 min进行抗原修复,3% H2O2封片1 h,阻断内源性过氧化物酶干扰,山羊血清封闭1 h,滴加PCNA一抗(1 :100)或IL-6一抗(1 :100),4 ℃封闭过夜,PBS洗涤加生物素化二抗,室温孵育0.5 h,PBS洗3遍。辣根过氧化物酶抗生物素三抗,室温孵育0.5 h,PBS洗3遍。DAB显色,阳性表达区域为黄褐色。组织免疫荧光:α-SMA一抗(1 :150),FITC标记二抗(1 :100),DAPI染细胞核,阳性表达区域呈绿色。
1.5 小鼠原代主动脉平滑肌细胞分离培养取3月龄的C57BL/6普通小鼠6只,购自四川省人民医院实验动物研究所。麻醉后打开胸腔,取胸主动脉,用眼科剪去除肋间动脉分支,轻柔去除血管外层脂肪组织。用生理盐水冲洗血管腔后,放入1 mL Ⅱ型胶原酶溶液(2 mg/mL)中浸泡15 min,用眼科镊剥除血管外膜(呈脱袜状),勿牵拉血管,纵行剪开血管,用无菌棉签刮除内皮细胞,将中层平滑肌组织剪碎,放入3 mL消化液(2 mg/mL Ⅱ型胶原酶+1% BSA)中,室温摇床上消化1.5 h。1 000×g离心10 min后,弃上清。加入5 mL含20%胎牛血清和100 U/L双抗的DMEM培养基重悬,将组织块平铺在培养瓶瓶底,竖立培养瓶,使组织稍干,紧贴于培养瓶底。20 min后,将培养瓶放平,使培养基浸润组织块,动作轻柔,勿使组织块飘起。培养箱培养7 d,观察血管平滑肌细胞生长情况。用α-SMA(1 :200)鉴定原代小鼠主动脉平滑肌细胞,FITC标记荧光二抗染色。
1.6 细胞实验小鼠原代主动脉平滑肌细胞消化后,接种于6孔板,融合度达到30%~40%时,实验分4组:①saline+ Ad-LacZ组加入腺病毒Ad-LacZ(MOI=100)孵育12 h;②saline+Ad-S1PR1组加入腺病毒Ad-S1PR1(MOI=100)孵育12 h;③S1P+Ad-LacZ组加入腺病毒Ad-LacZ (MOI=100)孵育12 h后换含1%胎牛血清的DMEM新鲜培养基1 mL,加入S1P(1 μmol/L)继续孵育24 h;④S1P+Ad-S1PR1组加入腺病毒Ad-S1PR1 (MOI=100)孵育12 h后换含1%胎牛血清的DMEM新鲜培养基1 mL,加入S1P(1 μmol/L)继续孵育24 h。
1.7 Western blot检测取各组小鼠颈动脉或原代血管平滑肌细胞,加入RIPA裂解液后匀浆,BCA法测定匀浆蛋白浓度,加入6×loading buffer,上样后行SDS-PAGE胶电泳,转膜2 h。5% BSA封闭2 h,相应一抗(1 :1 000)4 ℃孵育过夜。TBST洗3次后,二抗室温孵育2 h,加入显影液后曝光。采用Gel-Pro Analyzer 4.0进行分析。
1.8 细胞免疫荧光24孔板培养原代血管平滑肌细胞,各组细胞处理同1.7。弃去培养基,PBS洗3遍;4%多聚甲醛固定15 min,PBS洗3遍;0.5% TritonX-100室温通透20 min,PBS洗3遍;5%BSA封闭2 h,PBS洗3遍;加入α-SMA一抗工作液(1 :200)75 μL,4 ℃孵育过夜,PBS洗3遍;加入FITC标记荧光二抗,室温孵育1.5 h,PBS洗3遍;DAPI复染5 min,PBS洗3遍,荧光显微镜拍照。
1.9 EdU染色采用Cell-LightTM EdU染色试剂盒检测增殖活性。细胞融合度达到40%~50%时,换含1%胎牛血清的DMEM新鲜培养基1 mL,加入腺病毒Ad-LacZ或Ad-S1PR1(MOI=100)孵育12 h,加入S1P(1 μmol/L)孵育1 h后,加EdU(终浓度10 μmol/L)继续孵育24 h,固定细胞,DAPI染细胞核,倒置显微镜观察并拍照。红染细胞核为阳性,用Image Pro Plus 6.0观察并计算EdU阳性细胞比例,检测细胞增殖活性。
1.10 划痕实验细胞融合度达到40%~50%时,加入腺病毒Ad-LacZ或Ad-S1PR1(MOI=100)孵育,待细胞长至90%左右,用高压灭菌枪头在6孔板中央区域作一条平整划痕,加入S1P(1 μmol/L)孵育24 h后,Image Pro Plus 6.0测定并计算细胞迁移距离。
1.11 Transwell实验选用8 μm孔径Transwell板进行相关实验。上室加入200 μL含有2×104细胞和腺病毒(MOI=100)的悬液,下室加入750 μL含1%胎牛血清培养基,培养12 h。弃去上室和下室培养基,上室加入200 μL新鲜无血清培养基,下室加入750 μL新鲜无血清培养基(含终浓度为1 μmol/L的S1P),继续孵育24 h。PBS洗涤Transwell小室后,棉签轻轻擦除上室内侧细胞,甲醇固定后DAPI染色,倒置显微镜下拍照并进行染色细胞计数。
1.12 统计学分析采用SPSS 22.0统计软件进行分析,数据以x±s表示。确定为正态分布后,两组间比较采用t检验,多组间比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 过表达S1PR1加重导丝损伤后血管内膜增生导丝损伤4周后,成功诱导小鼠颈动脉内膜增生。与AAV-LacZ组相比,Injury+AAV-LacZ组小鼠颈动脉可见明显血管重构:血管内膜增生,血管平滑肌细胞表型转化和内膜细胞增殖(图 1A)。HE染色可见显著内膜增生和管腔狭窄(图 1A、B),免疫组化和免疫荧光观察显示:损伤后血管平滑肌细胞α-SMA表达下调(P < 0.05,图 1A、C),内膜增殖标记蛋白PCNA阳性细胞比例上调(P < 0.05,图 1A、D);同时,Western blot检测发现导丝损伤后颈动脉S1PR1表达上调(P < 0.05),AAV-S1PR1组和Injury+AAV-S1PR1组颈动脉组织S1PR1表达均上调(P < 0.05,图 2)。与Injury+AAV-LacZ组相比,Injury+AAV-S1PR1组血管内膜增生,血管平滑肌细胞表型转化和内膜细胞增殖现象更加严重(图 1)。

|
| A:各组颈动脉组织形态学检测;B:各组颈动脉内膜/(内膜+中膜)厚度比值;C:各组颈动脉组织α-SMA免疫荧光光密度值;D:各组颈动脉组织PCNA阳性细胞比例 1:AAV-LacZ组;2:AAV-S1PR1组;3:Injury+AAV-LacZ组:4:Injury+AAV-S1PR1组 a:P < 0.05,与AAV-LacZ组比较;b:P < 0.05,与Injury+AAV-LacZ组比较 图 1 过表达S1PR1加重导丝损伤后血管内膜增生 |
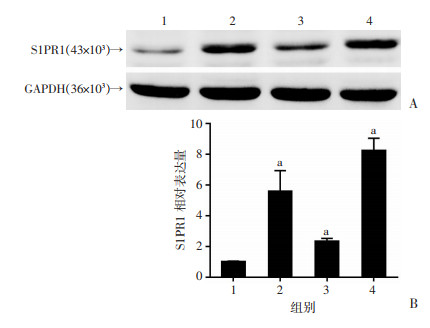
|
| 1:AAV-LacZ组;2:AAV-S1PR1组;3:Injury+AAV-LacZ组:4:Injury+AAV-S1PR1组;a:P < 0.05,与AAV-LacZ组比较 A:Western blot检测结果; B:半定量分析 图 2 Western blot检测各组颈动脉组织S1PR1表达及半定量分析 |
2.2 S1PR1加重S1P诱导的小鼠原代血管平滑肌细胞表型转化
成功分离培养小鼠原代血管平滑肌细胞,经α-SMA染色鉴定,纯度在95%以上(图 3C)。Western blot检测结果显示:与saline+Ad-LacZ组(对照)相比,S1P+Ad-LacZ组α-SMA表达上调(P < 0.05),Vimentin和MMP-9表达也上调(P < 0.05)。利用Ad-S1PR1诱导原代血管平滑肌细胞S1PR1高表达(P < 0.05)。与S1P+ Ad-LacZ组相比,S1P+Ad-S1PR1组α-SMA表达水平下降,Vimentin和MMP-9表达水平进一步上升(P < 0.05),出现显著的血管平滑肌细胞表型转化现象(图 3A、B)。而细胞免疫荧光发现类似变化(图 3D)。结果提示:S1PR1加重S1P诱导的小鼠原代血管平滑肌细胞表型转化。
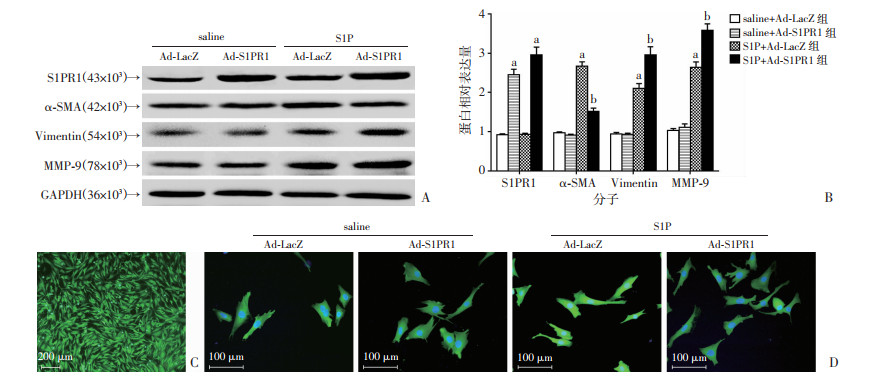
|
| A、B:Western blot检测各组原代血管平滑肌细胞表型转化相关蛋白表达及半定量分析 a:P < 0.05,与saline+Ad-LacZ组比较;b:P < 0.05,与S1P+Ad-LacZ组比较;C:α-SMA染色鉴定原代血管平滑肌细胞;D:细胞免疫荧光检测各组原代血管平滑肌细胞α-SMA表达水平 绿色:α-SMA;蓝色:DAPI 图 3 S1PR1加重S1P诱导的小鼠原代血管平滑肌细胞表型转化 |
2.3 S1PR1促进S1P诱导的小鼠原代血管平滑肌细胞增殖和迁移
Western blot检测结果显示:与saline+Ad-LacZ组相比,S1P+Ad-LacZ组增殖标志性蛋白分子PCNA和Cyclin D1表达上调(P < 0.05);与S1P+Ad-LacZ组相比,S1P+Ad-S1PR1组PCNA和Cyclin D1表达水平进一步升高(P < 0.05,图 4A、B)。EdU染色结果显示:与saline+Ad-LacZ组相比,S1P+Ad-LacZ组阳性细胞比例上升(P < 0.05),说明S1P可诱导血管平滑肌细胞增殖;过表达S1PR1后,与S1P+Ad-LacZ组相比,S1P+Ad-S1PR1组EdU染色阳性细胞比例进一步上升(P < 0.05,图 4C、F)。划痕实验和Transwell实验结果显示:与saline+Ad-LacZ组相比,S1P+Ad-LacZ组血管平滑肌细胞迁移能力增强;与S1P+Ad-LacZ组相比,S1P+Ad-S1PR1组血管平滑肌细胞迁移能力进一步增强(P < 0.05,图 4D、E、G、H)。结果提示:S1P可诱导血管平滑肌细胞增殖和迁移,过表达S1PR1后,S1P诱导小鼠原代血管平滑肌细胞增殖和迁移能力进一步增强。
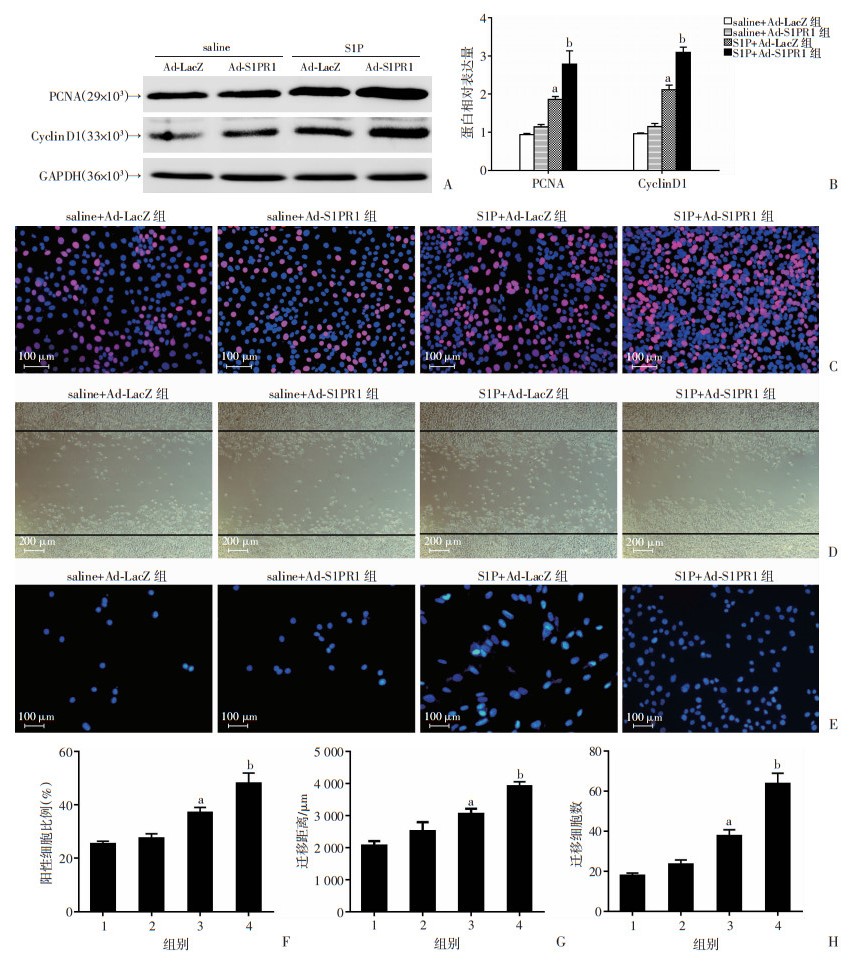
|
| A、B:Western blot检测各组原代血管平滑肌细胞增殖相关蛋白表达水平及半定量分析;C、F:EdU染色观测各组原代血管平滑肌细胞增殖能力及相应定量分析 红色:EdU;蓝色:DAPI;D、G:划痕实验检测各组原代血管平滑肌细胞迁移能力及迁移距离分析;E、H:Transwell实验检测各组原代血管平滑肌细胞迁移能力及迁移细胞数分析 1:saline+Ad-LacZ组;2:saline+Ad-S1PR1组;3:S1P+Ad-LacZ组;4:S1P+Ad-S1PR1组;a:P < 0.05,n=3,与saline+Ad-LacZ组比较;b:P < 0.05,与S1P+Ad-LacZ组比较 图 4 S1PR1促进S1P诱导的小鼠原代血管平滑肌细胞增殖和迁移 |
2.4 S1P/S1PR1激活血管平滑肌细胞IL-6/STAT3通路从而促进血管内膜增生
动物组织免疫荧光检测结果显示:与AAV-LacZ组相比,Injury+AAV-LacZ组小鼠颈动脉组织IL-6和p-STAT3表达上调;而与Injury+AAV-LacZ组相比,Injury+AAV-S1PR1组颈动脉组织IL-6和p-STAT3表达上调更加显著(图 5A)。Western blot检测结果显示:与saline+Ad-LacZ组相比,S1P+Ad-LacZ组原代血管平滑肌细胞p-STAT3和IL-6表达上调(P < 0.05);与S1P+Ad-LacZ组相比,S1P+Ad-S1PR1组血管平滑肌细胞p-STAT3和IL-6表达水平进一步升高(P < 0.05,图 5B~D)。
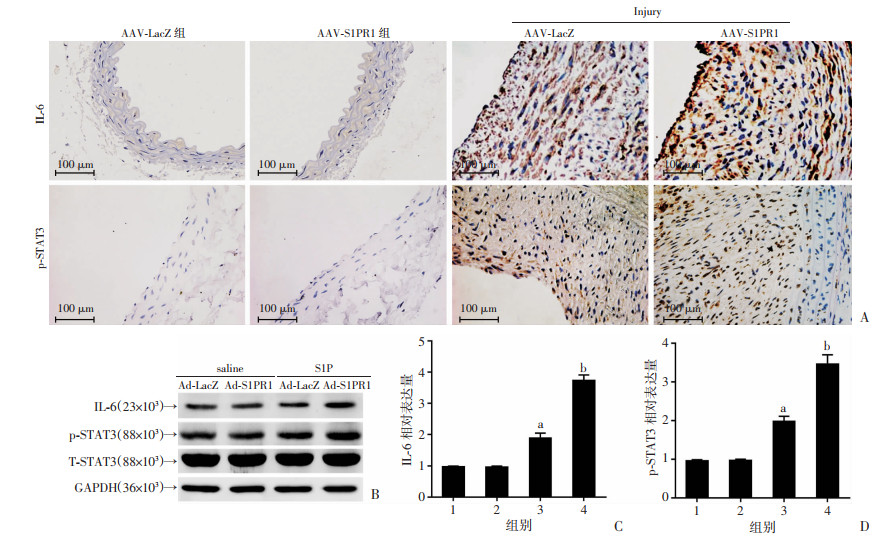
|
| A:免疫组化检测各组小鼠颈动脉组织IL-6表达水平;B~D:分别为Western blot检测各组原代血管平滑肌细胞IL-6、p-STAT3和总STAT3表达水平及半定量分析 1:saline+Ad-LacZ组;2:saline+Ad-S1PR1组;3:S1P+Ad-LacZ组;4:S1P+Ad-S1PR1组;a:P < 0.05,与Saline+Ad-LacZ组比较;b:P < 0.05,与S1P+Ad-LacZ组比较 图 5 S1P/S1PR1激活原代血管平滑肌细胞IL-6/STAT3通路从而促进血管内膜增生 |
3 讨论
支架植入术后再狭窄、冠脉搭桥术后旁路再狭窄及血管损伤后血管重构的主要病理生理学改变为血管内膜增生。血管平滑肌细胞表型转化、增殖和迁移是血管内膜增生的病理生理学基础[10]。血管损伤后,受损内皮细胞和炎症细胞释放炎症因子和细胞因子(如血小板源生长因子PDGF),促进血管平滑肌细胞发生显著表型转化(静止/收缩型标记蛋白平滑肌肌动蛋白α-SMA、钙调蛋白calponin、平滑肌分化特异性抗原smoothelin等表达减少,合成型标记蛋白波形Vimentin、基质金属蛋白MMP、骨桥蛋白OPN等表达增多);同时血管平滑肌细胞增殖和迁移能力增强,迁移至血管内膜,合成分泌大量细胞外基质,形成新生内膜和管腔狭窄[10-11]。本研究发现导丝损伤后新生内膜增厚,伴有显著的血管平滑肌细胞表型转化、增殖,这与以往研究结果一致。
鞘氨醇(sphingosine,Sph)在鞘氨醇激酶(SphK)催化下形成具有生物活性的1-磷酸鞘氨醇(S1P)。血浆中60%~80%的S1P与高密度脂蛋白(HDL)相结合。S1P作为具有生物活性的脂质代谢产物,在心血管系统和免疫系统中有着重要作用[12-13]。S1PR有5型,血管系统主要表达1~3型。研究表明,成熟血管平滑肌细胞主要表达S1PR2,抑制血管平滑肌细胞增殖和迁移,维持血管平滑肌静止状态[7, 14-15],S1PR2-/-小鼠颈动脉损伤后血管内膜增生严重[9]。成熟血管平滑肌细胞S1PR1表达水平低,而在血管损伤修复过程中S1PR1表达有上调趋势,提示S1PR1可能在血管重构发生、发展中有着重要作用[7]。本研究动物实验结果显示:颈动脉损伤后内膜新生增厚,血管S1PR1表达上调,与上述推断一致。既往研究表明,S1P通过激活S1PR1,促进PDGF分泌,促进血管平滑肌细胞增殖迁移[16]。VPC25239选择性抑制S1PR1/3后,S1P诱导的血管平滑肌细胞增殖效应受到一定程度抑制,收缩型标记分子α-SMA、smoothelin荧光报告基因表达活性增高;JTE013特异性抑制S1PR2后,S1P诱导的血管平滑肌细胞增殖能力增强,α-SMA、smoothelin荧光报告基因表达活性降低[14],说明S1P通过激活S1PR1促进血管平滑肌细胞增殖、迁移和表型转化。本研究动物实验结果显示,过表达S1PR1加重颈动脉损伤后血管内膜新生;细胞实验结果显示,S1PR1促进S1P诱导的血管平滑肌细胞表型转化、增殖和迁移。细胞实验中S1P诱导血管平滑肌表型转化时收缩型标记分子α-SMA和合成型标记分子Vimentin均表达上调。这可能是由于原代血管平滑肌细胞同时表达较高丰度S1PR1和S1PR2,S1P/S1PR1促进血管平滑肌细胞表型转化和增殖迁移,S1P/S1PR2促进血管平滑肌细胞向收缩型分化并上调α-SMA表达。
血管损伤后血管重构局部炎症激活,聚集的炎症细胞和受损血管平滑肌细胞炎症通路激活,释放大量炎症因子和细胞因子,加重血管内膜增生。作为重要的细胞因子,IL-6与动脉粥样硬化、心肌梗死等多种心血管疾病发病率正相关[17]。研究表明,血管平滑肌细胞IL-6表达上调后,血管损伤后内膜增生更加严重[18]。S1P/S1PR1可通过Gi激活JAK2-STAT3通路,促进IL-6表达上调,而IL-6与IL-6R结合后,继续激活JAK2-STAT3,形成正反馈效应,从而促进肿瘤的发生、发展[19]。本研究动物实验结果显示,导丝损伤后颈动脉组织IL-6表达上调,激活血管平滑肌细胞IL-6/STAT3通路。过表达S1PR1后,颈动脉组织IL-6表达进一步上调,IL-6/STAT3通路进一步激活,可能级联激活下游其他炎症转录因子和增殖相关基因,促进血管平滑肌细胞增殖迁移,加重损伤后血管重构。
综上,本研究发现过表达S1PR1后,S1P/S1PR1促进血管平滑肌细胞表型转化和增殖迁移,加重损伤后血管内膜增生,可能与血管平滑肌细胞IL-6/STAT3通路激活有关,其具体机制需进一步探究。
| [1] |
WEINTRAUB W S. The pathophysiology and burden of restenosis[J]. Am J Cardiol, 2007, 100(5): S3-S9. DOI:10.1016/j.amjcard.2007.06.002 |
| [2] |
ZHANG S M, ZHU L H, CHEN H Z, et al. Interferon regulatory factor 9 is critical for neointima formation following vascular injury[J]. Nat Commun, 2014, 5: 5160. DOI:10.1038/ncomms6160 |
| [3] |
SANCHEZ T. Sphingosine-1-phosphate signaling in endothelial disorders[J]. Curr Atheroscler Rep, 2016, 18(6): 1-13. DOI:10.1007/s11883-016-0586-1 |
| [4] |
VESTRI A, PIERUCCI F, FRATI A, et al. Sphingosine 1-phosphate receptors: do they have a therapeutic potential in cardiac fibrosis?[J]. Front Pharmacol, 2017, 8: 296. DOI:10.3389/fphar.2017.00296 |
| [5] |
ŻAK M M, GKONTRA P, CLEMENTE C, et al. Sequential bone-marrow cell delivery of VEGFA/S1P improves vascularization and limits adverse cardiac remodeling after myocardial infarction in mice[J]. Hum Gene Ther, 2019, 30(7): 893-905. DOI:10.1089/hum.2018.194 |
| [6] |
DAI M, WU L, HE Z, et al. Epoxyeicosatrienoic acids regulate macrophage polarization and prevent LPS-induced cardiac dysfunction[J]. J Cell Physiol, 2015, 230(9): 2108-2119. DOI:10.1002/jcp.24939 |
| [7] |
TAKUWA Y. Sphingosine-1-phosphate signaling and biological activities in the cardiovascular system[J]. Biochim et Biophys Acta BBA - Mol Cell Biol Lipids, 2008, 1781(9): 483-488. DOI:10.1016/j.bbalip.2008.04.003 |
| [8] |
张大棣, 张智超, 伍荣, 等. 1-磷酸鞘氨醇受体在心血管系统中的作用及机制[J]. 中国动脉硬化杂志, 2013, 21(11): 1047-1052. ZHANG D D, ZHANG Z C, WU R, et al. Effects and mechanisms of sphingosine-l-phosphate receptors in cardiovascular system[J]. Chin J Arterioscler, 2013, 21(11): 1047-1052. |
| [9] |
SHIMIZU T, NAKAZAWA T, CHO A, et al. Sphingosine 1-phosphate receptor 2 negatively regulates neointimal formation in mouse arteries[J]. Circ Res, 2007, 101(10): 995-1000. DOI:10.1161/circresaha.107.159228 |
| [10] |
O'BRIEN E R, MA X, SIMARD T, et al. Pathogenesis of neointima formation following vascular injury[J]. Cardiovasc Hematol Disord Drug Targets, 2011, 11(1): 30-39. DOI:10.2174/187152911795945169 |
| [11] |
MCDONALD O G, OWENS G K. Programming smooth muscle plasticity with chromatin dynamics[J]. Circ Res, 2007, 100(10): 1428-1441. DOI:10.1161/01.res.0000266448.30370.a0 |
| [12] |
ZHANG F, XIA Y, YAN W, et al. Sphingosine 1-phosphate signaling contributes to cardiac inflammation, dysfunction, and remodeling following myocardial infarction[J]. Am J Physiol Heart Circ Physiol, 2016, 310(2): H250-H261. DOI:10.1152/ajpheart.00372.2015 |
| [13] |
PETERS S L, ALEWIJNSE A E. Sphingosine-1-phosphate signaling in the cardiovascular system[J]. Curr Opin Pharmacol, 2007, 7(2): 186-192. DOI:10.1016/j.coph.2006.09.008 |
| [14] |
WAMHOFF B R, LYNCH K R, MACDONALD T L, et al. Sphingosine-1-phosphate receptor subtypes differentially regulate smooth muscle cell phenotype[J]. Arterioscler Thromb Vasc Biol, 2008, 28(8): 1454-1461. DOI:10.1161/atvbaha.107.159392 |
| [15] |
WANG Y, CHEN D, ZHANG Y, et al. Novel adipokine, FAM19A5, inhibits neointima formation after injury through sphingosine-1-phosphate receptor 2[J]. Circulation, 2018, 138(1): 48-63. DOI:10.1161/CIRCULATIONAHA.117.032398 |
| [16] |
TANIMOTO T, LUNGU A O, BERK B C. Sphingosine 1-phosphate transactivates the platelet-derived growth factor β receptor and epidermal growth factor receptor in vascular smooth muscle cells[J]. Circ Res, 2004, 94(8): 1050-1058. DOI:10.1161/01.res.0000126404.41421.be |
| [17] |
KAPTOGE S, SESHASAI S R, GAO P, et al. Inflammatory cytokines and risk of coronary heart disease: new prospective study and updated meta-analysis[J]. Eur Heart J, 2014, 35(9): 578-589. DOI:10.1093/eurheartj/eht367 |
| [18] |
MORIYA J. Critical roles of inflammation in atherosclerosis[J]. J Cardiol, 2019, 73(1): 22-27. DOI:10.1016/j.jjcc.2018.05.010 |
| [19] |
LEE H, DENG J, KUJAWSKI M, et al. STAT3-induced S1PR1 expression is crucial for persistent STAT3 activation in tumors[J]. Nat Med, 2010, 16(12): 1421-1428. DOI:10.1038/nm.2250 |




