2. 401121 重庆,重庆市人民医院妇产科
2. Department of Gynecology and Obstetrics, Chongqing General Hospital, Chongqing, 401121, China
干细胞移植是治疗膀胱功能障碍最有前途和挑战性的应用。最近,成人自体干细胞移植治疗压力性尿失禁(stress urinary incontinence,SUI),取得了一些开拓性进展[1-2]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有容易获取、免疫原性小以及不涉及伦理问题等优势,被认为是一种理想的移植种子细胞[3-4]。研究表明表观遗传调控在干细胞向平滑肌细胞(smooth muscle cells,SMCs)分化过程中发挥重要作用[5],通过对SMCs启动子区进行特殊的组蛋白修饰来调节SMCs标记基因的表达[6]。多项研究发现,胚胎干细胞(embryonic stem cells,ESCs)向SMCs分化过程中,SMCs相关基因启动子区具有高水平的H3和H4残基(H3ace和H4ace)乙酰化[7-9]。组蛋白乙酰化是组蛋白修饰之一,受组蛋白乙酰化酶(histone acetyltransferase,HATs)和组蛋白去乙酰化酶(histone deacetylase,HDACs)调控。HDACs分为4个类别,其中一些与SMCs标记基因的表达有关[10-11]。HDAC1和HDAC2是HDAC的Ⅰ类成员,序列存在85%相似性,通常共同调控相关基因的表达[12-13]。此外,HDAC2抑制SMCs特定基因的表达[14]。
HDAC通过调节组蛋白特殊位点乙酰化,使致密染色质解聚,招募转录因子结合到DNA启动子区的特殊序列,从而调控相关基因的表达。血清反应因子(serum response factor,SRF)是SMCs的关键转录因子之一,与SMCs标志基因启动子区特殊DNA序列CArG box[CC(A/T)6GG]结合激活SMCs基因转录[15-18]。然而,在MSCs向SMCs分化过程中,SRF以及相关组蛋白乙酰化修饰调控机制尚未阐明。本研究在建立体外诱导MSCs向SMCs分化的基础上,从表观遗传调控角度探讨其分子机制,以期为组织工程和细胞种植治疗提供实验依据。
1 材料与方法 1.1 材料与试剂实验用30只4周龄雌性清洁级SD大鼠,体质量60 g,购自陆军军医大学实验动物中心,生产许可证号SYXK(渝)20170002,使用许可证号SYXK(渝),动物实验均遵循陆军军医大学动物伦理实验委员会制定的指导原则进行。DMEM/F12培养基、H-DMEM培养基、胎牛血清(fetal bovine serum,FBS)购自Hyclone公司,胰蛋白酶、胶原酶、PBS、青-链霉素双抗购自Gibco公司,细胞培养耗材购自Hyclone公司,Transwell小室购自Millipore公司;抗大鼠α-平滑肌肌动蛋白(α-SMA)、抗大鼠钙调蛋白(Caponin)和抗大鼠平滑肌肌球蛋白重链(SM-MHC)抗体购自Abcam公司,FITC标记山羊抗鼠IgG二抗购自Abcam公司;定量PCR试剂盒购自TaKaRa公司;ChIP级抗大鼠HDAC1抗体,ChIP级抗大鼠HDAC2抗体,ChIP级抗大鼠乙酰基组蛋白H3K9(H3K9ace)抗体,ChIP级抗大鼠乙酰基组蛋白H4(H4ace)抗体和ChIP级抗大鼠IgG抗体购自Abcam公司,ChIP级抗大鼠乙酰基组蛋白H3(H3ace)抗体购自Millipore公司,ChIP级抗大鼠SRF抗体购自Santa Cruz公司,ChIP试剂盒购自Millipore公司,丁酸钠(sodium butyrate,NaB)购自Sigma公司。
1.2 骨髓间充质干细胞分离培养取1~2只SD大鼠断颈法处死后,无菌分离大鼠股骨和胫骨,用10 mL注射器冲洗骨髓腔两次。将冲洗液离心后获得的细胞沉淀采用DMEM/F12培养基(含10 %FBS)重悬。细胞悬液在37 ℃,5 % CO2饱和湿度培养箱中培养。细胞密度达到80%~90%时,进行传代。本研究中所使用的是第3代或第4代细胞。
1.3 膀胱平滑肌细胞分离培养从上述SD大鼠中无菌分离膀胱,去除浆膜层和黏膜层,通过胶原酶Ⅰ和Ⅱ(1:1)消化后,收集游离细胞。将获得的细胞在含10%FBS的H-DMEM培养基中重悬,于37 ℃,5 % CO2饱和湿度培养箱中培养。细胞密度达到80%~90 %时进行传代。本研究中第3代或第4代细胞用于与MSCs共培养。
1.4 骨髓间充质干细胞与膀胱平滑肌细胞共培养将MSCs与SMCs在Transwell小室中共培养。胰蛋白酶消化SMCs后,以1×104个/mL密度接种于Transwell的外室中。胰蛋白酶消化MSCs后,同样也以1×104个/mL密度接种于Transwell的内室中。在0、24、48和72 h收获共培养的MSCs细胞,用于RT-PCR测定SMCs标志基因表达;在0、36和72 h收集共培养MSCs,用于ChIP-qPCR检测组蛋白乙酰化修饰、HDAC和SRF在SMCs标志基因启动子区的富集。分离的MSCs用1.0 mmol/L NaB预处理48 h后,再与SMCs在Transwell小室中共培养72 h,胰蛋白酶消化收集MSCs细胞,实验分为对照组和NaB干预组,ChIP-qPCR方法检测组蛋白修饰和SRF富集量。
1.5 免疫荧光检测MSCs、SMCs和共培养72 h的MSCs,以5×103个/mL密度接种在培养板中,用4%多聚甲醛固定10 min。采用抗大鼠α-SMA、抗大鼠Calponin和抗大鼠SM-MHC的一抗,在4 ℃孵育12 h。然后采用FITC偶联IgG二抗孵育30 min。最后采用4′,6-diamidino-2-phenylindole (DAPI)进行5 min的细胞核染色,进行激光共聚焦显微镜分析。
1.6 实时定量聚合酶链反应(qPCR)在0、24、48、72 h收获共培养的1×106个MSCs,预冷PBS洗涤。提取总RNA后,基于TaKaRa反转录试剂盒进行反转录。使用PrimeScript第一链cDNA合成试剂盒合成cDNA。采用SYBR Green PCR Master Mix试剂盒处理后,通过实时定量扩增系统(MxPro-MX30000P)进行实时PCR。通过将定量的cDNA转录物标准化为β-肌动蛋白(β-actin)来计算基因相对表达水平。引物序列参见表 1。退火温度为60 ℃。每个值代表至少3次独立实验的平均值。
| 序号 | 基因名称 | 引物序列 |
| 1 | α-SMA | 5′-GGGCATCCACGAAACCACCTAT-3′(正向) |
| 5′-CGCCGATCCAGACAGAATATTTG-3′(反向) | ||
| 2 | Calponin | 5′-CCCACAATCACCACCCACACAAC-3′(正向) |
| 5′-CCTCGGCCTGATCTCCCCAAACT-3′(反向) | ||
| 3 | SM-MHC | 5′-GAGGAGGCGGTGCAGGAGTGTAG-3′(正向) |
| 5′-GGCGCTGGTGTCCTGCTCCTT-3′(反向) | ||
| 4 | β-actin | 5′-TGGTGGGAATGGGTCAGAAG-3′(正向) |
| 5′-ACGCACGATTTCCCTCTCAG-3′(反向) |
1.7 染色质免疫沉淀法(chromatin immunoprecipitation,ChIP)
在0、36和72 h收集1×107个共培养MSCs以及正常共培养对照组和NaB预处理干预组MSCs,在室温下用1%多聚甲醛固定10 min。通过超声处理,将交联的DNA剪切至200~500 bp的长度。将ChIP级抗大鼠HDAC1抗体(1 μg)、ChIP级抗大鼠HDAC2抗体(1 μg)、ChIP级抗大鼠乙酰基组蛋白H3K9抗体(5 μg)、ChIP级抗大鼠乙酰基组蛋白H3抗体(5 μg),ChIP级抗大鼠乙酰基组蛋白H4抗体(5 μg)和ChIP级抗大鼠SRF抗体(10 μg)与每种免疫沉淀在4 ℃磁珠中孵育过夜,并将正常大鼠ChIP级抗大鼠IgG抗体(5 μg)用作阴性对照。在反向交联之后,纯化DNA,使用qPCR进行定量测定。引物序列参见表 2。退火温度为60 ℃。每个值代表至少3个独立实验的平均值。
| 序号 | 基因名称 | 引物序列 |
| 1 | α-SMA | 5′-CCGCAGTTACAGTGATTC-3′(正向) |
| 5′-GCTAAGGGCTTGAGATGA-3′(反向) | ||
| 2 | Calponin | 5′-CAGTCAGCTCCCAATACAA-3′(正向) |
| 5′-TTCCAAGCCTGTCCCATT-3′(反向) | ||
| 3 | SM-MHC | 5′-CAGATCCGTACAGGGCTAA-3′(正向) |
| 5′-TGCCTGGGACCAATAAC-3′(反向) |
1.8 统计学分析
使用GraphPad Prism 5.0分析数据,数据以x±s形式表示,多组间比较采用单因素方差分析,两组间比较采用t检验。
2 结果 2.1 共培养体系诱导骨髓间充质干细胞分化为膀胱平滑肌细胞为了建立诱导MSCs分化为SMCs的可行和有效的方法,我们采用Transwell小室,将MSCs与SMCs共培养72 h,并采用RT-PCR检测不同时间点诱导的MSCs中SMCs标志基因的表达,结果在共培养的MSCs中α-SMA,Calponin(P<0.05)和SM-MHC(P<0.01)表达量显著增加(图 1A);使用免疫荧光技术检测上述细胞中α-SMA、Calponin和SM-MHC蛋白表达,结果这些蛋白在共培养的MSCs中表达增强(图 1B)。
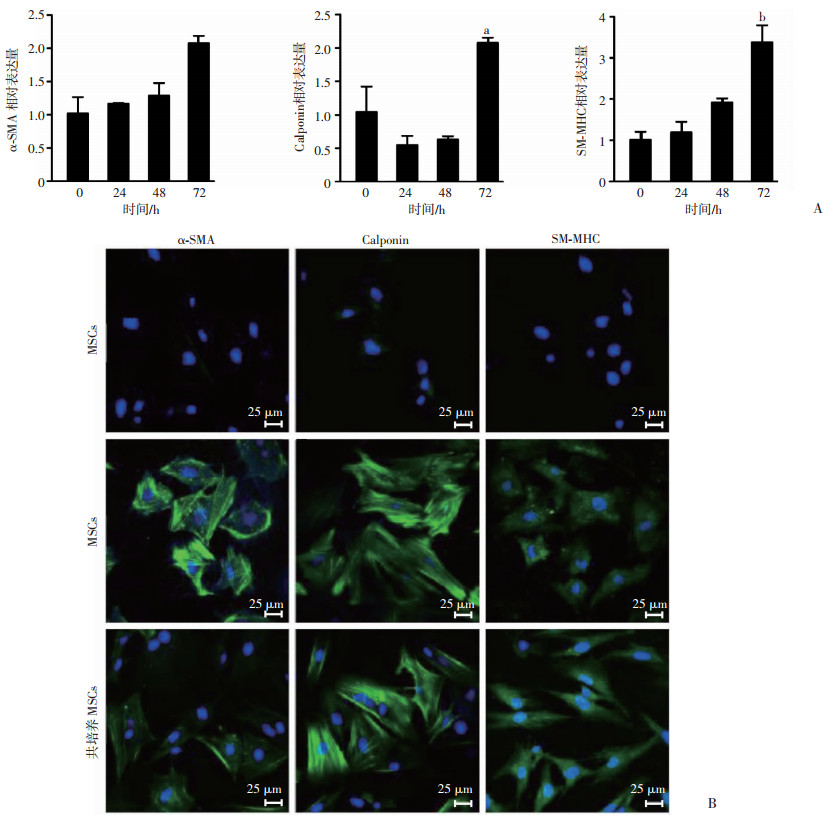
|
| A:RT-PCR测量不同时间点共培养MSCs的α-SMA、Calponin和SM-MHC基因表达量(n=3,x±s) a:P<0.05, b:P<0.01,与0 h比较B:免疫荧光分析MSCs,SMCs和共培养MSCs中α-SMA、Calponin和SM-MHC蛋白表达 图 1 共培养MSCs中α-SMA标志基因的表达 |
2.2 MSCs共培养后不同时间点SMCs标志基因组蛋白乙酰化修饰
为了测试是否有组蛋白乙酰化修饰参与了MSCs向SMCs的分化,使用ChIP-qPCR检测MSCs中α-SMA、Calponin和SM-MHC启动子区的H3K9ace,H3ace和H4ace富集情况。图 2显示,在共培养72 h时,MSCs的SMCs标志基因启动子区的H3K9ace、H3ace和H4ace富集量显著增加(P<0.05),具有统计学意义。
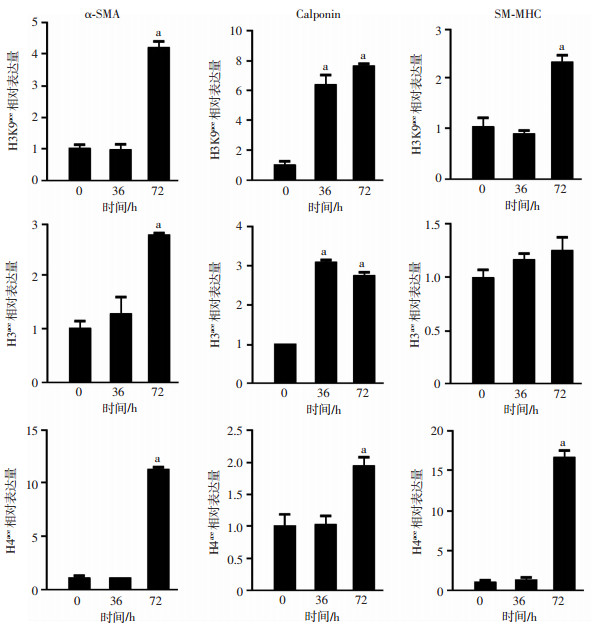
|
| a:P<0.05,与0 h比较 图 2 ChIP-qPCR分析共培养MSCs中组蛋白乙酰化修饰(n=3,x±s) |
2.3 HDAC1和HDAC2参与MSCs向SMCs分化的过程
为了进一步证明组蛋白乙酰化对SMCs基因表达的影响,我们采用ChIP-qPCR检测不同时间点诱导的MSCs中HDAC1和HDAC2的富集。结果表明,诱导的MSCs中HDAC1和HDAC2在SMCs标志基因启动子区的富集量显著降低,有统计学意义(P<0.05, P<0.01, P<0.001, 图 3)。
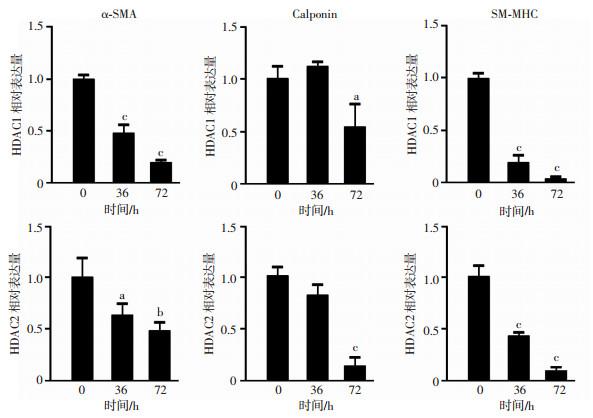
|
| a: P<0.05,b:P<0.01,c:P<0.001, 与0 h比较 图 3 共培养的MSCs中SMCs标志基因HDAC1和HDAC2富集量(n=3,x±s) |
2.4 SRF促进MSCs向SMCs分化
为了测定MSCs向SMCs分化是否受SRF调控,我们测定共培养后MSCs的SMCs标志基因启动子区SRF的富集情况,图 4显示随着共培养时间的延长,SRF在α-SMA和SM-MHC基因中富集量显著增加(P<0.05)。
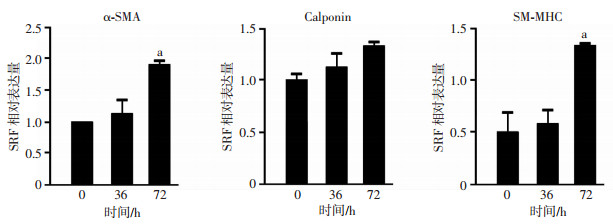
|
| a:P<0.05,与0 h比较 图 4 共培养的MSCs的SMCs标志基因中SRF富集(n=3,x±s) |
2.5 组蛋白乙酰化可能通过SRF促进MSCs分化成SMCs
研究采用1.0 mmol/L NaB提高其乙酰化水平,并比较NaB处理干预组与对照组间组蛋白乙酰化修饰和SRF富集情况。结果显示:NaB干预组α-SMA和SM-MHC基因中H3K9ace和H4ace的富集量明显高于对照组(P<0.05,图 5A);SRF在干预组中呈现相同增高趋势,差异具有统计学意义(P<0.05,图 5B)。相反,经NaB干预组的H3ace显著低于对照组(P<0.05,图 5A)。
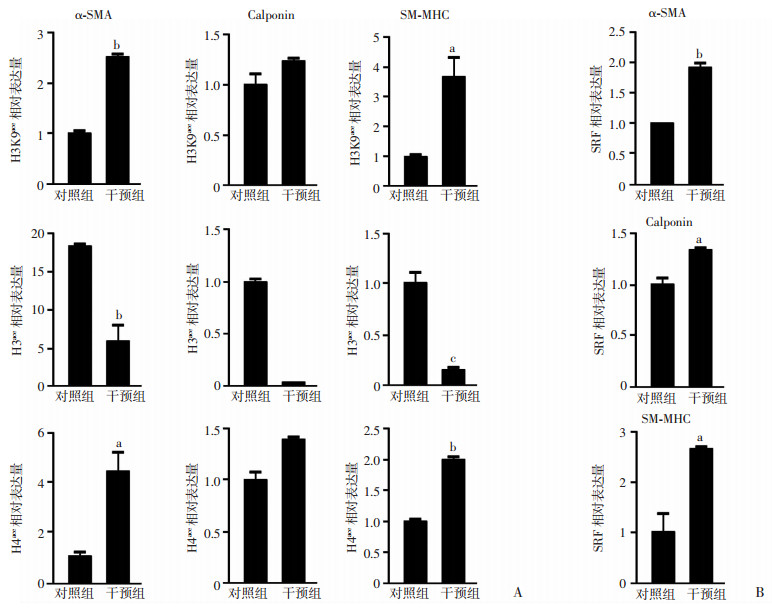
|
| a:P<0.05,b:P<0.01,c:P<0.001,与干预组比较A:两组SMCs标志基因中H3K9ace、H3ace和H4ace的富集量;B:两组SMCs标志基因中SRF富集量 图 5 NaB预处理对共培养间充质干细胞中组蛋白乙酰化修饰和SRF结合富集的影响(n=3,x±s) |
3 讨论
临床上细胞移植治疗受到干细胞来源的限制[2]。由于MSCs能够分化成多种细胞,因此被认为是一种极具应用潜能的种子细胞。体外培养中,MSCs可通过直接接触或者细胞因子诱导分化为SMCs [19-20]。在体内,骨髓间充质干细胞经尿道和膀胱颈黏膜下注射可分化为膀胱平滑肌细胞[1]。我们的研究发现共培养后MSCs的SMCs标志基因表达增加,说明体外Transwell小室共培养能够诱导MSCs向SMCs分化,这为干细胞定向分化寻找到一个较为可靠的途径。
MSCs向SMCs分化的机制尚不清楚。先前的研究表明,组蛋白乙酰化修饰参与了SMCs的分化[21-23]。干细胞系的乙酰化水平较低,而在分化后的SMCs中,SMCs标志基因的H3ace和H4ace升高[8]。与此相一致,我们还发现,SMCs标志基因中H3ace和H4ace的富集在MSCs向SMC分化中升高,这意味着H3ace和H4ace在MSCs分化过程中启动了相关基因表达。MCDONALD[6]报道α-SMA和SM-MHC的H3K9ace升高。我们还发现分化的MSCs中α-SMA,Calponin和SM-MHC的H3K9ace显著高于未分化的MSCs。这些数据表明在MSCs分化为SMCs中,H3K9ace激活平滑肌标记基因表达。所有结果表明,组蛋白乙酰化修饰在MSCs分化为SMCs中起促进作用。
组蛋白乙酰化状态由HAT和HDAC调节。在HDAC家族中,HDAC1和HDAC2保持相同的85%序列,通常共同存在并抑制基因转录。研究证明,HDAC2通过结合某些SMCs特异性转录因子来抑制SMCs标志基因的表达[14, 24]。我们的研究结果表明,随着共培养时间的延长,HDAC1和HDAC2在SMCs标记基因上的富集程度显著降低,说明HDAC1和HDAC2抑制了MSC向SMC分化中SMCs标记基因的表达。
组蛋白修饰通过转录因子调控基因表达[25-26]。SRF是SMCs特异性基因表达的关键转录因子之一。MCDONALD[6]报道SRF与H4乙酰化结合可以控制SMCs的分化。在本研究中,我们发现在MSCs分化中,SRF在SMCs标志基因启动子区富集量增加,促进MSCs中SMCs标志基因的表达。进一步,我们通过1.0 mmol/L NaB提高组蛋白乙酰化修饰水平,并观察了SRF的富集和组蛋白修饰的变化。结果发现,与对照组相比,NaB干预组SMCs基因启动子区H3ace富集量显著降低,原因可能是H4高乙酰化状态抑制了H3乙酰化[6];同时,SRF、H3K9ace和H4ace明显升高,提示H3K9ace和H4ace可能联合SRF促进MSCs的SMCs标志基因表达。
本研究通过建立体外共培养体系,揭示了组蛋白乙酰化修饰在MSCs向SMCs分化中的作用。虽然组蛋白特异位点乙酰化修饰促进MSCs的SMCs标志基因的表达,并且NaB提高乙酰化修饰后SRF与其有相同的增高趋势,然而SRF与相关乙酰化组蛋白间的结合是直接还是间接,尚未明确,并且上述组蛋白特异位点乙酰化与HDAC1和/或HDAC2之间结合关系也需在后续研究中进一步阐明。
总之,体外Transwell小室共培养体系能够诱导MSCs分化成SMCs。在分化过程中,H3K9ace、H3ace和H4ace可能经HDAC1和HDAC2调整,促进SMCs标志基因的表达,H3K9ace和H4ace可能结合SRF参与SMCs标志基因的初始转录。
| [1] |
KUISMANENK, SARTONEVA R, HAIMI S, et al. Auto-logous adipose stem cells in treatment of female stress urinary incontinence: results of a pilot study[J]. Stem Cells Transl Med, 2014, 3(8): 936-941. DOI:10.5966/sctm.2013-0197 |
| [2] |
ROMANS, MANGERA A, OSMAN N I, et al. Developing a tissue engineered repair material for treatment of stress urinary incontinence and pelvic organ prolapse-which cell source?[J]. Neurourol Urodynam, 2014, 33(5): 531-537. DOI:10.1002/nau.22443 |
| [3] |
LIAOW, YANG S, SONG C, et al. Construction of ureteral grafts by seeding bone marrow mesenchymal stem cells and smooth muscle cells into bladder acellular matrix[J]. Transplant Proc, 2013, 45(2): 730-734. DOI:10.1016/j.transproceed.2012.08.023 |
| [4] |
HAN J, LIU J Y, SWARTZ D D, et al. Molecular and functional effects of organismal ageing on smooth muscle cells derived from bone marrow mesenchymal stem cells[J]. Cardiovasc Res, 2010, 87(1): 147-155. DOI:10.1093/cvr/cvq024 |
| [5] |
GAN Q, YOSHIDA T, MCDONALD O G, et al. Concise review: epigenetic mechanisms contribute to pluripotency and cell lineage determination of embryonic stem cells[J]. Stem Cells, 2007, 25(1): 2-9. DOI:10.1634/stemcells.2006-0383 |
| [6] |
MCDONALD O G, WAMHOFF B R, HOOFNAGLE M H, et al. Control of SRF binding to CArG box chromatin regulates smooth muscle gene expression in vivo[J]. J Clin Invest, 2006, 116(1): 36-48. DOI:10.1172/jci26505 |
| [7] |
QIU P, LI L. Histone acetylation and recruitment of serum responsive factor and CREB-binding protein onto SM22 promoter during SM22 gene expression[J]. Circ Res, 2002, 90(8): 858-865. DOI:10.1161/01.res.0000016504.08608.b9 |
| [8] |
MANABE I, OWENS G K. Recruitment of serum response factor and hyperacetylation of histones at smooth muscle-specific regulatory regions during differentiation of a novel P19-derived in vitro smooth muscle differentiation system[J]. Circ Res, 2001, 88(11): 1127-1134. DOI:10.1161/hh1101.091339 |
| [9] |
CAO D, WANG Z, ZHANG C L, et al. Modulation of smooth muscle gene expression by association of histone acetyltransferases and deacetylases with myocardin[J]. Mol Cell Biol, 2005, 25(1): 364-376. DOI:10.1128/mcb.25.1.364-376.2005 |
| [10] |
ZHOU B, MARGARITI A, ZENG L, et al. Splicing of histone deacetylase 7 modulates smooth muscle cell proliferation and neointima formation through nuclear β-catenin translocation[J]. Arterioscler Thromb Vasc Biol, 2011, 31(11): 2676-2684. DOI:10.1161/atvbaha.111.230888 |
| [11] |
SINGH N, TRIVEDI C M, LU M M, et al. Histone deacetylase 3 regulates smooth muscle differentiation in neural crest cells and development of the cardiac outflow tract[J]. Circ Res, 2011, 109(11): 1240-1249. DOI:10.1161/circresaha.111.255067 |
| [12] |
TURGEON N, BLAIS M, GAGNÉ J M, et al. HDAC1 and HDAC2 restrain the intestinal inflammatory response by regulating intestinal epithelial cell differentiation[J]. PLoS ONE, 2013, 8(9): e73785. DOI:10.1371/journal.pone.0073785 |
| [13] |
HE S H, KHAN D H, WINTER S, et al. Dynamic distribution of HDAC1 and HDAC2 during mitosis: Association with F-actin[J]. J Cell Physiol, 2013, 228(7): 1525-1535. DOI:10.1002/jcp.24311 |
| [14] |
KONG X, FANG M, LI P, et al. HDAC2 deacetylates class Ⅱ transactivator and suppresses its activity in macrophages and smooth muscle cells[J]. J Mol Cell Cardiol, 2009, 46(3): 292-299. DOI:10.1016/j.yjmcc.2008.10.023 |
| [15] |
WANG Z, WANG D Z, HOCKEMEYER D, et al. Myocardin and ternary complex factors compete for SRF to control smooth muscle gene expression[J]. Nature, 2004, 428(6979): 185-189. DOI:10.1038/nature02382 |
| [16] |
PENKE L R, HUANG S K, WHITE E S, et al. Prostaglandin E2 inhibits α-smooth muscle actin transcription during myofibroblast differentiation via distinct mechanisms of modulation of serum response factor and myocardin-related transcription factor-A[J]. J Biol Chem, 2014, 289(24): 17151-17162. DOI:10.1074/jbc.m114.558130 |
| [17] |
MORITA T, HAYASHI K. Arp5 is a key regulator of myocardin in smooth muscle cells[J]. J Cell Biol, 2014, 204(5): 683-696. DOI:10.1083/jcb.201307158 |
| [18] |
DAVIS F J, GUPTA M, CAMORETTI-MERCADO B, et al. Calcium/calmodulin-dependent protein kinase activates serum response factor transcription activity by its dissociation from histone deacetylase, HDAC4. Implications in cardiac muscle gene regulation during hypertrophy[J]. J Biol Chem, 2003, 278(22): 20047-20058. DOI:10.1074/jbc.m209998200 |
| [19] |
PARK W S, HEO S C, JEON E S, et al. Functional expression of smooth muscle-specific Ion channels in TGF-β(1)-treated human adipose-derived mesenchymal stem cells[J]. Am J Physiol Cell Physiol, 2013, 305(4): C377-C391. DOI:10.1152/ajpcell.00404.2012 |
| [20] |
WANG T, XU Z, JIANG W, et al. Cell-to-cell contact induces mesenchymal stem cell to differentiate into cardiomyocyte and smooth muscle cell[J]. Int J Cardiol, 2006, 109(1): 74-81. DOI:10.1016/j.ijcard.2005.05.072 |
| [21] |
LIU R, LESLIE K L, MARTIN K A. Epigenetic regulation of smooth muscle cell plasticity[J]. Biochim Biophys Acta, 2015, 1849(4): 448-453. DOI:10.1016/j.bbagrm.2014.06.004 |
| [22] |
VILLENEUVE L M, REDDY M A, LANTING L L, et al. Epigenetic histone H3 lysine 9 methylation in metabolic memory and inflammatory phenotype of vascular smooth muscle cells in diabetes[J]. Proc Natl Acad Sci USA, 2008, 105(26): 9047-9052. DOI:10.1073/pnas.0803623105 |
| [23] |
ALEXANDER M R, OWENS G K. Epigenetic control of smooth muscle cell differentiation and phenotypic switching in vascular development and disease[J]. Annu Rev Physiol, 2012, 74(1): 13-40. DOI:10.1146/annurev-physiol-012110-142315 |
| [24] |
MENG F, HAN M, ZHENG B, et al. All-trans retinoic acid increases KLF4 acetylation by inducing HDAC2 phosphorylation and its dissociation from KLF4 in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2009, 387(1): 13-18. DOI:10.1016/j.bbrc.2009.05.112 |
| [25] |
KATAN-KHAYKOVICH Y, STRUHL K. Splitting of H3-H4 tetramers at transcriptionally active genes undergoing dynamic histone exchange[J]. Proc Natl Acad Sci USA, 2011, 108(4): 1296-1301. DOI:10.1073/pnas.1018308108 |
| [26] |
XU M, LONG C, CHEN X, et al. Partitioning of histone H3-H4 tetramers during DNA replication-dependent chromatin assembly[J]. Science, 2010, 328(5974): 94-98. DOI:10.1126/science.1178994 |




