太赫兹(terahertz,THz)电磁辐射是指频率在0.1~10 THz的电磁辐射,处于宏观电子学向微观光子学过渡的频段。早期由于THz源及检测技术发展的滞后,关于THz的研究进展缓慢。因此,THz频段一度被称为电磁波谱中的“THz空隙”。目前,THz技术在雷达通讯、安检及生物医学等领域具有广泛的应用前景[1-4]。特别是在生物医学领域,THz辐射在药物结构和纯度分析及筛选、病原体鉴定和定量、生物医学成像诊断等方面表现出极大优势[5-7]。
许多生物大分子如核酸、蛋白质等的吸收、共振及谐振频段均处于THz波段[8]。因此,THz辐射很可能通过影响这些生物大分子的结构和功能进而对机体产生影响。尽管THz辐射属于非电离辐射,其量子能量较低,不会对生物大分子、细胞和组织产生电离损伤[9-10],但近年研究表明,THz辐射仍然具有热效应和非热效应,并且对细胞、组织甚至实验动物产生影响。比如THz辐射可通过热效应引起脂质体和细胞膜通透性改变,导致细胞和组织的基因组、蛋白组和转录组发生一定程度的变异[11-12],甚至可以引起实验动物焦虑、抑郁样行为发生[13-14]。因此,针对THz辐射的生物效应与生物安全性问题亟待研究解决。
当前,关于THz辐射的生物效应特点及生物安全性研究的结果尚不明确。基于神经系统是THz辐射的敏感靶标,本研究采用小鼠神经母细胞瘤Neuro-2a细胞株作为神经细胞体外暴露模型,监测THz辐射暴露细胞温度变化特点,检测细胞增殖、凋亡和突触生长等基本生理过程,旨在揭示THz辐射暴露对神经系统的生物效应特点,为THz辐射相关环境和职业暴露医学防护提供实验依据。
1 材料与方法 1.1 细胞培养Neuro-2a细胞株购自ATCC细胞库。将细胞培养在含10%胎牛血清(HyClone,美国)和100 U的双抗(Sigma,美国)的DMEM高糖培养基(HyClone,美国)中,置于细胞培养箱中培养,培养条件为37 ℃,5%CO2。当细胞长满约80%培养瓶底部时进行传代培养或实验处理。
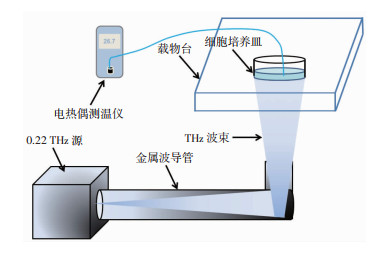
1.2 太赫兹暴露系统及细胞暴露太赫兹辐照装置(图 1)主要由1支0.22 THz的行波管、前级固态信号源、高压电源、冷却系统、测试组件和控制系统组成(中国工程物理研究院研制)。该装置可以产生中心频率为0.22 THz,输出功率达1.18 W的THz波束。由于水对太赫兹波的强烈吸收,而培养细胞的塑料孔板对太赫兹波的透过,所以采用从细胞孔板底部进行辐照,同时控制THz辐射过程中细胞培养基温度在25 ℃,并在辐照过程中采用电热偶测温仪(LIHUADA,中国)实时监测细胞培养基温度变化情况。实验分为3组:Sham组、25 mW/cm2辐照组和50 mW/cm2辐照组,辐照时间为5 min。分别于辐照后不同时相点进行相关指标检测。
|
| 图 1 THz辐射暴露装置及细胞暴露模式图 |
1.3 光学显微镜观察细胞生长情况
细胞于辐照结束后24 h置于光学显微镜(Leica,德国)下进行观察并采集图片。
1.4 EdU掺入法检测细胞增殖EdU(锐博,中国)掺入法检测细胞增殖的具体方法参照产品说明书。细胞于辐照结束后22 h加入EdU溶液(50 μmol/L)于细胞培养箱中孵育2 h,弃掉细胞培养基,PBS清洗细胞5 min×3次;4%多聚甲醛溶液(博士德,中国)室温固定15 min,然后加入甘氨酸溶液(2 mg/mL)摇床孵育5 min以中和过量的甲醛;加入0.5% Triton X-100-PBS溶液打孔10 min;加入1×Apollo染色反应液,室温避光孵育30 min,弃染液,PBS清洗5 min×3次;细胞核用DAPI染液(碧云天,中国)复染;利用荧光显微镜(Leica,德国)进行图像采集及细胞计数,细胞增殖情况以EdU阳性细胞百分比表示。
1.5 CCK-8检测细胞活力细胞活力采用CCK-8试剂盒(Dojindo,日本)检测,方法参考前期研究[15]。具体方法如下:将细胞(1×104个/孔)接种于96孔培养板,待其贴壁后更换培养基,进行THz辐射暴露。暴露结束后24 h,取10 μL CCK-8试剂加入到90 μL细胞培养基中,37 ℃孵育1 h。在荧光分光光度仪InfiniteTM M200 Microplate Reader (Tecan, Mannedorf, 瑞士)中检测培养基光密度。
1.6 细胞γH2AX免疫荧光染色细胞处理结束24 h后,采用4%多聚甲醛固定15 min。免疫荧光染色步骤参照本实验室前期研究进行[16],具体方法如下:向固定好的细胞加入PBS漂洗5 min×3次;加入0.5% Triton X-100-PBS溶液打孔10 min;PBS漂洗5 min×3次,加入γH2AX一抗(兔源,Abcam,美国),浓度为1 :300,4 ℃过夜;PBS漂洗5 min×3次,加入驴抗兔-488荧光二抗(Invitrogen,美国),浓度为1 :500,室温避光孵育1 h;PBS漂洗5 min×3次,DPAI复染细胞核5 min后,PBS漂洗后采用荧光抗淬灭封片剂封片,于陆军军医大学基础医学院生物医学测试中心利用共聚焦显微镜(Leica SP5,德国)观察染色结果。
1.7 TUNEL法检测细胞凋亡利用TUNEL试剂盒(罗氏,瑞士)检测细胞凋亡,具体方法参考产品说明书。主要步骤如下:细胞处理结束24 h后,采用4%多聚甲醛固定20 min,PBS漂洗5 min×3次;3% H2O2甲醇溶液室温封闭10 min,PBS漂洗5 min×3次;0.25% Ttiton冰上透膜10 min,PBS漂洗5 min×3次;加入TdT和荧光素标记的dUTP的混合反应液(1 :9配置),于37 ℃湿盒避光孵育1 h,PBS漂洗10 min×3次;DPAI复染细胞核5 min后封片,在荧光显微镜(Leica,德国)下进行图像采集及细胞计数。
1.8 实时定量荧光PCR分析细胞处理结束24 h后,采用RNAiso Plus(宝生物, 日本)试剂提取总RNA,具体步骤详见产品说明书。按照逆转录试剂盒PrimeScript RT reagent Kit(宝生物, 日本)说明书步骤取0.5 μg总RNA,将其逆转录为cDNA模板以进行后续基因表达检测。采用荧光定量检测试剂SYBR Master Mix(宝生物, 日本)及荧光定量PCR仪(CFX96,美国伯乐)进行相关基因mRNA表达分析,引物序列见表 1。以GAPDH为内参,采用2-ΔΔCt方法计算mRNA表达量[17]。参照Sham组计算基因相对表达水平。
| 基因名称 | Genbank编码 | 上游引物(5′→3′) | 下游引物(5′→3′) | 产物长度/bp |
| Bax | NM_007527.3 | TTGGAGATGAACTGGACAGC | CAGTTGAAGTTGCCATCAGC | 124 |
| Bcl2 | NM_009741.5 | GGACTTGAAGTGCCATTGGTA | GTTATCATACCCTGTTCTCCCG | 78 |
| Tubb3 | NM_023279.3 | CGCCTTTGGACACCTATTCAG | TTCTCACACTCTTTCCGCAC | 141 |
| Syp | NM_009305.2 | AGTGCCCTCAACATCGAAG | GCCACGGTGACAAAGAATTC | 149 |
| GAPDH | NM_008084.3 | CTTTGTCAAGCTCATTTCCTGG | TCTTGCTCAGTGTCCTTGC | 133 |
1.9 细胞突触生长分析
采用Incucyte活细胞分析系统(Essen BioScience, 美国)分析细胞突触生长。首先将Neuro-2a细胞培养于含有10 μmol/L视黄酸(retinoic acid,RA,Sigma-Aldrich, 美国)的DMEM高糖培养基中诱导突触生长,同时进行THz辐射暴露。于暴露结束48 h后将细胞置于Incucyte活细胞分析系统中记录胞体上发出的突触长度和分支数目。
1.10 统计学分析采用SPSS 22.0统计软件进行分析,数据以x±s表示,各组比较先进行单因素方差分析,再采用Fisher’s post hoc检测进行两两比较,检验水准α=0.05。
2 结果 2.1 THz辐射暴露后细胞培养基温度变化研究将Neuro-2a细胞暴露于0.22 THz太赫兹电磁辐射场中(图 1),采用电热偶测温仪实时监测细胞培养基温度变化情况。结果显示,平均功率密度为25 mW/cm2和50 mW/cm2的太赫兹电磁辐射暴露过程中,与Sham组比较,辐照组细胞培养基温度升高在0.1~0.4 ℃(表 2),均不超过1 ℃。
| 暴露时间 | ΔT1/℃ | ΔT2/℃ |
| 1 min | 0.1 | 0.4 |
| 2 min | 0.2 | 0.3 |
| 3 min | 0.1 | 0.1 |
| 4 min | 0.1 | 0.1 |
| 5 min | 0.1 | 0.2 |
| ΔT1: 25 mW/cm2辐照组与Sham组温度差;ΔT2: 50 mW/cm2辐照组与Sham组温度差 | ||
2.2 THz暴露后细胞增殖情况改变
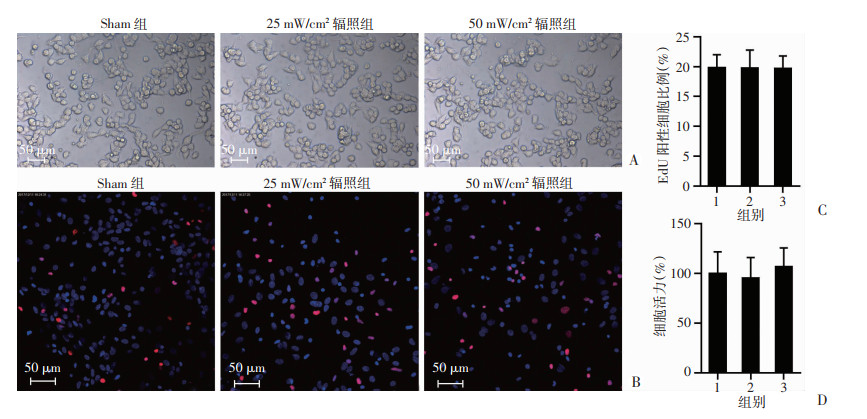
光学显微镜下观察THz辐射暴露后24 h后细胞生长情况,结果显示,25 mW/cm2和50 mW/cm2辐照组细胞数目和细胞成团能力与Sham组相比无明显变化(图 2A)。在此基础上,采用EdU掺入法进一步检测细胞增殖能力变化情况。结果显示,THz辐射暴露细胞5 min,于暴露后24 h时EdU阳性细胞比例与Sham组相比差异无统计学意义(图 2B、C)。同时,CCK-8比色法检测细胞活力,结果也未见明显变化(图 2D)。
|
|
1:Sham组;2:25 mW/cm2辐照组;3:50 mW/cm2辐照组 A:光镜观察各组细胞生长;B:EdU染色检测各组细胞增殖变化;C:各组EdU阳性细胞比例分析;D:CCK-8检测各组细胞活力 图 2 THz辐射暴露细胞增殖变化(n=5) |
2.3 THz辐射暴露后细胞凋亡情况
将细胞采用不同平均功率密度THz辐射暴露5 min,于暴露后24 h,采用细胞免疫荧光法检测细胞核中γH2AX变化情况。结果显示,25 mW/cm2和50 mW/cm2辐照组γH2AX阳性细胞比例无明显改变(图 3A、B)。进一步通过TUNEL试剂盒检测细胞凋亡情况,与Sham组比较,辐照组细胞凋亡也未见明显增加(图 3C、D),并且凋亡相关基因Bax和Bcl2的mRNA表达均未见明显改变(图 3E、F)。

|
|
1:Sham组;2:25 mW/cm2辐照组;3:50 mW/cm2 辐照组A:γH2AX染色检测各组DNA链断裂改变;B:各组γH2AX阳性细胞比例分析;C:TUNEL检测各组细胞凋亡;D:各组TUNEL阳性细胞比例分析;E:各组Bax mRNA表达;F:各组Bcl2 mRNA表达 图 3 THz辐射暴露后细胞凋亡情况(n=5) |
2.4 THz辐射暴露损伤细胞突触生长
Neuro-2a细胞在RA诱导下可分化产生神经元,其突触生长能反映神经元的成熟情况。结果显示,50 mW/cm2辐射组暴露后48 h,经RA诱导产生的神经元突触长度以及由胞体上产生的分支数显著低于Sham组(P < 0.01),而25 mW/cm2辐照组并不引起突触生长发生改变(图 4A~C)。通过实时荧光定量PCR检测突触生长及功能相关的基因Tubb3和Syp的表达水平,结果显示仅50 mW/cm2辐照组Tubb3和Syp的mRNA表达明显降低(P < 0.05,图 4D、E)。

|
|
1:Sham组;2:25 mW/cm2组;3:50 mW/cm2组;a:P < 0.01,b:P < 0.05,与Sham组比较 A:光镜观察各组胞体上突触生长情况;B:各组突触长度;C:各组胞体突触分支数目;D:各组Tubb3 mRNA表达;E:各组Syp mRNA表达 图 4 THz暴露后细胞突触生长变化情况(n=5) |
3 讨论
随着THz辐射从理论走向现实,作为一种新开发利用的电磁辐射频段,其生物效应研究日益受到关注。本研究采用0.22 THz辐射暴露小鼠神经母细胞瘤细胞株——Neuro-2a细胞,发现THz辐射暴露以非热效应为主,能够损伤细胞的突触生长,而并不改变细胞的增殖和凋亡。
神经系统是电磁辐射作用于机体的敏感靶系统,无论是极低频,还是射频段(包括微波)已有大量关于神经系统生物效应的研究,比如50 Hz极低频电磁辐射可以促进神经发生及神经元突触生长[18-19],高功率微波暴露损伤大鼠学习记忆功能[20],然而THz辐射对于神经系统的影响尚不明确。尽管已有THz辐射对神经系统生物效应的报道[13-14],但相关研究较少。神经细胞突触生长是脑发育过程中的重要事件,涉及神经纤维投射、突触形成及神经元成熟等。我们既往研究发现突触生长是极低频(50 Hz)和射频(1 800 MHz)电磁辐射作用于神经系统的敏感靶点[19, 21],但是THz频段的电磁辐射对神经细胞突触生长的效应尚不明确。基于文献[22-24]报道,结合本研究结果,提示THz辐射是否影响神经细胞突触生长受到细胞类型、THz频率、波型、功率密度、暴露时间等因素的影响。此外,各实验室进行体外细胞暴露的实验体系千差万别,特别是细胞暴露过程中对温度和培养基体积的控制(水对THz辐射具有明显的吸收),对THz暴露的剂量效应关系影响很大。因此,全面揭示THz辐射的神经生物效应亟需大量研究。
目前,THz生物效应研究的相关文献较少,关于暴露参数(频率、功率密度、时间等)与生物效应之间的剂量效应关系尚不清楚。TITOVA等[25]将人造人体三维皮肤组织暴露于功率密度为57 mW/cm2的THz辐射10 min后,可诱导H2AX磷酸化增加,上调细胞周期和肿瘤抑制相关蛋白的表达。然而,BOURNE等[26]报道,将背根神经节神经母细胞(ND7/23细胞系)和原代培养皮肤角质细胞暴露于功率密度为24 mW/cm2和62 mW/cm2的0.14 THz辐射10 min或24 h后,角质细胞的活力和屏障功能、神经元分化能力以及反映细胞应激反应的谷胱甘肽和热休克蛋白70表达均未受影响;而且我们前期动物皮肤暴露实验结果也显示,功率密度为50 mW/cm2的THz辐射暴露导致皮肤组织明显损伤。因此,在体外细胞效应研究中,本研究采用25 mW/cm2和50 mW/cm2两种功率密度,以便与文献报道和前期实验结果比较。
既往研究表明,THz辐射存在热效应和非热效应[27-29]。由于水对THz辐射的吸收非常显著,当功率密度较高时,THz辐射的能量被细胞培养基吸收引起其温度升高,同时,THz辐射本身作用于细胞中的生物大分子,引起其分子高速振动、碰撞、摩擦产热,导致细胞温度升高,随之产生一系列生理功能改变甚至损伤效应。根据现有基于细胞水平的THz辐射生物效应结果来看,当THz暴露引起培养基温度上升超过1 ℃时,就能引起细胞活力、细胞增殖、细胞周期等的改变,部分应激性分子如热休克蛋白升高,甚至出现γH2AX表达升高和DNA损伤及染色体分离异常[25, 30-32],例如以功率密度为84.8 mW/cm2的THz辐射暴露人皮肤成纤维细胞,发现细胞培养基温度升高达3 ℃,细胞热休克蛋白表达显著增加[27];当以较低功率密度的THz辐射进行暴露时,辐射能量不足以引起细胞培养基温度显著升高,但是THz辐射可能通过改变生物大分子自身的共振、谐振状态,进而改变DNA双链的动态稳定性(DNA breathing dynamics)、影响酶的活性等,从而产生生物效应[33-34]。本研究显示,两种平均功率密度的THz辐射暴露,其细胞培养基温度升高与Sham组相比均不超过1 ℃,而细胞突触生长受到抑制,提示THz辐射非热效应产生的损伤效应同样需要引起重视。我们既往研究发现1 800 MHz电磁辐射能抑制神经细胞突触生长[21],同在非热效应的暴露剂量下,THz辐射也可损伤神经细胞突触生长。与射频辐射相比,THz辐射由于频率更高,其穿透细胞的深度更浅。因此,我们推测其抑制细胞突触生长的机制有别于射频辐射,需要进一步深入研究。
综上,本研究发现,0.22 THz暴露在50 mW/cm2时,能够明显损伤Neuro-2a细胞的突触生长。提示神经细胞突触生长是THz辐射暴露所致细胞损伤的靶点,为后期深入研究揭示THz辐射暴露所致神经细胞损伤特点,阐明相关分子机制提供了实验依据。
| [1] |
CROWE T W, GLOBUS T, WOOLARD D L, et al. Terahertz sources and detectors and their application to biological sensing[J]. Philos Trans Royal Soc Lond Ser A: Math Phys Eng Sci, 2004, 362(1815): 365-377. DOI:10.1098/rsta.2003.1327 |
| [2] |
谢莎, 李浩然, 李玲香, 等. 太赫兹通信技术综述[J]. 通信学报, 2020, 41(5): 168-186. XIE S, LI H R, LI L X, et al. Survey of terahertz communication technology[J]. J Commun, 2020, 41(5): 168-186. DOI:10.11959/j.issn.1000-436x.2020107 |
| [3] |
陈小霞, 李玉钊, 安建波, 等. 太赫兹近场成像雷达系统误差补偿方法[J]. 太赫兹科学与电子信息学报, 2019, 17(1): 1-7. CHEN X X, LI Y Z, AN J B, et al. Error compensation methods of terahertz near-field imaging radar system[J]. J Terahertz Sci Electron Inf Technol, 2019, 17(1): 1-7. DOI:10.11805/TKYDA201901.0001 |
| [4] |
SUN Q S, HE Y Z, LIU K, et al. Recent advances in terahertz technology for biomedical applications[J]. Quant Imaging Med Surg, 2017, 7(3): 345-355. DOI:10.21037/qims.2017.06.02 |
| [5] |
STERCZEWSKI L A, NOWAK K, SZLACHETKO B, et al. Chemometric evaluation of THz spectral similarity for the selection of early drug candidates[J]. Sci Rep, 2017, 7(1): 14583. DOI:10.1038/s41598-017-14819-6 |
| [6] |
LEE D K, KANG J H, KWON J, et al. Nano metamaterials for ultrasensitive terahertz biosensing[J]. Sci Rep, 2017, 7(1): 8146. DOI:10.1038/s41598-017-08508-7 |
| [7] |
DORADLA P, JOSEPH C, GILES R H. Terahertz endoscopic imaging for colorectal cancer detection: Current status and future perspectives[J]. World J Gastrointest Endosc, 2017, 9(8): 346-358. DOI:10.4253/wjge.v9.i8.346 |
| [8] |
PLUSQUELLIC D F, SIEGRIST K, HEILWEIL E J, et al. Applications of terahertz spectroscopy in biosystems[J]. ChemPhysChem, 2007, 8(17): 2412-2431. DOI:10.1002/cphc.200700332 |
| [9] |
SUN Y W. A promising diagnostic method: terahertz pulsed imaging and spectroscopy[J]. World J Radiol, 2011, 3(3): 55. DOI:10.4329/wjr.v3.i3.55 |
| [10] |
YU C, FAN S, SUN Y, et al. The potential of terahertz imaging for cancer diagnosis: a review of investigations to date[J]. Quant Imaging Med Surg, 2012, 2(1): 33-45. DOI:10.3978/j.issn.2223-4292.2012.01.04 |
| [11] |
YANG X, ZHAO X, YANG K, et al. Biomedical applications of terahertz spectroscopy and imaging[J]. Trends Biotechnol, 2016, 34(10): 810-824. DOI:10.1016/j.tibtech.2016.04.008 |
| [12] |
ROMANENKO S, BEGLEY R, HARVEY A R, et al. The interaction between electromagnetic fields at megahertz, gigahertz and terahertz frequencies with cells, tissues and organisms: risks and potential[J]. J R Soc Interface, 2017, 14(137): 20170585. DOI:10.1098/rsif.2017.0585 |
| [13] |
BONDAR N P, KOVALENKO I L, AVGUSTINOVICH D F, et al. Behavioral effect of terahertz waves in male mice[J]. Bull Exp Biol Med, 2008, 145(4): 401-405. DOI:10.1007/s10517-008-0102-x |
| [14] |
KIRICHUK V F, ANTIPOVA O N, KRYLOVA Y A. Effect of continuous irradiation with terahertz electromagnetic waves of the NO frequency range on behavioral reactions of male albino rats under stress conditions[J]. Bull Exp Biol Med, 2014, 157(2): 184-189. DOI:10.1007/s10517-014-2521-1 |
| [15] |
PI H F, LI M, TIAN L, et al. Enhancing lysosomal biogenesis and autophagic flux by activating the transcription factor EB protects against cadmium-induced neurotoxicity[J]. Sci Rep, 2017, 7: 43466. DOI:10.1038/srep43466 |
| [16] |
CHEN C H, MA Q L, DENG P, et al. Critical role of TRPC1 in thyroid hormone-dependent dopaminergic neuron development[J]. Biochim Biophys Acta Mol Cell Res, 2017, 1864(10): 1900-1912. DOI:10.1016/j.bbamcr.2017.07.019 |
| [17] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
CUCCURAZZU B, LEONE L, PODDA M V, et al. Exposure to extremely low-frequency (50 Hz) electromagnetic fields enhances adult hippocampal neurogenesis in C57BL/6 mice[J]. Exp Neurol, 2010, 226(1): 173-182. DOI:10.1016/j.expneurol.2010.08.022 |
| [19] |
MA Q L, CHEN C H, DENG P, et al. Extremely low-frequency electromagnetic fields promote in vitro neuronal differentiation and neurite outgrowth of embryonic neural stem cells via up-regulating TRPC1[J]. PLoS ONE, 2016, 11(3): e0150923. DOI:10.1371/journal.pone.0150923 |
| [20] |
WANG H, PENG R Y, ZHAO L, et al. The relationship between NMDA receptors and microwave-induced learning and memory impairment: a long-term observation on Wistar rats[J]. Int J Radiat Biol, 2015, 91(3): 262-269. DOI:10.3109/09553002.2014.988893 |
| [21] |
CHEN C H, MA Q L, LIU C, et al. Exposure to 1800 MHz radiofrequency radiation impairs neurite outgrowth of embryonic neural stem cells[J]. Sci Rep, 2014, 4: 5103. DOI:10.1038/srep05103 |
| [22] |
ZHI T S, CHENG T P, QING L L, et al. Exposure effects of terahertz waves on primary neurons and neuron-like cells under nonthermal conditions[J]. Biomed Environ Sci, 2019, 32(10): 739-754. |
| [23] |
PERERA P, APPADOO D, CHEESEMAN S, et al. PC 12 pheochromocytoma cell response to super high frequency terahertz radiation from synchrotron source[J]. Cancers, 2019, 11(2): 162. DOI:10.3390/cancers11020162 |
| [24] |
DUKA M V, DVORETSKAYA L N, BABELKIN N S, et al. Numerical and experimental studies of mechanisms underlying the effect of pulsed broadband terahertz radiation on nerve cells[J]. Quantum Electron, 2014, 44(8): 707-712. DOI:10.1070/qe2014v044n08abeh015486 |
| [25] |
TITOVA L V, AYESHESHIM A K, GOLUBOV A, et al. Intense THz pulses cause H2AX phosphorylation and activate DNA damage response in human skin tissue[J]. Biomed Opt Express, 2013, 4(4): 559. DOI:10.1364/boe.4.000559 |
| [26] |
BOURNE N, CLOTHIER R H, D'ARIENZO M, et al. The effects of terahertz radiation on human keratinocyte primary cultures and neural cell cultures[J]. Altern Lab Animals, 2008, 36(6): 667-684. DOI:10.1177/026119290803600610 |
| [27] |
WILMINK G J, RIVEST B D, ROTH C C, et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation[J]. Lasers Surg Med, 2011, 43(2): 152-163. DOI:10.1002/lsm.20960 |
| [28] |
KIM K T, PARK J, JO S J, et al. High-power femtosecond-terahertz pulse induces a wound response in mouse skin[J]. Sci Rep, 2013, 3: 2296. DOI:10.1038/srep02296 |
| [29] |
BOGOMAZOVA A N, VASSINA E M, GORYACHKOVSKAYA T N, et al. No DNA damage response and negligible genome-wide transcriptional changes in human embryonic stem cells exposed to terahertz radiation[J]. Sci Rep, 2015, 5: 7749. DOI:10.1038/srep07749 |
| [30] |
ALEXANDROV B S, PHIPPS M L, ALEXANDROV L B, et al. Specificity and heterogeneity of terahertz radiation effect on gene expression in mouse mesenchymal stem cells[J]. Sci Rep, 2013, 3: 1184. DOI:10.1038/srep01184 |
| [31] |
FRANCHINI V, DE SANCTIS S, MARINACCIO J, et al. Study of the effects of 0.15 terahertz radiation on genome integrity of adult fibroblasts[J]. Environ Mol Mutagen, 2018, 59(6): 476-487. DOI:10.1002/em.22192 |
| [32] |
DE AMICIS A, DE SANCTIS S, CRISTOFARO S D, et al. Biological effects of in vitro THz radiation exposure in human foetal fibroblasts[J]. Mutat Res-Gen Toxi En, 2015, 793: 150-160. DOI:10.1016/j.mrgentox.2015.06.003 |
| [33] |
ALEXANDROV B S, GELEV V, BISHOP A R, et al. DNA breathing dynamics in the presence of a terahertz field[J]. Phys Lett A, 2010, 374(10): 1214-1217. DOI:10.1016/j.physleta.2009.12.077 |
| [34] |
HOMENKO A, KAPILEVICH B, KORNSTEIN R, et al. Effects of 100 GHz radiation on alkaline phosphatase activity and antigen-antibody interaction[J]. Bioelectromagnetics, 2009, 30(3): 167-175. DOI:10.1002/bem.20466 |



