太赫兹(terahertz,THz)波是指频率为0.1~10 THz的电磁波,它在电磁波谱中所处的位置非常特殊,其长波长方向主要属于电子学范畴,而其短波长方向主要属于光子学范畴,所以太赫兹波段也被称为“太赫兹空隙(THz Gap)”。随着电子学和光子学技术的快速发展,太赫兹波应用在通讯、雷达、安检和生物医学等诸多领域逐渐成为可能[1],许多生物大分子如核酸、蛋白质,以及细胞的吸收、共振及谐振频段均处于太赫兹波段[2],利用太赫兹波可以获得丰富的生物学信息,使得THz波在医学成像和检测上具有巨大的潜在应用前景。
THz医学成像技术的应用需明确太赫兹辐射的生物效应,如太赫兹辐射敏感器官生物效应的量效关系、损伤特点,太赫兹医学成像应用是否具有生物安全性等。但是,目前针对THz波生物效应与生物安全性的研究却较少,远远落后于其应用研究的进展,涉及太赫兹波应用的生物安全性问题尚未解决[3]。尽管如此,已有研究表明,THz电磁辐射暴露可造成细胞明显的热效应损伤,包括影响细胞增殖、细胞周期及DNA损伤修复等重要的生理过程[4-5],且在无明显热效应的情况下,仍可观察到太赫兹所致细胞损伤,提示有非热效应存在[6]。由于其频率特性和医学应用前景,目前国内外太赫兹辐射生物效应研究多集中于太赫兹辐射对皮肤组织和皮肤细胞的生物效应研究。已有研究表明,太赫兹电磁辐射暴露可引起动物皮肤组织病理损伤[7-9],并可导致皮肤细胞DNA损伤和增殖活性降低[10]。然而,目前对太赫兹辐射的皮肤组织生物效应及其机制研究仍很不全面。本研究拟利用动物太赫兹局部暴露模型,观察太赫兹辐射暴露对皮肤炎症反应的影响,并进一步研究NLRP3炎性小体活化在其中的作用。
1 材料与方法 1.1 实验动物C57BL/6J雄性小鼠,年龄10~12周龄,体质量40~ 60 g,购于陆军军医大学实验动物中心。常规动物饲料喂养,光照周期12/12 h,温度22~25 ℃,湿度50%~ 70%。用随机数字表法将实验动物分4组:采用频率为0.22 THz,峰值功率密度分别为0(对照组)、25(25 mW/cm2组)、80(80 mW/cm2组)、160 mW/cm2(160 mW/cm2组)辐照小鼠,每组6只,每组再根据暴露时间分为5 min和10 min两个亚组,各3只。实验动物暴露结束之后立即取样本进行相关指标检测。所有动物实验处理遵循陆军军医大学实验动物操作规范和动物伦理准则,获得陆军军医大学实验动物伦理审查委员会批准(AMUWEC20200528)。手术操作都在麻醉下进行,尽量减少实验动物的痛苦。
1.2 太赫兹源及暴露方式本研究中应用的太赫兹源系中国工程物理研究院应用电子学研究所研制,采用折叠波导行波管技术路线。系统主要包括折叠波导行波管高压电源、0.22 THz返波管源、折叠波导行波管放大器、触发和控制系统等。主要工作原理:系统阴极发射出电子,在周期永磁系统产生的磁场约束下在电子束通道内传输,在0.22 THz返波管源产生的太赫兹波信号的激励下电子束产生群聚,并与折叠波导慢波结构中的电磁波相互作用并放大,最后,放大的信号由输出窗输出。输出的太赫兹波经过定向耦合器后,通过角锥喇叭天线辐射照射到效应物。太赫兹源中心频率0.22 THz,输出功率1.18 W,3 dB带宽3.5 GHz, 占空比从1:1~1:10可调,太赫兹源实物和动物暴露方式见图 1。

|
| A:太赫兹暴露装置;B:动物暴露示意图 图 1 太赫兹暴露装置及动物暴露示意图 |
小鼠暴露处皮肤毛发去除干净,四肢固定于木质平台上,置于太赫兹源角锥天线上方,通过调节小鼠与天线口距离调整太赫兹暴露的功率密度。本实验中太赫兹峰值功率密度分别为0、25、80、160 mW/cm2,占空比1:5,每天暴露1次,每次辐射暴露5 min和10 min,连续2周。
1.3 实时定量荧光PCR分析暴露部位的皮肤组织经液氮速冻后研磨,加入RNAiso Plus(宝生物,日本)试剂裂解皮肤组织提取总RNA,具体步骤详见产品说明书。按照逆转录试剂盒(宝生物,日本)说明书步骤取1.0 μg总RNA将其逆转录为cDNA模板以进行后续基因表达检测。采用荧光定量检测试剂SYBR Master Mix(宝生物,日本)及荧光定量PCR仪(CFX96,美国伯乐)进行相关基因mRNA表达分析,引物序列见表 1。以β-actin为内参,采用2-ΔΔCt方法计算mRNA表达量。
| 基因名称 | 引物(5′→3′) | 产物长度/bp |
| IL-1β | 上游ACGGACCCCAAAAGATGAAG 下游TTCTCCACAGCCACAATGAG | 139 |
| IL-6 | 上游CAAAGCCAGAGTCCTTCAGAG 下游GTCCTTAGCCACTCCTTCTG | 150 |
| β-actin | 上游ACCTTCTACAATGAGCTGCG 下游CTGGATGGCTACGTACATGG | 147 |
1.4 皮肤组织炎症因子检测
暴露部位的皮肤组织经液氮速冻后剪碎,置于1 mL预冷的RIPA裂解液,玻璃匀浆器冰上匀浆。匀浆液经12 000 r/min 4 ℃离心15 min,收集上清。分别采用Abcom公司小鼠ELISA检测试剂盒检测皮肤组织中IL-1β、PGE2和IL-6含量。操作方法按照产品说明书:包被稀释抗体4 ℃过夜。次日洗涤3次,后加入皮肤组织匀浆上清,置37 ℃孵育1 h,洗涤3次。加入第二抗体,37 ℃孵育30~60 min,洗涤3次。加入TMB底物溶液0.1 mL,37 ℃ 20 min,洗涤3次后加入2 mol/L硫酸0.05 mL。M200荧光酶标仪(Tecan,瑞士)测定450 nm波长下的光密度值[D(450)],IL-1β、PGE2和IL-6含量表示为pg/mg。
1.5 皮肤组织氧化应激检测皮肤组织中的超氧化物歧化酶(MDA)和脂质过氧化产物丙二醛(SOD)含量采用碧云天公司测试剂盒。皮肤样品制备同上。MDA检测主要步骤:按照试剂盒说明书配制好MDA检测工作液及MDA标准品。将标准品或皮层组织匀浆同MDA检测工作液在EP管中混合,置于电浴锅中100 ℃加热15 min。将就含有上述反应EP管在1 000×g离心10 min,将上清吸取100 μL到透明96孔板中,测定532 nm波长下的光密度值[D(532)];测定各样品中的蛋白浓度,将样品的MDA含量标准化为μmol/mg。SOD含量检测:测定532 nm波长下的光密度D(532)按照试剂盒说明,配置好WST工作液和酶工作液。在96孔板中配置好样品测试孔及空白孔,将96孔板放置于37 ℃中孵育20 min;将96孔板至酶标仪读取波长450 nm处的光密度值[D(450)],计算各样品的抑制率。检测体系中SOD酶活力单位=抑制百分率/(1-抑制百分率),测定各样品中的蛋白浓度,将样品的SOD的活性标准化为U/mg。
1.6 Western blot检测太赫兹辐射暴露后,取小鼠皮肤组织,RIPA裂解液提取组织蛋白,BCA试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳后,250 mA、100 min转至PVDF膜。NLRP3一抗(1:1 000,NOVUS公司)、Caspase-1一抗(1:1 000,NOVUS公司)、IL-1β一抗(1:1 000,Abcom公司,美国)和β-actin一抗(1:2 000,Sigma公司)4 ℃孵育过夜。辣根过氧化物酶标记羊抗兔二抗(1:1 000,碧云天)室温孵育1 h。加入化学发光试剂,ChemiDocTM XRS+凝胶成像系统(Bio-Rad,美国)中曝光检测。
1.7 统计学分析采用SPSS 18.0统计软件进行分析。数值以x±s表示,多组数值之间采用单因素方差分析,并以Tukey test进行组间两两比较,检验水准α=0.05。
2 结果 2.1 太赫兹辐射暴露对大鼠皮肤炎症因子的影响皮肤炎症因子的mRNA和蛋白检测结果显示,25 mW/cm2组和80 mW/cm2组THz暴露5、10 min均未导致皮肤IL-1β的表达水平发生显著变化,160 mW/cm2组THz辐射暴露5 min同样也未引起皮肤IL-1β水平改变,但暴露10 min可导致皮肤IL-1β和PGE2含量显著升高(P < 0.05)。与上述结果相似的是,25 mW/cm2组和80 mW/cm2组THz暴露5、10 min均未引起皮肤IL-6含量显著升高,但160 mW/cm2组THz辐射暴露5 min和10 min导致了皮肤IL-6水平升高(P < 0.05,图 2)。
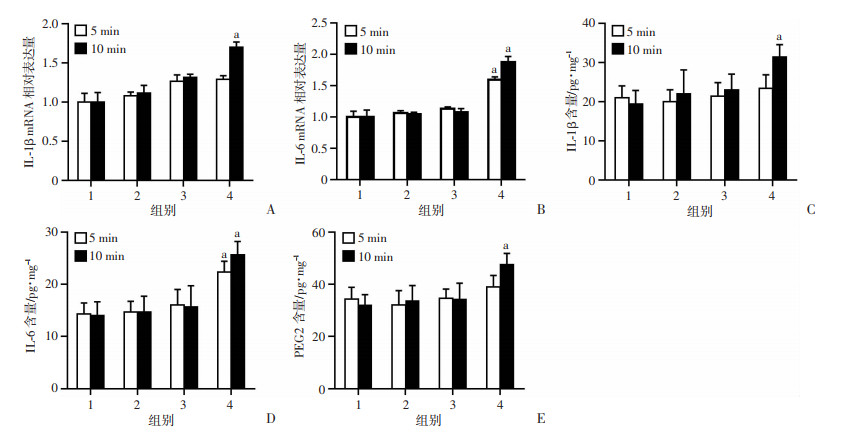
|
| 1:对照组;2:25 mW/cm2组;3:80 mW/cm2组;4:60 mW/cm2组;a, :P < 0.05,与对照组比较 A:IL-1β mRNA相对表达量;B:IL-6 mRNA相对表达量;C:IL-1β水平;D:IL-6浓度;E:PEG2水平 图 2 不同功率THz暴露不同时间后皮肤组织炎症因子表达(n=3) |
2.2 太赫兹辐射暴露致大鼠皮肤氧化应激反应
25 mW/cm2组、80 mW/cm2组THz暴露5、10 min不引起皮肤组织氧化应激反应,160 mW/cm2组THz辐射暴露5 min和10 min均可导致皮肤组织的氧化应激反应,表现为皮肤组织MDA升高,SOD降低(P < 0.05,图 3)。

|
| 1:对照组;2:25 mW/cm2组;3:80 mW/cm2组;4:160 mW/cm2组;a:P < 0.05,与对照组比较 A:SOD活性;B:MDA含量 图 3 不同功率THz暴露不同时间后皮肤氧化应激改变(n=3) |
2.3 太赫兹辐射暴露激活皮肤组织NLRP3炎症小体
80 mW/cm2组和160 mW/cm2组的太赫兹辐射暴露10 min可导致小鼠皮肤组织Caspase-1活化体p20 (Casp1 p20)表达水平显著升高(P < 0.05,P < 0.01)。80 mW/cm2组和160 mW/cm2组的太赫兹辐射暴露同样导致皮肤组织中IL-1β含量升高(P < 0.05,P < 0.01)。这些结果显示,80 mW/cm2组和160 mW/ cm2组的太赫兹辐射暴露能够激活小鼠皮肤组织NLRP3炎症小体。此外,Caspase-1活性测定结果与上述结果一致,80 mW/cm2组和160 mW/cm2组的太赫兹辐射暴露可引起皮肤组织内Caspase-1酶活性显著增强(图 4)。
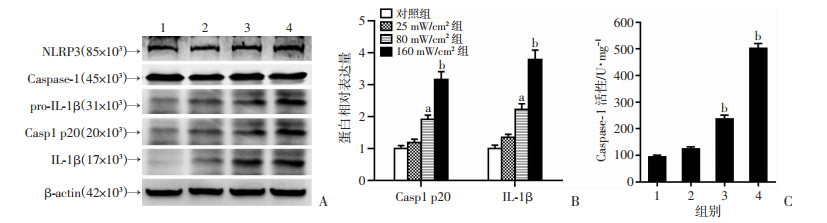
|
| A:太赫兹辐射暴露后皮肤组织NLRP3炎症小体活化蛋白表达;B:太赫兹辐射暴露后皮肤组织Casp1 p20和IL-1β相对表达;C:太赫兹辐射暴露后皮肤组织内Caspase-1活性变化 1:对照组;2:25 mW/cm2组;3:80 mW/cm2组;4:160 mW/cm2组;a:P < 0.05,b:P < 0.01,与对照组比较 图 4 太赫兹辐射激活皮肤组织NLRP3炎症小体(n=3) |
2.4 NLRP3炎症小体激活介导太赫兹辐射导致的皮肤组织炎症
采用Caspase-1特异性抑制剂Z-YVAD处理小鼠,发现Z-YVAD可显著抑制太赫兹辐射暴露导致的Caspase-1活化为标志的NLRP3炎性小体激活。并且,抑制NLRP3炎性小体活化(Z-YVAD处理),同样显著降低了太赫兹辐射暴露后小鼠皮肤组织IL-1β、PGE2和IL-6含量(P < 0.05,P < 0.01, 图 5)。
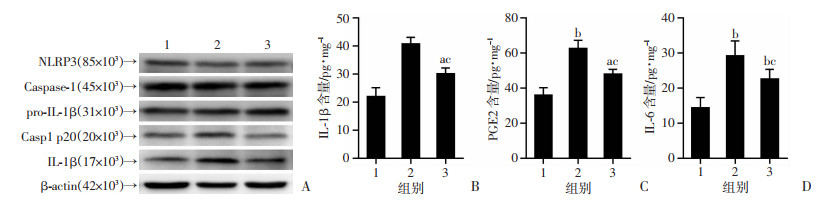
|
| A:Z-YVAD对太赫兹所致皮肤NLRP3炎症小体激活的抑制;B~D:分别为Z-YVAD对太赫兹所致皮肤炎症因子IL-1β、PEG2和IL-6表达的影响 1:对照组;2: THz暴露组;3:Z-YVAD处理后THz暴露组;a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,与THz暴露组比较 图 5 抑制NLRP3炎症小体激活减轻太赫兹辐射所致的皮肤炎症因子释放(n=3) |
3 讨论
太赫兹光谱分析已经实验性地用于皮肤病理、成分分析和检测,如皮肤癌的早期光谱分析和3D成像,以及皮肤黑色素含量检测[11-12]。然而,另有一些研究表明,太赫兹电磁辐射暴露作用于皮肤后,可以引起皮肤组织的病理损伤[7],具体表现为皮下渗出、水肿等炎性反应。太赫兹所致的皮肤组织炎性反应可能源于高强度长时间太赫兹辐射暴露后引起的皮肤热效应损伤[13]。然而,目前太赫兹致使皮肤损伤,或是太赫兹热效应引起皮肤损伤的原因机制并不清楚。
氧化应激反应已被证明在多个其他频段的电磁辐射引起的组织细胞损伤中发挥了重要作用。例如,900、1 800、2 100 MHz射频电磁辐射暴露可引起动物脑组织脂质过氧化和DNA氧化性损伤[14]。本研究发现,太赫兹电磁辐射暴露可导致皮肤组织内MDA升高,SOD含量降低,表明太赫兹辐射可引起皮肤组织发生氧化应激反应。氧化应激可能是太赫兹引起皮肤损害的途径之一。既往研究表明,炎性反应是电磁辐射致机体损伤的重要机制[15-16],THz辐射作为电磁波谱的组成部分,同样可能诱导皮肤的炎症反应。本实验结果证实了这一推测,太赫兹辐射暴露引起了皮肤IL-1β、IL-6和PEG2等炎性因子含量的升高。这些皮肤的炎症反应,可能由太赫兹所致的氧化应激损伤引起。因为,先前的研究已经表明,氧化应激是炎症反应的重要诱因[17]。
炎性小体是细胞内的一类蛋白复合物,在内源性和外源性刺激引起的固有免疫反应防御中发挥重要作用。NLRP3炎性小体是目前研究最为透彻的一种炎性小体,由识别蛋白NLRP3、连接蛋白ASC和效应蛋白Caspase-1构成[18]。NLRP3炎性小体被激活后,Caspase-1裂解为p10和p20亚基,剪切IL-1β前体生成成熟的IL-1β,并可导致细胞发生焦亡[18-19]。已有多个研究表明,NLRP3炎性小体可被多种外源性物理刺激激活,如紫外线和电离辐射,并介导组织的无菌性炎症[20-21]。本实验结果显示,太赫兹辐射同样能够激活NLRP3炎症小体,并且介导了太赫兹辐射引起的皮肤组织炎症。另一方面,太赫兹辐射暴露后,皮肤NLRP3炎性小体的激活,同样可能由太赫兹引起的氧化应激介导,因为氧化应激生成的ROS是激活NLRP3炎性小体的主要机制[22]。
太赫兹在皮肤疾病检测、诊断中的应用前景广阔,因此其对皮肤的生物效应和安全性显得尤为重要。本研究结果部分揭示了太赫兹辐射对皮肤损伤效应的可能机制,提示在以后太赫兹应用过程中应尤其注意暴露强度和时间的控制。并且,本研究结果也为可能的太赫兹暴露皮肤损伤的防护和救治提供思路,应重点关注皮肤炎症,阻断氧化应激和NLRP3炎症小体的激活。当然,太赫兹辐射对皮肤的损伤,仍然需要进一步、更全面的研究。
| [1] |
CROWE T W, GLOBUS T, WOOLARD D L, et al. Terahertz sources and detectors and their application to biological sensing[J]. Philos Trans A Math Phys Eng Sci, 2004, 362(1815): 365-374. DOI:10.1098/rsta.2003.1327 |
| [2] |
PLUSQUELLIC D F, SIEGRIST K, HEILWEIL E J, et al. Applications of terahertz spectroscopy in biosystems[J]. ChemPhysChem, 2007, 8(17): 2412-2431. DOI:10.1002/cphc.200700332 |
| [3] |
SUN Q, HE Y, LIU K, et al. Recent advances in terahertz technology for biomedical applications[J]. Quant Imaging Med Surg, 2017, 7(3): 345-355. DOI:10.21037/qims.2017.06.02 |
| [4] |
PERERA P, APPADOO D, CHEESEMAN S, et al. PC 12 pheochromocytoma cell response to super high frequency terahertz radiation from synchrotron source[J]. Cancers, 2019, 11(2): 162. DOI:10.3390/cancers11020162 |
| [5] |
FRANCHINI V, DE SANCTIS S, MARINACCIO J, et al. Study of the effects of 0.15 terahertz radiation on genome integrity of adult fibroblasts[J]. Environ Mol Mutagen, 2018, 59(6): 476-487. DOI:10.1002/em.22192 |
| [6] |
ALEXANDROV B S, PHIPPS M L, ALEXANDROV L B, et al. Specificity and heterogeneity of terahertz radiation effect on gene expression in mouse mesenchymal stem cells[J]. Sci Rep, 2013, 3: 1184. DOI:10.1038/srep01184 |
| [7] |
JO S J, YOON S Y, LEE J Y, et al. Biological effects of femtosecond-terahertz pulses on C57BL/6 mouse skin[J]. Ann Dermatol, 2014, 26(1): 129-132. DOI:10.5021/ad.2014.26.1.129 |
| [8] |
KIM K T, PARK J, JO S J, et al. High-power femtosecond-terahertz pulse induces a wound response in mouse skin[J]. Sci Rep, 2013, 3: 2296. DOI:10.1038/srep02296 |
| [9] |
HWANG Y, AHN J, MUN J, et al. In vivo analysis of THz wave irradiation induced acute inflammatory response in skin by laser-scanning confocal microscopy[J]. Opt Express, 2014, 22(10): 11465-11475. DOI:10.1364/oe.22.011465 |
| [10] |
CHEN C, MA Q, DENG P, et al. Critical role of TRPC1 in thyroid hormone-dependent dopaminergic neuron development[J]. Biochim Biophys Acta Mol Cell Res, 2017, 1864(10): 1900-1912. DOI:10.1016/j.bbamcr.2017.07.019 |
| [11] |
RAHMAN A, RAHMAN A K, RAO B. Early detection of skin cancer via terahertz spectral profiling and 3D imaging[J]. Biosens Bioelectron, 2016, 15(82): 64-70. DOI:10.1016/j.bios.2016.03.051 |
| [12] |
PERALTA X G, LIPSCOMB D, WILMINK G J, et al. Terahertz spectroscopy of human skin tissue models with different melanin content[J]. Biomed Opt Express, 2019, 10(6): 2942-2955. DOI:10.1364/boe.10.002942 |
| [13] |
ZILBERTI L, ARDUINO A, BOTTAUSCIO O, et al. Parametric analysis of transient skin heating induced by terahertz radiation[J]. Bioelectromagnetics, 2014, 35(5): 314-323. DOI:10.1002/bem.21842 |
| [14] |
ALKIS M E, BILGIN H M, AKPOLAT V, et al. Effect of 900-, 1800-, and 2100-MHz radiofrequency radiation on DNA and oxidative stress in brain[J]. Electromagn Biol Med, 2019, 38(1): 32-47. DOI:10.1080/15368378.2019.1567526 |
| [15] |
TSOY A, SALIEV T, ABZHANOVA E, et al. The effects of mobile phone radiofrequency electromagnetic fields on β-amyloid-induced oxidative stress in human and rat primary astrocytes[J]. Neuroscience, 2019, 408: 46-57. DOI:10.1016/j.neuroscience.2019.03.058 |
| [16] |
JEONG Y, SON Y, HAN N K, et al. Impact of long-term RF-EMF on oxidative stress and neuroinflammation in aging brains of C57BL/6 mice[J]. Int J Mol Sci, 2018, 19(7): 2103. DOI:10.3390/ijms19072103 |
| [17] |
MCGARRY T, BINIECKA M, VEALE D J, et al. Hypoxia, oxidative stress and inflammation[J]. Free Radic Biol Med, 2018, 125: 15-24. DOI:10.1016/j.freeradbiomed.2018.03.042 |
| [18] |
SCHRODER K, TSCHOPP J. The inflammasomes[J]. Cell, 2010, 140(6): 821-832. DOI:10.1016/j.cell.2010.01.040 |
| [19] |
LAMKANFI M, DIXIT V M. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 157(5): 1013-1022. DOI:10.1016/j.cell.2014.04.007 |
| [20] |
AHMAD I, MUNEER K M, CHANG M E, et al. Ultraviolet radiation-induced downregulation of SERCA2 mediates activation of NLRP3 inflammasome in basal cell carcinoma[J]. Photochem Photobiol, 2017, 93(4): 1025-1033. DOI:10.1111/php.12725 |
| [21] |
LIU Y G, CHEN J K, ZHANG Z T, et al. NLRP3 inflammasome activation mediates radiation-induced pyroptosis in bone marrow-derived macrophages[J]. Cell Death Dis, 2017, 8(2): e2579. DOI:10.1038/cddis.2016.460 |
| [22] |
ABDERRAZAK A, SYROVETS T, COUCHIE D, et al. NLRP3 inflammasome: from a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J]. Redox Biol, 2015, 4: 296-307. DOI:10.1016/j.redox.2015.01.008 |



