太赫兹(terahertz,THz)辐射是指频率为0.1~10 THz的电磁波。由于核酸、蛋白质等生物大分子的谐振频率均处于太赫兹波段[1],太赫兹检测在生物医学领域具有广泛应用前景。应用太赫兹光谱技术,国内外多个研究已经进行了多种生物分子的检测,包括氨基酸、DNA和蛋白质[2-4],以及多种疾病的分子标志物,获得了这些分子的太赫兹光谱特征[5-6]。另外,太赫兹成像已被研究应用于离体和在体组织成像检测,如皮肤和肝癌组织的太赫兹成像[7-8]。另一方面,太赫兹辐射的医学应用要求明确其生物效应和生物安全性。已有研究显示,太赫兹辐射可使小鼠皮肤发生炎症反应[9]。在细胞水平,也观察到了太赫兹辐射暴露可引起细胞明显的热效应损伤,包括抑制细胞增殖和导致细胞凋亡[10-11]。尽管如此,目前针对太赫兹波生物效应与生物安全性的研究仍较少,涉及太赫兹辐射医学应用的生物安全性问题尚未解决。
视觉系统是太赫兹辐射暴露的主要靶器官之一,主要原因是太赫兹辐射波长较短,其组织穿透能力有限,主要作用于体表组织器官。并且,视觉系统是一个折光系统,能将透过的太赫兹辐射聚焦投射在视网膜上,这种会聚作用会造成视网膜暴露的剂量增加[12]。目前尚无太赫兹辐射视觉系统生物效应的研究,因此揭示太赫兹辐射对视觉系统尤其是视网膜的生物效应是其安全应用于医学检测和诊断的重要前提之一。
本实验通过太赫兹辐射暴露小鼠眼部,采用RNA-seq技术对暴露所引起的视网膜基因表达变化进行系统分析,并进一步通过生物信息学方法对筛选出的差异基因进行富集分析及聚类分析,以此揭示太赫兹辐射暴露对视网膜组织的生物效应。我们还在RNA-seq筛选出的差异表达基因中进一步根据基因功能,选出变化幅度大、对视网膜功能有关键调控作用的基因进行表达验证,以期揭示反应视网膜损伤的关键敏感基因,为全面揭示太赫兹辐射在视觉系统的生物效应奠定基础。
1 材料与方法 1.1 实验动物C57BL/6J雄性小鼠12只,年龄6~8周龄,体质量18~20 g,由陆军军医大学实验动物中心提供。实验动物分为对照组及辐照组,每组6只。小鼠于辐照前采用托吡卡胺散瞳,辐照组接受平均功率密度为80 mW/cm2、光斑直径为5 mm的太赫兹辐射暴露,暴露时间为2 min。对照组动物除不接受太赫兹辐射暴露外,其他处理同辐照组。根据实验设计,分别于暴露后5 min及24 h取视网膜进行相关指标检测。
所有实验操作严格按照动物伦理规范进行,获得陆军军医大学实验动物伦理审查委员会批准(AMUWEC 20200528)。
1.2 太赫兹暴露系统采用的太赫兹辐射源系中国工程物理研究院最新研制的CTFEL太赫兹源装置。采用直流高压光阴极电子枪作为高亮度电子束源,采用超导加速器作为主加速段来获得高平均功率电子束,电子束经过束流传输系统进入摇摆器,在摇摆器中实现束波相互作用产生太赫兹辐射。太赫兹辐射的频率主要通过调节摇摆器的间隙实现;功率的调节通过电子束能量以及摇摆器磁场强度调节。太赫兹辐射在激光谐振腔中放大直至饱和,通过激光谐振腔下游镜输出,传输到各个束线站。其相关参数如下:中心频率1~3.5 THz,谱半高宽 < 2%,平均功率>10 W,微脉冲长度 < 1 ps,微脉冲功率>0.5 mW,微脉冲重频54.17 MHz,微脉冲间隔18.5 ns,初始发散角28 mrad,宏脉冲重频1~1 000 Hz,宏脉冲间隔时间200 ns至1 ms,时间抖动 < 300 fs。
小鼠麻醉、散瞳,固定接受辐照,辐照过程中采用红外热像仪实时监测小鼠眼部温度变化情况。
1.3 转录组测序(RNA-seq)分析于暴露结束后5 min取小鼠视网膜组织,迅速冻入液氮,RNA提取及测序等均由上海派诺森公司负责,具体流程简述如下:总RNA提取(TRIzol试剂)→RNA质量检测(每组保证RIN值>8.0的样本4个)→mRNA纯化→mRNA片段化(200~300 bp)→cDNA合成→PCR富集建库→文库质检→Illumina平台上机测序。
测序完成后,首先对原始下机数据(raw data)进行过滤,将过滤后得到的高质量序列(clean data)比对到该物种的参考基因组上。根据比对结果,计算每个基因的表达量。在此基础上,进一步采用Dseq软件对样品进行表达差异分析。差异表达基因(differential expression genes, DEGs)的筛选标准采用:P < 0.05,|logFC|≥1。然后将筛选出的DEG进行富集分析和聚类分析等。其中GO注释采用Blast2go软件,KEGG分析采用KAAS软件。
1.4 Real-time PCR检测相关基因表达小鼠于辐照结束后5 min及24 h取视网膜组织, 迅速冻入液氮保存,每组取4个样本。将组织剪碎、研磨,采用TRIzol(Invitrogen,美国)试剂提取总RNA,并将其逆转录为cDNA,Real-time PCR扩增所用各基因引物序列见表 1。
| 基因名称 | 引物序列 | 片段大小/bp |
| Foxe3 | 上游5′-CATACATCGCGCTCATTGCC-3′ 下游5′-GATGCTGTTCTGCCACTTGC-3′ | 134 |
| Serpine3 | 上游5′-AGAAACGGGACAAACTTCGTC-3′ 下游5′-GTCTTGCACTGTATAGCCGAG-3′ | 126 |
| Lix1 | 上游5′-GACTGGTGGTCTATGAGTCAATG-3′ 下游5′-TGATGAGCGCCACTTTAGCAG-3′ | 147 |
| Rpe65 | 上游5′-ACTAACAGCTCATGTCACAGGC-3′ 下游5′-AAACAGGTGATAGAAAGGCTCAG-3′ | 109 |
| Rgr | 上游5′-CCTCAATGGCCTGACCATCTT-3′ 下游5′-GCTGCAACAAGGGCATTCA-3′ | 123 |
| Arsi | 上游5′-CAGGATTGCAGCACTCCATTA-3′ 下游5′-TCCTTCCGGTAGAAGCCCAG-3′ | 142 |
| Krt12 | 上游5′-CCTACCTGGGTAAGGTTCGCT-3′ 下游5′-GTTCTCCGTGTTTCATACCACT-3′ | 85 |
| Cfd | 上游5′-TACATGGCTTCCGTGCAAGTG-3′ 下游5′-CACAGAGTCGTCATCCGTCA-3′ | 117 |
| Wnt3a | 上游5′-CTCCTCTCGGATACCTCTTAGT-3′G 下游5′-CCAAGGACCACCAGATCGG-3′ | 75 |
| Adipoq | 上游5′-TGTTCCTCTTAATCCTGCCCA-3′ 下游5′-CCAACCTGCACAAGTTCCCTT-3′ | 104 |
1.5 统计学分析
采用GraphPad Prism 8.0统计软件进行分析,实验结果以x±s表示,先采用单因素方差分析,再采用Fisher’s post hoc检测进行两两比较,检验水准α=0.05。
2 结果 2.1 太赫兹辐射暴露所致眼部升温特点为探讨太赫兹辐射暴露对视觉系统的影响,将实验动物小鼠麻醉、散瞳,暴露于平均功率密度为80 mW/cm2的太赫兹辐射,暴露时长2 min。暴露过程中,采用功率仪监测强太赫兹源的实时发射功率,其发射功率在暴露过程中变化幅度不超过±5 mW,小鼠眼部温度通过红外热像仪进行实时监测。形态学观察结果表明太赫兹辐射暴露后,未见眼部角膜、晶状体等组织有明显变化。眼部升温曲线结果表明,眼部平均升温幅度不超过1.5 ℃,而最高温度变化在3 ℃以内(图 1)。该结果显示,在太赫兹辐射暴露眼部时,能量并非全部在表层组织吸收,有大部分能量能够透过角膜组织穿透到眼部更深层次。

|
| 图 1 太赫兹辐射暴露后眼部升温曲线 |
2.2 太赫兹辐射暴露所致视网膜基因表达变化整体特征
为全面揭示太赫兹辐射暴露所致视网膜损伤的整体特征,对暴露后小鼠视网膜组织进行RNA-seq分析。为减少生物学差异对测试结果的影响,每组取4个样本,测试结果表明每个样本的Map总数均在35 000 000以上,Map率均在97%以上,说明测序质量较为可靠。差异基因表达分析结果显示,共筛选出17 909个基因,以P < 0.05、|logFC|≥1为筛选条件,其中17 275个基因无明显变化,上调基因625个,下调基因9个(图 2A)。通过对这些筛选出的DEG进行PPI聚类分析,发现有两处聚类较高的基因簇(基因数>10),其余大部分为散在分布(基因数<5),见图 2B。这些高度相关性基因表明太赫兹辐射暴露可能对视网膜某些特定功能产生明显的影响。
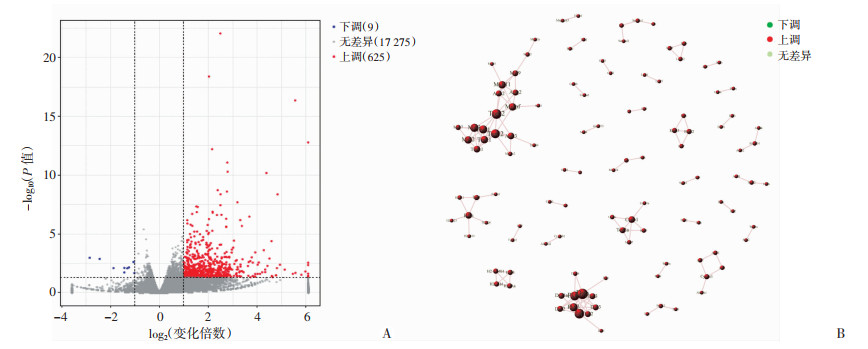
|
| A:火山图显示强太赫兹暴露后差异基因的总体情况 红色点表示上调基因;蓝色点表示下调基因;B:蛋白质相互作用网络分析显示所有差异基因之间的内在联系 图 2 太赫兹辐射暴露后RNA-seq分析视网膜基因变化整体情况 |
2.3 太赫兹辐射暴露所致视网膜差异基因GO分析
为深入分析太赫兹辐射暴露所致差异基因主要影响细胞哪些功能,将全部差异基因进行了GO富集分析。GO富集分析结果按照分子功能、生物过程和细胞组分进行GO分类,图 3所示为每个GO分类中富集最显著的前10个GO子集条目。从该结果可以看出,细胞组分分类中主要是细胞外成分(细胞外区域部分、细胞外区域),表明强太赫兹暴露所影响的基因主要是编码细胞外成分的蛋白;分子功能分类中变化最为显著的子集主要包括蛋白结合(同型蛋白结合、蛋白结合)、钙离子通道蛋白结合以及蛋白二聚体活性等;生物过程分类中变化最为显著的为发育相关子集(组织发育、发育过程、系统发育)、与外界有害因素刺激反应相关子集(细胞外刺激反应、应激系统)、细胞增殖、细胞黏附等(图 3)。
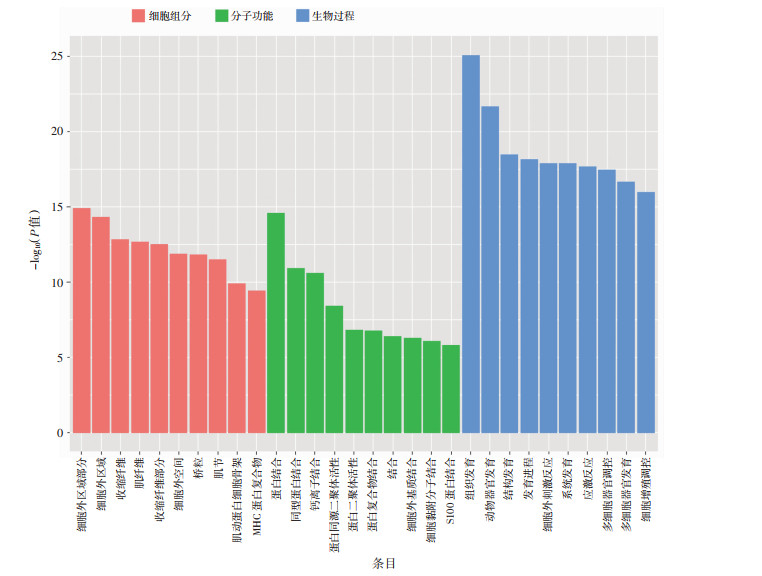
|
| 根据P值大小及基因数进行显著性排序,显示每个项目的前10个子集条目 图 3 太赫兹辐射暴露后差异基因GO分析 |
为进一步分析这些受影响的GO子集条目在整个GO富集图中所处的层级关系,进行了GO有向无环图(directed acyclic graph, DAG)的分析。DAG富集图中方形图所示为排列前10位的子集条目在生物过程(图 4A)和分子功能(图 4B)中分别所处的层级关系,结果显示太赫兹辐射暴露所致差异基因聚集的子集条目在整个分类中所处的层级高低。
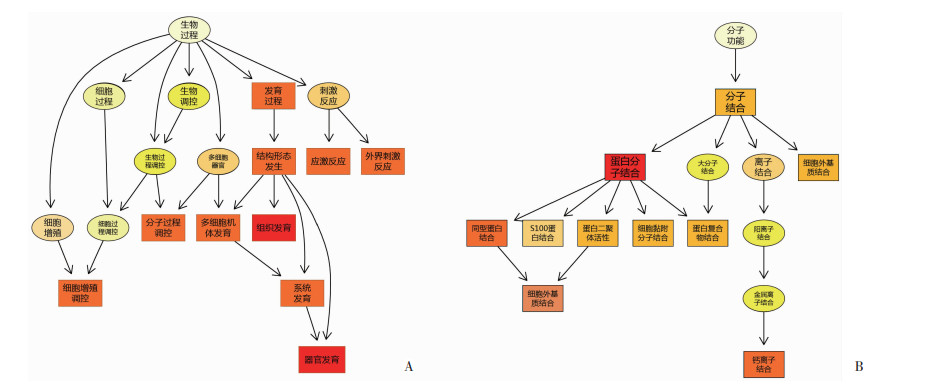
|
|
显著性高的前10个GO子集为方形,其他的GO子集为圆形。越接近根结点的GO子集越概括,往下分支的GO子集为注释到更细层级的子集。颜色越深,代表该GO子集越显著,颜色由浅到深为无色-浅黄-深黄-红色 A:生物过程DAG富集图;B:分子功能DAG富集图 图 4 太赫兹辐射暴露后差异基因GO DAG富集图 |
2.4 太赫兹辐射暴露所致视网膜差异基因KEGG通路分析
根据前述条件所筛选出的DEGs,进一步进行KEGG信号通路富集分析,根据富集结果,通过富集指数、FDR值和富集到此通路上的基因个数来衡量富集的程度,制作了富集气泡图,该图列出了差异显著的前20个KEGG条目(图 5)。由图 5可知,DEGs主要集中于以下这些信号通路:PPAR信号通路,癌症相关信号通路,细胞紧密连接,钙离子信号通路,PI3K-AKT信号通路,以及与代谢相关的一些信号通路。KEGG信号通路的富集分析揭示了太赫兹辐射暴露后可能影响的细胞功能及潜在分子机制。
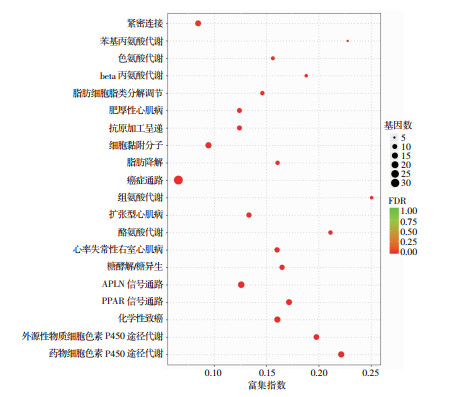
|
| 富集指数指该通路中富集到的差异基因个数与注释到的基因个数的比值。富集指数越大,表示富集的程度越大。FDR一般取值范围为0~1,越接近于零,表示富集越显著 图 5 太赫兹辐射暴露后差异基因KEGG信号通路分析 |
2.5 太赫兹辐射暴露所致视网膜损伤相关重要基因的表达变化
为进一步在DEG中寻找影响视网膜损伤的关键基因,根据GO及KEGG分析结果,将所有下调表达基因及上调表达基因前20个的功能进行了进一步分析(表 2),并从中筛选出与视网膜功能相关的基因进行了表达验证,以揭示太赫兹辐射暴露对其影响的时效关系。这些基因包括与视网膜病变直接相关的基因Rpe65、Rgr、Arsi及Adipoq,以及通过炎症,细胞老化、凋亡等间接影响视网膜功能的基因Foxe3、Serpine3、Lix1、Krt12、Cfd及Wnt3a。分别在强太赫兹辐射暴露后5 min及24 h取样,检测相关基因表达,由图 6可知,Foxe3、Serpine3、Lix1、Rpe65、Rgr及Arsi在太赫兹辐射暴露后表达出现了明显下降,而Krt12、Cfd、Wnt3a及Adipoq表达出现了明显的升高,并且暴露后5 min基因表达变化明显强于暴露后24 h。
| 基因 | 变化倍数 | 基因描述 |
| 表达下调 | ||
| Foxe3 | -2.85 | 头叉转录因子框E3 |
| Serpine3 | -2.44 | 丝氨酸蛋白酶抑制剂E3 |
| Crygn | -1.87 | 晶状体蛋白,γN |
| Lix1 | -1.43 | 肢体和中枢神经表达1 |
| R3hdml | -1.43 | R3H结构域包含蛋白 |
| Rpe65 | -1.30 | 视网膜色素上皮蛋白65 |
| Nupr1 | -1.24 | 核蛋白转录调节因子1 |
| Rgr | -1.05 | 视网膜G蛋白偶联受体 |
| Arsi | -1.02 | 芳香硫酸酯酶i |
| 表达上调 | ||
| Padi4 | infa | 肽基精氨酸脱亚氨酶Ⅳ |
| Hrasls5 | infa | HRAS样抑制家族,成员5 |
| Gbp11 | infa | 鸟苷结合蛋白11 |
| Ucp1 | 6.09 | 解偶联蛋白1 |
| Ces1f | 5.98 | 羧酸酯酶1F |
| Fam83a | 5.81 | 序列相似家族83, 成员A |
| Slurp1 | 5.57 | 分泌型Ly6结构域包含蛋白1 |
| Pck1 | 5.56 | 胞质型磷酸烯醇丙酮酸羧激酶1 |
| Krt12 | 5.46 | 角蛋白12 |
| Kif2b | 5.13 | 驱动蛋白家族成员2B |
| Cfd | 4.93 | 补体因子D (降脂素) |
| Plin1 | 4.84 | 围脂滴蛋白1 |
| Tmprss11a | 4.81 | 跨膜蛋白酶, 丝氨酸11a |
| Ttll10 | 4.77 | 微管蛋白酪氨酸连接酶家族,成员10 |
| Sdr9c7 | 4.77 | 短链脱氢酶/还原酶家族9C,成员7 |
| Wnt3a | 4.64 | 无翼型MMTV整合位点家族, 成员3A |
| Gm3164 | 4.60 | 预言基因3164 |
| Ubqln3 | 4.60 | 泛醌蛋白3 |
| Adtrp | 4.59 | 激素依赖性TFPI调节蛋白 |
| Adipoq | 4.50 | 脂联素 |
| a:未在对照组测出 | ||

|
| A:Foxe3 mRNA表达;B:Serpine3 mRNA表达;C:Lix1 mRNA表达;D:Rpe65 mRNA表达;E:Rgr mRNA表达;F:Arsi mRNA表达;G:Krt12 mRNA表达;H:Cfd mRNA表达;J:Wnt3a mRNA表达;K:Adipoq mRNA表达a:P < 0.05,b:P < 0.01, 与对照组比较 图 6 强太赫兹暴露对视网膜损伤关键基因表达的影响(n=6) |
3 讨论
近年来,随着太赫兹源技术的快速发展,太赫兹技术在医学领域的应用日趋临近和成熟,急需研究揭示太赫兹生物效应及生物安全性。视觉系统是太赫兹辐射暴露损伤的主要靶点之一,揭示太赫兹辐射暴露对视觉系统尤其是视网膜的影响,是全面揭示太赫兹辐射生物安全性的重要内容之一,也是进一步制定太赫兹安全暴露标准的基础之一。本研究通过RNA-seq技术系统分析了太赫兹辐射暴露所致视网膜组织基因变化情况,并利用生物信息学技术分析这些差异基因所揭示的生物效应及可能的机制,并且还通过Real-time PCR进一步验证了太赫兹辐射暴露对视网膜损伤关键基因表达的时效关系,揭示了太赫兹辐射暴露所致视网膜损伤敏感基因表达变化特征。
从眼部的升温曲线特征来看,太赫兹辐射暴露所致眼部温度升高较皮肤有明显差异,主要表现为平均温度升高不明显,且最高温度的上升幅度也非常小。其中比较重要的原因可能是由于太赫兹辐射在频率上比较接近于可见光,而视觉系统是一个折光系统。因此,有大部分能量可能经过角膜、晶状体和玻璃体等折光系统,最后集中会聚于视网膜,导致投射到视网膜上的太赫兹辐射平均功率密度经过视觉系统会聚后会更高,从而加重视网膜的损伤。这也是视觉系统不同于其他系统的一个比较独特的地方,提示视网膜可能是太赫兹暴露损伤的重要靶点。另一方面,其热效应也与太赫兹辐射功率密度大小有关。目前,太赫兹辐射的应用研究和生物效应研究极大程度上受制于所能获得的太赫兹辐射源,使得各研究组所用功率差异极大,暴露功率密度与暴露时间也不一致[13]。根据文献以及前期实验探索,本研究采用80 mW/cm2暴露2 min,以期获得较为明确的生物效应,为探索其所致的视网膜基因表达改变和潜在的效应机制提供可能。
GO分析显示太赫兹影响的差异表达基因主要编码细胞外成分,而胞外蛋白可能是吸收太赫兹辐射能量较多的地方,会进一步导致蛋白表达变化幅度增加。从分子功能上来讲,主要是影响蛋白结合等相关功能。这可能涉及多种细胞功能,如受体配体结合、酶的结合活性、离子通道的活性等。从差异基因的生物学功能来看,主要是对发育、细胞应激反应及细胞增殖等产生影响。将这些差异表达基因所揭示的功能及通路与KEGG信号通路分析结果结合分析,可推测太赫兹辐射暴露导致视网膜组织改变的机制:一是介导炎症反应,表现为PPAR信号通路、PI3K-Akt信号通路等炎症相关的信号通路的变化[14]。二是影响神经元的信号传导,表现为细胞紧密连接及钙离子通路的改变[15]。三是可能导致DNA损伤,表现为癌症相关信号通路的改变[16]。但是这些功能分析所揭示的太赫兹辐射生物效应需要进一步实验验证。
检测涉及这些功能的具体基因的表达量,结果显示,与视网膜病变及眼部疾病直接相关的基因Rpe65、Rgr、Arsi及Adipoq 表达出现显著变化。前期研究表明,这几个基因均直接调控视网膜功能,在视网膜损伤修复及视网膜相关疾病的发生、发展中发挥了关键作用[17-21]。此外,调控眼部炎症、细胞老化、凋亡及细胞增殖等功能的基因Foxe3、Serpine3、Lix1、Krt12、Cfd及Wnt3a表达也出现变化,这些基因的表达变化可能间接影响视网膜功能或视网膜损伤修复[22-27]。以上这些关键基因的表达变化提示太赫兹辐射暴露后能够造成视网膜损伤,且损伤机制可能与这些关键基因相关,但其具体效应机制仍有待进一步研究。
综上所述,本研究通过对太赫兹辐射暴露后,视网膜组织RNA-seq测序结合生物信息学分析,揭示太赫兹辐射能够导致视网膜组织众多基因表达产生变化。这些差异基因涉及的生物功能提示太赫兹辐射可能造成视网膜组织炎症损伤、视网膜神经元功能损伤及细胞DNA损伤。通过对涉及视网膜病理损伤的关键基因表达验证分析,发现Rpe65、Rgr、Arsi、Adipoq、Foxe3、Serpine3、Lix1、Krt12、Cfd及Wnt3a 等基因在其中扮演了关键角色,为下一步研究太赫兹视觉系统损伤的具体效应及机制提供了新的方向。尽管如此,本研究结果并未揭示太赫兹辐射对视网膜效应的细胞特异性,以及太赫兹辐射是否可引起视网膜组织病理和视觉功能的改变。因此,应进一步研究太赫兹辐射对视网膜组织和细胞的损伤效应及其分子机制,以及上述基因表达改变在这些效应中所发挥的作用。
| [1] |
WANG C L, GONG J X, XING Q R, et al. Application of terahertz time-domain spectroscopy in intracellular metabolite detection[J]. J Biophotonics, 2010, 3(10/11): 641-645. DOI:10.1002/jbio.201000043 |
| [2] |
CHEON H, YANG H J, LEE S H, et al. Terahertz molecular resonance of cancer DNA[J]. Sci Rep, 2016, 6: 37103. DOI:10.1038/srep37103 |
| [3] |
LIU Y, ZHOU T, CAO J C. Terahertz spectral of enantiomers and racemic amino acids by time-domain-spectroscopy technology[J]. Infrared Phys Technol, 2019, 96: 17-21. DOI:10.1016/j.infrared.2018.10.026 |
| [4] |
HAN X, YAN S, ZANG Z, et al. Label-free protein detection using terahertz time-domain spectroscopy[J]. Biomed Opt Express, 2018, 9(3): 994-1005. DOI:10.1364/boe.9.000994 |
| [5] |
LI T, MA H, PENG Y, et al. Gaussian numerical analysis and terahertz spectroscopic measurement of homocysteine[J]. Biomed Opt Express, 2018, 9(11): 5467-5476. DOI:10.1364/boe.9.005467 |
| [6] |
CHEN W, PENG Y, JIANG X, et al. Isomers identification of 2-hydroxyglutarate acid disodium salt (2HG) by terahertz time-domain spectroscopy[J]. Sci Rep, 2017, 7(1): 12166. DOI:10.1038/s41598-017-11527-z |
| [7] |
RONG L, LATYCHEVSKAIA T, CHEN C, et al. Terahertz in-line digital holography of human hepatocellular carcinoma tissue[J]. Sci Rep, 2015, 5: 8445. DOI:10.1038/srep08445 |
| [8] |
FAN S, UNG B S Y, PARROTT E P J, et al. In vivo terahertz reflection imaging of human scars during and after the healing process[J]. J Biophotonics, 2017, 10(9): 1143-1151. DOI:10.1002/jbio.201600171 |
| [9] |
HWANG Y, AHN J, MUN J, et al. In vivo analysis of THz wave irradiation induced acute inflammatory response in skin by laser-scanning confocal microscopy[J]. Opt Express, 2014, 22(10): 11465-11475. DOI:10.1364/oe.22.011465 |
| [10] |
WILMINK G J, RIVEST B D, ROTH C C, et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation[J]. Lasers Surg Med, 2011, 43(2): 152-163. DOI:10.1002/lsm.20960 |
| [11] |
PERERA P, APPADOO D, CHEESEMAN S, et al. PC 12 pheochromocytoma cell response to super high frequency terahertz radiation from synchrotron source[J]. Cancers, 2019, 11(2): 162. DOI:10.3390/cancers11020162 |
| [12] |
WESTHEIMER G. Focused and defocused retinal images with Bessel and axicon pupil functions[J]. J Opt Soc Am A, 2020, 37(1): 108. DOI:10.1364/josaa.37.000108 |
| [13] |
WILMINK G J, GRUNDT J E. Invited review article: current state of research on biological effects of terahertz radiation[J]. J Infrared Millim Terahertz Waves, 2011, 32(10): 1074-1122. DOI:10.1007/s10762-011-9794-5 |
| [14] |
ZHANG H, GONG M, LUO X L. Methoxytetrahydro-2H-pyran-2-yl)methyl benzoate inhibits spinal cord injury in the rat model via PPAR-γ/PI3K/p-Akt activation[J]. Environ Toxicol, 2020, 35(6): 714-721. DOI:10.1002/tox.22902 |
| [15] |
BOUSSADIA B, GANGAROSSA G, MSELLI-LAKHAL L, et al. Lack of CAR impacts neuronal function and cerebrovascular integrity in vivo[J]. Exp Neurol, 2016, 283(part A): 39-48. DOI:10.1016/j.expneurol.2016.05.018 |
| [16] |
ZENKE F T, ZIMMERMANN A, SIRRENBERG C, et al. Pharmacologic inhibitor of DNA-PK, M3814, potentiates radiotherapy and regresses human tumors in mouse models[J]. Mol Cancer Ther, 2020, 19(5): 1091-1101. DOI:10.1158/1535-7163.mct-19-0734 |
| [17] |
YANG U, GENTLEMAN S, GAI X, et al. Utility of in vitro mutagenesis of RPE65 protein for verification of mutational pathogenicity before gene therapy[J]. JAMA Ophthalmol, 2019, 137(12): 1-9. DOI:10.1001/jamaophthalmol.2019.3914 |
| [18] |
LI S, XIAO X, YI Z, et al. RPE65 mutation frequency and phenotypic variation according to exome sequencing in a tertiary centre for genetic eye diseases in China[J]. Acta Ophthalmol, 2020, 98(2): e181-e190. DOI:10.1111/aos.14181 |
| [19] |
MORSHEDIAN A, KAYLOR J J, NG S Y, et al. Light-driven regeneration of cone visual pigments through a mechanism involving RGR opsin in Müller glial cells[J]. Neuron, 2019, 102(6): 1172-1183. DOI:10.1016/j.neuron.2019.04.004 |
| [20] |
OSHIKAWA M, USAMI R, KATO S. Characterization of the arylsulfatase I (ARSI) gene preferentially expressed in the human retinal pigment epithelium cell line ARPE-19[J]. Mol Vis, 2009, 15: 482-494. |
| [21] |
LI H Y, HONG X, CAO Q Q, et al. Adiponectin, exercise and eye diseases[J]. Int Rev Neurobiol, 2019, 147: 281-294. DOI:10.1016/bs.irn.2019.07.006 |
| [22] |
TRZECIECKA A, CARMY T, HACKAM A S, et al. Lipid profiling dataset of the Wnt3a-induced optic nerve regeneration[J]. Data Brief, 2019, 25: 103966. DOI:10.1016/j.dib.2019.103966 |
| [23] |
MCKEY J, MARTIRE D, DE SANTA BARBARA P, et al. LIX1 regulates YAP1 activity and controls the proliferation and differentiation of stomach mesenchymal progenitors[J]. BMC Biol, 2016, 14: 34. DOI:10.1186/s12915-016-0257-2 |
| [24] |
NISHINO T, KOBAYASHI A, MORI N, et al. In vivo histology and p.L132V mutation in KRT12 gene in Japanese patients with Meesmann corneal dystrophy[J]. Jpn J Ophthalmol, 2019, 63(1): 46-55. DOI:10.1007/s10384-018-00643-6 |
| [25] |
LIN R, FU X, LEI C, et al. Intravitreal injection of amyloid β1-42 activates the complement system and induces retinal inflammatory responses and malfunction in mouse[J]. Adv Exp Med Biol, 2019, 1185: 347-352. DOI:10.1007/978-3-030-27378-1_57 |
| [26] |
ROHRER B, GUO Y, KUNCHITHAPAUTHAM K, et al. Eliminating complement factor D reduces photoreceptor susceptibility to light-induced damage[J]. Invest Ophthalmol Vis Sci, 2007, 48(11): 5282-5289. DOI:10.1167/iovs.07-0282 |
| [27] |
WILLIAMS J A, STAMPOULIS D, GUNTER C E, et al. Regulation of C3 activation by the alternative complement pathway in the mouse Retina[J]. PLoS ONE, 2016, 11(8): e0161898. DOI:10.1371/journal.pone.0161898 |



