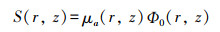在电磁波谱中,太赫兹辐射频段位于红外和微波之间,属于非电离辐射的范畴。通常将太赫兹辐射定义为频率范围在(0.1~10)×1012Hz,波长为30~3 000 μm的电磁波,量子能量E为0.4~41 meV。由于太赫兹辐射既具有量子特性又具有电子特性,太赫兹的应用前景非常广泛。THz脉宽在皮秒级,可用作时间分辨瞬时光谱来分析多种类型的物质特性,且其相干性强,更有助于获得样本准确的折射率和吸收系数。THz辐射的量子能量很低,理论上不会造成组织电离,可用于生物活检[1]。近20年来,随着多种新型THz源和器件的蓬勃发展,THz技术被广泛应用于医疗、军事和安检等领域。在军事和安检中,THz技术被应用于非接触扫描,探查隐藏危险品、毒品、武器等[2-3]。在医疗中,THz技术用于肿瘤、烧伤、创伤等疾病的探测、诊断和分辨是目前的研究热点[4-8]。
近年来,由于THz技术的深入研究和广泛应用前景,THz应用的生物安全性越来越受到关注,而THz生物效应研究是评价THz技术生物安全性的基础和前提,因此THz辐射生物效应的研究也越来越多。现将近年来THz辐射在热效应和非热效应方面生物效应研究的进展,进行总结和展望。
1 THz辐射的热效应频率在射频段以上的非电离辐射,其主要的生物效应来自于热效应,太赫兹也不例外。太赫兹能量传递到生物体,部分能量被生物体吸收、转换,产生热能,因此,热效应也是THz生物效应的主要特征。THz辐射的热效应受两个方面因素的影响:一是THz暴露参数,如频率、光斑大小、暴露时长、辐射通量密度、射束轮廓;二是生物组织的组成和性质,如折射率、吸收率、散射率等。这些因素都会影响到太赫兹辐射在生物组织中的传播、能量分布和热效应。
生物组织在THz频段的吸收特性主要与水分子相关,也与生物大分子相关。当THz能量传递到生物组织,光能量被生色基团如水分子所吸收,然后转变为热能,因此产生显著的温度瞬变,从而造成显著的热效应。皮肤组织吸收的能量可应用THz功率密度、皮肤组织吸收系数进行计算,获得热生成率S(W/m3):
Ф0(r, z)为组织某位置(r, z)的功率密度,μa为该位置的吸收系数。
并可通过获得的S值,计算组织局部温升ΔT:
ΔT为某位置的局部温升,Δt为热暴露的时间,ρ为组织密度(g/m3),c为组织比热[J/(g·K)]。
由于THz能量可被生物组织所吸收,较高功率的THz辐射可能引起生物组织的热效应。THz的热效应通常包括引起组织凝固、破坏结构蛋白、细胞死亡、激活细胞应激反应、细胞器功能障碍等。THz热效应的类型和程度取决于5个方面的因素:①与温度的指数依赖性;②与暴露时长的线性依赖性;③器官、组织、细胞类型;④组织结构和宏观环境(如血液灌注、含水量等);⑤代谢、生理和细胞成分微环境(如pH、O2、CO2、ATP、葡萄糖、代谢产物的水平等)[9]。不同的生物组织中这些因素差别很大,因此,每一种组织表现出截然不同的热敏感性。并且,由于影响热敏感性的因素很多,要精准明确某一特定生物组织的热敏感性也很困难。但在热的作用下,所有的生物组织都表现出类似的反应趋势,可用来将观察到的效应与剂量联系起来。
高温在器官和组织水平可激活急性炎症反应,引起组织干燥和坏死。高温引起的急性炎症反应可持续数日,既用来清除致伤物质,也启动损伤修复过程。炎症反应的经典表征为红肿热痛。这些表征也是血流增加帮助白细胞向受损组织区域移动的结果。当生物组织暴露于80~100 ℃数秒,就会发生干燥和坏死,在50~70 ℃暴露数分钟,就会发生不可逆的胞外蛋白的损伤[10]。在细胞水平,最常见的热效应有:①刺激细胞生长和代谢;②形态改变(肿胀、气泡化、皱缩);③激活细胞应激反应机制;④通过凋亡或坏死引起细胞死亡。在设立THz和可见光的安全标准时,是将可见的组织损伤作为生物效应终点。因此,研究组织的热效应对于制定THz频段的安全标准是非常重要的。
美国空军研究实验室(AFRL)对THz辐射的热效应开展了系列研究。人真皮成纤维细胞于温度控制小室中暴露于2.52 THz(84.8 mW/cm2),辐照过程中细胞温度上升2.9 ℃,随着暴露时长的增加,细胞死亡率也随之上升,在暴露80 min达到最大死亡率(5%)[11]。在系列THz暴露实验中,细胞温度上升2.9~3.0 ℃,THz暴露组和热处理阳性对照组在细胞死亡率和HSP表达水平指标上均呈现相当的变化。因此,研究者认为THz辐照所引起的效应主要是热效应引起的。DALZELL等[12]应用计算模型和实验手段研究确定THz频段短时暴露(数秒)和长时暴露(数分钟)的组织损伤阈值,0.1~1.0 THz短时暴露的组织损伤阈值(ED50)为7.16 W/cm2,组织终末温度为60 ℃,将蛋清样本暴露于1.89 THz,189.92 mW/cm2,样本表现出可见的凝固征象,蛋清的温度在60 min暴露过程中升高了10~12 ℃。
本期陈纯海[13]、高鹏等[14]的研究聚焦THz辐射热效应的敏感组织——皮肤组织,阐明了THz辐射暴露所致皮肤组织损伤的生物效应特点及其潜在的分子机制。研究发现THz辐射具有明显的致皮肤升温效应,且具有剂量依赖性,50 mW/cm2 THz辐照能够导致辐照动物皮肤平均温度迅速升高超过2 ℃, 并且导致辐照部位皮肤组织出现上皮脱落及出血等病理损伤特征。损伤皮肤组织转录组测序发现THz辐照引起与调控机体组织免疫及炎症反应相关的基因表达显著变化,且THz暴露后皮肤炎症因子IL-1β、IL-6及TNF-α表达明显升高。因此,我们课题组的研究发现了THz辐射暴露能够导致暴露部位皮肤出现明显的热效应损伤及引起炎症反应等损伤效应。这一发现提示在开发THz技术的过程中,应该关注THz辐射暴露的热效应量效关系,并研究获得THz辐射热效应的致伤阈值。
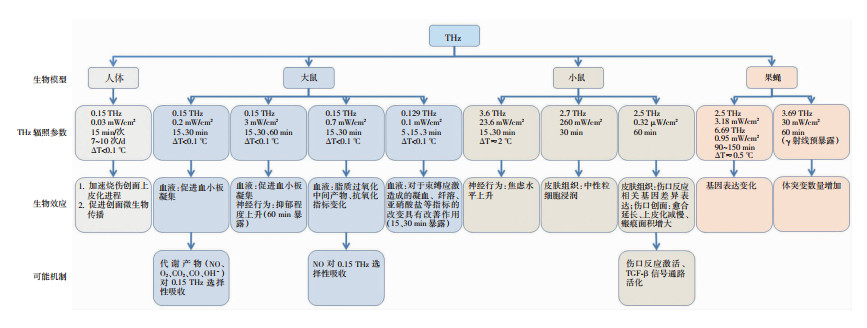
2 THz辐射非热效应 2.1 THz辐射非热效应在体研究在控制温升的前提下,THz辐射生物效应的非热效应在体研究主要集中在大鼠、小鼠模型,也有在人体和模式生物果蝇模型上开展的研究,其主要观察的效应集中在皮肤组织病理变化、创面愈合及血液样本指标的变化(图 1)[15-21]。
|
| 图 1 THz辐射非热效应在体研究 |
在OSTROVSKIY等[15]的研究中,浅度和深度烧伤的患者接受0.15 THz辐照(0.03 mW/cm2,每次辐照15 min,每天进行7~10次辐照)。研究表明THz辐照治疗可通过加速上皮化进程促进局部烧伤创面的修复。对于深度烧伤患者,THz治疗可促进微生物传播达100~1 000倍。在大鼠模型上的THz生物效应研究发现THz暴露可调节大鼠血液凝集功能,动物血液抗氧化水平、血液电解质组成、凝血和纤溶检测指标有显著改变,THz暴露还引起动物抑郁程度上升[16-17]。在小鼠暴露模型上观察到3.6 THz暴露使小鼠焦虑水平显著提升[18]。将小鼠耳朵皮肤暴露于2.7 T脉冲THz,暴露后6 h观察到辐照局部皮肤区域中性粒细胞浸润显著,提示THz辐照引起了受照皮肤的急性炎症反应[19]。KIM等[20]将小鼠暴露于fs-THz脉冲(2.5 THz,脉宽310 fs,0.26 nJ/pulse,0.32 μW/cm2,1 h),辐照后24 h检测到有149个差异表达基因变化强度超过1.5倍,最显著的变化是与修复相关的功能,提示THz辐射引起与伤口反应相关的基因表达变化。变化最显著的两组基因,一组与伤口修复相关(Bmp2、Cd44、Krt6a、Lep、Serpine1、Sprrb1和Thbs1),一组与组织生长相关(Ccl19、Hmgb1、Myf6、Nfatc1、Nr4a1、Nr4a3和Vdr),与伤口反应相关的大部分基因在THz辐照后1 h表达上调。THz辐射的伤口皮肤组织中TGF-β信号通路活化,且THz辐射显著延长了伤口愈合的时间,并观察到暴露组的皮肤伤口上皮化速度减慢、疤痕形成面积更大,提示THz辐射可引起创伤样刺激的细胞反应,并可能影响创面的愈合。果蝇幼虫和成年果蝇分别暴露于FIR激光产生的两种频率的THz辐射,均引起果蝇基因表达的改变。而将预暴露于γ射线的成年果蝇暴露于3.69 THz,30 mW/cm2,暴露时长60 min,THz暴露使果蝇体突变数目显著增加[21]。
本室卢永辉等[22]在小鼠模型上探讨了THz辐射对视网膜组织基因表达的影响,发现THz辐照后视网膜组织数组基因表达有显著变化,主要为细胞外成分,其分子功能主要为影响蛋白结合等,生物功能主要为细胞应激反应与细胞增殖等。差异基因主要影响PPAR信号通路、癌症相关信号通路、钙离子信号通路及PI3K-Akt信号通路等。进一步验证发现,在THz暴露后5 min及24 h,均可上调Krt12、Cfd、Wnt3a及Adipoq表达,下调Foxe3、Serpine3、Lix1、Rpe65、Rgr及Arsi基因表达,且暴露后5 min上调或下调幅度明显强于24 h。THz辐射能够导致视网膜大量基因表达异常,提示THz暴露可能造成视网膜损伤。
2.2 THz辐射非热生物效应离体研究为了明确THz生物效应的机制和THz可能的作用位点,近年来报道了大量的在离体组织、细胞、生物样本上进行的THz效应研究。THz生物效应的离体研究主要集中在细胞活力与增殖、脂质膜结构与功能、基因组与遗传物质、细胞功能这4个方面。
2.2.1 THz辐射对细胞活力与增殖的影响不同的细胞类型对THz辐照的反应不同,THz辐射对细胞活力的影响研究表明,THz辐射可抑制E.coli细胞、HeLa细胞、Hep-2细胞、RH细胞生长,诱导细胞死亡。而人红细胞和淋巴细胞暴露于THz,表现出细胞增殖上升,但照后出现38%的细胞死亡[23]。在酵母细胞中也观察到THz辐射显著促进了细胞生长。THz辐射引起的细胞死亡的机制研究表明,THz诱导的细胞死亡通过凋亡和坏死两种途径。BOROVKAVA等[24]将大鼠胶质细胞C6暴露于THz,辐照1 min引起细胞凋亡上升1.5倍,THz辐照3 min,凋亡细胞上升2倍,该效应与辐照时间呈正相关。
在不同种类的细胞和不同的辐照模型中,也有研究报道THz辐射对细胞活力和细胞增殖等方面未造成影响,如人皮肤角质细胞、角膜细胞、ND7/23细胞、仓鼠成纤维细胞暴露于THz,没有观察到THz暴露影响细胞活力、增殖、膜通透性、热休克蛋白和GSH表达的效应。我们采用Neuro-2a细胞,也没有观察到THz辐射影响细胞增殖和凋亡,与细胞凋亡相关的Bax、Bcl2基因表达无明显改变。
2.2.2 THz辐射对脂质膜结构和功能的影响既往研究表明THz辐射可增加脂质膜通透性。THz辐射引起HeLa细胞、Hep-2细胞和RH细胞细胞膜破坏,THz暴露使人红细胞、成纤维细胞膜通透性上升。RAMUNDO-ORLANDO等[25]采用THz辐照两种含酶催化脂质体:二烯丙基膦酰胆碱(DPCC)和棕榈酰油酸磷脂酰胆碱(POPC),研究表明两种脂质体模型在暴露于脉冲THz辐射后,均表现出膜通透性增高2倍,研究者认为该效应是由于共振机制引起的。
在探索THz皮秒电脉冲用于电穿孔技术的研究中,THz电脉冲(≤500 ps)暴露可诱导大鼠海马神经元产生动作电位,引起大鼠神经膜细胞瘤-胶质瘤杂合细胞NG108钙瞬变,并在1 ns内引起膜通透性改变[26]。
2.2.3 THz辐射对基因组与遗传物质的影响在基因组和遗传物质方面,既往的报道主要研究了THz辐射对DNA链完整性、染色体、基因表达、细胞分裂、微核形成等的影响。THz脉冲辐射引起人胎儿成纤维细胞在暴露后1 h S期细胞比例显著下降,细胞微核数量显著上升,且细胞线粒体基质疏松、线粒体嵴肿胀、粗面内质网扩大、游离多聚核糖体增多,而暴露后24 h均恢复正常,因此这种效应可能是一过性的[27]。机制研究表明,强THz暴露引起多条与细胞应激反应相关的通路活化,且有部分基因(如细胞因子、白介素、凋亡相关基因)在THz暴露组发生显著上调,提示这些上调基因可能作为THz暴露生物标志物的候选。小鼠间充质干细胞暴露于THz 6 h后,在胞质中出现了“脂滴样内含体”,脂联素、GLUT4、FABP4、PPARg等基因在THz辐照后上调超过14倍,且具有时间依赖性,在辐照9 h变化最大[28]。
THz暴露可抑制细胞DNA合成,辐照后在细胞分裂后期和分裂末期出现纺锤体障碍表现,主要是单个染色体不分离或分离滞后[29]。人血液淋巴细胞暴露于连续波THz,染色体11和17对THz辐照最为敏感,THz辐照引起非整倍体率上升,染色体11、17和1中着丝粒复制不同步显著上升,提示THz辐射可诱导基因组不稳定性。成人成纤维细胞HDF暴露于THz,着丝粒阳性微核率和染色体不分离事件在THz辐照后有所上升,提示THz可能通过引起非整倍体形成影响基因组完整性[30]。在仿真人皮肤组织,观察到THz辐射引起H2AX磷酸化显著上升,提示THz脉冲辐射可能引起暴露的皮肤组织DNA损伤,且THz辐照使多个与细胞周期调节及肿瘤抑制的蛋白表达上调(p53、p21、p16、p27、KU70),提示DNA损伤修复机制被迅速地激活了[31]。人胚胎干细胞暴露于THz(2.3 THz,0.14 W/cm2,1 h),没有观察到THz暴露诱导γH2AX焦点形成或结构染色体异常,转录组学研究显示THz辐照后约1%的基因有轻微的变化[32]。
甲基化的胞苷具有THz特征吸收能量,DNA甲基化在THz频段具有特征分子共振指纹,CHEON等[33]将THz辐射应用于DNA甲基化的探测和调节研究,将来源于血液系统肿瘤的DNA样本暴露于THz,发现强THz辐射可引起去甲基化效应,效应程度与肿瘤细胞的类型相关,提示THz辐射可用于DNA甲基化的检测和全DNA甲基化的调控,这可能为THz辐射作为表观遗传调控的工具应用于肿瘤的探测和治疗提供依据。
而在人血液样本和HaCaT、HDF、Neuro-2a细胞中,没有观察到THz辐射诱导微核形成及DNA链断裂。
2.2.4 THz辐射对细胞功能的影响神经系统、造血系统是电磁辐射的敏感系统,因此,THz对神经、造血细胞功能的影响也受到关注。TAN等[34]研究报道了THz暴露引起不同神经元中神经递质含量显著变化,且在不同类型的神经元中变化不同,在海马、小脑和脑干神经元中,THz辐照引起谷氨酸(Glu)含量显著下降,海马神经元中甘氨酸(Gly)和丙氨酸(Ala)含量显著上升,而在皮层神经元中,THz辐照引起Glu显著上升、Ala显著下降。在海马神经元中SYN表达下调,在皮层神经元中PSD95表达下调,海马、皮层神经元及MN9D细胞对THz辐射相对较敏感,且效应与暴露时长呈正相关。THz辐射对神经细胞生长、黏附、膜形态、胞内结构和神经元静息膜电位均有显著影响。较低功率密度THz辐射能够适度刺激大鼠脾细胞溶血素生成,而高功率密度THz辐射则引起溶血素生成下降,THz辐射还可影响脾细胞的迁移功能。在THz辐照E.coli/pKatG-gfp生物感应细胞的研究中,THz辐射可引起细胞产生GFP[35]。本室马秦龙等[36]评价了THz辐射对Neuro-2a细胞突出生长的变化情况,发现THz辐照引起Neuro-2a细胞突出长度和分支数目显著减少,突出生长及功能相关的基因Tubb3和Syp表达显著下调,且具有剂量依赖效应。
这些研究表明,神经细胞是THz辐照的敏感细胞类型之一,虽然THz辐射不影响神经细胞的活力和增殖,不影响细胞凋亡,但对神经细胞的关键功能,如神经递质、突触生长具有明显的效应。因此,深入研究THz辐射对敏感细胞和敏感组织的功能影响的量效特征及可能机制,是阐明THz效应特征和安全性,推动THz在医疗、生物探测、生物成像应用的基础。
3 THz辐射生物效应研究的启示和展望THz辐射因其独特的瞬态性、宽带性、相干性、低能量性、穿透性和吸收性等特性,未来将更加广泛地应用在光谱学、成像技术、医疗、安检、通讯等方面[37]。虽然随着THz应用和研究的逐渐扩展,THz生物效应的研究也日益深入,但由于THz属于非电离辐射的范畴,理论上不会引起物质电离,因此THz的可能危害效应和安全性研究未受到足够的重视。为了THz技术更有效、更安全地应用于不同的领域,有必要加强生物学、医学、光学、计算、电子、物理学等多学科领域的交叉合作,在不断开发应用THz技术的同时,对于THz辐射生物效应研究也提出了以下启示和展望。
3.1 THz生物效应研究亟需加强顶层设计和多方合作THz覆盖频段较为宽泛,研究模型、源体和研究环境控制的差别造成不同研究团队的结果很难进行比较。不同的研究团队采用的THz源不同,目前应用比较广泛的THz源的类别主要有直接产生激光源、固态电子装置(频率上转换)和加速电子源这3大类,每一类源体产生THz波的原理和波束路径构成不尽相同,因此其造成的生物效应也各不相同;不同研究中的THz辐照参数不同,包括THz源中心频率、发射功率、功率密度、连续波或脉冲波、脉冲参数(重复频率、脉冲宽度、脉冲间隔、脉冲功率等)、辐照时间、光斑大小等,这就造成了很难将不同的研究进行对比分析,且很难重复;应用于THz生物效应研究的不同生物模型,由于不同的生物模型组织结构差异较大,存在生物种属之间的差异问题;THz辐射生物效应研究的环境控制对生物效应结果的影响不容忽视,由于THz辐射引起的热效应是其生物效应的主要因素,进行THz生物效应实验时的环境温度和温度控制也影响着THz生物效应实验结果,目前的细胞实验既有在室温下进行的,也有在温度控制的培养箱环境下进行的,由于室温远低于细胞生长的适宜温度,是否会抵消或影响部分由于温度变化引起的生物效应,也是在THz生物效应研究中应该考虑的问题。
未来应规范THz辐射生物效应研究模型建立程序,增加不同团队THz辐射效应研究结果的可比性,开展多中心、源体共享联合THz生物效应研究,以同类源体开展生物效应研究,获得可比对的剂量-效应反应关系。加强THz效应实验环境控制,进行热效应研究时,采用计算模拟和实测相结合的方式获得温升数据,并开展普通加热方式对照,明确热效应特征和效应机制;进行非热效应研究时,控制实验环境温度和局部暴露温度,最大可能地消除暴露环境对实验结果的影响。
3.2 THz生物安全性研究是THz辐射未来应用的前提,量效关系是核心问题THz辐射安全性评价是未来THz技术广泛应用的前提,而系统的THz生物效应研究是开展THz安全性评价的基础。目前THz辐射生物效应研究主要集中在急性暴露效应,剂量效应特征研究积累不够,阈值研究证据尚不充分,而对于THz长期慢性暴露效应缺乏评估,THz辐射是否具有远后遗传效应也尚不清楚,无法就现有研究结果绘制清晰的剂量-效应曲线,而制定安全标准和应用安全性评估还需要系统开展剂量效应特征研究和长期慢性效应研究;THz辐射安全性评价仍然缺少敏感器官和组织的效应研究数据。目前的研究较为分散,且在细胞层次的研究较多,而在组织和器官层次的研究较少。因此,在细胞模型上发现的效应和机制需要进一步在动物、组织和器官层面进行验证,才可能为评估THz辐射的人体应用安全性和明确THz辐射应用的安全阈值提供证据。
未来应进一步开展系统的THz生物效应的量效关系研究,划分THz亚频段开展量效关系研究,按照亚频段分别获得THz辐射产生损伤效应阈值,为制定和规范THz暴露安全标准提供科学依据;对THz辐照整体动物的重点功能器官、组织进行分系统、分功能、分指标的安全性评价,为THz技术安全应用于人体奠定基础;在不同种属动物开展同种效应和机制研究,明确THz在不同种属动物的共性效应特征和种属差异性效应特征。同时,开展THz长期慢性暴露生物效应评估,明确THz长期慢性暴露的效应特征和量效关系。随着THz技术在不同领域的应用越来越广泛,人类接触THz辐射的机会和时间也越来越多。因此,要明确THz长期慢性暴露的生物效应,特别是THz慢性长期暴露对人基因组、遗传物质的影响,并研究THz慢性长期暴露是否具有远后遗传效应。这是长期安全有效地应用THz技术的前提和基础。
3.3 THz辐射关键分子事件研究是THz辐射生物效应和防护研究的基础THz辐射生物效应研究是开发THz在生物医疗领域应用潜能的奠基石,解析THz辐射关键分子事件是获得THz辐射生物效应机理和研究THz辐射防护的前提。目前关于THz辐射的机制研究建立在基因组分析和零散信号通路研究的基础上,虽然有THz对部分细胞生长和致死亡类型的初步探讨,但仍然缺乏系统研究和多种类型细胞研究的证据。在THz生物效应中,发生了哪些关键分子事件,如哪些细胞死亡的类型(如凋亡、坏死、焦亡等)在THz致细胞死亡过程中起关键作用,THz辐射是否引起细胞氧化应激反应,炎症反应在THz生物效应中的作用,THz辐射是否影响细胞自噬,THz辐射对神经递质生成、传递的影响机制,THz与遗传物质相互作用机制等,都有待进一步研究。
因此,未来应进一步围绕膜通透性机制、细胞死亡机制、炎性反应机制、氧化应激机制、THz-遗传物质相互作用机制、表观遗传机制等关键分子事件深入开展THz生物效应的机制研究,为进一步探讨THz生物医学应用和THz技术安全性奠定基础。
3.4 THz辐射对生物大分子的影响研究是解析THz生物效应和THz技术在生物医疗领域应用的关键生物组织的介电属性和生物大分子在THz频段响应特征复杂,是影响THz辐射生物效应研究的难点和瓶颈问题。THz辐射生物效应的观察与生物组织、细胞的状态有关,在体和离体组织、活体和固定组织的生物特性、介电特性、生物大分子的组成和含水量有很大不同,而活体生物组织介电属性的研究也受到活体组织培养、培养介质属性和活体组织状态的影响,由不同方式获得的生物组织介电特性和含水量的不同,直接导致对THz生物效应的观察在不同状态的生物组织和细胞上有不同的结果。
生物体由具有不同功能的生物大分子组成,不同的生物大分子在THz频段有着不同的共振响应和指纹特征,这就为应用THz技术实现分子层面的活体检测和成像,以及THz辐射应用在分子层面的疾病治疗提供了可能。未来应进一步系统开展生物组织和生物大分子THz吸收特征研究,从生物组织介电特征、含水量、透射率、折射率、生物大分子组成等方面开展THz能量吸收、传递和分布研究,系统阐明不同生物组织THz能量吸收和分布机制,系统解析THz辐射对重要的生物大分子的影响及响应指纹谱,这是深入揭示THz生物效应机制和开发未来THz生物医疗应用的基础。
随着人类对THz技术研究的不断深入和应用的日益广泛,为将THz技术尽早且安全地用于通讯、医疗、生物成像、安检等领域,THz辐射生物效应研究也刻不容缓,从生物能量转换、量效关系研究、安全性评价、关键分子事件解析和生物大分子THz响应规律等方面,进一步加强THz辐射生物效应研究,并在此基础上制定THz辐射人员安全暴露标准,是扩展THz技术应用领域的前提,也是THz技术和产品开发和应用的安全保证。
| [1] |
ZHAO L, HAO Y H, PENG R Y. Advances in the biological effects of terahertz wave radiation[J]. Mil Med Res, 2014, 1: 26. DOI:10.1186/s40779-014-0026-x |
| [2] |
CHENG Y Y, WANG Y X, NIU Y Y, et al. Concealed object enhancement using multi-polarization information for passive millimeter and terahertz wave security screening[J]. Opt Express, 2020, 28(5): 6350-6366. DOI:10.1364/OE.384029 |
| [3] |
CREEDEN D, MCCARTHY J C, KETTERIDGE P A, et al. Compact, high average power, fiber-pumped terahertz source for active real-time imaging of concealed objects[J]. Opt Express, 2007, 15(10): 6478-6483. DOI:10.1364/oe.15.006478 |
| [4] |
RONG L, LATYCHEVSKAIA T, CHEN C, et al. Terahertz in-line digital holography of human hepatocellular carcinoma tissue[J]. Sci Rep, 2015, 5: 8445. DOI:10.1038/srep08445 |
| [5] |
CHEON H, PAIK J H, CHOI M, et al. Detection and manipulation of methylation in blood cancer DNA using terahertz radiation[J]. Sci Rep, 2019, 9(1): 6413. DOI:10.1038/s41598-019-42855-x |
| [6] |
DORADLA P, JOSEPH C, GILES R H. Terahertz endoscopic imaging for colorectal cancer detection: current status and future perspectives[J]. World J Gastrointest Endosc, 2017, 9(8): 346-358. DOI:10.4253/wjge.v9.i8.346 |
| [7] |
EL-SHENAWEE M, VOHRA N, BOWMAN T, et al. Cancer detection in excised breast tumors using terahertz imaging and spectroscopy[J]. Biomed Spectrosc Imaging, 2019, 8: 1-9. DOI:10.3233/bsi-190187 |
| [8] |
BAJWA N, SUNG S, ENNIS D B, et al. Terahertz imaging of cutaneous edema: correlation with magnetic resonance imaging in burn wounds[J]. IEEE Trans Biomed Eng, 2017, 64(11): 2682-2694. DOI:10.1109/TBME.2017.2658439 |
| [9] |
WILMINK G J, GRUNDT J E. Invited review article: current state of research on biological effects of terahertz radiation[J]. J Infrared Millim Terahertz Waves, 2011, 32(10): 1074-1122. DOI:10.1007/s10762-011-9794-5 |
| [10] |
MORITZ A R. Studies of thermal injury: Ⅲ. The pathology and pathogenesis of cutaneous burns. An experimental study[J]. Am J Pathol, 1947, 23(6): 915-941. |
| [11] |
WILMINK G J, RIVEST B D, IBEY B L, et al. Quantitative investigation of the bioeffects associated with terahertz radiation[C]. SPIE, 2010, 7562: 75620L-75620L-10. DOI: 10.1117/12.844916.
|
| [12] |
DALZELL D, MCQUADE J, VINCELETTE R, et al. Damage threscholds for terahertz radiation[C]. SPIE, 2010, 7562: 75620M-75620M-8. DOI: 10.1117/12.849243.
|
| [13] |
陈纯海, 马秦龙, 陶嘉雯, 等. 太赫兹辐射暴露致小鼠皮肤损伤效应研究[J]. 第三军医大学学报, 2020, 42(23): 2282-2289. CHEN C H, MA Q L, TAO J W, et al. Effects of terahertz exposure-induced skin injury[J]. J Third Mil Med Univ, 2020, 42(23): 2282-2289. DOI:10.16016/j.1000-5404.202008138 |
| [14] |
高鹏, 卢永辉, 马秦龙, 等. NLRP3炎症小体激活在太赫兹暴露所致皮肤炎症中的作用[J]. 第三军医大学学报, 2020, 42(23): 2290-2301. GAO P, LU Y H, MA Q L, et al. NLRP3 inflammasome activation mediates terahertz exposure-induced skin sterile inflammation[J]. J Third Mil Med Univ, 2020, 42(23): 2290-2301. DOI:10.16016/j.1000-5404.202008142 |
| [15] |
OSTROVSKIY N, NIKITUK C, KIRICHUK V, et al. Application of the terahertz waves in therapy of burn wounds. 2005 Joint 30th International Conference on Infrared and Millimeter Waves and 13th International Conference on Terahertz Electronics, 19-23 Sept. 2005[C]. Piscataway: IEEE, 2005: 301-302. DOI: 10.1109/icimw.2005.1572528.
|
| [16] |
KIRICHUK V F, ANTIPOVA O N, KRYLOVA Y A. Effect of continuous irradiation with terahertz electromagnetic waves of the NO frequency range on behavioral reactions of male albino rats under stress conditions[J]. Bull Exp Biol Med, 2014, 157(2): 184-189. DOI:10.1007/s10517-014-2521-1 |
| [17] |
KIRICHUK V F, TSYMBAL A A. Effects of terahertz radiation at atmospheric oxygen frequency of 129 GHz on blood nitrite concentrations under conditions of different types of stress against the background of administration of nonselective inhibitor of constitutive NO-synthases[J]. Bull Exp Biol Med, 2012, 152(4): 435-438. DOI:10.1007/s10517-012-1547-5 |
| [18] |
BONDAR N P, KOVALENKO I L, AVGUSTINOVICH D F, et al. Behavioral effect of terahertz waves in male mice[J]. Bull Exp Biol Med, 2008, 145(4): 401-405. DOI:10.1007/s10517-008-0102-x |
| [19] |
HWANG Y, AHN J, MUN J, et al. In vivo analysis of THz wave irradiation induced acute inflammatory response in skin by laser-scanning confocal microscopy[J]. Opt Express, 2014, 22(10): 11465-11475. DOI:10.1364/oe.22.011465 |
| [20] |
KIM K T, PARK J, JO S J, et al. High-power femtosecond-terahertz pulse induces a wound response in mouse skin[J]. Sci Rep, 2013, 3: 2296. DOI:10.1038/srep02296 |
| [21] |
FEDOROV V I, POGODIN A S, DUBATOLOVA T D, et al. Comparative study of effect of infrared, submillimeter, and millimeter electromagnetic radiation on wing somatic mutations in Drosophila melanogaster induced by gamma-irradiation[J]. Biofizika, 2001, 46(2): 298-302. |
| [22] |
卢永辉, 陈纯海, 高鹏, 等. 太赫兹辐射暴露引起小鼠视网膜基因表达改变[J]. 第三军医大学学报, 2020, 42(23): 2274-2281. LU Y H, CHEN C H, GAO P, et al. Terahertz radiation exposure results in alterations of gene expression phenotype in mice retina[J]. J Third Mil Med Univ, 2020, 42(23): 2274-2281. DOI:10.16016/j.1000-5404.202008140 |
| [23] |
KHAMOYAN A G, EKATERINA Y S, CHERNYKH E R. Investigation of possibility of submillimeter laser using as instrument for diagnostics in medicine[C]. SPIE, 2007, 6734(4): 1-7. DOI: 10.1117/12.753111.
|
| [24] |
BOROVKOVA M, SEREBRIAKOVA M, FEDOROV V, et al. Investigation of terahertz radiation influence on rat glial cells[J]. Biomed Opt Express, 2017, 8(1): 273-280. DOI:10.1364/boe.8.000273 |
| [25] |
RAMUNDO-ORLANDO A, GALLERANO G P. Terahertz radiation effects and biological applications[J]. J Infrared Millim Terahertz Waves, 2009, 30(12): 1308-1318. DOI:10.1007/s10762-009-9561-z |
| [26] |
VERNIER P T, LEVINE Z A, HO M C, et al. Picosecond and terahertz perturbation of interfacial water and electropermeabilization of biological membranes[J]. J Membr Biol, 2015, 248(5): 837-847. DOI:10.1007/s00232-015-9788-7 |
| [27] |
DE AMICIS A, SANCTIS S D, CRISTOFARO S D, et al. Biological effects of in vitro THz radiation exposure in human foetal fibroblasts[J]. Mutat Res Genet Toxicol Environ Mutagen, 2015, 793: 150-160. DOI:10.1016/j.mrgentox.2015.06.003 |
| [28] |
ALEXANDROV B S, PHIPPS M L, ALEXANDROV L B, et al. Specificity and heterogeneity of terahertz radiation effect on gene expression in mouse mesenchymal stem cells[J]. Sci Rep, 2013, 3: 1184. DOI:10.1038/srep01184 |
| [29] |
HINTZSCHE H, JASTROW C, KLEINE-OSTMANN T, et al. Terahertz radiation induces spindle disturbances in human-hamster hybrid cells[J]. Radiat Res, 2011, 175(5): 569-574. DOI:10.1667/rr2406.1 |
| [30] |
FRANCHINI V, DE SANCTIS S, MARINACCIO J, et al. Study of the effects of 0.15 terahertz radiation on genome integrity of adult fibroblasts[J]. Environ Mol Mutagen, 2018, 59(6): 476-487. DOI:10.1002/em.22192 |
| [31] |
TITOVA L V, AYESHESHIM A K, GOLUBOV A, et al. Intense THz pulses cause H2AX phosphorylation and activate DNA damage response in human skin tissue[J]. Biomed Opt Express, 2013, 4(4): 559-568. DOI:10.1364/boe.4.000559 |
| [32] |
BOGOMAZOVA A N, VASSINA E M, GORYACHKOVSKAYA T N, et al. No DNA damage response and negligible genome-wide transcriptional changes in human embryonic stem cells exposed to terahertz radiation[J]. Sci Rep, 2015, 5: 7749. DOI:10.1038/srep07749 |
| [33] |
CHEON H, YANG H J, LEE S H, et al. Terahertz molecular resonance of cancer DNA[J]. Sci Rep, 2016, 6: 37103. DOI:10.1038/srep37103 |
| [34] |
TAN S Z, TAN P C, LUO L Q, et al. Exposure effects of terahertz waves on primary neurons and neuron-like cells under nonthermal conditions[J]. Biomed Environ Sci, 2019, 32(10): 739-754. DOI:10.3967/bes2019.094 |
| [35] |
DEMIDOVA E V, GORYACHKOVSKAYA T N, MALUP T K, et al. Studying the non-thermal effects of terahertz radiation on E. coli/pKatG-GFP biosensor cells[J]. Bioelectromagne-tics, 2013, 34(1): 15-21. DOI:10.1002/bem.21736 |
| [36] |
马秦龙, 陈纯海, 林敏, 等. 0.22太赫兹电磁辐射暴露致Neuro-2a细胞损伤的非热效应研究[J]. 第三军医大学学报, 2020, 42(23): 2267-2273, 2289. MA Q L, CHEN C H, LIN M, et al. Effects of 0.22 terahertz electromagnetic radiation exposure-induced injury in neuro-2a cells[J]. J Third Mil Med Univ, 2020, 42(23): 2267-2273, 2289. DOI:10.16016/j.1000-5404.202008145 |
| [37] |
伊如汉, 彭瑞云, 王波, 等. 太赫兹波辐射生物效应研究现状与展望[J]. 中华放射医学与防护杂志, 2018, 38(3): 230-235. YI R H, PENG R Y, WANG B, et al. Research progress on biological effects of terahertz wave radiation[J]. Chin J Radiol Med Prot, 2018, 38(3): 230-235. DOI:10.3760/cma.j.issn.0254-5098.2018.03.014 |