太赫兹(terahertz,THz)辐射是指频率在0.1~10 THz的电磁波,处于宏观电子学向微观光子学过渡的波段,一度被称为电磁波谱中的“THz空隙”。由于其独特的特性,THz技术在通讯、雷达、考古、安检及生物医学等领域均有广泛的应用前景[1-2]。近5年,随着THz波的产生、传输和检测技术的逐渐成熟,THz技术的应用得到了极大的拓展,其应用方向也发生了广泛而深刻的变化,THz在各个领域的应用逐步从实验室走入现实场景,彰显出巨大价值。
生物大分子如氨基酸、肽、蛋白质及DNA等吸收、共振与谐振频段均处于THz频段[3-4],这一方面促进了THz技术在生物医学领域的广泛应用,另一方面也提示THz辐射有可能对机体产生不同于其他频段电磁波的独特生物效应。因此,为了更加快速、安全及全面地应用好THz技术,系统研究THz辐射生物效应特点及机制,从而在此基础上揭示THz辐射暴露致机体损伤的阈值,制定安全应用的暴露标准十分重要。
由于THz技术的突破性进展主要发生在近5~10年,且THz生物效应的研究涉及多学科的交叉,暴露系统需要多平台整合运行,加之能够提供可供生物效应研究的THz源的单位十分有限,因此关于THz生物效应研究的文献较少,许多涉及THz应用的生物安全性关键问题尚未解决[5],如关于THz暴露损伤靶器官效应特点及损伤阈值、损伤剂量效应关系等,而这些问题恰恰是THz技术广泛应用的先决条件。
本研究主要探讨THz暴露对皮肤损伤效应,采用小鼠为暴露模型,观察暴露部位升温曲线特点和皮肤组织病理损伤情况,并进一步通过转录组测序结合生物信息学分析,全面揭示THz暴露对皮肤组织的损伤效应特点及分子机制。
1 材料与方法 1.1 实验动物6~8周龄C57BL/6J雄性小鼠60只,体质量22~24 g,由陆军军医大学实验动物中心提供,生产许可证号SCXK(渝) 20170002,使用许可证号SYXK(渝) 20170002,所有动物实验的开展获得陆军军医大学实验动物伦理审查委员会批准(AMUWEC20200528)。实验动物分为对照组与辐照组,对照组不接受THz暴露,辐照组分别接受平均功率密度为25 mW/cm2与50 mW/cm2的辐照,每个剂量20只动物,辐照时间为5 min,分别于辐照完即刻或24 h取样本进行相关指标检测。
1.2 THz暴露系统采用FIRL100气体THz源(中国工程物理研究院研制),中心频率为0.22 THz,THz光束通过两个离轴抛物面镜准直并扩束2倍,采用633 nm的氦氖激光辅助光路校正。暴露装置系统如图 1A所示。小鼠麻醉、皮肤脱毛,固定接受辐照,辐照过程中采用红外热像仪实时监测小鼠皮肤温度变化情况。
1.3 皮肤组织苏木精-伊红染色于辐照结束后取小鼠暴露部位皮肤组织,采用4%的多聚甲醛(PFA)固定,24 h后,进行石蜡包埋,切片12 μm,采用苏木精-伊红染色法(HE)进行染色,于Leica光学显微镜、20×镜头下进行观察分析及图片采集。
1.4 ELISA检测炎症因子表达于辐照结束后即刻或24 h后,取小鼠暴露部位皮肤组织,剪碎、研磨,采用RIPA试剂(Thermo, 美国)提取总蛋白。ELSIA检测采用试剂盒(R & D,美国)进行,详细操作步骤参见说明书。
1.5 转录组测序(RNA-seq)分析为保证RNA-seq结果稳定可靠,每个小组测4个样本。暴露剂量选用50 mW/cm2,暴露时间5 min,于暴露结束后即刻取小鼠皮肤组织,迅速冻入液氮,待所有样本收集完成后统一进行实验。RNA提取及测序具体流程简述如下:总RNA提取(TRIzol试剂)→RNA质量检测(每组保证RIN值>8.0的样本4个)→ mRNA纯化→mRNA片段化(200~300 bp)→cDNA合成→PCR富集建库→文库质检→Illumina平台上机测序。
测序完成后首先对原始下机数据(raw data)进行过滤,将过滤后得到的高质量序列(clean data)比对到该物种的参考基因组上。根据比对结果,计算每个基因的表达量。在此基础上,进一步采用Dseq软件对样品进行表达差异分析。差异表达基因(differential expression genes, DEGs)的筛选标准采用: P < 0.05,∣logFC∣≥1,然后将筛选出的DEG进行富集分析和聚类分析等,其中GO注释采用Blast2go软件,KEGG分析采用KAAS软件。
1.6 统计学分析采用SPSS 18.0统计软件进行分析,结果用x±s表示,两组间比较采用Student-t检测,多组比较先进行单因素方差分析,再采用Dunnett post hoc检测进行两两比较,检验水准α=0.05。
2 结果 2.1 THz辐射暴露所致皮肤升温特点小鼠暴露系统如图 1A所示,在暴露过程中采用红外热像仪实时监测小鼠皮肤温度的变化情况(图 1B)。结果显示,平均功率密度25 mW/cm2的THz辐射暴露后,暴露部位皮肤最高温度改变幅度不超过0.5 ℃,而平均温度变化在±0.3 ℃(图 1C);当暴露平均功率密度增高至50 mW/cm2时,暴露部位皮肤平均温度在1 min内迅速升高超过1 ℃,在2 min内平均温度升高超过2 ℃,之后一直维持在较高水平,直到暴露结束,并且最高温度的升高在2 min内接近4 ℃,但继续延长暴露时间并不能使小鼠皮肤温度进一步升高(图 1D)。以上数据表明,当平均功率密度达到50 mW/cm2时,THz辐射暴露将会导致暴露部位温度明显升高,提示可能存在明显的热效应损伤。
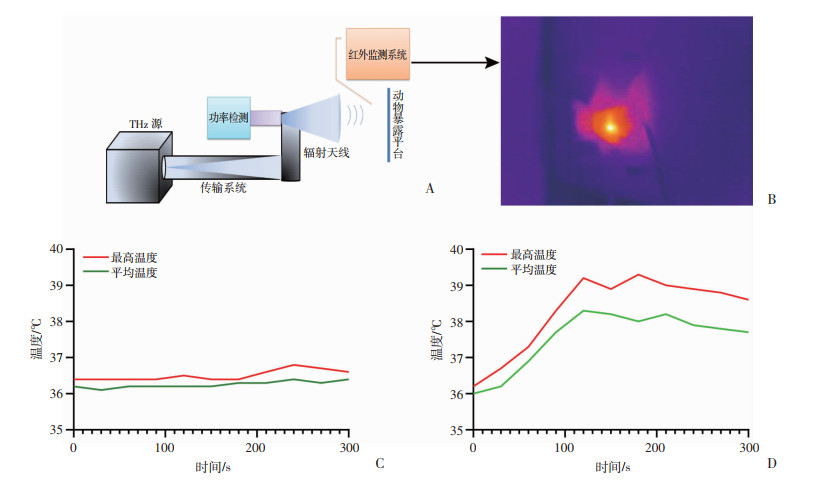
|
| A: THz暴露装置模式图;B:小鼠皮肤红外热像图;C、D:分别为25、50 mW/cm2 THz辐射暴露后小鼠皮肤升温曲线(n=6) 图 1 THz辐射暴露后小鼠皮肤升温特点 |
2.2 THz辐射暴露后小鼠皮肤组织病理改变
为探讨THz辐射所致皮肤组织损伤特点,检测不同功率密度THz辐射暴露5 min后小鼠皮肤组织的病理改变。根据前期文献报道及预实验结果,选择平均功率密度25 mW/cm2及50 mW/cm2两个剂量进行研究。HE染色结果表明,25 mW/cm2辐照组无明显病理改变(图 2)。当暴露平均功率密度升高至50 mW/cm2时出现明显病理损伤,可见有局部地方存在表皮脱落及轻微的皮下出血等病理现象出现(图 2),但组织病理损伤的位点分布并不均一,主要集中在辐照光斑的中心位置。以上结果表明THz辐射暴露所致热效应能够造成暴露部位出现明显损伤。

|
| A:对照组;B: 25 mW/cm2辐照组;C、D:不同放大倍数50 mW/cm2辐照组 ↑:示皮下出血及表皮脱落 图 2 HE染色观察不同平均功率密度THz辐射暴露后小鼠皮肤组织病理学变化 |
2.3 THz辐射暴露后小鼠皮肤组织基因表达变化整体情况
THz辐射除产生热效应外,其非热效应损伤也不可忽视。为全面揭示THz辐射暴露所致皮肤组织损伤的整体特征及分子机制,取暴露后小鼠皮肤组织进行RNA-seq分析,每组4个样本,其中辐照组1个样本经PCA分析与其他3个样本偏离较远被排除。测试结果显示每个样本的Clean_Reads总数均在37 000 000以上,Map率均在97%以上,说明测序质量较为可靠。差异表达基因(DEGs)分析结果显示,共鉴定出18 203个基因,以P < 0.05,∣logFC∣≥1为筛选条件,其中18 127个基因无明显变化,上调表达基因49个,下调表达基因27个(图 3A)。热度图(heatmap)揭示每个重复样本基因表达情况的组内组间差异,各重复样本基因表达在组内差异较小,说明重复性较好,而在对照组和THz辐照组之间差异较大,揭示THz暴露所导致的基因表达变化整体情况(图 3B)。以上结果均显示,THz辐射暴露能够导致皮肤组织一系列基因表达异常。
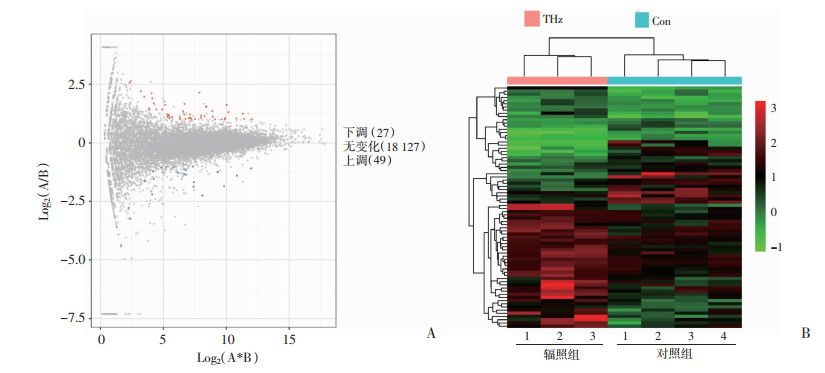
|
| A:差异表达基因MA图 横纵坐标中的A和B分别表示基因在两样本中的表达量;B:所有重复样本差异基因热度图 THz:辐照组;Con:对照组 图 3 THz辐射暴露后小鼠皮肤基因变化整体情况 |
2.4 THz辐射暴露所诱导皮肤组织DEGs GO分析
为深入分析THz暴露所诱导的DEGs主要参与调控了哪些细胞功能,将全部DEGs进行GO富集分析,其结果按照分子功能(molecular function, MF)、生物过程(biological process, BP)和细胞组分(cellular component, CC)进行分类,图 4为各GO分类中富集最显著的前10个GO子集条目,按照P值及所包括的基因数进行排序。该结果显示,CC分类中主要富集于细胞外成分(细胞外区域部分、细胞外区域、细胞外空间),说明THz暴露所影响的基因主要编码细胞外成分的蛋白;MF分类中变化最为显著的是影响各种酶的活性(肽酶抑制剂活性、肽酶调节剂活性、酶抑制剂活性);而BP分类中变化最为显著的为机体对外源性有害刺激的免疫反应与炎症反应相关的条目(对细菌及其他生物的防御反应、对细菌及其他生物的反应、对外部生物刺激的反应、对生物刺激的反应),见图 4。以上分析结果充分揭示了THz暴露所诱导的DEGs影响的主要是细胞外分子为主,主要影响功能为酶的活性,以及机体免疫应答及炎症反应等相关的功能。
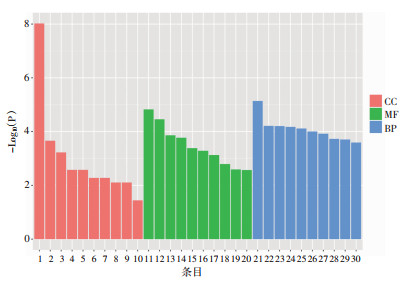
|
| 1:细胞外区域;2:细胞外空间;3:细胞外区域部分;4:糖萼;5:细胞膜成分;6:胞外封装结构;7:孤儿样受体1/2蛋白复合体;8:其他生物细胞膜;9:其他生物膜;10:特定颗粒;11:肽酶抑制剂活性;12:肽酶调节剂活性;13:内肽酶抑制剂活性;14:内肽酶调节剂活性;15:酶抑制剂活性;16:肝素结合;17:半胱氨酸型内肽酶抑制剂的活性;18:糖胺聚糖结合;19:神经肽Y受体结合;20:核糖核酸酶活性;21:对细菌的防御反应;22:对其他生物的防御反应;23:精子获能;24:对细菌的反应;25:肽酶活性的负调控;26:发育成熟;27:细胞成熟;28:对其他生物的反应;29:对外部生物刺激的反应;30:对生物刺激的反应;以上显示每个子集的前10个条目 图 4 THz辐射暴露诱导皮肤组织DEGs GO分析 |
2.5 THz辐射暴露诱导皮肤组织DEGs KEGG分析
以上述条件筛选出的DEGs为基础,进一步进行了KEGG信号通路分析,富集气泡图显示了分析结果中前20个KEGG条目(图 5)。通过富集指数(rich factor)、FDR值和富集到此通路上的基因个数来衡量富集的程度,该结果中比较突出的信号通路包括: MAPK信号通路(MAPK signaling pathway)、雌激素信号通路(estrogen signaling pathway)、多巴胺能突触(dopaminergernic synapse)、甲状腺激素信号通路(thyroid hormone signaling pathway)以及孤儿样受体信号通路(Toll-like receptor signaling pathway),KEGG信号通路的富集分析揭示了THz辐射暴露后可能影响的细胞功能及其潜在的分子机制。从上述结果来看,并不是全面集中于与热效应相关的信号通路上,结合GO分析结果综合分析,说明THz辐射所产生的效应同时也包括非热效应。
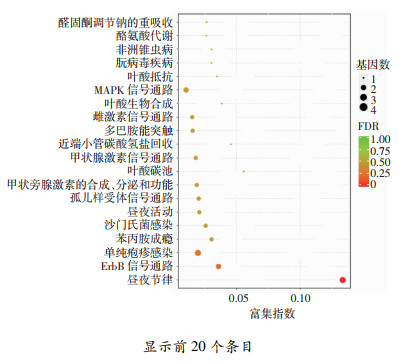
|
| 图 5 THz辐射暴露诱导皮肤组织DEGs KEGG分析 |
2.6 THz暴露后小鼠皮肤炎症因子变化
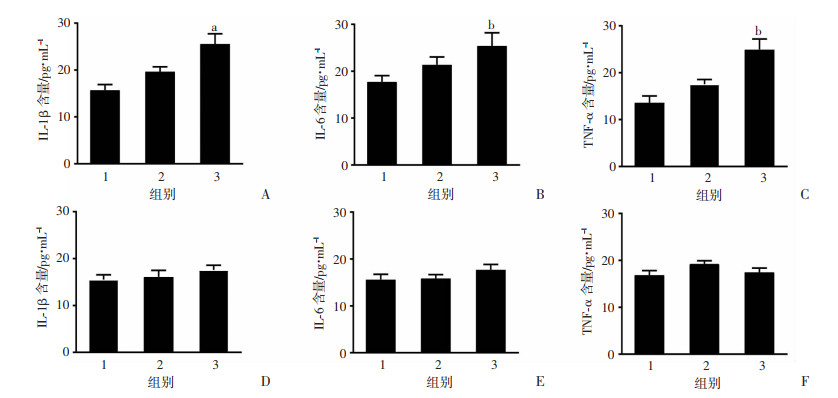
通过RNA-seq结合GO与KEGG分析,提示致皮肤炎症反应可能是THz辐射暴露所致皮肤损伤的主要特点之一。为验证这一生物效应特点,采用ELISA法检测THz暴露所引起的皮肤组织炎症因子的表达变化情况。实验动物接受不同平均功率密度THz辐射暴露5 min后,收集暴露部位皮肤组织提取总蛋白,采用ELISA法检测皮肤组织中IL-1β、IL-6及TNF-α等炎症因子的表达水平。结果显示,平均功率密度为25 mW/cm2的THz暴露不引起皮肤组织炎症因子表达变化,但当暴露平均功率密度达到50 mW/cm2时,暴露后即刻皮肤组织IL-1β、IL-6及TNF-α的表达水平均明显升高(P < 0.05,P < 0.01,图 6A~C),表明THz辐射暴露能够引起暴露部位产生明显的炎症反应。为探讨暴露部位炎症反应的持续时间,进一步检测了暴露24 h后暴露部位皮肤炎症因子的表达变化情况。结果发现与对照组相比,辐照组各炎症因子表达均无明显差异,表明THz一次性暴露所致暴露部位炎症反应并不能长时间维持(图 6D~F)。
|
| A~C:各组辐射暴露5 min后即刻检测小鼠皮肤炎症因子表达;D~F:各组辐射暴露5 min,24 h后检测小鼠皮肤炎症因子表达 1: 0 mW/cm2辐照组;2: 25 mW/cm2辐照组;3: 50 mW/cm2辐照组;a:P < 0.05, b: P < 0.01, 与0 mW/cm2辐照组比较 图 6 THz辐射暴露后小鼠皮肤炎症因子表达(n=4) |
3 讨论
THz辐射暴露生物效应研究及损伤阈值的寻找是THz技术安全应用的前提,但既往关于THz辐射生物效应报道较少。本研究采用中心频率为0.22 THz辐射暴露小鼠,发现THz辐射暴露能够产生明显的皮肤组织热效应损伤,并导致辐照部位一系列基因表达异常,GO及KEGG分析结果提示其相关生物效应也存在非热效应损伤。
根据文献[6]报道,THz辐射损伤效应主要分为热效应与非热效应。THz辐射由于其波长位于毫米波与红外线之间。因此,不难解释其与毫米波和红外线相似,会产生明显的热效应。但是前期研究也提示,THz所致热效应损伤与毫米波和红外线可能存在明显区别。本研究发现,THz所致皮肤温度升高发生速度非常快,在辐照前2~3 min内即可达到峰值,此后暴露部位皮肤温度并不随着时间的延长而继续升高。这可能与皮肤组织自身的散热机制有关,也可能是由于THz辐射本身的频率及穿透性所决定,其具体机制还需要进一步在多参数条件下观察研究。在本实验中所观察到的皮肤组织病理损伤,应该与热效应随着时间的累积有明显的相关性,但太赫兹热效应的具体特点及机制,还有待进一步研究。这在文献[7]研究中也有发现。
在辐照剂量和时间的选择上,本研究参考前期研究结果[8-9],同时也进行了预实验进行摸索,最终确定为25 mW/cm2及50 mW/cm2。本研究发现,25 mW/cm2暴露后,虽有明显温度升高,但是上升幅度不超过1 ℃,但50 mW/cm2暴露1 min后,暴露部位平均温度升高就超过1 ℃。温度变化超过1 ℃是既往研究界定电磁辐射产生热效应的阈值,是THz热效应的有力证据。关于THz辐射所致细胞及实验动物损伤的阈值,目前尚不十分明确。本研究显示,25 mW/cm2 THz暴露时,未见明显的皮肤温度升高及病理损伤,而50 mW/cm2 THz暴露时,可出现明显损伤,提示0.22 THz暴露导致皮肤组织明显损伤的阈值可能介于25~50 mW/cm2,但其具体的损伤阈值还需要大量的数据支撑,包括分子水平的效应数据。此外,结果还提示THz暴露所致皮肤损伤与单纯的热损伤存在明显区别,表现在5 min暴露即可观察到明显的组织病理损伤,说明其损伤机制较单纯热损伤更为复杂,具体细节还有待进一步研究。
关于THz辐射暴露在实验动物上的生物效应研究非常少,主要研究集中在低剂量THz暴露对动物神经行为功能的影响上[10-11]。从体外培养细胞的THz辐射暴露生物效应研究结果来看,THz辐射暴露可显著改变细胞活力及细胞周期等,甚至引起细胞死亡,在分子水平,会导致热休克蛋白的表达升高,DNA损伤或其损伤标记物rH2AX表达升高,以及一些损伤敏感基因表达异常等[8, 12-13]。但由于体外实验尚无统一的实验模型,各实验室在开展实验时用于细胞暴露的实验体系千差万别,特别是培养体系中温度的控制和培养基的多少,对THz暴露的生物效应影响很大,因为水对THz会产生明显的吸收作用,导致研究结果的差异很大,尤其是DNA损伤的研究结果[14-15]。因此,体外实验中关于剂量效应关系的研究结论往往很难直接推导到动物水平的研究,而本研究体内实验结果尤其是基因表达变化的结果,可为体内体外数据的结合分析提供新的参考。
除组织形态学的改变外,分子水平的变化也是非常值得关注的,分子水平的改变随着暴露时间的累积,往往会发展成组织形态甚至动物形为等方面的改变。由于目前大型的THz源非常有限,使用和维护成本均非常昂贵,因此尚无法满足大量的动物实验慢性暴露需求,因此,关注分子水平的变化能够为可能的长时程暴露生物效应研究提供方向。本研究通过对辐照部位组织的转录组测序,较为全面地揭示了THz辐射所致皮肤组织损伤的生物效应特点及其分子机制。提示DEGs编码的蛋白主要为细胞外成分蛋白,而相对于射频段电磁辐射,THz辐射本身的穿透能力也较弱,这些胞外蛋白的变化可能与THz生物效应的机制密切相关。GO分析结果显示,DEGs所参与调控的功能主要为免疫反应与炎症反应等。这与前期研究在其他THz频段上的转录组测序结果有部分相似[16],说明不同频段THz辐射在生物效应上可能有一定的共性。而本研究通过ELISA实验检测小鼠皮肤组织炎症因子的蛋白表达,也验证了这一生物效应特点。炎症反应是微波辐射暴露导致机体损伤重要机制[17-18]。这说明THz辐射生物效应与微波生物效应在机制上也有部分共同之处。本研究发现THz辐射暴露诱导的皮肤组织炎症反应虽然不能持久存在,但相关信号通路分子改变等提示随着暴露时间的延长和剂量的增加,炎症反应损伤不可忽视。
同时,在今后的研究中还需要关注THz不同于微波辐射的独特生物效应。比如本研究发现THz所诱导的DEGs参与很多与自身免疫功能相关的生理过程,提示THz技术可能用于调控机体免疫功能。这对THz技术的应用开发有较大的意义,也是前期研究中所关注的重点之一。此外,本研究还发现THz对酶活性的改变、对细胞成熟的影响等相关的生物效应,这些均值得关注及进一步研究。
综上所述,THz生物效应研究是寻找暴露损伤阈值、保护暴露人员、安全应用THz技术的关键环节。本研究发现,0.22 THz暴露在50 mW/cm2时,能够导致暴露部位皮肤温度升高,皮肤组织病理损伤及炎症因子表达升高,此外,还可导致一系列与机体免疫及炎症反应、酶活性等相关的基因表达异常。这些结果揭示了THz辐射暴露所致皮肤损伤的特点,为后期深入研究THz辐射暴露所致机体其他系统的损伤特点,以及寻找THz暴露损伤阈值提供了新的证据和线索。
| [1] |
CROWE T W, GLOBUS T, WOOLARD D L, et al. Terahertz sources and detectors and their application to biological sensing[J]. Philos Trans A Math Phys Eng Sci, 2004, 362(1815): 365-377. DOI:10.1098/rsta.2003.1327 |
| [2] |
赵国忠, 申彦春, 刘影. 太赫兹技术在军事和安全领域的应用[J]. 电子测量与仪器学报, 2015, 29(8): 1097-1101. ZHAO G Z, SHEN Y C, LIU Y. Application of terahertz technology in military and security field[J]. J Electron Meas Instrum, 2015, 29(8): 1097-1101. DOI:10.13382/j.jemi.2015.08.001 |
| [3] |
PLUSQUELLIC D F, SIEGRIST K, HEILWEIL E J, et al. Applications of terahertz spectroscopy in biosystems[J]. ChemPhysChem, 2007, 8(17): 2412-2431. DOI:10.1002/cphc.200700332 |
| [4] |
孙金海. 太赫兹电磁波在生物医学领域中的应用原理及进展[J]. 首都师范大学学报(自然科学版), 2004, 25(4): 17-22. SUN J H. Applications and developments of terahertz electromagnetic wave in biological and medical fields[J]. J Cap Norm Univ Nat Sci Ed, 2004, 25(4): 17-22. DOI:10.3969/j.issn.1004-9398.2004.04.006 |
| [5] |
SUN Q, HE Y, LIU K, et al. Recent advances in terahertz technology for biomedical applications[J]. Quant Imaging Med Surg, 2017, 7(3): 345-355. DOI:10.21037/qims.2017.06.02 |
| [6] |
ROMANENKO S, BEGLEY R, HARVEY A R, et al. The interaction between electromagnetic fields at megahertz, gigahertz and terahertz frequencies with cells, tissues and organisms: risks and potential[J]. J Royal Soc Interface, 2017, 14(137): 20170585. DOI:10.1098/rsif.2017.0585 |
| [7] |
PARKER J E, BEASON C W, STURGEON S P, et al. Revisiting 35 and 94 GHz millimeter wave exposure to the non-human primate eye[J]. Heal Phys, 2020, 119(2): 206-215. DOI:10.1097/hp.0000000000001216 |
| [8] |
TITOVA L V, AYESHESHIM A K, GOLUBOV A, et al. Intense THz pulses cause H2AX phosphorylation and activate DNA damage response in human skin tissue[J]. Biomed Opt Express, 2013, 4(4): 559-568. DOI:10.1364/boe.4.000559 |
| [9] |
WILMINK G J, RIVEST B D, ROTH C C, et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation[J]. Lasers Surg Med, 2011, 43(2): 152-163. DOI:10.1002/lsm.20960 |
| [10] |
BONDAR N P, KOVALENKO I L, AVGUSTINOVICH D F, et al. Behavioral effect of terahertz waves in male mice[J]. Bull Exp Biol Med, 2008, 145(4): 401-405. DOI:10.1007/s10517-008-0102-x |
| [11] |
KIRICHUK V F, ANTIPOVA O N, KRYLOVA Y A. Effect of continuous irradiation with terahertz electromagnetic waves of the NO frequency range on behavioral reactions of male albino rats under stress conditions[J]. Bull Exp Biol Med, 2014, 157(2): 184-189. DOI:10.1007/s10517-014-2521-1 |
| [12] |
ALEXANDROV B S, PHIPPS M L, ALEXANDROV L B, et al. Specificity and heterogeneity of terahertz radiation effect on gene expression in mouse mesenchymal stem cells[J]. Sci Rep, 2013, 3: 1184. DOI:10.1038/srep01184 |
| [13] |
FRANCHINI V, DE SANCTIS S, MARINACCIO J, et al. Study of the effects of 0.15 terahertz radiation on genome integrity of adult fibroblasts[J]. Environ Mol Mutagen, 2018, 59(6): 476-487. DOI:10.1002/em.22192 |
| [14] |
KOYAMA S, NARITA E, SHIMIZU Y, et al. Twenty four-hour exposure to a 0.12 THz electromagnetic field does not affect the genotoxicity, morphological changes, or expression of heat shock protein in HCE-T cells[J]. Int J Environ Res Public Heal, 2016, 13(8): 793. DOI:10.3390/ijerph13080793 |
| [15] |
BOGOMAZOVA A N, VASSINA E M, GORYACHKOV-SKAYA T N, et al. No DNA damage response and negligible genome-wide transcriptional changes in human embryonic stem cells exposed to terahertz radiation[J]. Sci Rep, 2015, 5: 7749. DOI:10.1038/srep07749 |
| [16] |
TITOVA L V, AYESHESHIM A K, GOLUBOV A, et al. Intense THz pulses down-regulate genes associated with skin cancer and psoriasis: a new therapeutic avenue?[J]. Sci Rep, 2013, 3: 2363. DOI:10.1038/srep02363 |
| [17] |
TSOY A, SALIEV T, ABZHANOVA E, et al. The effects of mobile phone radiofrequency electromagnetic fields on β-amyloid-induced oxidative stress in human and rat primary astrocytes[J]. Neuroscience, 2019, 408: 46-57. DOI:10.1016/j.neuroscience.2019.03.058 |
| [18] |
JEONG Y, SON Y, HAN N K, et al. Impact of long-term RF-EMF on oxidative stress and neuroinflammation in aging brains of C57BL/6 mice[J]. Int J Mol Sci, 2018, 19(7): 2103. DOI:10.3390/ijms19072103 |



