类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,BP)简称类鼻疽杆菌,属兼性胞内革兰阴性杆菌,可引起一种称为类鼻疽的人兽共患病[1]。其主要分布于东南亚和澳大利亚北部,我国海南、广东等地区是类鼻疽病的重灾区[2]。人和动物可通过皮肤擦伤、吸入或摄入等方式感染该菌[3],由于易传播、诊断难、耐药广、无疫苗等潜在的生物威胁,已被WHO列为B类生物恐怖制剂。研究表明溶血素共调节蛋白1(hemolysin coregulated protein 1,Hcp1)作为类鼻疽杆菌的Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)毒力因子,可刺激机体产生特异性抗体[4],在血清学鉴定及疫苗候选抗原的筛选方面都具有潜在的应用价值,但目前尚未见利用DNA重组技术表达类鼻疽杆菌Hcp1蛋白的相关报道。因此,本研究通过重组表达获得纯度达95%的Hcp1蛋白,并对其免疫学性质进行初步研究,旨在为后续深入研究类鼻疽杆菌T6SS的致病机制提供工具手段,也为开发血清学检测方法及开展类鼻疽流行病学调查提供相应的技术支撑。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株pET-28a表达载体购自北京索莱宝公司,E.coli BL21(DE3)、类鼻疽杆菌BPC006,小鼠巨噬细胞RAW264.7由本室保存。
1.1.2 主要试剂细菌DNA基因组提取试剂盒、PCR超薄产物回收试剂盒、质粒提取试剂盒购自康为世纪公司,DNA聚合酶、DNA连接酶、BamHⅠ和HindⅢ限制性内切酶购自大连TaKaRa公司,蛋白质定量(bicinchoninic acid,BCA)试剂盒、SDS-PAGE凝胶试剂盒、硫酸卡那霉素购自上海碧云天公司,异丙基β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)、DMEM培养基、牛血清白蛋白BSA购自Thermo Fisher公司,小鼠抗组氨酸(histidine,His)标签单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠抗体及兔抗人抗体购自北京中杉金桥公司,His Trap层析柱购自美国GE Healthcare公司,弗氏完全佐剂和弗氏不完全佐剂购自美国Sigma公司,结合缓冲液(pH=8.0)由20 mmol/L Na3PO4、30 mmol/L imidazole、500 mmol/L NaCl配制,洗脱缓冲液(pH=8.0)由20 mmol/L Na3PO4、500 mmol/L imidazole、500 mmol/L NaCl配制。
1.1.3 实验动物6~8周龄BALB/c雌性小鼠10只,体质量14~16 g,购自陆军军医大学实验动物中心。
1.1.4 血清样本收集2009年海南省三亚市人民医院感染科确诊为类鼻疽住院患者临床血清。本实验收集5份患者血清,其中男性3例,女性2例;年龄40~ 70岁;入院诊断:类鼻疽杆菌感染。纳入标准:①入院后第一时间采集患者脓液和分泌物标本,进行实验室培养、分离鉴定为类鼻疽杆菌;②典型临床症状;③病例信息资料完整。排除标准:①无疫区接触史;②无典型的影像学表型:如肺脓肿、肺空洞等;③拒绝参与者。同时收集来自该院健康体检者血清。共5份阴性对照血清,其中男性2例,女性3例;年龄40~70岁;入院诊断:健康体检。纳入标准:无疫区接触史,身体状况良好。排除标准:拒绝参与者。本研究中所使用的血清样本患者均知情。
1.2 方法 1.2.1 蛋白重组表达 1.2.1.1 Hcp1原核表达载体的构建根据BPC006菌株Hcp1蛋白的基因序列(NCBI上检索)以及质粒pET-28a多克隆位点序列设计PCR上下游引物,上游引物:5′-GGATCCATGCTGGCCGGAATATATC-TCAA-3′(BamHⅠ),下游引物:5′- AAGCTTTCAGCCATTCGTCCAGTTTGCGGC-3′(Hind Ⅲ),PCR扩增目的基因Hcp1(510 bp);将Hcp1基因片段与pET-28a质粒同时进行Bam HⅠ/Hind Ⅲ双酶切,连接产物转化至E.coli BL21(DE3)感受态细胞并涂布于卡那霉素抗性平板筛选阳性菌落于LB液体培养基进行增菌培养,提取质粒,进行DNA测序[5]验证。
1.2.1.2 工程菌的诱导表达阳性重组大肠杆菌BL21(DE3)于37 ℃培养至光密度D(600)值为0.6~0.8,加入0.5 mmol/L IPTG于16、25、37 ℃分别诱导3、5、12 h后收集菌体,SDS-PAGE检测蛋白的表达情况,确定最佳诱导表达的条件。收集菌体,超声波法充分裂解菌体(冰浴条件下),离心(4 ℃,12 000 r/min)收集上清液和沉淀,SDS-PAGE检测蛋白的表达情况。工程菌于37 ℃培养至光密度D(600)值为0.6~0.8,加入不同量的IPTG至终浓度分别为:0.1、0.3、0.5、0.7、0.9 mmol/L,等量收集菌体,以SDS-PAGE检测IPTG诱导浓度对Hcp1表达量的影响。
1.2.1.3 Hcp1蛋白的纯化与鉴定将蛋白粗提液利用His Trap亲和层析进行纯化,采用梯度浓度洗脱(流速2.5 mL/min),并收集目的蛋白的洗脱液,经超滤浓缩后冷冻干燥,获得固体粉末状纯化蛋白。纯化的Hcp1蛋白经12% SDS-PAGE电泳后转膜,一抗为小鼠抗组氨酸标签单抗(1:1 000)4 ℃孵育过夜,二抗为HRP-山羊抗小鼠IgG(1:8 000),用MaxiLuminTM化学发光液成像。
1.2.2 免疫学性质鉴定 1.2.2.1 抗Hcp1多克隆抗体的制备及效价测定将纯化的重组Hcp1蛋白与弗氏完全佐剂等体积混合并充分乳化后,腹腔注射免疫小鼠[17],0.05 mg/只。每间隔7 d免疫1次,共免疫3次。小鼠断尾取血,以ELISA检测抗血清效价。抗血清效价设定标准:抗血清效价≥ 1:8 000。如达到设定标准,麻醉小鼠后,迅速摘眼球取全血分离血清备用。抗体效价检测:以重组Hcp1蛋白(5 μg/mL;100 μL/孔)包被96孔酶标板,4 ℃过夜,5%的脱脂奶粉37 ℃封闭2 h,采用间接ELISA检测抗血清的效价,加入倍比稀释的小鼠抗血清(1:1 000~1:1 024 000;100 μL/孔),每个浓度梯度3个复孔,HRP-山羊抗小鼠IgG为二抗,以TMB溶液显色,以未免疫小鼠血清作为阴性对照,检测抗体滴度,结果判读标准为:D(450)样品/D(450)阴性≥2.1。
1.2.2.2 免疫印迹验证抗体特异性纯化的Hcp1蛋白经12%SDS-PAGE电泳后转膜,一抗为制备的小鼠抗血清4℃过夜孵育,二抗为HRP-山羊抗小鼠IgG,同时设置牛血清白蛋白作为阴性对照;同法,将来自本校第一附属医院阴性血清和海南省三亚市人民医院类鼻疽阳性患者血清进行4 ℃过夜孵育,以HRP-兔抗人IgG作为二抗检测Hcp1蛋白,同时设置牛血清白蛋白作为对照。将实验室保存的不同类鼻疽杆菌临床菌株(BPC008、BPC010、BPC014、BPC018、BPC006)灭活后(70 ℃加热处理30 min)采用相同方法分别检测其与Hcp1抗血清之间的抗原抗体反应。此外,以同样方法检测Hcp1抗血清与结核分枝杆菌、泰国伯克霍尔德菌、铜绿假单胞菌和金黄色葡萄球菌之间的抗原抗体反应,鉴定其特异性。
1.2.2.3 免疫荧光实验将爬片放置12孔板中,培养小鼠巨噬细胞RAW 264.7至1.5×105/孔,以感染复数1:10加入类鼻疽杆菌菌液,同时以大肠杆菌组做对照,培养6 h后,将爬片用4%多聚甲醛固定10 min,0.3% Triton X-100透膜10 min,染目的蛋白Hcp1:一抗为1:1 000稀释的Hcp1多克隆抗体37 ℃孵育1 h,二抗为1:1 000稀释的Alexa Fluor488抗鼠室温避光1 h;染菌体:一抗为1:200稀释实验室制备的类鼻疽菌体多克隆兔抗体37 ℃孵育1 h,二抗为1:500稀释的Alexa Fluor555抗兔室温避光1 h;染细胞核用1:1 000稀释的DAPI避光孵育10 min。小心扣取爬片,反扣在滴有荧光淬灭剂的载玻片上,避光操作放于4 ℃暂存,等待激光共聚焦显微镜观察结果。
1.3 统计学分析采用SPSS 20.0统计软件对数据进行分析。结果以x±s表示,实验重复3次。采用t检验,检验水准α=0.05。
2 结果 2.1 原核表达载体pET-28a-Hcp1的构建以BPC006菌株全基因组DNA为模板,经PCR扩增得到目的基因Hcp1(约510 bp,图 1A)。重组质粒pET-28a-Hcp1,经双酶切法(BamHⅠ/HindⅢ)鉴定目的片段与理论大小一致(图 1B),其DNA测序结果与NCBI检索结果一致。

|
| A:PCR扩增Hcp1基因M:标准;1:Hcp1基因PCR产物;B:pET-28a-Hcp1重组质粒双酶切鉴定M:标准;1:pET-28a-Hcp1未酶切;2:pET-28a-Hcp1 BamHⅠ/Hind Ⅲ双酶切 图 1 Hcp1基因扩增产物和pET-28a-Hcp1载体鉴定 |
2.2 Hcp1蛋白的诱导表达、纯化与鉴定
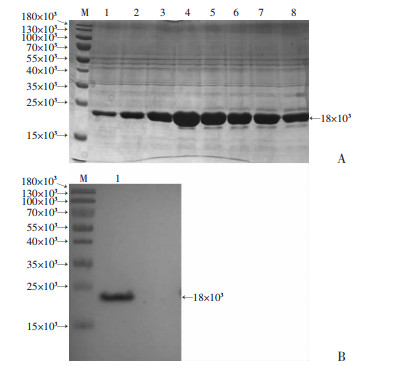
重组质粒pET-28a-Hcp1转入E.coli BL21(DE3)后,在不同的诱导温度培养(16、25、37 ℃)、不同诱导时间(3、5、12 h)和不同IPTG诱导浓度条件下,Hcp1在25 ℃,诱导5 h,0.7 mmol/L IPTG诱导表达效果最佳。利用His Trap层析柱对重组蛋白进行分离纯化。采用梯度浓度洗脱(流速2.5 mL/min),并收集目的蛋白的洗脱液。以超滤离心管(分子量=3 000)浓缩所收集目的蛋白(1.8 mL,6.2 mg/mL),其回收率为4.6%。SDS-PAGE结果显示,目的蛋白的纯度达95%左右,其相对分子量约18×103,与预期理论值相一致(图 2A)。目的蛋白经电泳后转膜,一抗为小鼠抗组氨酸标签单抗,二抗为HRP-山羊抗小鼠IgG,免疫印迹结果显示在相应分子量位置出现特异的印迹带(图 2B)。
|
| A:重组蛋白纯化 M:标准;1~8:不同时间点流穿液;B:免疫印迹鉴定重组蛋白 M:标准;1:重组蛋白 图 2 重组蛋白的纯化和鉴定 |
2.3 重组Hcp1的免疫学性质鉴定
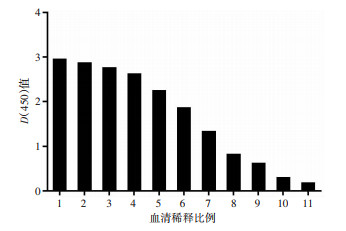
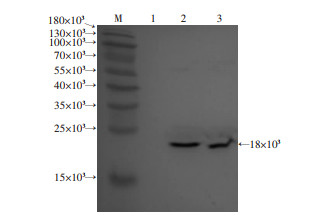
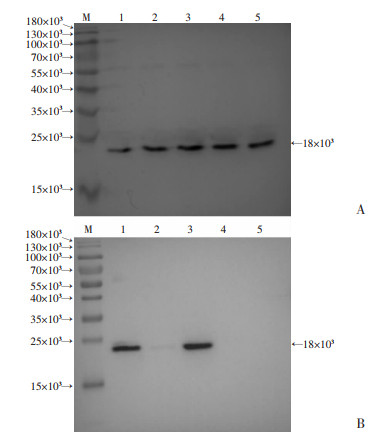
收集纯化后的重组Hcp1蛋白免疫小鼠血清进行ELISA检测,结果显示血清抗体滴度为1:512 000(图 3)。将其作为一抗,以HRP-山羊抗小鼠IgG抗体作为二抗,进行免疫印迹实验,结果显示该抗血清与Hcp1蛋白和类鼻疽全菌裂解液在18×103处均出现了特异性印迹条带(图 4)。同时,在不同的类鼻疽杆菌临床菌株(BPC008、BPC010、BPC014、BPC018、BPC006)细胞裂解液中也检测到相同分子量的特异条带(图 5A)。类鼻疽杆菌、结核分枝杆菌、泰国伯克霍尔德菌、铜绿假单胞菌和金黄色葡萄球菌的菌液样本检测结果显示,在类鼻疽杆菌和泰国伯克霍尔德菌全菌裂解液中检测到相同分子量的特异条带(图 5B)。此外,进一步研究发现Hcp1蛋白与类鼻疽杆菌感染的患者血清可发生特异性结合,而与阴性对照血清不发生反应(图 6),并且免疫荧光实验结果显示Hcp1多克隆抗体能够与类鼻疽杆菌表达的Hcp1蛋白发生特异性抗原抗体结合反应,菌体呈现红色荧光,Hcp1蛋白呈现绿色荧光,对照组大肠杆菌则没有产生相应的荧光(图 7)。上述结果显示Hcp1重组蛋白制备的抗血清可以和类鼻疽杆菌、泰国伯克霍尔德菌发生特异性反应,但不能与大肠杆菌、结核分枝杆菌、铜绿假单胞菌及金黄色葡萄球菌发生特异性结合。
|
| 1:1:1 000;2:1:2 000;3:1:4 000;4:1:8 000;5:1:16 000;6:1:32 000;7:1:64 000;8:1:128 000;9:1:256 000;10:1:512 000;11:1:1 024 000 图 3 ELISA检测抗Hcp1多克隆抗体效价 |
|
| M:标准;1:牛血清白蛋白作阴性对照;2:Hcp1蛋白;3:类鼻疽杆菌 图 4 重组Hcp1蛋白的免疫印迹鉴定 |
|
| A:免疫印迹鉴定抗血清与不同类鼻疽临床菌株间反应性 M:标准;1:BPC008;2:BPC010;3:BPC014;4:BPC018;5:BPC006;B:免疫印迹鉴定抗血清与其他菌属菌株间反应性M:标准;1:类鼻疽杆菌;2:结核分枝杆菌;3:泰国伯克霍尔德菌;4:铜绿假单胞菌;5:金黄色葡萄球菌 图 5 免疫印迹鉴定抗血清与不同类鼻疽临床菌株、其他菌属菌株间反应性 |
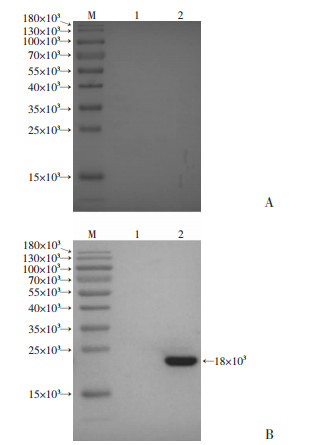
|
| M:标准;1:牛血清白蛋白作阴性对照;2:Hcp1蛋白 A:阴性血清;B:阳性血清 图 6 免疫印迹鉴定Hcp1蛋白与临床血清反应性 |
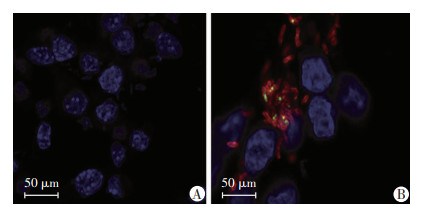
|
| A:大肠杆菌作对照;B:类鼻疽杆菌 图 7 免疫荧光分析Hcp1多克隆抗体与类鼻疽杆菌发生特异性结合反应(×400) |
3 讨论
类鼻疽是由类鼻疽杆菌感染引起的一种热带传染性疾病,其死亡率高达40%左右[3]。近年来类鼻疽的流行越来越广泛,非疫源地出现了输入性病例的报道。随着研究的不断深入,人们对于类鼻疽杆菌的致病机制有了更多的认识,相继发现了多种重要的毒力因子,其中主要包括群体感应系统、Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)、T6SS、荚膜多糖、脂多糖、类鼻疽致死因子1(Burkholderia lethal factor 1,BLF1)等[6]。存在于革兰阴性菌中的Ⅵ型分泌系统(T6SS)含13个保守的编码基因,可形成具有噬菌体尾状结构的大分子膜跨越注射器[7-8]。它通过效应物接触依赖方式将毒力因子分泌到宿主细胞中[9]。溶血素共调节蛋白(hemolysin coregulated protein,Hcp)是T6SS的分泌底物,与噬菌体尾部蛋白同源,也是T6SS发挥功能所必需的组成部分[10-11]。类鼻疽杆菌基因库中共有6个基因簇编码T6SS,分别是T6SS-1(BPSL3111-BPSL3097)、T6SS-2(BPSS0095-BPSS0116)、T6SS-3 (BPSS0158-BPSS0167)、T6SS-4 (BPSS0515-BPSS0533)、T6SS-5 (BPSS1493-BPSS1511)和T6SS-6 (BPSS2093-BPSS2109),通过检测6个类鼻疽杆菌T6SS基因簇在U937巨噬细胞感染过程中的表达谱,发现T6SS-5基因簇的转录显著升高,而其他5个基因簇未有明显变化,同时T6SS-5的效应蛋白Hcp1(BPSS1498)在被类鼻疽杆菌感染的U937巨噬细胞中的表达水平也显著升高,提示Hcp1很可能在类鼻疽的致病机制中发挥重要的作用[12-13]。对类鼻疽杆菌K96243的6个Hcp基因研究发现:Hcp1~6分别由BPSS1498、BPSS0518、BPSS2098、BPSS0171、BPSS0099以及BPSL3105编码。其中Hcp1是形成T6SS分泌装置的关键结构蛋白,也是其发挥生物学效应的重要效应蛋白,通常在表达T6SS细菌的上清液中被发现[14]。在吞噬细胞系和非吞噬细胞系中,细胞间融合和多核巨细胞(multinucleated giant cells,MNGC)的形成是类鼻疽杆菌感染的1个典型形态学改变[15],Hcp1突变/缺失株在RAW264.7巨噬细胞中不能形成MNGC或形成MNGC能力下降,提示Hcp1在类鼻疽杆菌感染以及后续致病过程中起到了非常重要的作用。研究还发现Hcp1优先与宿主体内抗原呈递细胞结合,通过增加对辅助T细胞的摄取和抗原呈递来增强其免疫原性,从而产生相应的抗体[16]。BURTNICK等[17]发现Hcp1免疫小鼠后,可使小鼠在42 d内的存活率达到50%,但进一步研究发现存活小鼠的脾脏中仍然观察到定植在其中的类鼻疽杆菌。类鼻疽杆菌自1911年被发现以来,人们就展开了其疫苗的研究工作,但目前还有进入临床研究的相关报道。本研究显示,重组Hcp1蛋白的抗血清可在伯克霍尔德菌属中引起交叉反应,推测其可能具有交叉保护作用,是潜在的疫苗候选抗原。结合文献[17]报道,Hcp1能否产生有效的免疫保护作用还需要进一步的深入研究。因此,研究Hcp1的生物学功能对揭示类鼻疽杆菌感染的致病机制及类鼻疽疫苗的研发具有重要意义。
本研究成功构建了表达Hcp1的重组质粒pET-28a-Hcp1,并在E.coli BL21(DE3)中诱导表达,通过亲和层析纯化,得到了分子质量为18×103左右的高纯度目的蛋白Hcp1。以重组蛋白Hcp1免疫BALB/c小鼠获得的抗血清中抗体效价达1:512 000。该抗血清能与多种的类鼻疽杆菌临床菌株发生特异性抗原抗体反应,而不与其他细菌(如大肠杆菌、结核分枝杆菌、铜绿假单胞菌及金黄色葡萄球菌)结合,此外,重组Hcp1还能与类鼻疽杆菌感染的患者血清发生特异性抗原抗体反应,表明重组表达的Hcp1具有良好的免疫原性和特异的抗原反应性。同时,在实验中我们发现抗Hcp1的多克隆抗体除了能识别类鼻疽杆菌外,还能与基因型相近的泰国伯克霍尔德菌发生抗原抗体反应。结果提示:一方面,类鼻疽杆菌和泰国伯克霍尔德菌Hcp1在结构和功能上可能具有相似性,我们制备的重组Hcp1及其抗血清可为伯克霍尔德菌属细菌T6SS的研究提供良好的工具和手段。另一方面,类鼻疽杆菌和泰国伯克霍尔德菌Hcp1与相应的抗血清具有交叉反应性,因此,在利用Hcp1作为诊断抗原进行类鼻疽血清学检验时,要充分考虑其特异性。下一步,课题组将对伯克霍尔德菌Hcp1蛋白进行核苷酸、氨基酸比对,找到类鼻疽杆菌特异的片段作为类鼻疽的血清学诊断抗原,来提高诊断的准确性,进一步为类鼻疽血清学筛查以及流行病学调查奠定基础。
| [1] |
WIERSINGA W J, CURRIE B J, PEACOCK S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. DOI:10.1056/nejmra1204699 |
| [2] |
LIMMATHUROTSAKUL D, GOLDING N, DANCE D A B, et al. Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis[J]. Nat Microbiol, 2016, 1(1): 15008. DOI:10.1038/nmicrobiol.2015.8 |
| [3] |
CHENG A C, CURRIE B J. Melioidosis: epidemiology, pathophysiology, and management[J]. Clin Microbiol Rev, 2005, 18(2): 383-416. DOI:10.1128/CMR.18.2.383-416.2005 |
| [4] |
D'CRUZE T, GONG L, TREERAT P, et al. Role for the Burkholderia pseudomallei type three secretion system cluster 1 bpscN gene in virulence[J]. Infect Immun, 2011, 79(9): 3659-3664. DOI:10.1128/iai.01351-10 |
| [5] |
胡艺, 胡志强, 马腾飞, 等. 类鼻疽杆菌Ⅲ型分泌系统BPSS1395蛋白表达及其抗体制备与鉴定[J]. 第三军医大学学报, 2017, 39(10): 941-945. HU Y, HU Z Q, MA T F, et al. Expression and identification of recombinant Burkholderia pseudomallei type Ⅲ secretion system BPSS1395 protein and preparation of its polyclonal antibodies[J]. J Third Mil Med Univ, 2017, 39(10): 941-945. DOI:10.16016/j.1000-5404.201611152 |
| [6] |
PUAH S M, PUTHUCHEARY S D, WANG J T, et al. Molecular characterization of putative virulence determinants in Burkholderia pseudomallei[J]. Sci World J, 2014, 2014: 590803. DOI:10.1155/2014/590803 |
| [7] |
BÖNEMANN G, PIETROSIUK A, MOGK A. Tubules and donuts: a type Ⅵ secretion story[J]. Mol Microbiol, 2010, 76(4): 815-821. DOI:10.1111/j.1365-2958.2010.07171.x |
| [8] |
CASCALES E, CAMBILLAU C. Structural biology of type Ⅵ secretion systems[J]. Philos Trans R Soc Lond B Biol Sci, 2012, 367(1592): 1102-1111. DOI:10.1098/rstb.2011.0209 |
| [9] |
HO B T, DONG T G, MEKALANOS J J. A view to a kill: the bacterial type Ⅵ secretion system[J]. Cell Host Microbe, 2014, 15(1): 9-21. DOI:10.1016/j.chom.2013.11.008 |
| [10] |
SILVERMAN J M, BRUNET Y R, CASCALES E, et al. Structure and regulation of the type Ⅵ secretion system[J]. Annu Rev Microbiol, 2012, 66: 453-472. DOI:10.1146/annurev-micro-121809-151619 |
| [11] |
HARRISON J W, DUNG T T, SIDDIQUI F, et al. Identification of possible virulence marker from Campylobacter jejuni isolates[J]. Emerg Infect Dis, 2014, 20(6): 1026-1029. DOI:10.3201/eid2006.130635 |
| [12] |
CHIENG S, CARRETO L, NATHAN S. Burkholderia pseudomallei transcriptional adaptation in macrophages[J]. BMC Genom, 2012, 13(1): 1-13. DOI:10.1186/1471-2164-13-328 |
| [13] |
CHIENG S, MOHAMED R, NATHAN S. Transcriptome analysis of Burkholderia pseudomallei T6SS identifies Hcp1 as a potential serodiagnostic marker[J]. Microb Pathog, 2015, 79: 47-56. DOI:10.1016/j.micpath.2015.01.006 |
| [14] |
BURTNICK M N, BRETT P J, HARDING S V, et al. The cluster 1 type Ⅵ secretion system is a major virulence determinant in Burkholderia pseudomallei[J]. Infect Immun, 2011, 79(4): 1512-1525. DOI:10.1128/iai.01218-10 |
| [15] |
BODDEY J A, DAY C J, FLEGG C P, et al. The bacterial gene lfpA influences the potent induction of calcitonin receptor and osteoclast-related genes in Burkholderia pseudomallei-induced TRAP-positive multinucleated giant cells[J]. Cell Microbiol, 2007, 9(2): 514-531. DOI:10.1111/j.1462-5822.2006.00807.x |
| [16] |
LIM Y T, JOBICHEN C, WONG J, et al. Extended loop region of Hcp1 is critical for the assembly and function of type Ⅵ secretion system in Burkholderia pseudomallei[J]. Sci Rep, 2015, 5: 8235. DOI:10.1038/srep08235 |
| [17] |
BURTNICK M N, BRETT P J, HARDING S V, et al. The cluster 1 type Ⅵ secretion system is a major virulence determinant in Burkholderia pseudomallei[J]. Infect Immun, 2011, 79(4): 1512-1525. DOI:10.1128/iai.01218-10 |



