食管癌是我国常见的恶性肿瘤之一,目前首选的仍是以外科手术切除为基础,再结合术后化疗、辅助治疗的综合治疗方案[1]。传统开放手术虽能切除病变,改善患者症状,但手术创伤大、并发症重、疼痛剧烈,影响患者术后生活质量。随着近年来微创腔镜技术的发展,胸腹腔镜联合微创手术成为食管癌手术治疗的热点,但在应用指征、肿瘤根治性、手术创伤、术后并发症、生存质量以及远期生存率方面存在较大争议[2]。对于两种手术方式的短期临床疗效,既往研究尚有争议[3-4]。此外,针对不同病理分期的食管癌患者,不同的手术方式是否对预后产生影响仍需探讨研究。本研究旨在探讨胸腹腔镜联合微创手术与传统开放手术对不同病理分期食管癌短期预后的影响,回顾性研究2017年1月至2018年12月间于我院行食管癌根治术患者的280份临床资料,提出并分析微创术式与开放术式在短期疗效上的迥异,对不同病理分期食管癌患者的手术选择提供临床经验。
1 资料与方法 1.1 一般资料收集2017年1月至2018年12月间于我院行食管癌根治术且临床资料完整的患者共280例,病例纳入标准:①术前行胃镜病检证实为食管鳞状细胞癌;②既往无胸腹部手术史;③经影像学检查无远处转移;④术前未接受过新辅助治疗。排除标准:①微创术中中转开胸或开腹;②合并其他肿瘤或有远处转移(Ⅳb期)者;③因肿瘤与周围结构关系密切仅行探查手术者;④术前接受过新辅助治疗。其中男性223例,女性57例,年龄40~81(63.66±8.01)岁。术后病理组织学检查证实诊断,依据2017年UICC/AJCC第8版食管癌TNM分期标准[5],其中0期8例,Ⅰ期43例,Ⅱ期103例,Ⅲ期106例,Ⅳ期20例(已排除Ⅳb期)。患者分为:①微创组,包括胸腹腔镜联合食管大部切除+胸内吻合术(Ivor-Lewis术式)、胸腹腔镜联合食管大部切除+颈部吻合术(McKeown术式),及机器人辅助手术;②开放组,包括传统开放下的Ivor-Lewis术式、Ivor-Lewis术式,及经左胸食管癌根治术。本研究已通过医院伦理委员会批准,最终纳入本研究的患者均签署知情同意书。
1.2 观察指标包括一般资料、手术时间、术中出血量、恢复进食时间、术后住院时间、术后并发症(肺部感染、吻合口瘘、切口感染、胸腔积液)、术后病理分期等指标。
1.3 统计学处理使用SPSS 20.0软件对数据进行统计学分析,计量资料若符合正态分布则以x±s表示,偏态分布数据以M(P25,P75)表示, 计数资料以例数和百分比表示。单因素分析采用计数四格表资料的χ2检验,偏态分布数据排除异常值并经过log10对数转换使数据符合正态分布后再行χ2检验;采用2×4(手术方式×病理分期)多因素分析研究术后饮食恢复和术后住院时间受到的影响,并行主体间效应检验及Bonferroni校正后两两对比检验,绘制折线图。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较两组患者临床资料对比无明显统计学差异(P>0.05,表 1),资料具有可比性。其中,行胸腹腔镜手术患者,肿瘤位置多位于食管中上段,术中多行颈部吻合;行开放手术患者,肿瘤多位于食管中下段,术中多行胸内吻合。
| 组别 | n | 性别 | 年龄/岁 | BMI | 吸烟史 | 饮酒史 | 高血压 | 糖尿病 | 肿瘤部位 | 吻合位置 | pTMNG分期 | |||||||||||||||||
| 男 | 女 | 有 | 无 | 有 | 无 | 有 | 无 | 有 | 无 | 胸上段 | 胸中段 | 胸下段 | 颈部 | 胸部 | 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | |||||||||
| 微创组 | 81 | 57(70.4) | 24(29.6) | 64.54±6.27 | 22.16±2.84 | 52(64.2) | 29(35.8) | 47(58.0) | 34(42.0) | 14(17.3) | 67(82.7) | 7(8.6) | 74(91.4) | 13(16.0) | 51(63.0) | 17(21.0) | 72(88.9) | 9(11.1) | 4(4.9) | 12(14.8) | 37(45.7) | 23(28.4) | 5(6.2) | |||||
| 开放组 | 199 | 166(83.4) | 33(16.6) | 63.42±8.21 | 22.47±3.08 | 150(75.4) | 49(24.6) | 138(69.3) | 61(30.7) | 31(15.6) | 168(84.4) | 8(4.0) | 191(96.0) | 12(6.0) | 93(46.7) | 94(47.2) | 22(11.1) | 177(88.9) | 4(2.0) | 31(15.6) | 66(33.2) | 83(41.7) | 15(7.5) | |||||
| t/χ2 | 6.044 | -1.229 | 0.801 | 3.58 | 3.292 | 0.124 | 2.425 | 19.426 | 156.38 | 7.045 | ||||||||||||||||||
| P | 0.014 | 0.221 | 0.424 | 0.058 | 0.07 | 0.724 | 0.119 | 0 | 0 | 0.134 | ||||||||||||||||||
2.2 两组手术围术期资料比较
本研究共纳入280例患者,手术时间(286.72± 89.31)min,总平均出血量200(100, 300)mL,总平均术后住院时间14(11, 19)d。微创组共81例(机器人手术17例),开放组共199例。在术中情况中,微创组手术时间明显长于开放组,术中出血量明显少于开放组,差异均具有统计学意义(P < 0.05)。围术期预后中,两组病例术后住院时间无明显差异(15 d vs. 14 d, P>0.05),但微创组术后恢复饮食所需时间长于开放组(12 d vs. 11 d, ),差异具有统计学意义(P < 0.05)。两组病例总的术后并发症发生率无明显差异(P>0.05),但微创组更容易发生吻合口瘘,开放组更容易出现肺部感染及胸腔积液,差异均具有统计学意义(P < 0.05,表 2)。
| 组别 | n | 手术时间/min | 出血量/mL | 恢复饮食时间/d | 术后住院时间/d | 术后并发症 | 吻合口瘘 | 肺部感染 | 切口感染 | 胸腔积液 | 心律失常 | 死亡 |
| 微创 | 81 | 331.74±83.44 | 100(100, 200) | 12(10, 17) | 15(12,20) | 40(49.4) | 19(23.5) | 22(27.2) | 14(17.1) | 6(7.5) | 4(4.9) | 2(2.5) |
| 开放 | 199 | 268.39±85.21 | 200(200, 300) | 11(9, 17) | 14(11, 19) | 110(55.3) | 20(10.1) | 83(41.7) | 32(16.1) | 33(16.6) | 14(7.0) | 5(2.5) |
| t/χ2 | -5.675 | 2.49 | -2.08 | -1.901 | 0.804 | 8.631 | 5.199 | 0.042 | 3.915 | 0.421 | 0 | |
| P | 0 | 0.013a | 0.038a | 0.058a | 0.37 | 0.003 | 0.023 | 0.838 | 0.048 | 0.517 | 0.983 | |
| a:P值为偏态分布数据排除异常值并经过log10对数转换使数据符合正态分布后所得 | ||||||||||||
2.3 不同病理分期食管癌的围术期恢复时间比较
在不同病理分期食管癌患者中,微创组的手术时间较开放组普遍更长,而病理分期对于手术时间无明显影响,见图 1A。病理分期无明显效应(F=1.300, P>0.05), 手术方式的主效应有统计学意义(F=20.231,P < 0.05),两者的交互作用无明显效应(F=0.221,P>0.05)。
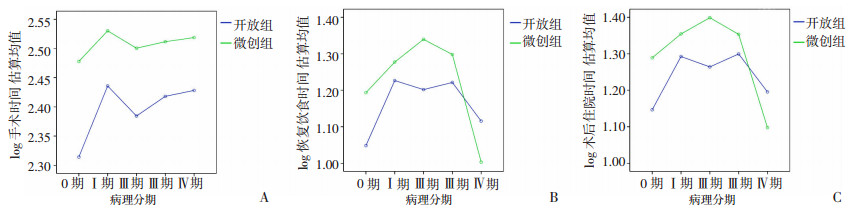
|
| 图 1 病理分期与手术方式对手术时间(A)、恢复饮食时间(B)、术后住院时间(C)的影响 |
病理分期与手术方式对于患者术后恢复饮食时间(图 1B)、术后住院时间(图 1C)均有共同作用。病理分期的主效应(F=30.794, P < 0.05), 手术方式的主效应(F=16.391,P < 0.05),两者的交互作用(F=10.930,P < 0.05)。病理分期的主效应(F= 26.253, P < 0.05),手术方式的主效应(F=18.579,P < 0.05),两者交互作用的主效应(F=12.203,P < 0.05)。
相较于其他病理分期,0期和Ⅳ期患者术后恢复饮食时间、术后住院时间均更短,差异均具有统计学意义(Bonferroni校正,P < 0.05)。对于Ⅳ期,无法行根治性切除、仅行R0期切除患者,微创组比开放组更能有效缩短术后恢复饮食时间及术后住院时间(P < 0.05)。见图 1B,图 1C。
3 讨论食管癌作为一种常见的消化道肿瘤,好发于40岁及以上的中老年人, 男性患者多于女性[6],本研究结果与文献报道一致。本研究结果显示手术方式的选择对于患者围术期情况有重要影响。开放手术相较于微创手术,手术时间更短,吻合口瘘发生率更低。然而,微创手术能明显减少术中出血、减少肺部感染的发生,更对于食管癌晚期非R0切除的患者的短期恢复,具有明显优势。
术中出血量和手术时间是评价食管癌手术的重要指标。与既往报道一致的是,微创手术能够有效减少术中出血(P < 0.05)[7-9]。同时,本研究显示,在不同病理分期的病例中,微创手术的手术时间也普遍长于开放手术(P < 0.05)。由于采用腔镜孔代替开放手术的长切口,一方面减少了对胸腹部肌肉和血管的损伤,不切断或撑开肋骨,不离断胸腹部呼吸肌,同时最大限度地减少腹部切口长度,使切口能更快愈合且外形美观[10];另一方面腔镜能够放大术野,使得胸腔和腹腔内的脏器和解剖结构更加清晰,使术者能对手术区域有精确把握,避免了手术中许多不必要的损伤[11]。而在手术时间上,微创手术明显长于开放手术(P < 0.05)[12],这与胸腹腔镜食管手术步骤较繁琐有关,如术中需改变体位,并需行颈胸腹多个切口等[13]。
在术后短期疗效上,开放手术略优于微创手术,虽在术后住院时间上两种手术方式差异无统计学意义(P>0.05),但开放手术恢复饮食时间更短(P < 0.05)。但由于本研究开放组以经左胸食管癌根治术为主(177/199, 88.9%),微创手术以经右胸三切口McKeown术式为主(72/81, 88.9%),使得这一结果具有一定局限性。但本研究术后住院时间与国内外报道基本一致[11]。一般认为,当术式相同时(微创和开放手术均行McKeown术式或Ivor-Lewis术式),微创手术的术后住院时间略短于开放手术[14-15]。
目前,对微创手术能否降低食管癌术后并发症总的发生率尚有争议[16-19]。但多项研究表明微创手术能够减少术后肺部并发症的发生,尤其是降低肺部感染的风险[20-22]。本研究也证实,相较于开放手术,微创手术能够降低术后肺部感染及胸腔积液的发生率。肺部并发症与胸腔内手术情况密切相关,由于微创手术对术区肌肉、骨骼损伤小,患者术后对疼痛耐受度好,术后主动咳嗽排痰、活动锻炼呼吸功能依从度高;同时避免了开放手术术中对于肺组织的较大范围的反复牵拉和挤压,减少了炎性因子的释放和气道分泌物的产生,从而有效减轻了术后感染的发生。
此外,本研究显示微创手术的吻合口瘘发生率明显高于开放手术,这可能是由于不同手术方式本身的吻合位置所导致。既往研究表明,颈部吻合是食管癌术后发生吻合口瘘的独立危险因素[23]。在本研究中,手术方式的选择决定了吻合位置的不同。行微创手术者,其肿瘤位置多处于食管中上段(79%),多为McKeown术式,其吻合位置位于颈部,而较少采用胸内吻合的Ivor-Lewis术式;而开放手术多为中下段食管癌(94%),多采用经左胸食管癌根治术,吻合位置位于胸内。事实上,当微创手术与开放手术均采用颈部吻合时,吻合口瘘的发生没有统计学差异(表 3)。因此,对于需行颈部吻合的个体,选择微创手术更有优势。颈部吻合几乎都在经右胸路径的颈胸腹三切口食管癌根治术(McKeown术式)中使用,相较于左胸路径的单切口术式,此术式切口多、手术范围大、术中须改变体位、淋巴结清扫数量更多、切缘安全距离更长[24-25]。而术式的选择首先应当考虑治疗效果的根治性,对于临床分期较晚的患者应当采用McKeown术式从而可以争取获得更好的远期生存[26]。
| 手术方式 | 是否发生吻合口瘘 | 合计 | χ2值 | P值 | |
| 是 | 否 | ||||
| 微创手术 | 18 | 54 | 72 | 0.437 | 0.509 |
| 开放手术 | 4 | 18 | 22 | ||
| 合计 | 22 | 72 | 94 | ||
在大多数微创食管癌根治术的远期疗效研究中,研究对象均为行根治性(R0)手术切除的患者,而由于Ⅳ期肿瘤侵犯食管周围结构,无法达到根治性切除,增加了统计分析中自变量的不确定性,常常只作为数据收集的排除标准。但另一方面,行非R0切除手术的Ⅳ期患者,往往更加需要尽快恢复,以及时接受术后化疗或辅助治疗以延长生存期。因此本研究虽排除掉Ⅳb期(已发生远处多器官转移)的病例,而保留了Ⅳa期,虽有周围结构侵犯,但仍进行了食管病灶切除的病例。本研究首次提出微创手术对于非R0切除的患者的短期恢复,具有明显优势。这或许是由于在进行非R0切除时,食管周围结构因受肿瘤或肿大淋巴结显著侵犯,进行仔细解剖切除意义不大,在完成病灶局部切除后,对周围结构仅行探查或组织采样,相对而言损伤少。因此,虽然在手术时间上与其他分期食管癌手术无统计学差异,但术后住院时间短、恢复时间快,充分体现了微创手术的优势,这对后续的进一步治疗具有重要意义。现有大多数研究认为,腔镜手术具有较高的R0切除率,较开放手术并不增加切缘阳性率[27-29]。而对于食管癌的远期生存率来说,当前的前瞻性和回顾性研究并未显示出两种手术方式在3年及5年生存率上的统计学差异。因此,对很少受关注的非根治性切除晚期食管癌患者,微创手术是否在远期疗效仍有积极影响,还需要更多的探讨研究。
综上所述,胸腹腔镜联合微创食管癌根治术在减少术中出血、保护肺功能、缓解术后疼痛、降低肺部并发症发生率等方面具有明显优势,但较长的手术时间仍是未来需要克服的问题。对于无法追求R0切除的患者,微创手术更利于患者术后快速恢复,从而得以尽快进行术后继续治疗,对延长晚期患者的生活质量、生存期限具有重要意义。因此在条件允许情况下,微创食管癌根治术值得在临床推广应用。
| [1] |
AJANI J A, D'AMICO T A, BENTREM D J, et al. Esophageal andesophagogastric junction cancers, version 2.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [2] |
于振涛. 食管癌外科治疗现状及争议热点[J]. 中华肿瘤杂志, 2016, 38(09): 646-649. YU Z T. Current status of surgical treatment of esophageal carcinoma and related hot issues[J]. Chin J Oncol, 2016, 38(09): 646-649. |
| [3] |
林涛, 解明然, 马冬春. 微创与开放Ivor Lewis食管切除术后急慢性疼痛对比研究[J]. 中华肿瘤防治杂志, 2019, 26(11): 784-789. LIN T, XIE M R, MA D C. Acute and chronic pain between minimally invasiveivor iewis esophagectomy and open ivor lewis esophagectomy[J]. Chin J Cancer Prev Treat, 2019, 26(11): 784-789. |
| [4] |
蔡华荣, 羽平, 周洪, 等. 胸腹腔镜联合食管癌根治术与传统食管癌根治术同期临床对照研究[J]. 第三军医大学学报, 2014, 36(20): 2142-2144. CAI H R, YU P, ZHOU H, et al. Radical resection of esophagus carcinoma by open versus minimally invasive approaches: a clinical study of 108 cases[J]. J Third Mil Med Univ, 2014, 36(20): 2142-2144. |
| [5] |
RICE T W, ISHWARAN H, FERGUSON M K, et al. Cancer of the esophagus andesophagogastric junction: an eighth edition staging primer[J]. J Thorac Oncol, 2017, 12(1): 36-42. DOI:10.1016/j.jtho.2016.10.016 |
| [6] |
肖蔼杰, 张志辉, 林植楷, 等. 胸腹腔镜联合手术在食管癌治疗中的应用效果探讨[J]. 中国医学创新, 2015, 12(16): 136-138. XIAO A J, ZHANG Z H, LIN Z K, et al. To explore the application effect of chest laparoscopic combined operation in the treatment of esophageal cancer[J]. Med Innov Chin, 2015, 12(16): 136-138. |
| [7] |
郑晓东, 张卫民, 侯建彬. 胸腹腔镜联合微创术与开放手术治疗食管癌的临床效果比较[J]. 中国临床新医学, 2019, 12(10): 1108-1112. ZHENG X D, ZHANG W M, HOU J B. Comparison of the clinical effects between minimally invasive surgery thoracolaparoscopic esophagectomy and open esophagectomy on treatment of esophageal carcinoma[J]. Chin J New Clin Med, 2019, 12(10): 1108-1112. |
| [8] |
MU J W, GAO S G, XUE Q, et al. Updated experiences with minimally invasive McKeown esophagectomy for esophageal cancer[J]. World J Gastroenterol, 2015, 21(45): 12873-12881. DOI:10.3748/wjg.v21.i45.12873 |
| [9] |
陈亮, 王武军, 蔡瑞君. 胸腔镜腹腔镜联合手术与开放手术治疗食管癌的Meta分析[J]. 中华胃肠外科杂志, 2012(06): 603-607. CHEN L, WANG W J, CAI R J. Thoracolaparoscopic esophagectomy versus open esophagectomy: A meta-analysis of outcomes[J]. Chin J Gastrointest Surg, 2012(6): 603-607. |
| [10] |
于洋复, 赵文刚, 刘仁杰. 胸腹腔镜联合手术在食管癌治疗中的临床效果及安全性[J]. 中国医药指南, 2020, 18(09): 141-142. YU Y F, ZHAO W G, LIU R J. Clinical effect and safety of combined thoracoscopic surgery in the treatment of esophageal cancer[J]. Guide Chin Med, 2020, 18(9): 141-142. |
| [11] |
柳林, 张勇, 王霄霖, 等. pT1b期食管鳞状细胞癌开放手术与微创食管切除术后预后分析[J]. 中国胸心血管外科临床杂志, 2020, 27(7): 1-8. LIU L, ZHANG Y, WANG X L, et al. Prognostic analysis of pT1b esophageal squamous cell carcinoma after open or minimally invasive esophagectomy[J]. Chin J Clin Thorac Cardiov Surg, 2020, 27(7): 1-8. |
| [12] |
YIBULAYIN W, ABULIZI S, LV H, et al. Minimally invasive oesophagectomy versus open esophagectomy for resectable esophageal cancer: a meta-analysis[J]. World J Surg Onc, 2016, 14: 304. DOI:10.1186/s12957-016-1062-7 |
| [13] |
孙超, 石维平, 吕小夏, 等. 三切口食管癌切除术:胸腔镜与开放手术的术后并发症分析[J]. 中华腔镜外科杂志(电子版), 2016, 9(6): 354-357. SUN C, SHI W P, LYU XX, et al. Analysis of postoperative complications for McKeown esophagectomy: minimally invasive versus open esophagectomy[J]. Chin J Laparosc Surg Electron Ed, 2016, 9(6): 354-357. |
| [14] |
SEESING M F J, GISBERTZ SS, GOENSE L, et al. A propensity score matched analysis of open versus minimally invasive transthoracic esophagectomy in the Netherlands[J]. Ann Surg, 2017, 266(5): 839-846. DOI:10.1097/sla.0000000000002393 |
| [15] |
王文凭, 何松林, 杨玉赏, 等. 食管癌微创外科手术的现状与思考[J]. 中国胸心血管外科临床杂志, 2018, 25(4): 338-344. WANG W P, HE S L, YANG Y S, et al. Development and future of the minimally invasiveesophagectomy for esophageal cancer[J]. Chin J Clin Thorac Cardiovasc Surg, 2018, 25(4): 338-344. |
| [16] |
林涛, 解明然, 马冬春. 微创与开放Ivor Lewis食管切除术后急慢性疼痛对比研究[J]. 中华肿瘤防治杂志, 2019, 26(11): 784-789. LIN T, XIE M R, MA D C. Acute and chronic pain between minimally invasiveivor iewis esophagectomy and open Ivor Lewis esophagectomy[J]. Chin J Cancer Prev Treat, 2019, 26(11): 784-789. |
| [17] |
陈保富, 朱成楚, 王春国, 等. 胸腔镜腹腔镜联合手术与开放手术治疗食管癌的同期临床对照研究[J]. 中华外科杂志, 2010, 48(16): 1206-1209. CHEN B F, ZHU C C, WANG C G, et al. Clinical comparative study of minimally invasive esophagectomy versus open esophagectomy for esophageal carcinoma[J]. Chin J Surg, 2010, 48(16): 1206-1209. |
| [18] |
KAUPPI J, RÄSÄNEN J, SIHVO E, et al. Open versus minimally invasive esophagectomy: clinical outcomes for locally advanced esophageal adenocarcinoma[J]. Surg Endosc, 2015, 29(9): 2614-2619. DOI:10.1007/s00464-014-3978-8 |
| [19] |
TAKEUCHI H, MIYATA H, GOTOH M, et al. a risk model foresophagectomy using data of 5354 patients included in a Japanese nationwide web-based database[J]. Ann Surg, 2014, 260(2): 259-266. DOI:10.1097/sla.0000000000000644 |
| [20] |
BIERE SS, VAN BERGE HENEGOUWEN M I, MAAS K W, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial[J]. Lancet, 2012, 379(9829): 1887-1892. DOI:10.1016/s0140-6736(12)60516-9 |
| [21] |
LI B, YANG Y, SUN Y, et al. Minimally invasive esophagectomy for esophageal squamous cell carcinoma-Shanghai Chest Hospital experience[J]. J Thorac Dis, 2018, 10(6): 3800-3807. DOI:10.21037/jtd.2018.06.75 |
| [22] |
LV L, HU W, REN Y, et al. Minimally invasive esophagectomy versus open esophagectomy for esophageal cancer: a meta-analysis[J]. Onco Targets Ther, 2016, 9: 6751-6762. DOI:10.2147/ott.s112105 |
| [23] |
张卫国, 李勉, 单言歌, 等. 食管癌术后颈部吻合口瘘的危险因素分析[J]. 中国胸心血管外科临床杂志, 2020, 27(03): 303-307. ZHANG W G, LI M, SHAN Y G, et al. Analysis of risk factors of cervical anastomotic leakage after esophageal cancer operation[J]. Chin J Clin Thorac Cardiov Surg, 2020, 27(3): 303-307. |
| [24] |
MO R, CHEN C, PAN L, et al. Cervical or thoracic anastomosis for patients with cervicothoracic esophageal squamous cell carcinoma[J]. Ann Transl Med, 2018, 6(11): 202. DOI:10.21037/atm.2018.05.19 |
| [25] |
BIERE S S A Y, MAAS K W, CUESTA M A, et al. Cervical or thoracic anastomosis after esophagectomy for cancer: a systematic review and meta-analysis[J]. Dig Surg, 2011, 28(1): 29-35. DOI:10.1159/000322014 |
| [26] |
张彤, 马永富, 李云婧, 等. 微创Ivor-Lewis术与McKeown术治疗T3期中下段食管癌的疗效比较[J]. 解放军医学院学报, 2020, 41(1): 60-63. ZHANG T, MA Y F, LI Y J, et al. Outcomes of minimally invasiveesophagectomy for patients with stage T3 tumors located on middle or lower thoracic esophagus: Ivor-Lewis versus McKeown[J]. Acad J Chin PLA Med Sch, 2020, 41(1): 60-63. |
| [27] |
DEIDDA S, CRIPPA J, DUCHALAIS E, et al. Hybrid minimally invasive/open approach versus total minimally invasive approach for rectal cancer resection: short-and long-term results[J]. Int J Colorectal Dis, 2019, 34(7): 1251-1258. DOI:10.1007/s00384-019-03311-4 |
| [28] |
YEROKUN B A, SUN Z F, YANG C F J, et al. Minimally invasive versus openesophagectomy for esophageal cancer: a population-based analysis[J]. Ann Thorac Surg, 2016, 102(2): 416-423. DOI:10.1016/j.athoracsur.2016.02.078 |
| [29] |
MITZMAN B, LUTFI W, WANG C H, et al. Minimally invasiveesophagectomy provides equivalent survival to open esophagectomy: an analysis of the national cancer database[J]. Semin Thorac Cardiovasc Surg, 2017, 29(2): 244-253. DOI:10.1053/j.semtcvs.2017.03.007 |




