肿瘤细胞的快速检测在恶性肿瘤的发生、治疗和预后中起着非常重要的作用[1]。临床样品的复杂环境使得很多方法难以检测样品中的稀有肿瘤细胞,极大地限制了多种检测方法的灵敏度和特异性。目前,临床实验室已将组织化学、免疫组织化学、流式细胞术等技术应用于肿瘤细胞的检测[2]。组织化学染色存在多种干扰作用,其敏感性可能不足以准确鉴定体液标本中低丰度的肿瘤细胞。免疫组织化学由于细胞病理切片的制备、固定、抗原提取等工作耗时较长,因此基于免疫组化的体液标本分析更为复杂。流式细胞术技术虽克服了评估的难度,实现了对多种细胞表面和细胞内标志物的灵敏分析,但是需要昂贵的试剂和仪器。因此,寻找一种简单、高效、低成本检查标本中低丰度的肿瘤细胞的方法仍然是十分迫切的。核酸适配体(aptamer)是一类具有特定三维构象的小分子RNA或单链DNA,长度一般为20~80个碱基,相对分子质量(Mr)为6 000~30 000。同抗原-抗体反应一样,核酸适配体以构象互补模式(shape complementarity)特异性识别靶点[3]。研究者以核酸适配体为平台发展了多种高灵敏的肿瘤细胞检测方法[4]。然而单价的适配体识别靶标时,仍然存在选择性差、靶向效率低的缺点,导致检测和治疗效果不佳,限制了其在检测和治疗应用中的发展。
在自然界中,生物系统经常使用多价协同相互作用方式,其中一个生物实体上的多个配体同时与另一个生物实体上的受体结合,以实现高亲和力和超选择性的目的。目前分子生物学家正利用多价相互作用的机制来制造新的分子组件,从而产生适配体的新功能或增强现有适配体的性能[5]。多个相同的适配体被修饰在金属纳米粒子[6]和脂质体[7]等支架上,或通过滚环扩增[8]和杂交链式反应[9]形成DNA纳米结构中以提高亲和力。多价适配体与靶标相互作用也相当于提高了靶位点配体的有效浓度,产生比单价相互作用之和还强得多的亲和力。相比单价适配体分子,多价适配体有助于更快、更有效地检测目标细胞[10]。因此,构建多价核酸适配体是一种有效提高核酸适配体在分析检测和临床治疗等领域的应用价值的策略。
滚环扩增(rolling circle amplification,RCA)是新近发展起来的一种恒温核酸扩增方法[11]。在RCA反应中,当有环形DNA模板和聚合酶时,通过DNA聚合酶的作用,以环形DNA为模板进行复制,形成一条含有几十、几百甚至上千个相互串联重复单元的单链DNA[12]。AS1411适配体可以特异性识别并特异性结合膜表面核仁素蛋白。核仁素蛋白是一种大小为76×103的高度磷酸化酸性蛋白,在正常细胞中主要分布于核仁,而在高度增殖的细胞中,核仁素蛋白能在细胞膜表面大量表达,其表达量与肿瘤细胞的恶性程度呈正相关,其高表达也可作为细胞早期癌变的有效信号[13]。目前已证实80多种恶性肿瘤细胞(如肺癌、乳腺癌、白血病、淋巴瘤、胶质母细胞瘤等)表面高表达核仁素,AS1411适配体对这些肿瘤细胞都具有高亲和力。多个短链AS1411适配体杂交到长的核酸支架上,从而形成多价适配体。多价适配体可以诱导协同结合增加与靶细胞的接触强度与频率。本研究制备了以RCA产物作为多价支架,以AS1411适配体为基础的多价适配体,并探索其在肿瘤诊断中的应用。
1 材料与方法 1.1 试剂与仪器DNA寡核苷酸序列见表 1,均由上海生工生物有限公司合成和纯化。使用的水通过Milli-Q超纯水系统(18.2 MΩ·cm,Millipore公司)进行处理。T4 DNA连接酶(150 U/μL)购自大连宝生生物科技有限公司。phi29 DNA聚合酶(10 U/μL)及其所对应的反应缓冲液购自New England Biolab公司。dNTPs、硫黄素T(ThT)、4S GelRed核酸染料购自BBI公司。鲑鱼精DNA、DL-二硫苏糖醇(DTT)购自北京索莱宝有限公司。Evagreen Dye(20×水溶液)购自Biotium公司。培养细胞所需的血清和DMEM、RPMI 1640培养基来自BI公司。DAPI、青霉素-链霉素溶液(100×)购自碧云天生物有限公司。免疫细胞化学(ICC)所使用的试剂购于广州安必平医药科技股份有限公司。
| 名称 | 序列(5′→3′) |
| AS1411 | GGTGGTGGTGGTTGTGGTGGTGGTGG |
| Circle primer | TTGTCCGTGCTAGAAAGGCAATGACAT |
| Pre-circle template | Phosphate-TAGCACGGACAAAAAAAAAAAAAAAAATTACTCCTAAGCAACACTAGCAGAGCAAAAAAAA- AAAAAAAATGTCATTGCCTTTC |
| FAM-AS1411-polyA | FAM-GGTGGTGGTGGTTGTGGTGGTGGTGGAAAAAAAAAAAA |
| AS1411-polyA | GGTGGTGGTGGTTGTGGTGGTGGTGGAAAAAAAAAAAA |
| FAM-PolyA | FAM-AAAAAAAAAAAAAAA |
恒温混匀仪(Thermo Fisher,美国)用于滚环扩增反应;马尔文激光粒度分析仪(Zeta SIZER 3000HS,美国)用于核酸链Zeta电位检测;核酸电泳系统(六一仪器有限公司,中国)用于聚丙烯酰胺凝胶电泳(PAGE);M200型多功能酶标仪(TECAN,瑞士)用于荧光光谱检测;Leica共聚焦激光显微镜和奥林巴斯荧光显微镜观察细胞表面荧光标记物;BD FACScanto流式细胞仪分析探针标记细胞的荧光强度。
1.2 细胞培养A549(人非小细胞肺癌细胞)、MDA-MB-231(人乳腺癌细胞)、BE-AS-2B(人正常肺支气管上皮细胞)、NCI-H446(人小细胞肺癌细胞)细胞株均来自重庆医科大学肿瘤学及表观遗传学实验室,A549、MDA-MB231和BE-AS-2B细胞株在加入10%胎牛血清和1%双抗的DMEM中培养,NCI-H446细胞株在加入10%胎牛血清和1%双抗的RPMI 1640培养基中进行培养,培养环境均为37 ℃、5%CO2。在细胞长至密度合适(70%~80%)的时候弃去培养皿中的培养液,用含有EDTA的0.25%的胰酶消化细胞1~2 min,观察待细胞变圆后,加入完全培养基终止消化,取所有细胞悬液放入干净的15 mL离心管内。细胞用PBS离心洗3次。细胞混悬于结合缓冲液(含有4.5 g/L葡萄糖,0.1 mg/mL鲑鱼精DNA,0.1 mg/mL BSA,5 mmol/L Mg2+的PBS)中,用罗氏细胞计数板进行细胞计数,以进行后续检测。
1.3 滚环扩增反应及识别探针的构建将1 μmol/L Pre-circle template和1.5 μmol/L Circle primer预先在1×T4 DNA连接酶缓冲液(660 mmol/L Tris-HCl,66 mmol/L MgCl2,100 mmol/L DTT,1 mmol/L ATP,pH=7.6)加热至95 ℃,5 min在恢复至室温后加入50 U T4 DNA连接酶后完全混匀,在16 ℃环境中反应12 h后,65 ℃下10 min灭活连接酶。滚环扩增反应在50 μL的反应溶液中进行,包括5 μL成环产物、5 μL 10×phi29 DNA聚合酶缓冲液[500 mmol/L Tris-HCl,100 mmol/L MgCl2,100 mmol/L (NH4)2SO4,40 mmol/L DTT]、5U phi29 DNA聚合酶和8 μL 10 mmol/L dNTPs,在30 ℃环境中反应一定时间之后,65℃下孵育10 min使酶失活。之后为了构建识别探针,取扩增产物与FAM-AS1411-polyA在杂交液(含有10 mmol/L Mg2+,200 mmol/L Na+的TE缓冲液)中杂交,经过95 ℃孵育10 min后,冰上孵育10 min,室温环境放置2 h,以得到多价适配体探针(Multi-AS1411-LS)用于识别细胞。与无荧光基团的AS1411-polyA杂交形成的杂交产物仅用于后续的Evagreen荧光检测,以判断多价适配体探针是否构建成功。与FAM-polyA杂交后的产物RCA product-polyA-FAM用于后续细胞结合的对照实验。
1.4 凝胶电泳实验将样品与6×加样缓冲液混合均匀后上样,用6%非变性聚丙烯酰胺凝胶在1×TBE缓冲液中110 V电泳45 min,然后将胶取出,在3×Gel Red染色液中泡染15 min,最后用凝胶成像仪进行成像分析。
1.5 Zeta电位检测将单价的适配体AS1411和Multi-AS1411-LS稀释成相同的浓度后,用马尔文激光粒度仪检测Zeta电位,实验重复3次。
1.6 荧光光谱检测将5 μL 20×Evagreen与被检产物混匀,在全黑96孔板中通过488 nm的激发光检测506~600 nm的发射光谱,重复测量3次,取平均值作图。
将2 μL 100 μmol/L ThT、50 μL 2×Tris-HCl缓冲液(终浓度为50 mmol/L Tris-HCL,50 mmol/L KCl,pH=7.2)、38 μL ddH2O和10 μL Multi-AS1411-LS溶液添加到全黑96孔板中,在425 nm激发下监测445~600 nm的发射光谱,重复检测4次。
1.7 细胞荧光成像和流式分析在24孔板内用细胞爬片接种细胞,待细胞贴壁后倾斜孔板吸弃上清液,用预冷的PBS进行洗涤3次,每次5 min,最后加入结合缓冲液(含0.1 mg/mL鲑鱼精DNA,0.1 mg/mL BSA,5 mmol/L Mg2+的PBS)和识别探针一起孵育,对照直接加入单价的AS1411-FAM或RCA product-polyA-FAM,随后用DAPI染细胞核10 min,以上均在避光条件下进行。在每步染色后均用冷PBS洗3次。最后在保持爬片湿润的情况下用针头和无菌镊子取出,倒扣于滴有5 μL Dako封片剂的载玻片上,可置于-20 ℃避光保存,观察时取出避光恢复至常温后共聚焦荧光显微镜下观察。对于细胞结合条件优化实验,稀释成约105个细胞的细胞悬液,与Multi-AS1411-LS探针在不同的温度以及不同时间的条件下孵育,然后用BD canto流式细胞仪计数约10 000个细胞检测。为了确定多价适配体探针与细胞结合的敏感性,用流式细胞仪测定了含有不同细胞数(3~38 000个细胞)样品,以高速率检测30 s,每个样品重复3次,流式结果均用flowjo V10进行数据分析。
1.8 多价适配体在临床样本检测中的应用收集本院2020年3-6月患者浆膜腔积液标本共70例(包括胸水49例,腹水16例,心包液5例),均来自重庆医科大学附属第一医院细胞病理室。研究经重庆医科大学附属第一医院伦理委员会批准[科伦审2020-543号]。将离心后的细胞沉淀收集于生理盐水中,离心洗涤3次,将细胞标本分为两部分:一部分进行HE染色用于细胞病理学诊断,另一部分与Multi-AS1411-LS探针孵育,荧光显微镜下观察。将代表性的临床样本制成细胞块,切片后进行免疫细胞化学(immunocytochemistry,ICC)染色鉴别。
1.9 统计学分析使用GraphPad Prism 8进行统计分析。两组之间比较采用Student’s t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 检测原理及设计研究使用的靶向序列为适配体AS1411,所设计的预成环的寡核酸链含有两段重复单元,均由15个A碱基构成。实验原理见图 1。通过滚环扩增反应获得具有支架DNA长链,并与FAM-AS1411-polyA以合适的浓度比混匀后,polyA与DNA长链上的重复T序列进行互补配对,柔性缠绕的DNA长链得到进一步的展开;再与样本中的细胞进行孵育,从而使靶向细胞与DNA长链上的多个AS1411适配体结合。由于协同效应,使得靶向细胞得到高效快速的识别,进而实现对其快速成功检测。
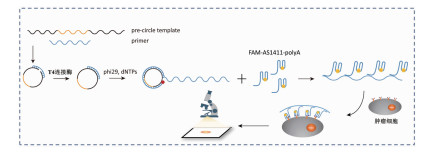
|
| 图 1 基于滚环合成的多价适配体对肿瘤细胞快速诊断的原理示意图 |
2.2 滚环产物支架和识别探针Multi-AS1411-LS的制备和验证
为了证实环状模板的成功制备以及滚环扩增的DNA长链的合成,使用凝胶电泳对不同的反应产物进行分析。成环后的模板明显要比预成环的单链迁移得慢且亮度更高,滚环产物滞留在加样孔内,反应时间为15 min后的产物条带中不见多余的成环产物(图 2)。说明短时间内即可获得较大分子量的滚环产物。
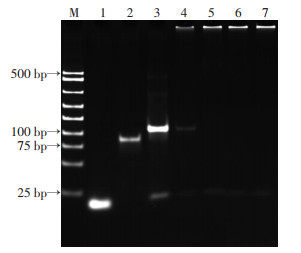
|
| M: DNA标准;1:环引物;2:预成环的模板;3:成环产物;4~7:分别为扩增5、15、30、60 min产物 图 2 6%非变性聚丙烯酰胺凝胶电泳分析 |
由于AS1411是富G序列,可形成G-四链体,硫黄素T(thioflavin T,ThT)是一种水溶性荧光染料,与G-四链体的结合会导致可见光区的发射增强,形成特征性的荧光光谱(图 3A)。在最大发射波长485 nm处,与ThT结合后,Multi-AS1411-LS探针较单价AS1411的荧光强度明显升高(P < 0.01,图 3B)。滚环产物经过热激活后荧光很弱(图 3C),表明滚环产物经热激活后没有聚集现象的发生,而Multi-AS1411-LS与Evagreen结合后荧光强度很高,证实了其杂交的成功。Zeta电位检测结果显示,与单价Zeta电位相比,Multi-AS1411-LS的电荷明显增多(P < 0.01,图 3D)。这也可证实Multi-AS1411-LS的成功制备。
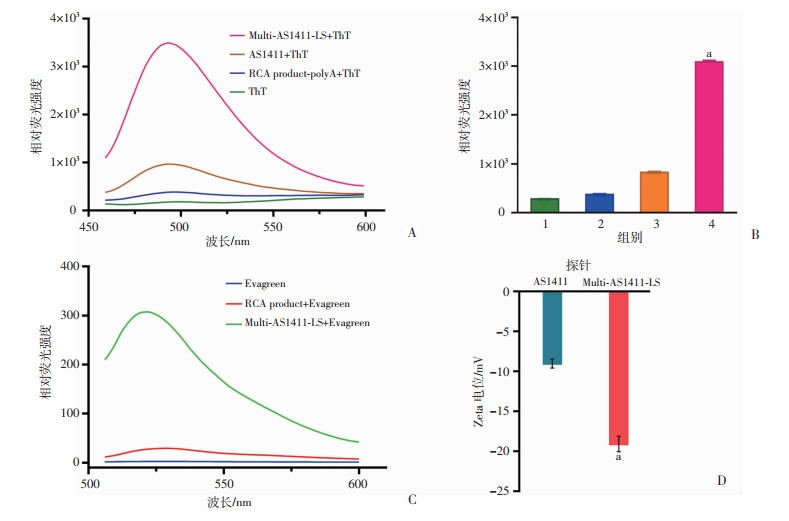
|
| A:结合ThT的荧光发射光谱图;B:各组在485 nm处与ThT结合的荧光强度 1: ThT;2: RCA product-polyA+ThT;3: AS1411+ThT;4: Multi-AS1411-LS+ThT;a:P < 0.01,与AS1411+ThT比较;C:结合Evagreen的荧光发射光谱图;D:单价AS1411和Multi-AS1411-LS的Zeta电位 a:P < 0.01,与AS1411比较 图 3 Multi-AS1411-LS探针的表征图 |
2.3 细胞检测的条件优化及性能分析
为了获得最佳的检测效果,通过控制不同的变量来获得最佳的实验参数。在4 ℃、25 ℃(室温)以及37 ℃的条件下孵育的A549细胞均能获得很好的荧光效应,37 ℃的荧光强度略微下降(图 4A)。因此选择室温作为孵育的最佳温度。而在孵育5 min的时候荧光强度就达到饱和(图 4B),说明这一探针的识别靶细胞的高效性。荧光显微镜下观察到细胞膜周围一圈有很强的荧光信号,且分布不均(图 5),可能与细胞膜上过表达的核仁素分布不均有关。流式细胞仪检测结果也显示Multi-AS1411-LS所检测出的细胞荧光强度比单价AS1411直接标记高出100倍左右。

|
| A:不同孵育温度;B:不同孵育时间 图 4 流式细胞仪分析Multi-AS1411-LS探针与A549细胞结合情况 |
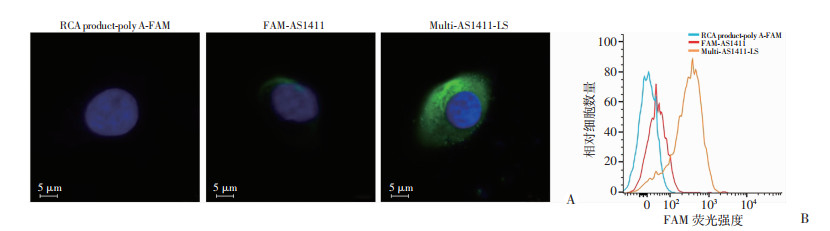
|
| 图 5 探针识别A549细胞的共聚焦荧光成像(A)和流式细胞仪分析结果(B) |
特异性检测结果显示,A549(人非小细胞肺癌细胞)、MDA-MB-231(人乳腺癌细胞)、NCI-H446(人小细胞肺癌细胞)这3种肿瘤细胞株的荧光信号均大幅增强,而BE-AS-2B(人正常肺支气管上皮细胞)细胞株未被Multi-AS1411-LS探针识别,未观察到荧光信号,见图 6。
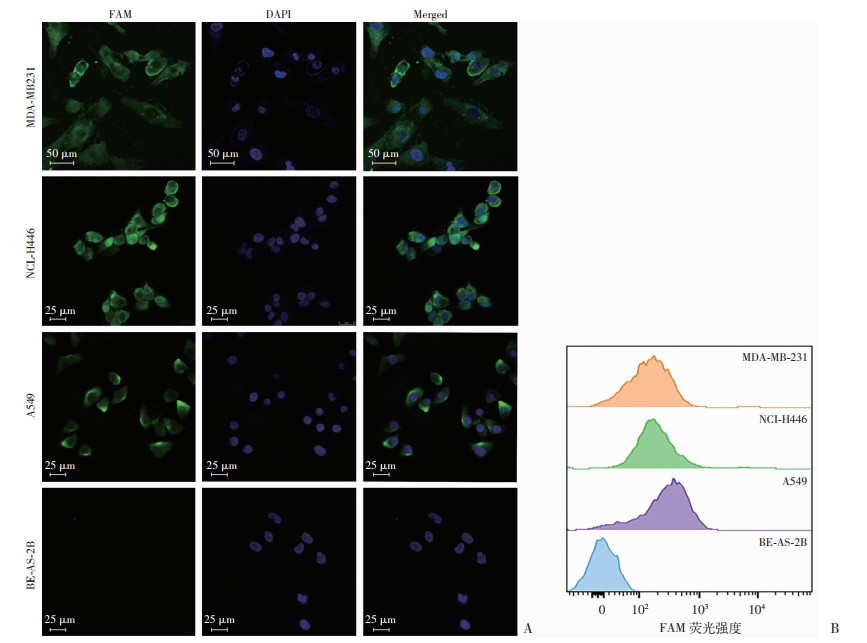
|
| 图 6 不同肿瘤细胞系及正常细胞系的共聚焦荧光成像(A)和流式细胞仪分析结果(B) |
采用Multi-AS1411-LS探针与A549细胞的定量分析进行敏感性实验。通过梯度稀释获得3~38 000个细胞的多个样本,经过流式细胞仪检测观察到随着细胞数量的减少,检测到标记的细胞数逐渐减少。通过作校准曲线图可以发现,血细胞计数器得到的A549细胞数量与通过Multi-AS1411-LS检测到的A549细胞数量之间在3~38 000细胞数范围内成线性相关,Y=0.969 3X-40.99,R2=0.999 5,所检测出的最低检测限为3个细胞(样品体积为500 μL)。由此可知,Multi-AS1411-LS多价适配体探针识别肿瘤细胞具有较高的敏感性。
2.4 临床体液样本的检测由于Multi-AS1411-LS多价适配体探针的良好的敏感性和特异性,进一步探索其在临床检测中的应用,评估在临床浆膜腔积液检测中的特异性和敏感度。多价适配体探针与临床标本中的细胞孵育后,用荧光显微镜观察结果见表 2。图 7显示具有代表性的经过免疫细胞化学证实细胞类型的临床标本,可以看出在阳性标本中Multi-AS1411-LS多价适配体探针能有效检出肿瘤细胞,并能与样本中其他背景细胞(如白细胞、红细胞、淋巴细胞、间皮细胞、巨噬细胞等)明显区分。在已知临床诊断的54例样本中,细胞学诊断的阳性率为92.59%。而Multi-AS1411-LS多价适配体检测的阳性率为88.89%。根据最终的病理结果,计算出Multi-AS1411-LS多价适配体在临床样本中诊断的敏感度为87.80%,特异性为93.10%。
| 编号 | 细胞学诊断 | Multi-AS1411-LS诊断 | 临床诊断(原发部位) |
| 1~14 | 腺癌细胞 | 阳性 | 肺腺癌 |
| 15 | 不典型细胞 | 阴性 | 肺腺癌 |
| 16 | 不典型细胞 | 阳性 | 肺腺癌 |
| 17 | 异型细胞 | 阳性 | 肺腺癌 |
| 18 | 异型细胞 | 阳性 | 肺腺癌 |
| 19 | 阴性 | 阴性 | 肺腺癌 |
| 20 | 阴性 | 阴性 | 肺腺癌 |
| 21 | 不典型细胞 | 阳性 | 肺鳞癌 |
| 22 | 阴性 | 阴性 | 肺鳞癌 |
| 23~25 | 小细胞癌细胞 | 阳性 | 小细胞肺癌 |
| 26 | 不典型细胞 | 阴性 | 乙状结肠恶性肿瘤 |
| 27 | 鳞癌细胞 | 阳性 | 宫颈癌 |
| 28 | 腺癌细胞 | 阳性 | 宫颈癌 |
| 29~32 | 腺癌细胞 | 阳性 | 卵巢癌 |
| 33 | 低分化癌细胞 | 阳性 | 喉癌 |
| 34 | 腺癌细胞 | 阳性 | 胃癌 |
| 35 | 异型细胞 | 阴性 | 胃癌 |
| 36 | 阴性 | 阴性 | 肝癌 |
| 37 | 腺癌细胞 | 阳性 | 胆管癌 |
| 38~42 | 腺癌细胞 | 阳性 | 未明确 |
| 43~47 | 阴性 | 阴性 | 未明确 |
| 48~50 | 阴性 | 阳性 | 未明确 |
| 51 | 淋巴瘤 | 阳性 | 未明确 |
| 52 | 不典型细胞 | 阴性 | 未明确 |
| 53 | 不典型细胞 | 阳性 | 未明确 |
| 54~55 | 阴性 | 阴性 | 结核性胸膜炎 |
| 56~57 | 阴性 | 阴性 | 结核性心包积液 |
| 58 | 阴性 | 阳性 | 结核性腹膜炎 |
| 59~61 | 阴性 | 阴性 | 心力衰竭 |
| 62 | 阴性 | 阴性 | 肺炎 |
| 63 | 阴性 | 阴性 | 全身感染 |
| 64~66 | 阴性 | 阴性 | 肾炎 |
| 67 | 阴性 | 阴性 | 急性肾损伤 |
| 68 | 阴性 | 阴性 | 肝硬化 |
| 69 | 阴性 | 阴性 | 肝囊肿 |
| 70 | 阴性 | 阴性 | 低蛋白血症 |

|
| A:腺癌细胞,ICC: TTF-1(+);B:鳞癌细胞,ICC: P63(+);C:腺癌细胞,ICC: TTF-1(+);D:小细胞肺癌细胞,ICC: CgA(+);ICC:免疫细胞化学 图 7 荧光显微镜观察具有代表性的临床样本免疫细胞化学检测结果 |
3 讨论
核酸适配体是基于SELEX技术从随机寡核苷酸文库中筛选获得的对靶物质具有很高特异性与亲和力的寡核苷酸序列[14]。适配体易于标记荧光且活性不受影响,因此易于结合应用其他检测技术。但是单价的适配体常常与靶标结合时具有弱结合力,或本身易被细胞内吞,从而导致检测时过高的假阳性和假阴性,这是其在免疫检测分析中应用的一个主要障碍。
免疫学检查常通过汇集多个单克隆抗体或使用多克隆抗血清来提高抗体亲和力[15]。由于适配体在检测中具有广阔的应用前景,有很多研究者采用多个适配体的鸡尾酒法来提高检测的敏感性[16]。不幸的是,由多种适配体组成的鸡尾酒配方大大增加了临床开发的复杂性和成本。为了增加适配体的亲和力,开发具有多个结合位点的多价或多齿适配体,用于复杂靶点,如蛋白质、细菌或其他细胞表面的多个表位的分析是近年来的发展趋势[5]。
近年来多价性在生物分析方案中得到了成功实现,识别的靶标可以被多个信号分子放大。此外,多价相互作用还可以大大提高目标生物分子的识别能力,这是生物传感器的重要步骤。多价性也已成为传感信号放大的一个关键概念[17]。此外,多价性可以提高生物分子相互作用的结合选择性[18]。当结合价增加时,非特异性相互作用选择性减少,而相应地,特异性相互作用显著增加。利用这些高选择性多价结合探针可以开发出一种灵敏度和选择性都有所提高的生物传感器。多价所具有的相互作用力比单价的弱结合力更加稳定而有力,提高了与靶点的结合力。
滚环扩增反应是一种新发展起来的核酸恒温扩增方式,已经广泛运用到检测的信号放大[19]、DNA纳米结构[20]及靶向药物运输[21]中。AS1411适配体对恶性肿瘤细胞都具有高亲和力。而CK19、Ep-CAM都是属于上皮细胞恶性肿瘤的标记物,在间叶恶性肿瘤细胞中低表达或不表达。核仁素作为筛选肿瘤细胞的标记物具有更大优势。本研究利用RCA反应的扩增DNA长链作为支架,然后将与癌细胞表面核仁素结合的AS1411适配体杂交到支架上,从而形成多价适配体,构建识别探针Multi-AS1411-LS。Evagreen是一种嵌入DNA染料,本身无荧光且对单链DNA的结合亲和力很弱,但在与双链的DNA结合后发出高强度的荧光[22]。通过PAGE胶电泳、Evagreen染色证明了多价适配体构建成功。由于AS1411是富G序列,可形成G-四链体,硫黄素T(ThT)是一种水溶性荧光染料,已被证实对DNA的G-四链体具有高度特异性,它与G-四链体的结合会导致可见光区的发射增强,形成特征性的荧光光谱[23]。多价适配体并没有失去这一性质,而且与ThT结合后,荧光强度升高,明显高于单价适配体。另外,多价适配体的负电荷较单价适配体的负电荷明显增加,而细胞本身也呈负电荷,是Multi-AS1411-LS探针能特异、高选择性识别肿瘤细胞的一个重要原因。因此,本研究采用该探针检测临床标本,能有效的检出肿瘤细胞,所检测出的最低检测限为3个细胞,远低于单价适配体的检测限[24-25],并能与样本中其他背景细胞(如白细胞、红细胞、淋巴细胞、间皮细胞、巨噬细胞等)明显区分,具有较高的敏感性和特异性。该方法能在室温下进行,孵育时间短。这种方法能大大缩短检测时间,对于检测人员的要求更低,且能初步筛选出各种来源的肿瘤细胞,不过这一方法不能对肿瘤细胞进行进一步分型,但是基于结合核仁素的AS1411适配体构建的多价适配体作为肿瘤早期筛查的方法,具有极大的应用前景,或可用于肿瘤细胞的辅助诊断。
综上所述,本研究构建了一种快速且灵敏度高的检测方法,该方法通过滚环扩增构建多价适配体,再与携带有荧光基团的短核苷酸链碱基互补配对后,能得到非常强的荧光信号;该探针的制备只需一台简单的恒温混匀仪即可实现。在检测效能方面,该方法能够很好地区分出肿瘤细胞,具有较高的特异性和敏感性。因此,该检测方法为肿瘤细胞在复杂生物样本中的检出提供了新的思路,并提高检出效率和准确性。
| [1] |
BABAYAN A, PANTEL K. Advances in liquid biopsy approaches for early detection and monitoring of cancer[J]. Genome Med, 2018, 10(1): 21. DOI:10.1186/s13073-018-0533-6 |
| [2] |
ZHANG X M, SOORI G, DOBLEMAN T J, et al. The application of monoclonal antibodies in cancer diagnosis[J]. Expert Rev Mol Diagn, 2014, 14(1): 97-106. DOI:10.1586/14737159.2014.866039 |
| [3] |
ZHANG H M, ZHOU L J, ZHU Z, et al. Recent progress in aptamer-based functional probes for bioanalysis and biomedicine[J]. Chem Eur J, 2016, 22(29): 9886-9900. DOI:10.1002/chem.201503543 |
| [4] |
XIONG X L, LV Y, CHEN T, et al. Nucleic acid aptamers for living cell analysis[J]. Annu Rev Anal Chem, 2014, 7(1): 405-426. DOI:10.1146/annurev-anchem-071213-015944 |
| [5] |
VOROBYEVA M, VOROBJEV P, VENYAMINOVA A. Multivalent aptamers: versatile tools for diagnostic and therapeutic applications[J]. Molecules, 2016, 21(12): 1613. DOI:10.3390/molecules21121613 |
| [6] |
SHENG W A, CHEN T, TAN W H, et al. Multivalent DNA nanospheres for enhanced capture of cancer cells in microfluidic devices[J]. ACS Nano, 2013, 7(8): 7067-7076. DOI:10.1021/nn4023747 |
| [7] |
PLOURDE K, DERBALI R M, DESROSIERS A, et al. Aptamer-based liposomes improve specific drug loading and release[J]. J Control Release, 2017, 251: 82-91. DOI:10.1016/j.jconrel.2017.02.026 |
| [8] |
YANG J M, LI X L, JIANG B Y, et al. In situ-generated multivalent aptamer network for efficient capture and sensitive electrochemical detection of circulating tumor cells in whole blood[J]. Anal Chem, 2020, 92(11): 7893-7899. DOI:10.1021/acs.analchem.0c01195 |
| [9] |
ZHU X, YE H, LIU J W, et al. Multivalent self-assembled DNA polymer for tumor-targeted delivery and live cell imaging of telomerase activity[J]. Anal Chem, 2018, 90(22): 13188-13192. DOI:10.1021/acs.analchem.8b04631 |
| [10] |
LI W S, YANG X H, HE L L, et al. Self-assembled DNA nanocentipede as multivalent drug carrier for targeted delivery[J]. ACS Appl Mater Interfaces, 2016, 8(39): 25733-25740. DOI:10.1021/acsami.6b08210 |
| [11] |
ALI M M, LI F, ZHANG Z Q, et al. Rolling circle amplification: a versatile tool for chemical biology, materials science and medicine[J]. Chem Soc Rev, 2014, 43(10): 3324. DOI:10.1039/c3cs60439j |
| [12] |
CHEN Y, TYAGI D, LYU M, et al. Regenerative Nano Octopus based on multivalent-aptamer-functionalized magnetic microparticles for effective cell capture in whole blood[J]. Anal Chem, 2019, 91(6): 4017-4022. DOI:10.1021/acs.analchem.8b05432 |
| [13] |
BERGER C M, GAUME X, BOUVET P. The roles of nucleolin subcellular localization in cancer[J]. Biochimie, 2015, 113: 78-85. DOI:10.1016/j.biochi.2015.03.023 |
| [14] |
WANG T, CHEN C Y, LARCHER L M, et al. Three decades of nucleic acid aptamer technologies: Lessons learned, progress and opportunities on aptamer development[J]. Biotechnol Adv, 2019, 37(1): 28-50. DOI:10.1016/j.biotechadv.2018.11.001 |
| [15] |
LÓPEZ-SAGASETA J, MALITO E, RAPPUOLI R, et al. Self-assembling protein nanoparticles in the design of vaccines[J]. Comput Struct Biotechnol J, 2016, 14: 58-68. DOI:10.1016/j.csbj.2015.11.001 |
| [16] |
KIM Y S, CHUNG J, SONG M Y, et al. Aptamer cocktails: Enhancement of sensing signals compared to single use of aptamers for detection of bacteria[J]. Biosens Bioelectron, 2014, 54: 195-198. DOI:10.1016/j.bios.2013.11.003 |
| [17] |
SCRIMIN P, PRINS L J. Sensing through signal amplification[J]. Chem Soc Rev, 2011, 40(9): 4488. DOI:10.1039/c1cs15024c |
| [18] |
FASTING C, SCHALLEY C A, WEBER M, et al. Multivalency as a chemical organization and action principle[J]. Angew Chem Int Ed, 2012, 51(42): 10472-10498. DOI:10.1002/anie.201201114 |
| [19] |
XU L L, JIANG Z, MU Y D, et al. Colorimetric assay of rare disseminated tumor cells in real sample by aptamer-induced rolling circle amplification on cell surface[J]. Sensor Actuat B: Chem, 2018, 259: 596-603. DOI:10.1016/j.snb.2017.12.111 |
| [20] |
GAO T, CHEN T S, FENG C, et al. Design and fabrication of flexible DNA polymer cocoons to encapsulate live cells[J]. Nat Commun, 2019, 10(1): 2946. DOI:10.1038/s41467-019-10845-2 |
| [21] |
WANG Y J, SHANG X X, LIU J, et al. ATP mediated rolling circle amplification and opening DNA-gate for drug delivery to cell[J]. Talanta, 2018, 176: 652-658. DOI:10.1016/j.talanta.2017.08.087 |
| [22] |
SHOUTE L C T, LOPPNOW G R. Characterization of the binding interactions between EvaGreen dye and dsDNA[J]. Phys Chem Chem Phys, 2018, 20(7): 4772-4780. DOI:10.1039/c7cp06058k |
| [23] |
MOHANTY J, BAROOAH N, DHAMODHARAN V, et al. Thioflavin T as an efficient inducer and selective fluorescent sensor for the human telomeric G-quadruplex DNA[J]. J Am Chem Soc, 2013, 135(1): 367-376. DOI:10.1021/ja309588h |
| [24] |
CHEN X, PAN Y, LIU H, et al. Label-free detection of liver cancer cells by aptamer-based microcantilever biosensor[J]. Biosens Bioelectron, 2016, 79: 353-358. DOI:10.1016/j.bios.2015.12.060 |
| [25] |
YUAN B, SUN Y, GUO Q, et al. High signal-to-background ratio detection of cancer cells with activatable strategy based on target-induced self-assembly of split aptamers[J]. Anal Chem, 2017, 89(17): 9347-9353. DOI:10.1021/acs.analchem.7b02153 |



