在我国,膀胱癌是泌尿系统常见的恶性肿瘤之一,占全身恶性肿瘤3.2%,其发病率呈上升趋势[1, 2]。根据浸润深度,膀胱癌分为非肌层浸润膀胱癌和肌层浸润膀胱癌,前者易复发、后者易转移[3-4]。虽然已有研究[5]表明肿瘤的临床分期、淋巴结阳性率等病理特征与肿瘤预后密切相关;但膀胱癌发病机制复杂,异质性明显,这导致即便肿瘤分期相同的患者,预后也会明显不同[6]。因此,寻找膀胱癌可靠的预后标志物和治疗靶点,对于早期发现、及早有效治疗至关重要。
SNF/SWI复合体是多种亚基组成的蛋白复合体,作为染色体重塑复合体家族成员,它可以利用水解ATP的能量动员核小体,进而调控基因表达[7-8]。SNF5是该复合体的核心成员,非典型畸胎瘤样/横纹肌样瘤中因突变导致的SNF5表达缺失是其主要特征,因而SNF5被视为抑癌基因被广泛研究[9]。然而,SNF5在膀胱癌中的表达及其临床意义罕有研究。
1 材料与方法 1.1 生物信息学分析 1.1.1 资料收集本研究通过检索癌症基因组图谱数据库(the Cancer Genome Atlas,TCGA),下载了412位膀胱癌患者组织的转录组数据,包括408份膀胱癌组织和19份正常膀胱组织,以及相应的临床信息文件。纳入标准:①具有完整的临床病理特征;②有效的随访资料;③含SNF5有效测序数据。排除标准:总生存时间<30 d。我们将临床组织样本与患者ID号进行匹配整理。
1.1.2 SNF5的生存分析依据SNF5表达量,使用survminer包确定最佳截断值,将患者分为高表达组和低表达组。运用survival包Kaplan-Meier法进行生存分析。对SNF5表达水平与临床资料进行单因素Cox分析,判断影响膀胱癌预后的潜在因素;多因素Cox分析,判断膀胱癌预后与SNF5表达、临床信息的相关性。
1.2 材料与试剂由HyClone公司购买RPMI-1640(SH30809.01)、MEM(SH30024.01)培养基,胎牛血清(SV30087.03)。从Bethyl公司购买SNF5抗体(A301-087A),Trizol(15596026)购自Invitrogen公司,Promega公司购买反转录试剂盒GoScript(A2801),Bio-Rad购买qPCR试剂盒SYBR Green Supermix(#1725271)。
成都擎科生物公司引物合成,SNF5引物序列正义链:5′-GGCATCAGAAGACCTACGCCTT-3′,反义链:5′-CTCCATCTCAGCGTCTGTCAGA-3′。从上海中科院细胞库购买膀胱癌细胞系5637、T24、RT4、UM-UC-3、TCCSUP、J82及正常尿路上皮SV-HUC-1细胞。
1.3 细胞培养及qPCR依照说明书,分别使用添加10%胎牛血清的RPMI-1640、MEM培养基,37 ℃培养。Trizol法提取细胞总RNA,反转录后,进行qPCR。
1.4 收集临床病理资料收集2012年1月至2018年12月我科收治入院的157例膀胱癌患者,其中男性140例,女性17例;年龄(62.0±9.8)岁。本研究共纳入Ta及T1期67例,T2期51例,T3期21例,T4期18例。纳入标准:①病理确诊为膀胱癌;②术前未接受过放化疗。排除标准:影像学检查存在远处转移。
1.5 组织标本及免疫组织化学检测将从以上157例患者术中取得的157份膀胱癌组织交由上海卓灝医药科技有限公司制作成厚度4 μm,单个芯片点针1.5 mm直径的组织芯片。经脱蜡、阻断、修复、封闭后,用SNF5抗体1:200稀释后孵育过夜,再进行二抗孵育、脱水、二甲苯透明、封片。依据染色强度分为阴、弱、强计0、1、2分;再根据染色阳性率计分(0分:0~10%;1分:>11%~25%;2分:>25%~50%;3分:>50%~70%;4分:>70%)。最终评分为二者之和,≤4分视为低表达,>4分视为高表达。
1.6 统计学方法R语言软件对数据进行分析。计量资料以x±s表示,Shapiro-wilk test检验数据分布情况,非正态分布数据两组间的比较,采用Mann-Whitney检验;多组非正态分布数据,采用Kruskal-Wallis检验。χ2检验分析SNF5与临床病理特征的关系。Log-rank法分析SNF5表达水平与膀胱癌预后的关系。
2 结果 2.1 SNF5 mRNA在膀胱癌及膀胱癌中的表达为明确SNF5基因在膀胱组织中表达情况,本研究分析了TCGA数据库中来自412例膀胱癌患者的膀胱组织。相对于正常膀胱组织(19例),研究结果显示SNF5在膀胱癌组织(408例)中mRNA水平明显上调(图 1A)。参照Robertson对膀胱癌的mRNA分子分型[10],我们进一步对不同的膀胱癌亚型中SNF5表达水平进行了比较。如图 1B所示,神经元型(Neuronal)SNF5表达水平最高,基底鳞状型(Basal)和管腔浸润型(Luminal infiltrated)表达水平最低。qPCR检测不同膀胱细胞系的mRNA水平,结果也显示膀胱癌细胞系较正常膀胱上皮表达有不同的增高(图 1C)。
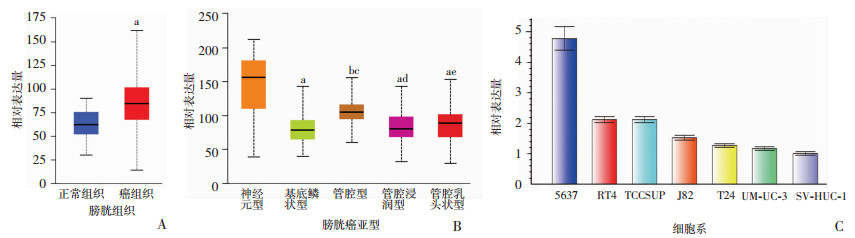
|
| A:SNF5在膀胱癌组织与正常膀胱组织中的表达 a:P < 0.05,与正常组织比较;B:不同膀胱癌亚型中SNF5 mRN表达 a:P < 0.000 1,b:P < 0.05,与神经元型比较;c:P < 0.01,d: P>0.05,与基底鳞状型比较;d:P < 0.05,与管腔型比较;e:P < 0.05,与管腔浸润型比较;C:SNF5在膀胱癌细胞系及正常膀胱系中表达水平 图 1 SNF5在膀胱癌及不同亚型中的mRNA表达 |
2.2 基于SNF5 mRNA对生存时间的影响
408例肿瘤样本中去除1例重复样本及2例生存时间缺失的患者,共405例患者进行生存分析。如图 2 Kaplan-Meier生存分析显示,膀胱癌患者中SNF5低表达组生存时间明显短于高表达组(P=0.008 3)。
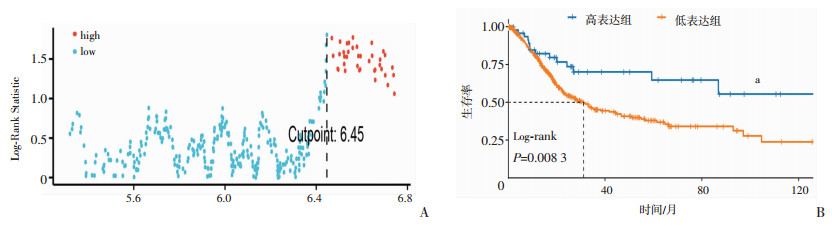
|
| A:TCGA患者依据SNF5表达水平分组最佳截断值;B:SNF5不同分组的生存曲线 a:P < 0.01,与低表达组比较 图 2 基于TCGA数据库中SNF5表达水平差异的Kaplan-Meier生存分析 |
2.3 SNF5 mRNA表达与膀胱癌临床病理特征相关性分析
利用Cox回归分析SNF5 mRNA与病理特征相关性,结果如表 1所示。年龄、SNF5表达水平、T分期、N分期、M分期、AJCC分期与患者生存时间相关,其中年龄和SNF5是膀胱癌独立风险因素。
| 因变量 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P | HR(95%CI) | P | ||
| 年龄 | 1.03 (1.02~1.05) | < 0.001 | 1.09 (0.75~1.60) | < 0.001 | |
| 性别 | 0.92 (0.73~1.16) | 0.471 | |||
| 种族 | 0.99 (0.74~1.31) | 0.921 | |||
| SNF5 | 0.88 (0.76~1.02) | < 0.05 | 0.91 (0.77~1.07) | < 0.05 | |
| T分期 | 1.70 (1.30~2.21) | < 0.001 | 1.46 (0.65~3.28) | 0.355 | |
| N分期 (淋巴分期) |
1.77 (1.42~2.21) | < 0.001 | 1.25 (0.82~1.93) | 0.301 | |
| M分期 (远处转移) |
0.85 (1.38~3.92) | < 0.001 | 1.01 (0.50~2.03) | 0.977 | |
| AJCC分期 | 1.64 (1.35~2.01) | < 0.001 | 1.12 (0.91~1.37) | 0.696 | |
2.4 SNF5蛋白水平与临床病理特征的相关性
Ta及T1期67例,T2期51例,T3期21例,T4期18例。如图 3所示,SNF5染色主要在核内。为探索SNF5蛋白水平与患者临床病理特征的相关性,我们依据免疫组织化学评分结果,将157例患者分为高表达组(92例)和低表达组(65例)。分析结果表明,SNF5蛋白水平与患者年龄、性别、吸烟情况无关,而与患者癌症是否有肌层浸润、淋巴结是否阳性密切相关(表 2)。此结果提示,SNF5表达与膀胱癌的进展密切相关。
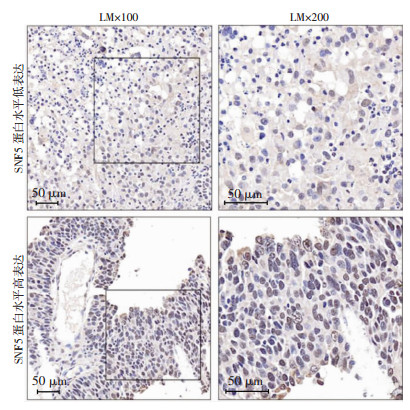
|
| 图 3 SNF5在膀胱癌组织中的免疫组织化学染色 |
| 临床病理特征 | SNF5表达 | P | |
| 高表达 | 低表达 | ||
| 例数 | 92 | 65 | |
| 年龄 | 0.601 |
||
| >60 | 53 (57.6) | 41 (63.1) | |
| ≤60 | 39 (42.4) | 24 (36.9) | |
| 性别 | 1 | ||
| 男 | 82 (89.1) | 58 (89.2) | |
| 女 | 10 (10.9) | 7 (10.8) | |
| 吸烟史 | 0.435 | ||
| 是 | 54 (58.7) | 43 (66.2) | |
| 否 | 38 (41.3) | 22 (33.8) | |
| 浸润肌层 | < 0.001 | ||
| 是 | 32 (34.8) | 58 (89.2) | |
| 否 | 60 (65.2) | 7 (10.8) | |
| 淋巴结 | < 0.001 | ||
| 阳性 | 7 (7.6) | 20 (30.8) | |
| 阴性 | 85 (92.4) | 45 (69.2) | |
3 讨论
膀胱癌为泌尿系统高发肿瘤,发病率逐年攀升,现已成为发病率第十的恶性肿瘤[11]。其易复发、易转移的特征给予社会沉重的负担,长期反复的随访造成了患者生活与工作的诸多不便[12]。尽管诊疗技术日新月异,但近30年来膀胱癌生存率仍未改善[13]。因此,寻找膀胱癌预后标志物和有效治疗靶点成为改善膀胱癌预后的迫切需求。
表观遗传学改变广泛存在于大多数癌症中[14-15],染色质重塑是主要的表观遗传学调控机制之一,它可以通过改变DNA转录时染色质的疏松程度,调控基因的表达[16-17]。SWI/SNF蛋白复合体是ATP依赖的染色质重塑复合体,在基因损伤修复、细胞周期、细胞增殖等多种生命活动中发挥重要作用[18-19]。多项研究表明,该复合体多个亚基在肿瘤中异常表达[20]。例如SMARCA2,是SWI/SNF复合体的ATP酶亚基之一,在胰腺癌中的异常表达可促进胰腺癌的生长并且提高了肿瘤细胞的耐药性[21]。在肝癌细胞系中,敲减SWI/SNF复合体的另一个ATP酶亚基SMARCA4,可下调周期蛋白B、周期蛋白D、周期蛋白E,进而抑制细胞增殖[22]。而SNF5是作为复合体核心亚基,在横纹肌肉瘤中常常缺失或突变,由此呈现出极强的肿瘤驱动能力,因而SNF5受到广泛关注。但目前为止,膀胱癌中SNF5的表达情况以及对肿瘤生物特性的影响罕有研究。
本研究首次探讨了SNF5在膀胱癌中的表达情况及其临床意义。通过对TCGA数据库中大样本测序数据的分析,比较癌与正常组织,我们发现SNF5在膀胱癌中表达水平上调。在不同膀胱上皮细胞系中,SNF5在膀胱癌细胞中表达水平也高于正常尿路上皮,这些结果提示SNF5可能在膀胱癌的发生过程中起着重要作用。在不同亚型和不同膀胱癌细胞系中的SNF5表达差异,不仅符合膀胱癌高异质性的特点,同时也表明SNF5可能参与了膀胱癌的发展过程。在生存分析中,SNF5低表达与膀胱癌不良预后密切相关。我们考虑可能是相对于正常膀胱组织,膀胱癌中SNF5 mRNA表达水平上调参与癌症的形成,而在膀胱癌患者中,相对的低表达可能与恶性表型相关,促进癌症的进展。Cox单因素回归分析再次确定了SNF5与预后的紧密联系。考虑到多数基因通过蛋白水平发挥作用,我们分析了157例患者SNF5膀胱癌组织的蛋白水平。结果表明,SNF5表达水平与膀胱癌是否肌层浸润、淋巴结是否阳性等进展特征密切相关。通过前文对SNF5的功能分析,笔者推测SNF5可能调控细胞周期加速了肿瘤生长所致。然而SNF5在膀胱癌中的具体作用机制仍需要进一步的研究证实。
综上所述,本研究通过对TCGA数据库和膀胱癌细胞系的分析与检测,发现SNF5 mRNA在膀胱癌中表达上调,在不同亚型和不同细胞系中也呈现出较高的异质性。SNF5 mRNA水平与生存预后呈现负相关,相关性分析提示SNF5与膀胱癌进展相关。因此,SNF5具有作为膀胱癌预后生物标志物的潜能,也为膀胱癌治疗提供了潜在治疗靶点,但有待进一步研究来探索SNF5在膀胱癌中的生物学作用机制,为将来的个性化治疗方案提供新的思路与手段。
| [1] |
SHI H, JIANG H, WANG L, et al. Overexpression of monocarboxylate anion transporter 1 and 4 in T24-induced cancer-associated fibroblasts regulates the progression of bladder cancer cells in a 3D microfluidic device[J]. Cell Cycle, 2015, 14(19): 3058-3065. DOI:10.1080/15384101.2015.1053666 |
| [2] |
HUANG C, LIAO X, JIN H, et al. MEG3, as a competing endogenous RNA, binds with miR-27a to promote PHLPP2 protein translation and impairs bladder cancer invasion[J]. Mol Ther Nucleic Acids, 2019, 16: 51-62. DOI:10.1016/j.omtn.2019.01.014 |
| [3] |
CAO R, YUAN L, MA B, et al. An EMT-related gene signature for the prognosis of human bladder cancer[J]. J Cell Mol Med, 2020, 24(1): 605-617. DOI:10.1111/jcmm.14767 |
| [4] |
DARWICHE F, PAREKH D J, GONZALGO M L. Biomarkers for non-muscle invasive bladder cancer: Current tests and future promise[J]. Indian J Urol, 2015, 31(4): 273-282. DOI:10.4103/0970-1591.166448 |
| [5] |
LYDIATT W M, PATEL S G, OSULLIVAN B, et al. Head and Neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67(2): 122-137. DOI:10.3322/caac.21389 |
| [6] |
SHEN M, DUAN X Z, ZHOU P, et al. Lymphotoxin β receptor activation promotes bladder cancer in a nuclear factor-κB-dependent manner[J]. Mol Med Rep, 2015, 11(2): 783-790. DOI:10.3892/mmr.2014.2826 |
| [7] |
MITTAL P, ROBERTS C W M. The SWI/SNF complex in cancer-biology, biomarkers and therapy[J]. Nat Rev Clin Oncol, 2020, 17(7): 435-448. DOI:10.1038/s41571-020-0357-3 |
| [8] |
COIRA I F, RUFINO-PALOMARES E E, ROMERO O A, et al. Expression inactivation of SMARCA4 by microRNAs in lung tumors[J]. Hum Mol Genet, 2015, 24(5): 1400-1409. DOI:10.1093/hmg/ddu554 |
| [9] |
CHOI S A, KIM S K, LEE J Y, et al. LIN28B is highly expressed in atypical teratoid/rhabdoid tumor (AT/RT) and suppressed through the restoration of SMARCB1[J]. Cancer Cell Int, 2016, 16: 32. DOI:10.1186/s12935-016-0307-4 |
| [10] |
ROBERTSON A G, KIM J, AL-AHMADIE H, et al. Comprehensive molecular characterization of muscle-invasive bladder cancer[J]. Cell, 2017, 171(3): 540-556.e25. DOI:10.1016/j.cell.2017.09.007 |
| [11] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [12] |
SIEVERT K D, AMEND B, NAGELE U, et al. Economic aspects of bladder cancer: what are the benefits and costs?[J]. World J Urol, 2009, 27(3): 295-300. DOI:10.1007/s00345-009-0395-z |
| [13] |
BERDIK C. Unlocking bladder cancer[J]. Nature, 2017, 551(7679): S34-S35. DOI:10.1038/551s34a |
| [14] |
HOADLEY K A, YAU C, WOLF D M, et al. Multiplatform analysis of 12 cancer types reveals molecular classification within and across tissues of origin[J]. Cell, 2014, 158(4): 929-944. DOI:10.1016/j.cell.2014.06.049 |
| [15] |
WITTE T, PLASS C, GERHAUSER C. Pan-cancer patterns of DNA methylation[J]. Genome Med, 2014, 6(8): 66. DOI:10.1186/s13073-014-0066-6 |
| [16] |
BONASIO R, TU S, REINBERG D. Molecular signals of epigenetic states[J]. Science, 2010, 330(6004): 612-616. DOI:10.1126/science.1191078 |
| [17] |
SELVI R B, KUNDU T K. Reversible acetylation of chromatin: implication in regulation of gene expression, disease and therapeutics[J]. Biotechnol J, 2009, 4(3): 375-390. DOI:10.1002/biot.200900032 |
| [18] |
COHET N, STEWART K M, MUDHASANI R, et al. SWI/SNF chromatin remodeling enzyme ATPases promote cell proliferation in normal mammary epithelial cells[J]. J Cell Physiol, 2010, 223(3): 667-678. DOI:10.1002/jcp.22072 |
| [19] |
SENDINC E, JAMBHEKAR A, SHI Y. Remodeling your way out of cell cycle[J]. Cell, 2015, 162(2): 237-238. DOI:10.1016/j.cell.2015.06.050 |
| [20] |
SHAIN A H, POLLACK J R. The spectrum of SWI/SNF mutations, ubiquitous in human cancers[J]. PLoS ONE, 2013, 8(1): e55119. DOI:10.1371/journal.pone.0055119 |
| [21] |
LIU F, XIA Z, ZHANG M, et al. SMARCAD1 promotes pancreatic cancer cell growth and metastasis through wnt/β-catenin-mediated EMT[J]. Int J Biol Sci, 2019, 15(3): 636-646. DOI:10.7150/ijbs.29562 |
| [22] |
KAUFMANN B, WANG B, ZHONG S, et al. BRG1 promotes hepatocarcinogenesis by regulating proliferation and invasiveness[J]. PLoS ONE, 2017, 12(7): e0180225. DOI:10.1371/journal.pone.0180225 |




