帕金森病(Parkinson's disease,PD)是目前全球第二大进展性退行性神经系统疾病,特征表现为静止性震颤、僵直、姿势不稳和运动迟缓等运动功能障碍[1]。从20世纪60年代起,左旋多巴药物替代治疗已被广泛认定为治疗帕金森病的金标准,但是随着病程进展,药效随之减退,长期服药过程中可逐渐出现异动症(levodopa-induced dyskinesia,LID)和波动现象等药物并发症。近年随着神经外科立体定向手术的发展,脑深部刺激术已成为中晚期PD患者的首选外科治疗方式,可明显地改善患者运动障碍,提高其生存质量。近年来有关丘脑底核(subthalamic nucleus,STN)脑深部电刺激术(deep brain stimulation,DBS)改善PD患者的震颤、僵直等核心症状的研究较多,但对异动症的治疗效果研究较少,且存在一定的争议。因此,本研究对STN-DBS治疗伴有异动症的PD患者资料进行回顾性分析,评估STN-DBS对伴有异动的帕金森病的治疗效果,并探讨STN-DBS治疗LID的可行性及其可能机制。
1 资料与方法 1.1 临床资料回顾性纳入2016年3月至2019年12月于我科行STN-DBS治疗伴有异动的PD患者的临床资料。本研究已获得重庆医科大学附属第一医院伦理委员会批准[2020年科研伦理(2020-312)号]和患者及家属知情同意。入选标准:①参照《中国帕金森病脑深部电刺激疗法专家共识》的标准,临床诊断符合典型的PD;②服用左旋多巴类药物后出现较重的异动症状[统一帕金森病评定量表(UPDRS)第Ⅳ部分的异动评分>2分];③年龄30~75岁;病程>4年;④急性左旋多巴试验改善率≥30%;⑤依据Hoehn-Yahr分期,选择“关”期(未服药)2.5~4.0期;⑥无手术禁忌证;⑦采用药物控制症状不满意、药物疗效下降或出现运动并发症;⑧患者依从性良好,随访时间≥6个月。排除标准:①伴有严重的智能减退;②诊断为帕金森综合征或多系统萎缩;③术前检查发现MRI异常(脑肿瘤、脑积水、脑梗死)或严重的循环、呼吸、肾脏或肝脏疾病。
1.2 手术步骤① 安装Leksell立体定向框架(Elekta,瑞典):局麻下安置立体定向框架,安放立体定向基架时使其正中矢状面重叠于头颅正中矢状面,基架基线与前联合-后联合(AC-PC线)的体表投影线平行。②靶点定位:基架安装完成后,行CT薄层扫描定位,并导入手术计划系统,建立坐标系。然后利用SurgiPlan计划系统(Elekta,瑞典)将CT图像与术前MRI影像融合,确定双侧STN靶点,并设计穿刺路径,穿刺路径避开脑室及脑沟内血管。③术中微电极记录:根据手术计划标记头皮穿刺点,局部麻醉后,以1 mm微钻头透过头皮于颅骨上作确切入颅点,切开头皮后颅骨钻孔,切开硬脑膜。安装立体定向系统弧弓及推进系统,缓慢推入微电极,利用LeadPoint(Medtronic,美国)记录不同位置的神经元细胞放电,确定丘脑底核位置。若记录的丘脑底核信号不满意则缓慢退出微电极,重新调整坐标。④双侧STN电极植入、术中测试:确认电生理信号最佳处,依次植入双侧STN电极。将电极连接至临时刺激器,选择不同触点,刺激参数选择频率150 Hz、脉宽90 μs。刺激强度从1.0 V开始增加至5.0 V,观察患者四肢震颤、肌张力、僵直及运动的灵活性的改善情况并测试不良反应。确定位置良好。以电极夹固定电极,将电极尾端缠绕于皮下并缝合头皮关颅。复查头颅薄层CT,和术前计划融合,确定电极位置准确。⑤刺激器植入:确认电极在最佳位置且患者症状改善理想,则在全身麻醉下,于左锁骨下置入刺激器,并经颈部皮下隧道与电极延长导线相连。
1.3 疗效评估术前对12例患者基线状态进行评估,采用国际统一帕金森病评定量表(the unified parkinson’s disease rating scale,UPDRS)Ⅲ部分、Ⅳ部分、帕金森患者生活质量问卷(Parkinson’s disease questionnaire,PDQ-39)、简易智力状态检查量表(minimum mental state examination,MMSE)和左旋多巴等效剂量(levodopa equivalent daily dose,LEDD)进行评估。
术后6个月进行随访,使用UPDRS Ⅲ部分、Ⅳ部分、异动评分[UPDRS Ⅳ部分第32~34项(第32项为异动持续时间评分,第33项为异动严重程度评分)]及左旋多巴等效剂量评估疗效。UPDRS Ⅲ部分在药物“关期”和药物“开期”分别进行评分。术前在急性左旋多巴冲击试验(acute levodopa challenge test, ALCT)中进行UPDRS Ⅲ部分评分,药物“关期”为至少停用多巴胺受体激动剂72 h、停用酶抑制剂24 h、左旋多巴类药物及其他抗PD药物12 h时的状态;而药物“开期”则为服用平时早上第1次服药的左旋多巴等效剂量1.5倍的左旋多巴后所达到的最佳改善状态[2]。症状改善率评分=(术前评分-术后评分)/术前评分。左旋多巴等效剂量(LEDD)换算比例如下:100 mg标准左旋多巴片=125 mg多巴丝肼片=133 mg卡左双多巴缓释片=100 mg吡贝地尔缓释片=1 mg盐酸普拉克索片=5 mg罗匹尼罗=10 mg溴隐亭=100 mg金刚烷胺。
1.4 统计学分析采用SPSS 26.0统计软件。共收集12例患者,样本量少,并且数据为非正态分布,故选用Wilcoxon检验方法进行数据分析,计量资料以x±s表示,以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料本研究共纳入12例患者(表 1),其中男性8例,女性4例;年龄49~72(60.83±5.92)岁;病程6~15(10.25±3.19)年;术前PDQ39评分为(63.5±20.7)分;术前MMSE评分为(27.00±1.75)分。
| 患者编号 | 年龄/岁 | 性别 | 病程/年 | H-Y分期 | Schwab & England日常活动分级 | PDQ-39评分 | MMSE评分 |
| 1 | 64 | 男 | 6 | 2.5 | 100% | 48 | 29 |
| 2 | 62 | 女 | 9 | 3.0 | 100% | 20 | 27 |
| 3 | 58 | 女 | 10 | 2.5 | 80% | 79 | 26 |
| 4 | 63 | 男 | 15 | 3.0 | 60% | 60 | 29 |
| 5 | 56 | 男 | 14 | 2.5 | 80% | 48 | 24 |
| 6 | 72 | 男 | 10 | 3.0 | 80% | 56 | 28 |
| 7 | 61 | 男 | 6 | 3.0 | 80% | 94 | 24 |
| 8 | 67 | 女 | 12 | 3.0 | 90% | 51 | 27 |
| 9 | 61 | 男 | 10 | 3.0 | 70% | 83 | 28 |
| 10 | 62 | 男 | 9 | 2.5 | 80% | 69 | 27 |
| 11 | 55 | 男 | 15 | 4.0 | 90% | 86 | 26 |
| 12 | 49 | 女 | 7 | 3.0 | 90% | 69 | 29 |
2.2 手术效果
12例患者术后均行薄层CT,并与术前MRI融合,提示电极位置理想。12例患者术后均未发生感染、穿刺道出血、电极移位等并发症。患者均于术后1个月开机,刺激方式均为单极刺激,电压为1.5~2.5 V,频率130~160 Hz,脉宽90~100 μm。开机过程中,有4例患者出现明显电刺激相关异动,改为双极模式及降低刺激电压后,异动症状显著改善,并于程控过程中逐步调整模式及电压。
2.3 随访情况 2.3.1 UPDRS Ⅲ评分术后6个月,12例患者运动症状均明显改善。关期术前、术后UPDRS Ⅲ评分差异有统计学意义(P < 0.05)。关期平均改善率为(68.14±9.51)%,与术前评估ALCT中预估最佳改善率[(71.18±6.21)%]比较差异无统计学意义(P=0.075),表明术后关期疗效基本达到术前评估开期时的最佳状态。术后开期评分比术前低,虽差异无统计学意义,但提示术后6个月患者开期状态优于术前开期状态(表 2)。
| 项目 | 术前评分 | 术后6个月评分 | 改善率(%) | P值 |
| UPDRSⅢ评分(关期) | 45.83±15.97 | 13.67±3.31 | 68.14±9.51 | 0.002 |
| UPDRSⅢ评分(开期) | 13.17±5.06 | 10.92±3.72 | 13.37±36.64 | 0.075 |
| UPDRSⅣ评分 | 10.67±2.30 | 5.58±1.24 | 45.91±13.01 | 0.002 |
| 异动评分 | 5.25±2.26 | 2.00±1.27 | 61.96±22.03 | 0.002 |
| LEDD/mg | 805.20±406.11 | 408.33±182.88 | 43.58±25.56 | 0.005 |
2.3.2 UPDRS Ⅳ评分
患者术后6个月较术前的LID改善率,主要通过对比术前、术后异动评分及UPDRS Ⅳ评分体现。术前UPDRS Ⅳ和异动评分基线分别为(10.67±2.30)和(5.25±2.26),术后6个月两者平均改善率分别为(45.91±13.01)%和(61.96±22.03)%,术前评分与术后评分对比差异均具有统计学意义(P < 0.05,表 2)。异动评分中异动持续时间及异动严重程度改善分别为(55.55±24.70)%和(63.89± 41.33)%(图 1)。
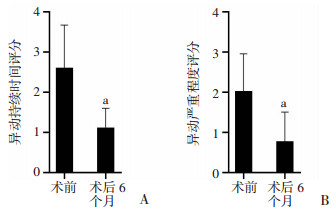
|
| a:P < 0.05, 与术前比较 图 1 术前、术后6个月异动持续时间评分和异动严重程度评分改善情况 |
2.3.3 左旋多巴等效剂量
术后6个月,LEDD量由术前(805.20±406.11)mg降至(408.33±182.88)mg,减药率达到(43.58±25.56)%,与术前比较差异具有统计学意义(P < 0.05)。在12例患者中,有2例药物剂量维持术前剂量,其余10例患者均减少了药物剂量,最高减药率达到72%(表 2)。
3 讨论左旋多巴诱发的LID是PD患者长期服用左旋多巴药物所致的诸多运动并发症之一。LID主要表现为肌张力障碍、舞蹈样动作、刻板样动作、肌阵挛及静坐不能等。依据病程、临床症状及服药时间相关性分为3大类:剂峰异动、双相异动和关期肌张力障碍。有研究报道:LID平均发病时间约为6.6年,在接受左旋多巴治疗4~6年的患者中,LID的发生率约为40%,并随着服用左旋多巴的时间延长,LID发生率逐渐增加,在治疗超过10年时,可有70%~90%的患者出现LID,特别是接受高剂量左旋多巴治疗的年轻女性患者风险尤其高[4-7]。LID对PD患者生活质量的影响有时严重于帕金森疾病本身[8]。本研究中有3例患者以剧烈的异动为主要诉求于本院行DBS治疗。
目前,LID的治疗手段依然十分有限。传统观念认为,改善帕金森患者的异动症状,调整药物是唯一途径。总结近年来治疗LID药物处理方法包括:①减少每次服用左旋多巴的剂量;②加用多巴胺受体激动剂或加用儿茶酚O-甲基转移酶(catechol-o-methyltransferase, COMT)抑制剂;③加用金刚烷胺。左旋多巴及其类似物是PD患者最有效的对症治疗药物,在服用左旋多巴治疗PD过程中出现LID,应首先考虑调整药物剂量,减少左旋多巴的单次摄入量。但随着PD病程发展,减少左旋多巴的摄入量会导致对震颤、僵直等核心症状控制欠佳,并存在对运动功能造成损害的潜在可能。由于众多左旋多巴相关的并发症被发现,以及左旋多巴可能加速神经元退化理论的提出[9],在PD病程中左旋多巴的最佳服用时间目前仍存在争论。部分学者提出在帕金森病程早期暂不服用左旋多巴,而选择以普拉克索为代表的多巴胺激动剂来延迟LID等运动并发症的发生。然而,一项大型随机试验表明:从长期随访中发现新诊断的PD患者中,早期使用左旋多巴的患者生活质量更佳,与多巴胺激动剂相关的不良反应更少,并且治疗费用明显低于同期使用多巴胺激动剂的患者[10]。现有治疗指南推荐添加非竞争性谷氨酸受体(N-methyl-D-asparate,NMDA)拮抗剂金刚烷胺用于剂峰异动症的治疗[11]。临床实践证实其对异动的改善作用,并能减轻帕金森症状。但有研究显示其疗效可能仅能持续8个月,并且使用金刚烷胺治疗1年以上,若撤药,可能导致异动症加重并会使精神障碍的发生风险增加[12-13]。因此,金刚烷胺并非治疗LID的完美药物,仍需更多的临床试验数据证实。
当药物治疗控制帕金森症状不佳时,DBS已成为治疗PD及LID等运动障碍的首选手术方式。本研究结果显示:STN-DBS不仅能显著改善PD的震颤、僵直、运动迟缓等核心症状,还能有效治疗LID。DBS治疗效果虽得到广泛肯定,但目前对最佳的目标靶点选择仍存在广泛争议。DBS可选择的靶点包括丘脑腹中间核(thalamic ventralisintermedius nucleus,Vim)、苍白球内侧核(globus pallidus internus,GPi)、丘脑底核(subthalamic nucleus,STN)和脚桥核(pedunculopontine nuclei,PPN),这些核团在PD的治疗中各有利弊,对患者预后和异动方面的疗效也不相同。其中Vim对PD症状改善局限于震颤,而PPN主要应用于改善姿势及步态不稳等中轴症状,并且机制不详临床证据少。因而近十多年来,以GPi-DBS和STN-DBS最为常见,国内机构多选用STN,而国外兼而有之。选择以GPi和STN作为靶点行DBS对PD患者运动症状的治疗作用已得到国际大量研究的认可,但目前有关DBS对LID的治疗研究报道较少。有文献对比了GPi-DBS和STN-DBS,发现两种术式均能改善异动症状[14]。有研究表明:GPi和STN对LID的改善率分别为47%~88%、20%~83%,故GPi对LID的改善稍优于STN,但STN-DBS对关期运动障碍的控制明显优于GPi-DBS[15]。在最近一项研究中,对800余例PD患者进行荟萃分析,结果显示:在术后12个月时GPi改善LID更佳,其余随访时间段GPi-DBS对LID的改善与STN-DBS没有明显差异[16]。FOLLETT[14]对GPi-DBS和STN-DBS进行24个月的长期随访表明,两个靶点对PD的预后改善和不良事件的发生未见明显差异。
GPi和STN-DBS在治疗异动上的机制不同。大多数学者支持GPi-DBS减轻LID症状是通过直接抑制多巴胺能环路来抑制GPi的活动的[9, 14, 16],而STN-DBS是通过减少LEDD剂量来改善异动症[17-18]。但随着对STN-DBS减轻异动症的深入研究,观察到部分PD患者在术后早期即使没减少药物或仅减少少量药物,LID等运动障碍也得到了良好改善[2, 14]。比如,在OSTERGAARD等[19]研究中,行双侧STN-DBS的患者术后12个月LEDD只减少19%,而异动的持续时间减少了86%。KIM等[2]发现:在行STN-DBS的PD患者中,术后LEDD减少量小于15%的患者,异动的改善可达到57%,并且总共100例患者异动的平均改善(约70%)远大于药物剂量的减少35%~40%。同时,本研究也发现2例患者术后药物LEDD量同术前,但异动症状明显改善,这与KIM等研究一致。此外,本中心在程控过程中也发现:未调整药物剂量,仅调整参数和模式,患者LID症状便能得到迅速控制,这表明STN-DBS不仅能通过减少药量也可以直接抑制LID的发生。
对于STN-DBS对LID的直接抑制作用,主要有以下3种假说:①多数研究表明,STN-DBS对异动最佳改善位置可能并非直接刺激STN核团内部的神经元,而是刺激了位于STN上方的苍白球、苍白球下丘脑或丘脑下部纤维或刺激了STN下缘与未定带上缘之间走行的1条来自GPi的白质束因而产生和刺激GPi-STN一样的反应。NISHIKAWA等[20]在1例行STN-DBS的PD患者个案报道中,发现通过刺激STN上部区域对异动明显改善;KIM等的同期研究也发现,术后12个月的随访中,刺激点位于STN以上包括未应带内对异动的改善率为73.57%,而刺激点位于STN内仅有37.44%;以上报道证实了STN-DBS对异动的直接抑制作用。②一些学者认为STN-DBS对异动的直接抑制作用是连续高频电刺激靶点造成的[21-23]。有研究报道,在给予冲击剂量的左旋多巴后,高频刺激STN使双相异动减轻47%,剂峰异动减轻30%,这也证实了STN的直接抑制作用,并表明STN对双相异动的改善程度优于剂峰异动的改善[22]。③还有部分学者提出第3种假说,通过直接刺激STN与不应带之间走行的多巴胺能束,通过轴突的去极化阻滞而产生抗多巴胺能反应,因而直接抑制LID[2, 24]。总体而言,GPi和STN DBS抑制异动的具体作用机制尚不清楚,还有待进一步研究。
本研究结果显示:STN-DBS术后6个月LEDD减少量为43%,这与既往研究结果一致,也证实了STN-DBS治疗LID与术后减药相关。GPi和STN在术后减药率方面,STN-DBS明显优于GPi-DBS[14, 17, 25]。有文献报道,STN较GPi术后12个月减药量明显(分别为546、208 mg/d,P=0.01)[17]。并有报道表明,STN-DBS术后药物剂量能减少35%~40%[2],而GPi-DBS却有报道术后药量不减反增[26]。关于DBS术后减药对PD患者预后的影响尚存争议。部分学者认为STN-DBS术后减少多巴胺能药物药量,不仅能改善异动,并且能够减轻其他服用左旋多巴药物所致的诸多运动并发症[14]。然而,有学者发现,随着多巴胺能药物的使用减少,可能会加重患者步态和平衡障碍、睡眠障碍、情感淡漠和抑郁,甚至加重自杀倾向[27]。并且在用STN-DBS治疗LID时,仍需注意STN-DBS刺激本身可以起电刺激相关异动(stimulation-induced dyskinesia, SID),本中心在程控中也遇到数例此类情况,但多数可通过调整药物、改变参数和刺激模式或使患者逐渐适应慢性刺激后改善,若上述措施无效,还考虑将靶点由STN转为GPi用于治疗SID[18]。SID的发生可能与刺激参数和刺激STN位置靠前有关[28],具体机制不详,仍需大样本量的研究。根据本中心程控经验及结合文献报道表明,诱发患者异动明显的电极触点通常为改善症状最佳的触点位置[15]。对于出现SID合并LID的患者,程控较为困难,本中心推荐的策略是可选择性地刺激STN核团上方区域、简化药物类型及药物剂量、以低电压为起点小幅度缓慢增加电压。
本研究为一项回顾性研究,未设置GPi-STN DBS对照组,且为单中心研究,样本量较少,需要进行多中心研究并扩大样本量进行研究。本研究中部分量表需评估者主观评分,不同评估医生的评估标准不同,可能对不同患者的评分存在一定程度上的偏倚[29]。
综上所述,本研究中患者异动改善率达到61.96%,可见STN-DBS是治疗PD及LID的有效手术方式。GPi作为靶点虽对LID也有较好的改善作用,但本中心认为仅对合并精神认知障碍、脆性反应或以步态和平衡障碍等轴性症状为主的PD患者,可考虑选择GPi为靶点来改善LID,而STN-DBS在震颤、僵直、运动迟缓等运动症状明显优于GPi-DBS,并且选择STN作为靶点,疗效方面具有对药物“关期”症状持续改善更佳、经济方面具有低电耗和药物剂量明显减少的优点,且对异动的改善效果与GPi相当,是治疗伴有异动症的帕金森病的理想靶点。
| [1] |
RADHAKRISHNAN D M, GOYAL V. Parkinson's disease: A review[J]. Neurol India, 2018, 66(Supplement): S26-S35. DOI:10.4103/0028-3886.226451 |
| [2] |
KIM J H, CHANG W S, JUNG H H, et al. Effect of subthalamic deep brain stimulation on levodopa-induced dyskinesia in Parkinson's disease[J]. Yonsei Med J, 2015, 56(5): 1316-1321. DOI:10.3349/ymj.2015.56.5.1316 |
| [3] |
RIECK M, SCHUMACHER-SCHUHA F, CALLEGARI-JACQUES S M, et al. Is there a role for ADORA2A polymorphisms in levodopa-induced dyskinesia in Parkinson's disease patients?[J]. Pharmacogenomics, 2015, 16(6): 573-582. DOI:10.2217/pgs.15.23 |
| [4] |
ESPAY A J, MORGANTE F, MEROLA A, et al. Levodopa-induced dyskinesia in Parkinson disease: Current and evolving concepts[J]. Ann Neurol, 2018, 84(6): 797-811. DOI:10.1002/ana.25364 |
| [5] |
TRAN T N, VO T N N, FREI K, et al. Levodopa-induced dyskinesia: clinical features, incidence, and risk factors[J]. J Neural Transm (Vienna), 2018, 125(8): 1109-1117. DOI:10.1007/s00702-018-1900-6 |
| [6] |
KUMAR N, VAN GERPEN J A, BOWER J H, et al. Levodopa-dyskinesia incidence by age of Parkinson's disease onset[J]. Mov Disord, 2005, 20(3): 342-344. DOI:10.1002/mds.20360 |
| [7] |
EVANS J R, MASON S L, WILLIAMS-GRAY C H, et al. The natural history of treated Parkinson's disease in an incident, community based cohort[J]. J Neurol Neurosurg Psychiatry, 2011, 82(10): 1112-1118. DOI:10.1136/jnnp.2011.240366 |
| [8] |
TURCANO P, MIELKE MM, BOWER J H, et al. Levodopa-induced dyskinesia in Parkinson disease: a population-based cohort study[J]. Neurology, 2018, 91(24): e2238-e2243. DOI:10.1212/wnl.0000000000006643 |
| [9] |
HUOT P, JOHNSTON T H, KOPRICH J B, et al. The pharmacology of L-DOPA-induced dyskinesia in Parkinson's disease[J]. Pharmacol Rev, 2013, 65(1): 171-222. DOI:10.1124/pr.111.005678 |
| [10] |
GROUP P M C. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson's disease (PD MED): a large, open-label, pragmaticrandomised trial[J]. Lancet, 2014, 384(9949): 1196-1205. DOI:10.1016/s0140-6736(14)60683-8 |
| [11] |
FERREIRA J J, KATZENSCHLAGER R, BLOEM B R, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson's disease[J]. Eur J Neurol, 2013, 20(1): 5-15. DOI:10.1111/j.1468-1331.2012.03866.x |
| [12] |
WOLF E, SEPPI K, KATZENSCHLAGER R, et al. Long-term antidyskinetic efficacy of amantadine in Parkinson's disease[J]. Mov Disord, 2010, 25(10): 1357-1363. DOI:10.1002/mds.23034 |
| [13] |
HINDLE J V. The practical management of cognitive impairment and psychosis in the older Parkinson's diseasepatient[J]. J Neural Transm, 2013, 120(4): 649-653. DOI:10.1007/s00702-013-0994-0 |
| [14] |
FOLLETT K A, WEAVER F M, STERN M, et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson's disease[J]. N Engl J Med, 2010, 362(22): 2077-2091. DOI:10.1056/nejmoa0907083 |
| [15] |
MUNHOZ R P, CERASA A, OKUN M S. Surgical treatment of dyskinesia in Parkinson's disease[J]. Front Neurol, 2014, 5: 65. DOI:10.3389/fneur.2014.00065 |
| [16] |
LIU Y, LI F, LUO H, et al. Improvement of deep brain stimulation in dyskinesia in Parkinson's disease: a meta-analysis[J]. Front Neurol, 2019, 10: 151. DOI:10.3389/fneur.2019.00151 |
| [17] |
ODEKERKEN V J, VAN LAAR T, STAAL M J, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson's disease (NSTAPS study): a randomised controlled trial[J]. Lancet Neurol, 2013, 12(1): 37-44. DOI:10.1016/s1474-4422(12)70264-8 |
| [18] |
FAN S Y, WANG K L, HU W, et al. Pallidal versus subthalamic nucleus deep brain stimulation for levodopa-induced dyskinesia[J]. Ann Clin Transl Neurol, 2020, 7(1): 59-68. DOI:10.1002/acn3.50961 |
| [19] |
OSTERGAARD K, SUNDE N, DUPONT E. Effects of bilateral stimulation of the subthalamic nucleus in patients with severe Parkinson's disease and motor fluctuations[J]. Mov Disord, 2002, 17(4): 693-700. DOI:10.1002/mds.10188 |
| [20] |
NISHIKAWA Y, KOBAYASHI K, OSHIMA H, et al. Direct relief of levodopa-induced dyskinesia by stimulation in the area above the subthalamic nucleus in a patient with Parkinson's disease: case report[J]. Neurol Medico Chir, 2010, 50(3): 257-259. DOI:10.2176/nmc.50.257 |
| [21] |
GURIDI J, OBESO J A, RODRIGUEZ-OROZ M C, et al. L-dopa-induced dyskinesia and stereotactic surgery for Parkinson's disease[J]. Neurosurgery, 2008, 62(2): 311-323. DOI:10.1227/01.neu.0000315998.58022.55 |
| [22] |
KRACK P, POLLAK P, LIMOUSIN P, et al. From off-period dystonia to peak-dose chorea. The clinical spectrum of varying subthalamic nucleus activity[J]. Brain, 1999, 122(Pt 6): 1133-1146. DOI:10.1093/brain/122.6.1133 |
| [23] |
RODRIGUEZ-OROZ M C. Efficacy of deep brain stimulation of thesubthalamic nucleus in Parkinson's disease 4 years after surgery: double blind and open label evaluation[J]. J Neurol Neurosurg Psychiatry, 2004, 75(10): 1382-1385. DOI:10.1136/jnnp.2003.031294 |
| [24] |
BRODSKY M A, HOGARTH P, NUTT J G. OFF-off rebound dyskinesia insubthalamic nucleus deep brain stimulation of Parkinson's disease[J]. Mov Disord, 2006, 21(9): 1487-1490. DOI:10.1002/mds.20964 |
| [25] |
TOMASINO B, MARIN D, ELEOPRA R, et al. To move or not to move: subthalamic deep brain stimulation effects on implicit motor simulation[J]. Brain Res, 2014, 1574: 14-25. DOI:10.1016/j.brainres.2014.06.009 |
| [26] |
JIANG Y G, TAN Z G, ZHOU Q, et al. Efficacies of globus pallidus stimulation and subthalamic nucleus stimulation for advanced Parkinson's disease: a meta-analysis of randomized controlled trials[J]. Clin Interv Aging, 2016, 777. DOI:10.2147/cia.s105505 |
| [27] |
WAGLE SHUKLA A, OKUN M S. Surgical treatment of Parkinson's disease: patients, targets, devices, andapproaches[J]. Neurotherapeutics, 2014, 11(1): 47-59. DOI:10.1007/s13311-013-0235-0 |
| [28] |
ZHENG Z, LI Y, LI J, et al. Stimulation-induced dyskinesia in the early stage after subthalamic deep brain stimulation[J]. Stereotact Funct Neurosurg, 2010, 88(1): 29-34. DOI:10.1159/000260077 |
| [29] |
向怡, 蒋理, 覃彬, 等. 帕金森病患者丘脑底核脑深部电刺激术中同期植入双侧电极精度及治疗效果的研究[J]. 第三军医大学学报, 2020, 42(05): 517-522. XIANG Y, JIANG L, QIN B, et al. Precision of bilateral electrode implantation and treatment outcome in Parkinson's disease after subthalamic nucleus deep brain stimulation[J]. J Third Mil Med Univ, 2020, 42(05): 517-522. DOI:10.16016/j.1000.5404.201910055 |




