2. 400038 重庆, 陆军军医大学(第三军医大学):军事预防医学系复合伤研究所,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injuries, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
贫铀(depleted uranium,DU)是铀浓缩过程中将235U去除后剩余的部分,指235U浓度低于0.7%的铀。其放射性较天然铀降低40%,但化学特性与天然铀很接近[1-2]。因贫铀密度高(19.3 g/cm3)、强度大、韧性好、穿透力强,被广泛用于民事(如辐射防护服)及军事活动中(如作为装甲材料及弹药成分)[3]。研究资料表明经呼吸道吸入是贫铀最主要及最危险的暴露方式[4]。但关于贫铀对机体的损伤,目前多为针对机体部分靶器官的组织病理、形态计量学等方面的研究[5-6], 其均不能及时反映机体早期发生的系列变化,尤其是其对核暴露早期紧急救治的指导意义欠缺。血液标本和影像资料具有采集方便、结果准确直观、可重复检查等优点,被广泛用于临床辅助疾病诊断及治疗。据此,本研究着眼适应现代卫勤快速高效救治的要求,对呼吸道高剂量贫铀暴露早期机体内血液相关指标变化规律及肺部影像改变特点进行深入研究,以期为战时贫铀武器损伤或核武器损伤及平时核电站事故后伤员的早期伤情判断提供数据支撑。
贫铀对机体的损伤效应呈一定剂量依赖关系[7]。张斌等[8]给犬左肺分别灌入低剂量(2 mg/kg)、高剂量(20 mg/kg)的贫铀混悬液观察30 d后,发现高剂量组生存时间为(11.2±8.9) d,而低剂量组除1只犬在贫铀混悬液灌注后22 d死亡外,其余犬存活时间均超过30 d。故本研究选取高剂量(20 mg/kg)贫铀以制造急性肺损伤染毒犬模型。另外,目前关于呼吸系统核暴露后的损伤和防护的研究数据主要来自模拟吸入贫铀气溶胶染毒动物模型,通常采用气囊吹入粉末染毒[9]、注射器经支气管镜注入混悬液染毒[10]、正压喷射混悬液染毒[11]等建立染毒动物模型,但这些方法在建模时存在贫铀粉末剂量难控制、染毒过程不持续、实验人员职业暴露风险高等缺点,且不能完全反映真实战场环境下贫铀气溶胶暴露后的发病过程。本研究采用本课题组设计、改进的纤支镜引导下喷雾式支气管染毒装置(授权号ZL201921851213.X)完成染毒,以期真实模拟战争情况下持续动态吸入气溶胶的情形,从而确保获得的数据具有较强的参考价值。
1 材料与方法 1.1 材料 1.1.1 动物健康成年比格犬8只,雌雄各半,购自重庆市中医药研究院实验动物研究所,体质量(10.48± 0.65) kg。实验前在动物房适应性饲养5~7 d,饲养条件:温度20~25 ℃,湿度30%~70%,饲料为全价营养配合饲料。实验全程于本校军事预防医学系复合伤研究所国家重点实验室完成并按本校动物伦理委员会批准的动物保护指南实施。
1.1.2 主要仪器与试剂主要仪器包括:超细纤维支气管镜(MB-156,日本),电感耦合等离子体质谱仪(ELEMENT XR,德国),喷雾式染毒装置(自主研发,授权号ZL201921851213.X),双腔支气管插管(35Fr.LEFT, 英国),数显磁力加热搅拌仪(MS7-H550-Pro, 苏州),64排螺旋CT(OPTIMA,美国),全自动模块式血液体液分析系统(XN-B3,日本),全自动生化免疫分析仪(VITROS5600,美国),全自动酶标仪(EMax Plus,英国)。主要试剂包括:贫铀氧化物粉末(U3O8,DD=99.9%,陆军军医大学复合伤研究所提供),盐酸赛拉嗪注射液(2 mL×10支,吉林省华牧动物保健品有限公司),盐酸苯噁唑注射液(2 mL×10支,吉林省华牧动物保健品有限公司),戊巴比妥钠盐(上海艾研生物科技有限公司),犬TNF-α、IL-1、IL-6、IL-8 ELISA检测试剂盒(96 T,酶标生物公司),血气生化8项测试卡(25人份/盒,Abbott Point of Care Inc)。
1.2 贫铀混悬液的制备贫铀氧化物粉末研磨后500目过筛,准确称量,高压灭菌,用生理盐水配成50 mg/mL的混悬液,磁力搅拌器低速持续搅拌,保持贫铀颗粒的混悬状态。
1.3 急性肺损伤染毒犬模型的建立实验前禁食12 h,染毒前肌肉注射约1.5 mL盐酸赛拉嗪注射液,麻醉起效后称其体质量并送至实验室。将其仰卧位固定四肢于实验台上,撑开犬上下颌,在喉镜直视下经口插入双腔支气管插管至左侧主支气管,调整犬体位至左侧卧位,气囊充气同时利用超细纤维支气管镜直视下定位,妥善固定插管位置后水封瓶法验证左右肺隔离良好。在超细纤维支气管镜引导下将课题组设计的喷雾式染毒装置导管前端放至肺段支气管分叉处,染毒剂量20 mg/kg,混悬液浓度50 mg/mL,混悬液温度37 ℃,将计算量的混悬液加入自主设计的染毒装置并启动,毒液以雾状形态均匀持续进入肺深部,染毒末加注2.0 mL生理盐水冲管,持续3~5 min完成染毒。肌注0.5 mL盐酸苯噁唑注射液加快实验犬苏醒,待其意识逐渐恢复后拔管归圈饲养。
1.4 血液标本检测及指标选取分别于沾染前及沾染后3、8 h,1、2、3、5、7 d采集犬股动脉血液标本,每次共约15 mL,先后检测动脉血气(pH值、PaO2、PaCO2、HCO3-含量、SatO2)、血常规(红细胞、白细胞、中性粒细胞、淋巴细胞,血小板)、肝功能(ALT、AST)、肾功能(肌酐、尿酸、尿素)、心肌酶谱(CK、CK-MB、LDH)、细胞因子(TNF-α、IL-1、IL-6、IL-8)、血铀含量等项目。血铀含量测定采用电感耦合等离子体质谱法(ICP-MS)。
1.5 胸部CT检查分别于沾染前及沾染后3、8 h,1、2、3、5、7 d在全麻下行胸部CT检查,扫描条件:120 kV,2 mAs,层厚5 mm。并由两名专科主治医师对肺部影像进行分析,参照SILLIA等[12]建立的评分标准和方法对左肺阴影面积最大层面中阴影累及范围进行评分。肺部阴影包括片状阴影、条索影、磨玻璃影、空腔影、网织影及实变影。评分标准(0~10分):0分为肺部影像无上述阴影改变,1分表示累及范围0~10%,2分表示累及范围11%~20%,3~10分以此类推。最终得分取两次评分平均值。
1.6 统计学分析采用SPSS 25.0统计软件,数据以 x±s表示,以一般线性模型单变量方差分析进行分析。P < 0.05认为差异有统计学意义。
2 结果 2.1 血铀含量变化沾染后各时相点,染毒犬血铀含量均高于沾染前(P < 0.05),且沾染8 h,1、2、3、5、7 d低于沾染3 h(P < 0.01),沾染1、2、3、5 d低于沾染8 h(P < 0.05),沾染7 d高于沾染1、2、3、5 d(P < 0.05,图 1)。
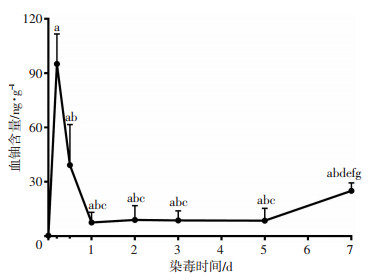
|
| a: P < 0.05,与沾染前比较;b: P < 0.01,与沾染3 h比较;c: P < 0.05,与沾染8 h比较;d: P < 0.05,与沾染1 d比较;e: P < 0.05,与沾染2 d比较;f: P < 0.05,与沾染3 d比较;g: P < 0.05,与沾染5 d比较 图 1 贫铀染毒犬各时相点血铀含量变化(n=8) |
2.2 动脉血气变化
染毒犬动脉血气指标各时相点波动幅度差异无统计学意义(图 2)。
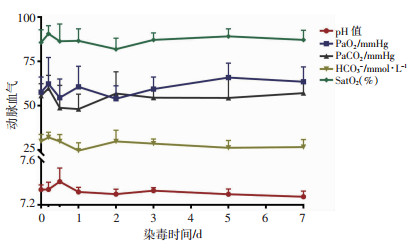
|
| 图 2 贫铀染毒犬各时相点动脉血气变化(n=8) |
2.3 血常规变化
染毒犬红细胞计数总体呈下降趋势,沾染7 d低于沾染前(P < 0.05);白细胞与中性粒细胞计数总体改变趋势较一致,且于沾染8 h、5 d高于沾染前(P < 0.05);血小板及淋巴细胞计数总体波动幅度较小,与沾染前相比,各时相点变化差异无统计学意义(图 3)。
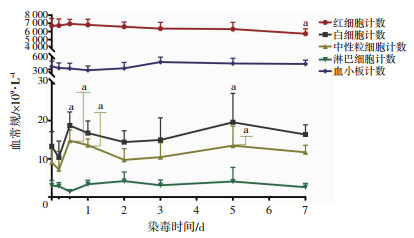
|
| a: P < 0.05,与沾染前比较 图 3 贫铀染毒犬各时相点血常规变化(n=8) |
2.4 肝功能变化
与沾染前相比,染毒犬ALT水平各时相点差异不明显;AST水平总体呈先上升后下降趋势,与沾染前相比,沾染3 h明显升高(P < 0.05),余时相点变化差异无统计学意义(图 4)。
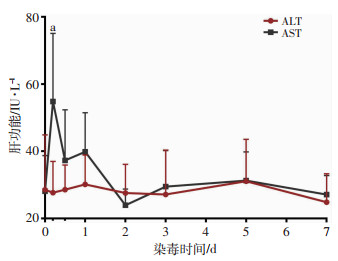
|
| a: P < 0.05,与沾染前比较 图 4 贫铀染毒犬各时相点肝功能变化(n=8) |
2.5 肾功能变化
染毒犬肌酐水平总体呈先稍下降后上升趋势,与沾染前相比,沾染5、7 d明显升高(P < 0.01);尿酸、尿素水平总体变化幅度较小,与沾染前相比,各时相点差异不明显(图 5)。

|
| a: P < 0.01,与沾染前比较 图 5 贫铀染毒犬各时相点肾功能变化(n=8) |
2.6 心肌酶谱变化
染毒犬CK、CK-MB两项指标总体呈先上升后下降趋势,与沾染前相比,沾染3 h明显升高(P < 0.01);LDH水平总体波动幅度较小,与沾染前相比,各时相点变化差异无统计学意义(图 6)。
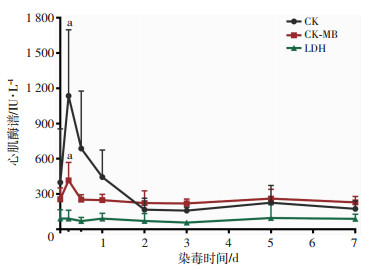
|
| a: P < 0.01,与沾染前比较 图 6 贫铀染毒犬各时相点心肌酶谱变化(n=8) |
2.7 细胞因子变化
与沾染前相比,染毒犬IL-1、IL-6水平各时相点变化差异无统计学意义;IL-8水平总体呈上升趋势,与沾染前相比,沾染3、7 d明显升高(P < 0.05);TNF-α水平总体呈下降趋势,与沾染前相比,沾染5 d明显下降(P < 0.05,图 7)。
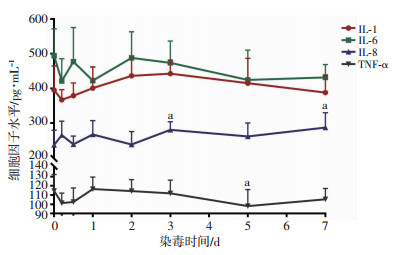
|
| a: P < 0.05,与沾染前比较 图 7 贫铀染毒犬各时相点血液细胞因子变化(n=8) |
2.8 胸部CT表现
染毒犬沾染前胸部CT检查未见明显异常影像(图 8A)。沾染后胸部CT检查显示:左肺尖叶、间叶、膈叶均不同程度出现多发磨玻璃影,呈斑片状,其间有地图样未受损伤区,左肺膈叶可见团状高密度区,系为贫铀沾染集中区(图 8B~H)。沾染后各时间点的肺部阴影得分由低到高再下降并稳定于5分左右,且均明显高于沾染前(P < 0.01);沾染3、8 h得分与其他时相点相比差异均有统计学意义(P < 0.01);沾染1 d得分明显高于沾染5、7 d(P < 0.05,图 9)。
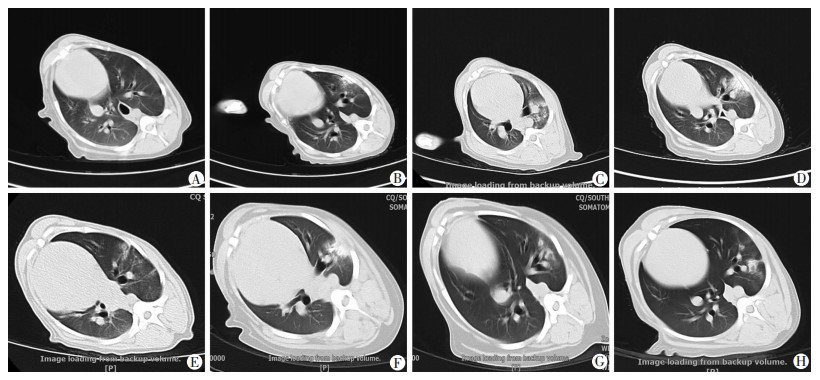
|
| A:沾染前;B:沾染3 h;C:沾染8 h;D:沾染1 d;E:沾染2 d;F:沾染3 d;G:沾染5 d;H:沾染7 d 图 8 贫铀染毒犬各时相点胸部CT表现 |
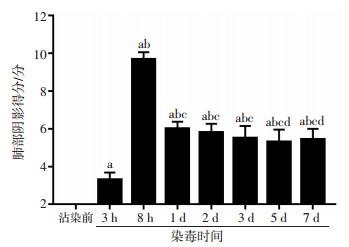
|
| a: P < 0.01,与沾染前比较;b: P < 0.01,与沾染3 h比较;c: P < 0.01,与沾染8 h比较;d: P < 0.05,与沾染1 d比较 图 9 贫铀染毒犬各时相点胸部CT评分(n=8) |
3 讨论
房室模型是把人体假想为一个系统,将组织器官按药物的分布速率分成不同房室,分布速率相近者视为同一室。二房室模型则是按照分布速率将组织器官分为分布快的中央室(如血、脑、肝、肾)和分布慢的周边室(如肌肉、脂肪)[13]。本研究中染毒犬血铀含量在沾染3 h内快速大幅升高,沾染3~8 h快速下降,沾染8 h~1 d缓慢下降,沾染1~5 d处于升高平台期,沾染5~7 d呈继续升高趋势。这表明贫铀经肺泡吸收后在体内的分布速率可能符合二房室模型。由于肺泡表面积大,肺血流丰富,可溶性贫铀能通过呼吸膜快速大量进入血液并分布于中央室,因而沾染3 h内血铀含量快速大幅升高。随着贫铀第2次分布进入周边室,同时部分贫铀被排泄,沾染3~8 h血铀含量随之开始快速下降。沾染8 h~1 d贫铀在体内二次分布已完成,中央室与周边室血铀浓度已相等,血铀含量下降速度减缓。沾染1~5 d贫铀在机体内的代谢动力学处于动态平衡,但随着体内贫铀对肾功能的损伤愈发严重,导致血铀不能及时有效排出,而沉积于肺内的部分贫铀仍持续被溶解吸收入血,故于沾染5 d时血铀再次出现升高趋势。血液是贫铀在体内吸收、分布、排泄的中介,血液中的贫铀含量能间接反映靶器官、靶组织的贫铀浓度,因此血铀含量可以作为体内贫铀最具代表性的指标。故本研究血铀含量检测结果不但揭示了经呼吸道高剂量贫铀暴露早期血液中铀含量随时间变化的规律,而且为研究呼吸道核素暴露早期对机体靶器官的损伤特点提供了数据支撑。
本研究动脉血气结果显示各指标各时相点变化不明显,这可能与本研究只沾染了左肺有关,因为右肺代偿了左肺损失的部分功能,从而在静息状态下检测动脉血气出现各时相点无明显差异的现象。
白细胞总数的变化主要受中性粒细胞数量增多或减少的影响。本研究结果显示,染毒犬白细胞与中性粒细胞同步波动,于沾染8 h明显升高是因为贫铀入血后可大量蓄积于骨骼[5],从而刺激骨髓细胞短暂的加速成熟和加快释放以及循环池及边缘池白细胞重新分布所致[14];于沾染5 d再次升高,则是因为随着时间推移肺部出现感染灶,部分炎症因子活化,诱导大量中性粒细胞趋化、募集所致。另外,红细胞、淋巴细胞、血小板检测结果波动幅度较小,临床意义不大。
本研究中,染毒犬沾染3 h时CK、CK-MB、AST明显升高,其可能原因分析如下:①肝功能损伤,但相关研究表明,铀化合物中毒时,伴发肝脏损伤者甚少[15],肝功能的改变主要是继发于肾脏功能障碍的结果。②心肌细胞损伤,相关研究表明贫铀的化学毒性可导致细胞内自由基失衡,并损伤DNA细胞膜,干扰细胞信号转导,导致细胞凋亡和炎症反应等[16]。加之本研究结果显示沾染3 h血铀含量很高,故不能排除贫铀进入并损伤心肌细胞造成CK、CK-MB释放的可能性。③肌肉损伤,CK、CK-MB、AST广泛分布于骨骼肌、心肌、平滑肌等组织,麻醉、插管、染毒等一系列操作可引起肌肉损伤,从而导致其一过性升高,但难以解释的是LDH没出现同步升高,需进一步做排除实验方可排除。因此,沾染3 h出现CK、CK-MB、AST明显升高的原因仍需进一步研究证实。
肾脏是贫铀主要的排泄器官,同时肾脏也是对贫铀毒性最敏感的器官[17-18]。而本研究结果也显示染毒犬沾染2 d肌酐开始缓慢升高,至沾染5 d,肌酐开始明显升高,并有持续升高趋势。KITAHARA等[19]研究发现贫铀的肾功能损伤与氧化应激反应有关。JIM等[20]的实验提示髓袢降支粗段和髓袢升支粗段及集合管可能是铀肾毒性的靶点。但贫铀的肾毒性机制至今还未得到很清楚的解释,这将是后期研究工作关注的重点。
细胞因子是由细胞分泌的一类小分子可溶性蛋白质,通过和靶细胞上的受体相结合而影响自身及其他细胞的行为,产生特定的生物性效应[21]。IL-1、IL-6、IL-8、TNF-α是机体重要的炎性细胞因子,主要由单核细胞和巨噬细胞分泌产生,尤其在机体抗细菌感染过程中发挥重要作用[21]。本研究结果显示:染毒犬IL-1、IL-6、TNF-α不但没升高反而呈稍下降趋势,可能与早期高剂量贫铀暴露引起机体免疫受抑制有关。ORONA等[22]通过细胞实验也发现:随着贫铀暴露浓度的增加,巨噬细胞凋亡也增加。加之染毒早期主要为贫铀化学性损伤引起的肺部炎症,而非细菌感染性炎症,故染毒早期上述细胞因子变化不大。至沾染3、7 d时,IL-8出现明显升高。这是因为随着时间后移,肺部开始出现细菌感染,加之IL-8在小支气管炎和肺部囊性纤维化的发病中起重要作用[23],故随着伤情的进展促使肺上皮细胞、单核细胞等分泌部分IL-8。
急性肺损伤是由多种因素导致肺组织结构改变而引起的急性进行性呼吸衰竭[24]。由于本研究仅行单侧肺染毒,受健侧肺的影响,血氧分压及肺部影像学表现无法完全符合传统上的急性肺损伤诊断标准[25],所以本研究涉及的肺损伤是指贫铀经呼吸道暴露后导致肺组织炎性细胞浸润、肺水肿、充血和肺不张以及后期的肺气肿、肺纤维化等肺部病理生理学改变[10]。本研究胸部CT检查结果显示:沾染后各时间点,染毒犬左肺影像均有不同程度的磨玻璃影和实变影改变。这充分说明本研究选用20 mg/kg贫铀剂量,采用支气管喷入染毒方式,成功建立了急性肺损伤染毒犬模型。另外,沾染1 d,炎症逐渐吸收,沾染3~7 d,肺部阴影得分停留在5分左右,表明炎症吸收有限,炎症反应持续存在。有研究表明贫铀难溶性微粒无论被吞噬与否,均可进入肺间质,而且随着时间的延长,几乎所有形式的铀都能被体液缓慢溶解[14]。一旦被溶解,铀便能与生物分子发生反应,形成铀酰离子,发挥其毒性作用。因此,呼吸道不慎吸入贫铀后,应设法尽快彻底将其清除,否则会对机体造成一系列近期损伤和远期损害。
综上所述,本研究采用20 mg/kg贫铀,经呼吸道染毒,成功建立了急性肺损伤染毒犬模型,研究结果表明:贫铀在机体内的分布速率可能符合二房室模型,沾染8 h,肺部出现严重炎症反应;沾染5 d,肾功能明显受损,且血铀随之复升。另外,早期对动脉血气、心肌酶谱、细胞因子中部分指标的影响特点,尚需进一步研究证实。
| [1] |
HON Z, ÖSTERREICHER J, NAVRÁTIL L. Depleted uranium and its effects on humans[J]. Sustainability, 2015, 7(4): 4063-4077. DOI:10.3390/su7044063 |
| [2] |
Armando F, Clara G, Daniela F, et al. Depleted uranium and human health[J]. Curr Med Chem, 2018, 25(1): 49-64. DOI:10.2174/0929867324666170426102343 |
| [3] |
BURKART W, DANESI P R, HENDRY J H. Properties, use and health effects of depleted uranium[J]. Int Congr Ser, 2005, 1276: 133-136. DOI:10.1016/j.ics.2004.09.047 |
| [4] |
艾国平, 李蓉, 肖桃元, 等. 大鼠长期摄入贫铀后的病理形态学特点观察[J]. 解放军医学杂志, 2007, 32(10): 1036-1039. AI G P, LI R, XIAO T Y, et al. Pathological changes of rats after chronic ingestion of depleted uranium[J]. Med J Chin PLA, 2007, 32(10): 1036-1039. DOI:10.3321/j.issn:0577-7402.2007.10.011 |
| [5] |
潘秀颉, 杨陟华, 曹珍山, 等. 大鼠吸入贫铀气溶胶后体内铀的分布[J]. 中华放射医学与防护杂志, 2009, 29(1): 23-26. PAN X J, YANG Z H, CAO Z S, et al. Distribution of uranium in Rata inhaled with depleted uranium aerosols[J]. Chin J Radiol Med Prot, 2009, 29(1): 23-26. DOI:10.3760/cma.j.issn.0254-5098.2009.01.007 |
| [6] |
曹珍山, 朱茂祥, 杨陟华, 等. 大鼠吸入贫铀气溶胶后主要器官的病理损伤特点[J]. 中国辐射卫生, 2005, 14(2): 81-84. CAO Z S, ZHU M X, YANG Z H, et al. Characteristic pathological changes of main organs of rats after inhalation of depleted uranium aerosol[J]. Chin J Radiol Heal, 2005, 14(2): 81-84. DOI:10.3969/j.issn.1004-714X.2005.02.001 |
| [7] |
岳永超, 李明华, 冀楠, 等. 贫铀的体内外毒性及流行病学研究进展[J]. 现代生物医学进展, 2018, 18(14): 2784-2787. YUE Y C, LI M H, JI N, et al. Research progress of depleted uranium toxicity in vivo/vitro and epidemiology[J]. Prog Mod Biomed, 2018, 18(14): 2784-2787. DOI:10.13241/j.cnki.pmb.2018.14.041 |
| [8] |
张斌, 段蕴铀, 贺文博, 等. 贫铀吸入性肺损伤犬模型的建立[J]. 解放军医学杂志, 2011, 36(2): 188-191. ZHANG B, DUAN Y Y, HE W B, et al. Reproduction of a model of lung injury induced by depleted uranium inhalation in canine[J]. Med J Chin PLA, 2011, 36(2): 188-191. |
| [9] |
REN J, HAO Y H, GAO R, et al. Effect of a novel polyethylene glycol compound on lung lavage in dogs after the inhalation of depleted uranium dust[J]. Int J Radiat Biol, 2018, 94(5): 462-471. DOI:10.1080/09553002.2018.1446228 |
| [10] |
张斌.全肺灌洗对贫铀吸入性肺损伤干预作用的实验研究[D].上海: 第二军医大学, 2011. ZHANG B. Interventional effect of whole lung lavage on lung injury induced by depleted uranium aspiration[D]. Shanghai: Second Military Medical University, 2011. |
| [11] |
苏翠文.硒对贫铀气管灌注大鼠致损伤的防护作用[D].合肥: 安徽医科大学, 2012. SU C W. Protection of selenium on dysfunction induced by depleted uranium instillation through trachea in rats[D]. Hefei: Anhui Medical University, 2012. |
| [12] |
SCILLIA P, KAFI S A, MÉLOT C, et al. Oleic acid-induced lung injury: thin-section CT evaluation in dogs[J]. Radiology, 2001, 219(3): 724-731. DOI:10.1148/radiology.219.3.r01jn01724 |
| [13] |
曹佳, 曹务春, 栗永萍, 等. 程天民军事预防医学[M]. 北京: 人民军医出版社, 2014: 900-914. CAO J, CAO W C, SU Y P, et al. Cheng Tianmin military preventive medicine[M]. Beijing: People's Military Medical Publishing House, 2014: 900-914. |
| [14] |
孙建宁. 药理学[M]. 北京: 中国中医药出版社, 2016: 28. SUN J N. Pharmacology[M]. Beijing: China Press of Traditional Chinese Medicine, 2016: 28. |
| [15] |
刘树铮. 铀毒理学[M]. 北京: 原子能出版社, 1995: 304-310. LIU S Z. Uranium toxicology[M]. Beijing: Atomic Energy Press, 1995: 304-310. |
| [16] |
SONG Y, SALBU B, TEIEN H C, et al. Hepatic transcriptional responses in Atlantic salmon (Salmo salar) exposed to gamma radiation and depleted uranium singly and in combination[J]. Sci Total Environ, 2016, 562: 270-279. DOI:10.1016/j.scitotenv.2016.03.222 |
| [17] |
NORDBERG G F, FOWLER B A, NORDBERG M. Handbook on the toxicology of metals[M]. London: EIsevier, 2015: 1307-1345.
|
| [18] |
冷言冰, 李蓉, 艾国平, 等. 贫铀长期摄入对大鼠肾脏损伤效应的研究[J]. 第三军医大学学报, 2008, 30(18): 1686-1689. LENG Y B, LI R, AI G P, et al. Toxic effects of depleted uranium on rat kidney after long-term ingestion[J]. J Third Mil Med Univ, 2008, 30(18): 1686-1689. |
| [19] |
KITAHARA K, NUMAKO C, TERADA Y, et al. Uranium XAFS analysis of kidney from rats exposed to uranium[J]. J Synchrotron Radiat, 2017, 24(Pt 2): 456-462. DOI:10.1107/S1600577517001850 |
| [20] |
JIM V, LAVIOLETTE C, BRIEHL M M, et al. Spatial distribution of uranium in mice kidneys detected by laser ablation inductively coupled plasma mass spectrometry[J]. J Appl Bioanal, 2017, 3(3): 43-48. DOI:10.17145/jab.17.007 |
| [21] |
邹义洲. 医学免疫学[M]. 北京: 中国医药科技出版社, 2018: 23-29. ZOU Y Z. Medical immunology[M]. Beijing: China Medical Science and Technology Press, 2018: 23-29. |
| [22] |
ORONA N S, TASAT D R. Uranyl nitrate-exposed rat alveolar macrophages cell death: influence of superoxide anion and TNF α mediators[J]. Toxicol Appl Pharmacol, 2012, 261(3): 309-316. DOI:10.1016/j.taap.2012.04.022 |
| [23] |
杨扬, 李威, 王左敏, 等. 牙周炎合并AECOPD患者血清IL-6、IL-8水平及相关性研究[J]. 安徽医科大学学报, 2018, 53(6): 964-966. YANG Y, LI W, WANG Z M, et al. Clinical significance of IL-6 and IL-8 in patients with periodontal disease and AECOPD and their correlations[J]. Acta Univ Med Anhui, 2018, 53(6): 964-966. DOI:10.19405/j.cnki.issn1000-1492.2018.06.029 |
| [24] |
HORIE S, MASTERSON C, DEVANEY J, et al. Stem cell therapy for acute respiratory distress syndrome: a promising future?[J]. Curr Opin Crit Care, 2016, 22(1): 14-20. DOI:10.1097/mcc.0000000000000276 |
| [25] |
伍冬冬, 潘频华, 覃庆武, 等. 急性肺损伤/急性呼吸窘迫综合征发病机制研究进展[J]. 中华结核和呼吸杂志, 2015, 38(7): 524-527. WU D D, PAN P H, QIN Q W, et al. Advances in the pathogenesis of acute lung injury/acute respiratory distress syndrome[J]. Chin J Tuberc Respir Dis, 2015, 38(7): 524-527. DOI:10.3760/cma.j.issn.1001-0939.2015.07.013 |




