肝癌是全球常见的恶性肿瘤之一,具有恶性程度高、易转移、疾病隐匿、预后差等特点[1]。流行病学研究表明,2018年世界范围内新增癌症病例中,肝癌占比高达8.2%,其发病率居世界恶性肿瘤发病率第6位,病死率居第4位,在男性中更是升至第2位,仅次于肺癌,给人类的生命和健康造成了极大的威胁[2]。与此同时,尽管近年来临床上涌现了大量的新型抗癌化疗药物,但靶点不明确引起的毒副作用、药物耐药性依旧是制约持续化疗、降低患者依从性、肿瘤复发转移的主要问题,这也是限制化疗药物成为癌症治疗首选方法的“瓶颈”之一。利用已批准用于治疗多种疾病的药物作为候选抗癌药物是区别于从源头开发新药的一种更快、更便宜的替代方法[3]。这也得益于现有的临床适用给药方案和患者耐受性的证据。
双硫仑(disulfiram,DSF),又名戒酒硫,是美国食品和药物管理局(FDA)批准用于治疗酒精依赖的药物,临床使用超过60年,在其推荐剂量下,具有完善的药代动力学、安全性和耐受性等多方面患者数据资料[4-5]。在体内,双硫仑抑制乙醛脱氢酶,阻挠乙醇的正常代谢,致使饮用少量乙醇也可引起乙醛中毒的反应,用药后再饮酒即出现软弱眩晕、嗜睡、全身潮红、头痛、恶心、呕吐、血压下降,甚至休克等反应,令嗜酒者不再思饮酒,而达到戒酒的目的。由于DSF在临床前模型中显示出抗癌活性,并且其体内代谢物二硫代氨基甲酸二乙酯(diethyldithiocarbamate, DTC)在临床试验中用做佐剂辅助治疗高危乳腺癌,因而DSF成为肿瘤学药物再利用的候选药物[6-10]。尽管DSF对多种癌细胞均有不同程度的抑制作用,且DSF的抗肿瘤活性依赖Cu2+,即DSF的代谢物DTC在体内与Cu2+形成螯合物二乙基二硫代氨基甲酸铜[copper(Ⅱ) diethyldithiocarbamate, CuET][11],但DSF抑制肝癌细胞生长的确切机制仍不清楚。本研究旨在考察不同浓度双硫仑体内活性代谢物CuET对肝癌细胞HepG2、SMMC-7721增殖及凋亡的影响,并初步探讨其可能的作用机制,以期为双硫仑的“老药新用”提供理论依据。
1 材料与方法 1.1 材料与试剂人肝癌细胞株HepG2、SMMC-7721均购自美国ATCC细胞库;RPMI 1640培养基、DMEM培养基、0.25%胰蛋白酶均购自Gibco公司;胎牛血清购自天津康源公司;二乙基二硫代氨基甲酸铜(Ⅱ)购自东京化成工业株式会社;Mdivi-1购自Selleck公司;MTT、LC3B、PI均购自Sigma公司;Annexin V-FITC购自BD公司;GAPDH购自上海碧云天公司;cleaved-Caspase 3、cleaved-Caspase 9、COXIV、P97均购自CST公司;NPL4、UFD1、cleaved-PARP1均购自成都正能公司;PARP1购自Epitomics公司。
1.2 方法 1.2.1 细胞培养HepG2用RPMI 1640培养基(10%胎牛血清),SMMC-7721细胞用DMEM完全培养基(10%胎牛血清)于37 ℃、5% CO2培养箱中培养,待细胞生长至80%左右,用0.25%胰蛋白酶消化离心传代。
1.2.2 MTT比色法检测细胞活度处于对数生长期的HepG2和SMMC-7721细胞,按5 000/孔铺96孔板,每孔90 μL培养基,37 ℃培养过夜后给予不同浓度(0、0.01、0.05、0.10、0.50、1.00、2.00 μmol/L)的CuET处理。给药处理后继续培养24 h,每孔加入20 μL 0.5% MTT,37 ℃继续培养4 h,吸尽孔内液体,每孔加入150 μL DMSO,室温避光振摇约10 min,溶解甲臜。酶标仪于波长490 nm处检测光密度值[D(490)]。设既无细胞也不给药的孔为调零孔,设有细胞但不给药的孔为对照孔(其细胞活性为100%)。所有组平行3个复孔。细胞存活率=[处理组D(490)-调零孔D(490)]/[对照组D(490)-调零孔D(490)]×100%。
1.2.3 软琼脂克隆形成实验用双蒸水配置质量分数为1.2%的琼脂糖,高压灭菌后置42 ℃水浴中保持融化状态。将1 L装DMEM完全培养基粉末(或者1 L装RPMI 1640培养基粉末)溶于双蒸水中,并定容至500 mL,0.22 μm滤膜过滤,即配置2×DMEM完全培养基(或2×RPMI 1640培养基)。取等体积的1.2%的琼脂糖和2×DMEM(或2×RPMI 1640)混匀,每孔1 mL加入12孔板中,室温凝固。HepG2和SMMC-7721组CuET浓度设置均为:0、0.05、0.10、0.50、1.00、2.00 μmol/L。制备单细胞悬液,调整细胞数为1×104/mL,取1.2%的琼脂糖和2×DMEM(或2×RPMI 1640)按1 :3比例混匀,加入100 μL细胞悬液混匀,取1 mL加入已经凝固的下层胶上。37 ℃、5%CO2培养箱中培养15~20 d,显微镜下拍照,每孔加入100 μL 5%MTT染色,计数比较各组克隆形成情况。每组3个复孔。
1.2.4 细胞凋亡处于对数生长期的HepG2和SMMC-7721细胞,按1.3×105/孔接种于6孔板,每孔2 mL培养基,37 ℃培养过夜。实验分组设置为:量效组(0、0.05、0.10、0.50、1.00、2.00 μmol/L)、时效组(0、3、6、9、12、24 h,CuET浓度均为2.00 μmol/L)。量效组给药处理后继续培养24 h收集细胞,时效组给药后不同时间点收集细胞。培养基收集于1.5 mL EP管内,PBS洗涤细胞1次,每孔加入100 μL胰蛋白酶消化细胞,培养基终止消化,收集细胞液于1.5 mL EP管内,1 000 r/min,4 ℃离心5 min。弃上清,按每个样100 μL 1×bingding buffer、2 μL Annexin V-FITC、5 μL PI(50 μg/mL)配置染液,每个样加入100 μL混合染液,斡旋转移液体至1.5 mL EP管内,避光染色15 min,流式细胞仪检测细胞凋亡率。
1.2.5 Western blot检测HepG2和SMMC-7721细胞给药处理24 h后,分别提取全细胞蛋白(细胞裂解液,碧云天)、线粒体蛋白和胞质蛋白(线粒体分离提取试剂盒,碧云天)并测定蛋白浓度(BCA蛋白浓度测定试剂盒增强型,碧云天),蛋白液加入loading buffer,96 ℃,金属浴10 min,保存于-80 ℃。经聚丙烯酰胺凝胶电泳(SDS-PAGE),电转3~4 h至PVDF膜,5%脱脂牛奶封闭30 min,于4 ℃摇床上孵育抗体过夜,TBST洗涤一抗10 min,重复3次,加入二抗于室温下孵育2 h,TBST洗涤后显影。
1.3 统计学分析采用GraphPad 7.0和SPSS 25.0统计软件,数据以x±s表示,进行独立样本t检验或单因素方差分析。检验水准α=0.05。
2 结果 2.1 CuET抑制肝癌细胞HepG2和SMMC-7721增殖结果显示(图 1):与对照组相比,随着CuET浓度的增加,肝癌细胞HepG2和SMMC-7721增殖活性逐渐降低,呈现较好的剂量效应。且最大给药组(2.00 μmol/L)处理后,HepG2组细胞存活率仅为23.04%,SMMC-7721组细胞存活率仅为11.02%,与对照组相比差异有统计学意义(PHepG2<0.01,PSMMC-7721<0.01)。CuET对两种肝癌细胞的半数致死浓度(IC50)分别为IC50(HepG2)=(0.315±0.134)μmol/L,IC50(SMMC-7721)=(0.219±0.007)μmol/L。其次,在相同药物浓度下,HepG2细胞敏感性强于SMMC-7721细胞,可见CuET对肝癌细胞HepG2和SMMC-7721增殖具有良好的抑制作用。
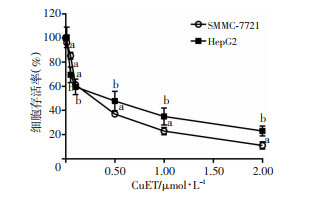
|
| a:P < 0.01,与SMMC-7721中0 μmol/L CuET组比较;b:P < 0.01,与HepG2中0 μmol/L CuET组比较 图 1 CuET抑制肝癌细胞HepG2和SMMC-7721增殖 |
2.2 CuET抑制HepG2和SMMC-7721细胞克隆球生长
结果显示(图 2):相较于对照组,CuET给药处理后,HepG2和SMMC-7721细胞克隆形成数目、克隆球大小均呈现剂量依赖性的减少。且最大给药组(2.00 μmol/L)处理后,与对照组相比,HepG2和SMMC-7721细胞克隆形成数分别减少了97.24%、98.00%(P < 0.01)。实验结果进一步证明了CuET能抑制肝癌细胞HepG2和SMMC-7721的增殖。
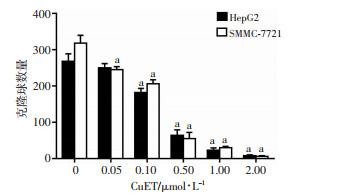
|
| a:P < 0.01,与对应0 μmol/L CuET比较 图 2 不同浓度CuET对HepG2和SMMC-7721细胞克隆球生长的影响 |
2.3 CuET可诱导肝癌细胞HepG2和SMMC-7721发生凋亡
结果显示(图 3):相较于对照组,CuET给药处理后,能诱导HepG2和SMMC-7721细胞发生凋亡,呈现一定的剂量和时效依赖性。且最大给药组(2.00 μmol/L)处理后,与对照组相比,HepG2和SMMC-7721细胞凋亡率分别为62.21%、74.22%(P < 0.01)。通过Western blot检测细胞内凋亡相关蛋白表达的变化情况(图 4),发现CuET给药处理后,引起PARP1剪切激活,cleaved-PARP1、cleaved-Caspase 3、cleaved-Caspase 9表达增加以及细胞色素C(cytochrome C,cyto C)释放至胞质。上述流式及Western blot检测结果表明,CuET激活细胞的凋亡通路,促进肝癌细胞HepG2和SMMC-7721发生凋亡。同时,凋亡活性物质细胞色素C的释放提示线粒体介导的内源性凋亡通路激活,线粒体可能参与CuET诱导肝癌细胞HepG2和SMMC-7721凋亡过程。
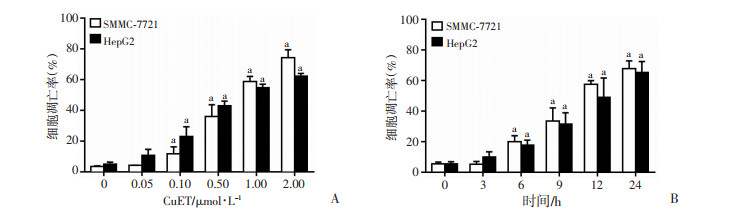
|
| A:量效组细胞凋亡统计分析;B:时效组细胞凋亡统计分析;a:P < 0.01,与各自空白对照比较 图 3 CuET可诱导肝癌细胞HepG2和SMMC-7721发生凋亡 |
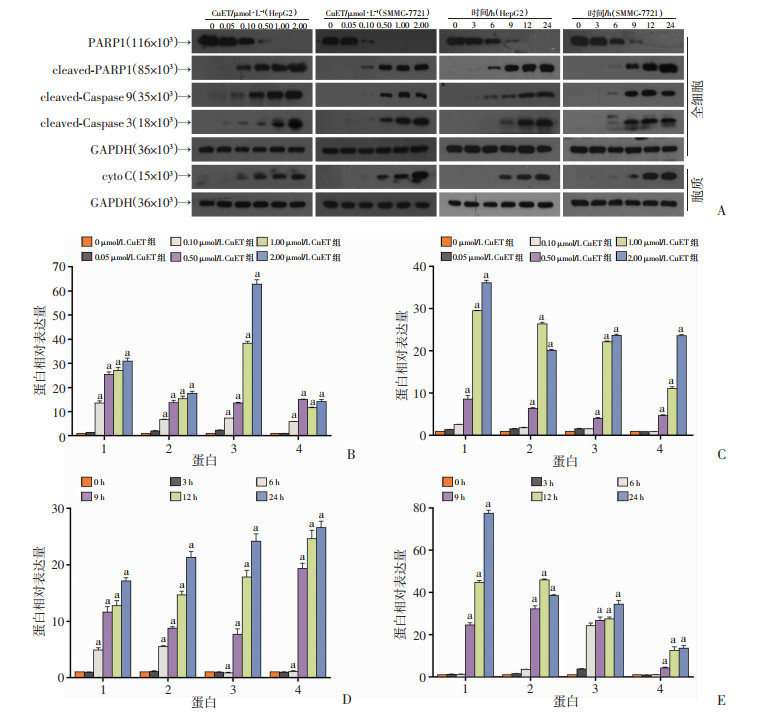
|
|
1:cleaved-PARP1;2:cleaved-Caspase 9;3:cleaved-Caspase 3;4:cyto C;a:P < 0.01,与各自空白对照比较 A:Western blot检测结果;B:HepG2量效组Western blot半定量分析;C:SMMC-7721量效组Western blot半定量分析;D:HepG2时效组Western blot半定量分析;E:SMMC-7721时效组Western blot半定量分析 图 4 CuET对肝癌细胞HepG2和SMMC-7721凋亡相关蛋白的影响 |
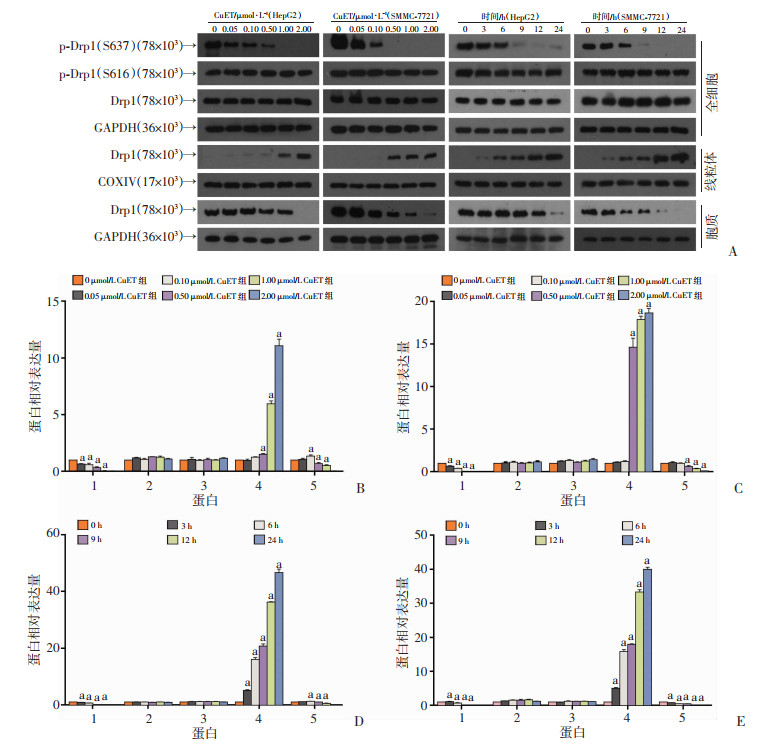
2.4 CuET对线粒体分裂关键蛋白Drp1的影响
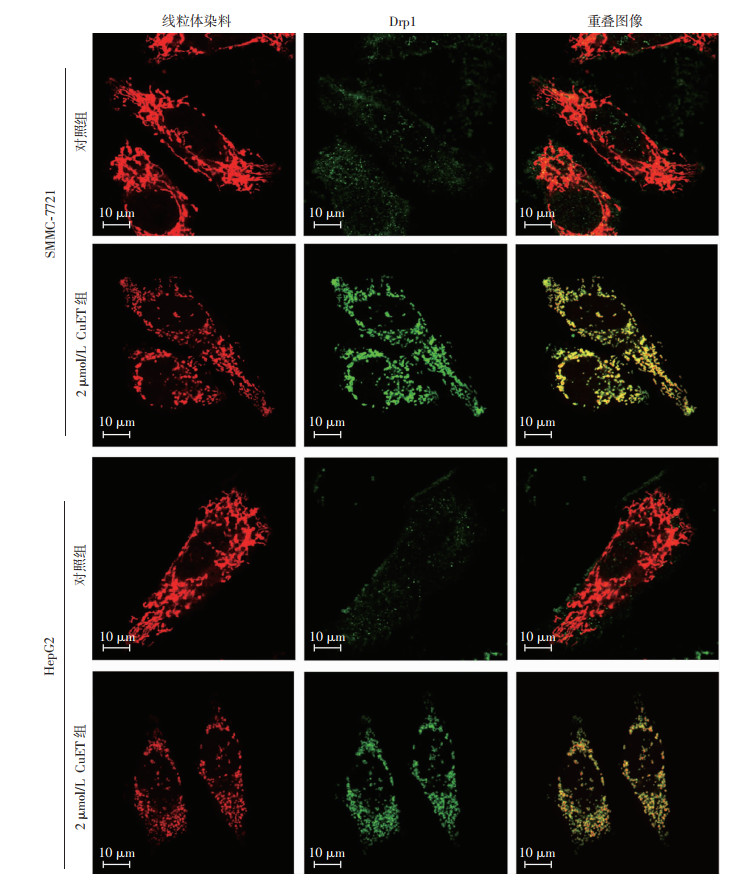
线粒体的过度分裂会导致线粒体膜通透性增高,进而引起Caspase活化的细胞色素C等物质释放,启动细胞凋亡的级联反应,最终引起细胞凋亡的发生,因此,过度的线粒体分裂与细胞凋亡之间存在一定的因果关系,而Drp1(dynamin-related protein 1)是线粒体分裂的关键蛋白。那么,CuET是否会影响Drp1的蛋白修饰和线粒体转位呢?为证实这一猜想,利用Western blot检测Drp1磷酸化状态的变化和其线粒体转位的变化(图 5),结果可见CuET给药处理后可显著减少Drp1在Ser637位点上的磷酸化,而对Ser616位点的磷酸化状态没有显著影响,进一步提取线粒体蛋白及胞质蛋白,Western blot检测Drp1的变化情况,发现CuET可使Drp1在线粒体上的表达明显增多,在胞质中的表达明显降低,说明CuET可使Drp1 S637发生去磷酸化及线粒体转位。此外,采用免疫荧光分别染色线粒体和Drp1蛋白,激光共聚焦观察发现,正常情况下,Drp1的蛋白的绿色荧光和线粒体的红色荧光很少共定位,而经CuET(2 μmol/L,24 h)处理后,可见Drp1蛋白的绿色荧光和线粒体的红色荧光出现明显的重叠,呈现黄色荧光共定位(图 6)。由此,进一步证明CuET处理后,可使胞质内Drp1转位到线粒体上。
|
|
1:p-Drp1(S637);2:p-Drp1(S616);3:全细胞Drp1;4:线粒体Drp1;5:胞质Drp1;a:P < 0.01,与各自空白对照比较 A:Western blot检测结果;B:HepG2量效组Western blot半定量分析;C:SMMC-7721量效组Western blot半定量分析;D:HepG2时效组Western blot半定量分析;E:SMMC-7721时效组Western blot半定量分析 图 5 CuET对线粒体分裂关键蛋白Drp1的影响 |
|
| 图 6 激光共聚焦检测Drp1线粒体转位 |
2.5 CuET通过影响线粒体分裂关键蛋白Drp1的转位促进肝癌细胞HepG2和SMMC-7721凋亡的发生
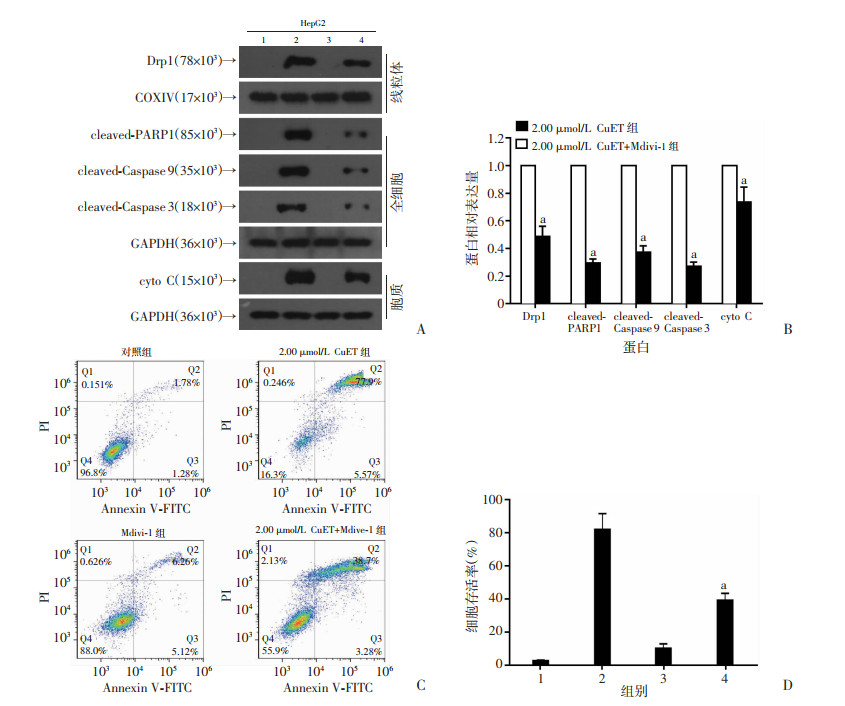
提取线粒体蛋白,Western blot检测发现,Mdivi-1(1 μmol/L)预处理后,可以明显阻断CuET诱导的Drp1线粒体转位(图 7A、B)。进一步通过Annexin V-FITC和PI双染,流式细胞术检测细胞凋亡率发现,细胞经Mdivi-1预处理后,可以明显阻断CuET诱导的细胞凋亡(图 7C、D)。进一步提取全细胞蛋白、线粒体蛋白和胞质蛋白,Western blot检测凋亡相关蛋白变化情况。研究结果表明,细胞经Mdivi-1预处理后可明显阻断CuET诱导的cleaved-PARP1、cleaved-Caspase 3、cleaved-Caspase 9表达增加以及细胞色素C的释放(图 7A、B)。以上结果说明,CuET通过使Drp1发生线粒体转位,导致线粒体发生过度分裂从而诱导肝癌细胞发生凋亡。
|
|
1:对照组;2:2.00 μmol/L CuET组;3:Mdivi-1组;4:2.00 μmol/L CuET+Mdivi-1组;a:P < 0.01,与2.00 μmol/L CuET组比较 A:Western blot检测结果;B:图A中2、4组蛋白表达半定量分析;C:抑制Drp1线粒体转位对CuET诱导的细胞凋亡的影响;D:细胞凋亡统计分析 图 7 抑制Drp1线粒体转位对CuET诱导的细胞凋亡的影响 |
3 讨论
原发性肝癌是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因[12]。2015年流行病学报告显示,我国新增46.6万肝癌病例和42.1万死亡病例[13],已逐步发展成为威胁国民健康的重大隐患[14-15]。目前,针对不能手术切除和消融的Ⅱb期、Ⅲ期、Ⅳ期肝癌患者,临床上主要考虑化学药物的系统治疗,代表药物有索拉菲尼、仑伐替尼等,但索拉菲尼在治疗开始后的2~6周内,可能出现腹泻、手足综合征、皮疹、心肌缺血以及高血压等不良反应,严重影响药物的疗效及患者用药的依从性[16-17]。
肿瘤细胞异常增殖和凋亡失衡在肿瘤发生、发展过程中发挥着重要作用,针对这个环节,对其进行干预性调节成为干预肿瘤发生、发展的重要治疗策略。由线粒体介导的内源性凋亡通路是哺乳动物细胞程序性死亡的主要途径。当细胞受到诸如DNA损伤、ATP耗竭等的凋亡刺激时,可导致线粒体膜肿胀,通透性增高,释放内部的凋亡相关的活性物质,如细胞色素C、激活下游的Caspase家族、激活后的Caspase切割特异性底物,最终导致细胞凋亡。线粒体的分裂-融合状态影响这一过程的开展[18-20]。
双硫仑作为经典的治疗酒精依赖的药物,近年来因为在候选抗癌药物大规模筛选中展现出一定的抗癌活性而焕发出新的活力。双硫仑的抗肿瘤活性离不开Cu2+的辅助,即与之形成螯合物CuET。有研究表明,CuET可诱导肿瘤细胞产生活性氧化物触发氧化应激[21-22],或调节肿瘤细胞内凋亡相关信号通路[23],或者通过改变乙醛脱氢酶(aldehyde dehydrogenase, ALDH)的活性[24],或抑制泛素-蛋白酶体系统[11],最终导致肿瘤细胞死亡,发挥抗肿瘤作用。此外,DSF还可通过抑制P-糖蛋白多药外排泵和抑制NF-κB的激活来逆转化疗药物的耐药[25-26]。本研究证明CuET能抑制肝癌细胞增殖,显著诱导肝癌细胞凋亡的发生,且导致线粒体内容物细胞色素C释放至胞质中,说明由线粒体介导的内源性凋亡通路参与了CuET诱导的细胞凋亡过程。
Drp1是调节细胞线粒体分裂的关键分子,正常情况下Drp1蛋白主要以去磷酸化的抑制状态定位于细胞质,在细胞凋亡过程中,Drp1蛋白可去磷酸化激活,转位至线粒体外膜,缢裂线粒体[27]。Drp1从胞质转位到线粒体并调控线粒体分裂,与线粒体细胞色素C释放和Caspase激活密切相关。本研究检测到Drp1的Ser637位磷酸化水平降低,其线粒体转位增加,说明线粒体途径参与CuET诱导的细胞凋亡。
综上所述,双硫仑与铜离子形成的螯合物(CuET)能抑制肝癌细胞增殖并诱导其发生凋亡,其可能的机制为CuET减少线粒体分裂关键蛋白Drp1在Ser 637位点上的磷酸化修饰水平,削弱了其对Drp1线粒体转位的抑制作用,从而导致线粒体过度分裂,线粒体膜通透性增高,凋亡活性物质细胞色素C释放至胞质中,从而激活下游的Caspase家族,进而促进肝癌细胞HepG2和SMMC-7721凋亡的发生。
| [1] |
HIROKAWA F, HAYASHI M, ASAKUMA M, et al. Risk factors and patterns of early recurrence after curative hepatectomy for hepatocellular carcinoma[J]. Surg Oncol, 2016, 25(1): 24-29. DOI:10.1016/j.suronc.2015.12.002 |
| [2] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
COLLINS F S. Mining for therapeutic gold[J]. Nat Rev Drug Discov, 2011, 10(6): 397. DOI:10.1038/nrd3461 |
| [4] |
WRIGHT C, MOORE R D. Disulfiram treatment of alcoholism[J]. Am J Med, 1990, 88(6): 647-655. DOI:10.1016/0002-9343(90)90534-k |
| [5] |
CVEK B. Nonprofit drugs as the salvation of the world's healthcare systems: the case of Antabuse (disulfiram)[J]. Drug Discov Today, 2012, 17(9/10): 409-412. DOI:10.1016/j.drudis.2011.12.010 |
| [6] |
ILJIN K, KETOLA K, VAINIO P, et al. High-throughput cell-based screening of 4910 known drugs and drug-like small molecules identifies disulfiram as an inhibitor of prostate cancer cell growth[J]. Clin Cancer Res, 2009, 15(19): 6070-6078. DOI:10.1158/1078-0432.ccr-09-1035 |
| [7] |
CHEN D, CUI Q C, YANG H, et al. Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity[J]. Cancer Res, 2006, 66(21): 10425-10433. DOI:10.1158/0008-5472.can-06-2126 |
| [8] |
ZHA J, CHEN F L, DONG H J, et al. Disulfiram targeting lymphoid malignant cell lines via ROS-JNK activation as well as Nrf2 and NF-kB pathway inhibition[J]. J Transl Med, 2014, 12(1): 1-9. DOI:10.1186/1479-5876-12-163 |
| [9] |
SAFI R, NELSON E R, CHITNENI S K, et al. Copper signaling axis as a target for prostate cancer therapeutics[J]. Cancer Res, 2014, 74(20): 5819-5831. DOI:10.1158/0008-5472.can-13-3527 |
| [10] |
DUFOUR P, LANG J M, GIRON C, et al. Sodium dithiocarb as adjuvant immunotherapy for high risk breast cancer: a randomized study[J]. Biotherapy, 1993, 6(1): 9-12. DOI:10.1007/bf01877380 |
| [11] |
SKROTT Z, MISTRIK M, ANDERSEN K K, et al. Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4[J]. Nature, 2017, 552(7684): 194-199. DOI:10.1038/nature25016 |
| [12] |
ZHOU M, WANG H, ZENG X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/s0140-6736(19)30427-1 |
| [13] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [14] |
WANG F S, FAN J G, ZHANG Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014, 60(6): 2099-2108. DOI:10.1002/hep.27406 |
| [15] |
FU J, WANG H. Precision diagnosis and treatment of liver cancer in China[J]. Cancer Lett, 2018, 412: 283-288. DOI:10.1016/j.canlet.2017.10.008 |
| [16] |
VOGEL A, CERVANTES A, CHAU I, et al. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29: ⅳ238-ⅳ255. DOI:10.1093/annonc/mdy308 |
| [17] |
European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI:10.1016/j.jhep.2018.03.019 |
| [18] |
ESTAQUIER J, ARNOULT D. Inhibiting Drp1-mediated mitochondrial fission selectively prevents the release of cytochrome C during apoptosis[J]. Cell Death Differ, 2007, 14(6): 1086-1094. DOI:10.1038/sj.cdd.4402107 |
| [19] |
BROOKS C, CHO S G, WANG C Y, et al. Fragmented mitochondria are sensitized to Bax insertion and activation during apoptosis[J]. Am J Physiol-Cell Physiol, 2011, 300(3): C447-C455. DOI:10.1152/ajpcell.00402.2010 |
| [20] |
WAI T, LANGER T. Mitochondrial dynamics and metabolic regulation[J]. Trends Endocrinol Metab, 2016, 27(2): 105-117. DOI:10.1016/j.tem.2015.12.001 |
| [21] |
XU B, WANG S, LI R, et al. Disulfiram/copper selectively eradicates AML leukemia stem cells in vitro and in vivo by simultaneous induction of ROS-JNK and inhibition of NF-κB and Nrf2[J]. Cell Death Dis, 2017, 8(5): e2797. DOI:10.1038/cddis.2017.176 |
| [22] |
SHAH O'BRIEN P, XI Y, MILLER J R, et al. Disulfiram (antabuse) activates ROS-dependent ER stress and apoptosis in oral cavity squamous cell carcinoma[J]. J Clin Med, 2019, 8(5): 611. DOI:10.3390/jcm8050611 |
| [23] |
KIM J Y, CHO Y, OH E, et al. Disulfiram targets cancer stem-like properties and the HER2/Akt signaling pathway in HER2-positive breast cancer[J]. Cancer Lett, 2016, 379(1): 39-48. DOI:10.1016/j.canlet.2016.05.026 |
| [24] |
CHOI S A, CHOI J W, WANG K C, et al. Disulfiram modulates stemness and metabolism of brain tumor initiating cells in atypical teratoid/rhabdoid tumors[J]. Neuro-Oncol, 2015, 17(6): 810-821. DOI:10.1093/neuonc/nou305 |
| [25] |
LOO T W. Blockage of drug resistance in vitro by disulfiram, a drug used to treat alcoholism[J]. J Natl Cancer Inst, 2000, 92(11): 898-902. DOI:10.1093/jnci/92.11.898 |
| [26] |
SONG W, TANG Z, SHEN N, et al. Combining disulfiram and poly(l-glutamic acid)-cisplatin conjugates for combating cisplatin resistance[J]. J Control Release, 2016, 231: 94-102. DOI:10.1016/j.jconrel.2016.02.039 |
| [27] |
KESHAMOUNI V G, MICHAILIDIS G, GRASSO C S, et al. Differential protein expression profiling by iTRAQ-2DLC-MS/MS of lung cancer cells undergoing epithelial-mesenchymal transition reveals a migratory/invasive phenotype[J]. J Proteome Res, 2006, 5(5): 1143-1154. DOI:10.1021/pr050455t |



