随着经皮冠状动脉介入术(percutaneous coronary intervention,PCI)的普及,冠心病心肌梗死的发病率、死亡率显著下降。但是,由于支架植入等机械性的操作引起血管内皮细胞损伤、迟发性血栓形成等仍旧影响着冠心病患者预后。其中,支架内再狭窄的影响甚为重要。研究发现,支架内再狭窄的主要发生机制为新生内膜增生及新生动脉粥样硬化,而平滑肌细胞(vascular smooth muscle cells,VSMCs)的过度增殖、迁移是PCI术后再狭窄的主要病理生理基础。研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)通过向免疫炎症细胞和内皮细胞等内源性细胞群传递细胞信号进行细胞通讯来促进组织愈合,而外泌体(exosomes)在其中发挥关键作用[1-2]。BMSCs源外泌体在动脉粥样硬化、肺动脉高压、缺血再灌注损伤等疾病中发挥重要作用[3-4],通过将其内容物递送至靶细胞,进而调控其生物学行为。外泌体作为细胞通讯的重要介质,是由活细胞分泌的直径为30~150 nm的细胞外囊泡,其中包含大量的非编码RNA分子。结果显示,在支架内再狭窄过程中,受损血管中血管平滑肌细胞或内皮细胞中某些非编码RNA表达水平发生变化,调控细胞增殖、迁移及新生内膜形成[5]。长链非编码RNA(long non-coding RNAs,lncRNAs)是长度超过200 nt的非编码RNA。众多研究表明,lncRNAs在包括细胞增殖、凋亡、迁移、炎症在内的病理生理过程中发挥关键作用[6]。然而,BMSCs源外泌体在PCI术后血管再狭窄中发挥的作用如何?其是否能调控受损血管中lncRNAs的表达?目前尚未完全阐明。因此,本研究将BMSCs源外泌体作用于球囊损伤后颈动脉组织以评估内膜增生情况。同时,利用Arraystar大鼠lncRNA芯片,分析大鼠颈动脉球囊损伤后颈动脉组织中lncRNAs的差异表达情况及BMSCs源外泌体的调控作用。
1 材料与方法 1.1 实验动物与分组雄性SD大鼠46只,购自陆军军医大学实验动物中心,体质量(200±20)g,合格证号:SCXK(渝)2017-0005。其中10只用于BMSCs源外泌体的提取,36只采用随机数字表法分为3组(n=12):①假手术组,只分离左颈总动脉血管;②损伤组,采用球囊损伤左颈总动脉建立大鼠颈动脉球囊损伤模型;③外泌体组,建立大鼠颈动脉球囊损伤模型后原位注射外泌体400 μL。假手术组大鼠其余各组大鼠的。建模14 d后,取颈动脉组织进行后续试验。
1.2 主要试剂及仪器Arraystar大鼠lncRNA V2.0芯片(上海康成);逆转录试剂盒及扩增试剂盒均购自日本TaKaRa公司;苏木精和伊红均购自美国Sigma公司,兔抗大鼠的CD63、HSP70、Alix、Cyclin D1、PCNA、GAPDH一抗及羊抗兔二抗均购自博士德生物公司。2.0×12.0 mm球囊导管购自美国Baxter Healthcare公司;倒置显微镜购自日本Olympas公司;Real-time PCR仪、凝胶成像系统均购自美国Bio-Rad公司。
1.3 方法 1.3.1 BMSCs来源外泌体的提取大鼠BMSCs的分离培养鉴定参考本课题组前期研究步骤[7-8]。无外泌体血清的制备:4 ℃,100 000×g超速离心去除胎牛血清来源的外泌体,过夜;离心后,吸取上层血清,0.22 μm滤膜过滤后备用。外泌体提取:无外泌体血清培养BMSCs 24 h后,收集细胞上清液后,4 ℃,300×g离心10 min以去除细胞沉淀,2 000×g离心10 min以去除死细胞,10 000×g离心30 min,去除亚细胞结构如细胞器等;小心地将去除沉淀的上清液转移至30 mL超速离心管中。4 ℃,100 000×g,140 min超速离心;弃上清液,沉淀即外泌体,PBS重悬外泌体,在相同的超速离心条件下(4 ℃,100 000×g,140 min)洗涤1次;小心弃掉上层清液,采用100 μL PBS重悬外泌体,测定蛋白浓度,过滤分装后备用。
1.3.2 透射电镜(TEM)观察外泌体形态提取的外泌体按照1:10的比例稀释后置入2.5%~3%戊二醛固定液中4 ℃固定;滴加在超薄的碳膜铜网上,静置5 min后吸干表面液体;在样本表面滴一滴1%磷钨酸(PTA)进行负染,静置3 min后吸干表面液体,待样本完全干燥后,透射电镜观察外泌体的形态、拍照。
1.3.3 Western blot检测外泌体表面标记蛋白CD63、HSP70、Alix的表达提取外泌体及细胞碎片中的蛋白,按BCA蛋白定量试剂盒说明书测定蛋白浓度,煮沸变性蛋白。等体积于SDS-PAGE凝胶,80 V,55 min跑浓缩胶,120 V跑分离胶至底部出现溴酚蓝,300 mA,1 h转膜,封闭1 h,CD63(1:300)、HSP70(1:300)、Alix(1:300)一抗孵育4 ℃过夜,二抗(1:2 000)室温孵育1 h,用凝胶成像系统检测灰度值,实验重复3次。
1.3.4 建立大鼠颈动脉球囊损伤模型选取体质量200~250 g的雄性SD大鼠,10%水合氯醛(0.03 mL/kg)腹腔注射进行麻醉,肝素钠100 U/kg腹腔注射抗凝。头颈部备皮,碘伏消毒,皮肤正中直切口。钝性分离皮下组织。充分暴露左颈总动脉,暴露左侧颈内动脉和颈外动脉。6-0丝线结扎颈外动脉远端,血管夹夹闭颈总动脉和颈内动脉。剪开颈外动脉远端。将2.0×12.0 mm球囊由颈外动脉切口插入颈总动脉,松开颈总动脉。球囊充气至3.0个大气压,顺时针及逆时针各旋转球囊3次造成颈总动脉内皮损伤。取出球囊导管,结扎颈外动脉,松开颈内动脉血管夹。恢复颈内动脉血流;外泌体组在球囊损伤模型完成后,即可原位注射0.25 μg/μL外泌体400 μL,夹闭血管5 min后,松开血管夹,即外泌体处理组。术后见颈总、颈内动脉血流通畅,搏动良好。逐层缝合肌肉、皮肤,单笼饲养。术后予青霉素(20万IU)腹腔注射预防感染,连续给药3 d,每天1次。喂食普通饲料,自由饮水。
1.3.5 HE染色检测病理变化各组大鼠饲养14 d后,取各组颈总动脉组织,取血管不同切面的切片3张,石蜡包埋,加入二甲苯Ⅰ、Ⅱ各10 min;100%、95%、80%、70%无水乙醇中各2 min脱蜡至水;ddH2O冲洗5 min;苏木精染色5 min;于1%盐酸酒精分化40 s;ddH2O冲洗;伊红染色3 min。于70%、80%、95%、100%无水乙醇中各2 min脱蜡至水;二甲苯Ⅰ、Ⅱ各10 min;中性树胶封片,显微镜拍照,通过Image J软件测量内膜/中膜面积比(intima/media,I/M)。
1.3.6 Western blot检测各组增殖及表型转化相关蛋白的变化提取各组颈动脉组织,加入蛋白裂解液,冰上裂解90 min提取组织蛋白并测定浓度,煮沸变性,等体积加于SDS-PAGE凝胶中,80 V,55 min跑浓缩胶,120 V跑分离胶至底部出现溴酚蓝,300 mA、1 h转膜,封闭1 h,Cyclin D1(1:300)、PCNA(1:300)、GAPDH(1:300)一抗孵育4 ℃过夜,二抗(1:2000)室温孵育1 h,用凝胶成像系统检测灰度值,实验重复3次。
1.3.7 lncRNA-mRNA共表达谱芯片检测标本球囊损伤后14 d,取假手术组及损伤组颈动脉组织送康成公司行lncRNA-mRNA共表达谱芯片分析,每组各3次重复实验。
1.3.8 lncRNA-mRNA共表达谱芯片结果数据分析使用Agilent Feature Extraction软件v11.0.1.1获得芯片原始数据。使用GeneSpring GX v12.1软件(Agilent Technologies)对原始数据进行Quantile标准化并筛选高质量探针。以P-value/FDR < 0.05及Fold Change≥2为标准筛选两组差异表达的lncRNAs和mRNAs。GO收集来自Gene Ontology和NCBI数据库的信息,根据生物过程,分子功能和细胞定位对基因进行注释和分类。KEGG是一个用于系统分析基因功能的综合数据库。对靶基因进行GO分析;采用KEGG对靶基因进行通路分析。应用Cytoscape软件生成lncRNA-mRNA共表达网络图。
1.3.9 采用qRT-PCR检测各组中lncRNAs的差异性变化选取U6作为内参基因进行qRT-PCR验证芯片数据。收集各组颈动脉组织,提取总RNA,制成cDNA,配成20 μL扩增体系。反应条件如下:预变性(1个循环),95℃× 30 s;扩增反应(45个循环):95 ℃× 5 s变性,62 ℃×30 s退火、延伸;溶解,55~95 ℃,每0.5 ℃ 10 s(81个循环)。扩增反应结束后,用Image Lab软件进行自动分析并计算结果,按表格中Quantity列下的Ct值采用2-△△Ct法进行计算比较。实验重复3次。
1.4 统计学分析使用GraphPad Prism 7进行分析。数据以x±s表示,多组间比较采用完全随机设计的单因素方差分析,组间两两比较用q检验,相关分析采用直线相关分析。检验水准α=0.05。
2 结果 2.1 BMSCs源外泌体的鉴定透射电镜观察到,BMSCs源外泌体呈现“茶杯垫样”有脂质膜包裹的囊泡状结构(图 1A)。Western blot结果显示,与细胞碎片(cell lysis)组相比,外泌体组中Alix、HSP70、CD63等特征性蛋白呈阳性表达(图 1B)。提示所提取外泌体符合国际外泌体囊泡协会标准。
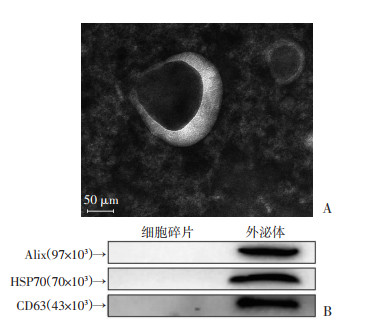
|
| A:BMSCs源外泌体呈现椭圆形盘状的囊泡状结构;B:Western blot检测BMSCs源外泌体表面标记蛋白Alix、HSP70以及CD63的表达 图 1 电镜观察BMSCs源外泌体形态 |
2.2 BMSCs源外泌体抑制大鼠颈动脉球囊损伤后内膜增生
HE染色结果显示:损伤组中内膜/中膜面积比(I/M)为2.656±0.393,较假手术组显著增加(P < 0.05,图 2);外泌体组I/M为0.866± 0.046,较损伤组明显下降(P < 0.05,图 2)。
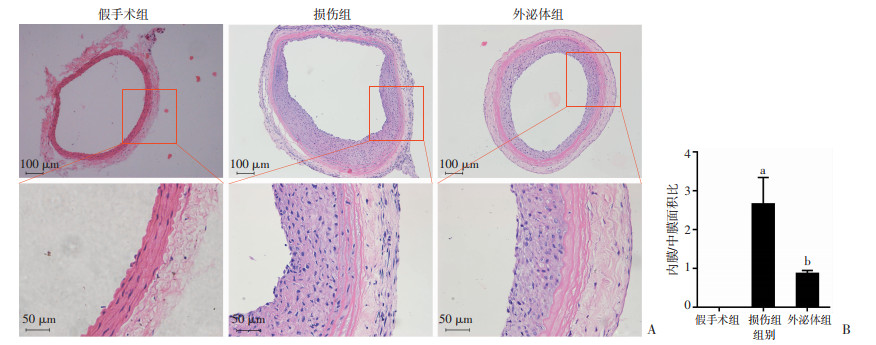
|
| A:HE染色观察各组内膜变化;B:各组内膜/中膜面积比(n=3) a:P < 0.05,与假手术组比较;b:P < 0.05,与损伤组比较 图 2 球囊损伤14 d后HE染色评估外泌体对大鼠颈动脉内膜增生的影响 |
2.3 BMSCs源外泌体抑制平滑肌细胞表型转化及细胞增殖
Western blot结果显示:损伤组中细胞周期蛋白Cyclin D1、增殖细胞核抗原PCNA表达较假手术组显著上调;与损伤组相比,外泌体组中PCNA、Cyclin D1表达显著下调,差异均有统计学意义(P < 0.05,图 3)。
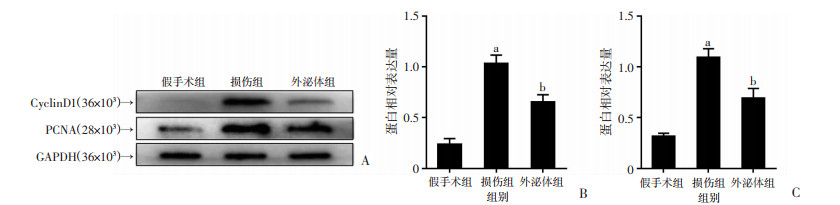
|
| A:Western blot检测各组的增殖相关蛋白表达;B、C:分别为各组Cyclin D1和PCNA蛋白半定量分析(n=3)a:P < 0.05,与假手术组比较;b:P < 0.05,与损伤组比较 图 3 球囊损伤14 d后外泌体对增殖蛋白表达的影响 |
2.4 球囊损伤后lncRNA-mRNA表达谱的变化
lncRNAs表达谱结果显示:与假手术组相比,损伤组差异性表达的lncRNAs共1 712条,按照Fold Change>2.0、P < 0.05为标准,其中1 083条表达上调,XR_600374的上调最为显著(Fold Change=101.066 175 6);629条表达下调,XR_594173下调最为显著(Fold Change=64.595 125 7),见图 4A、C。而在mRNAs表达谱结果显示:与假手术组相比,损伤组颈动脉组织中差异性表达的mRNAs共有4 491条,其中2 004条表达上调,2 487条表达下调(Fold Change>2.0、P < 0.05);其中,IL-6上调最为显著(Fold Change=678.531 743 5),Pkhd1l1下调最为显著(Fold Change=177.780 983 1),见图 4B、D。
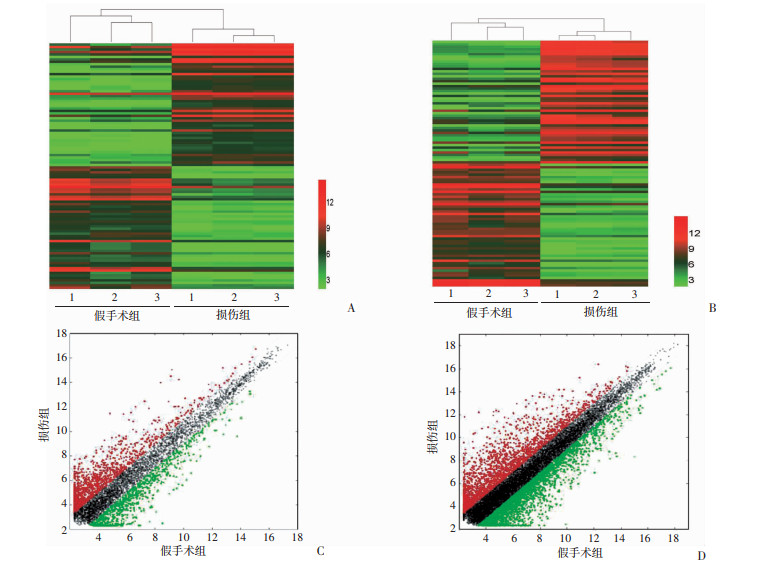
|
| A、B:两组中差异性表达的lncRNAs(A)与mRNAs(B)的聚类分析图;C、D:两组中差异性表达的lncRNAs(C)和mRNAs(D)的散点图;红色显示表达差异呈上升趋势的RNA分布情况,绿色显示表达差异呈下调趋势的RNA分布情况,黑色显示表达差异无统计学意义的基因分布情况 图 4 两组差异表达的lncRNA-mRNA聚类分析图 |
2.5 差异表达mRNAs生物学功能分析 2.5.1 差异表达mRNAs的GO分析
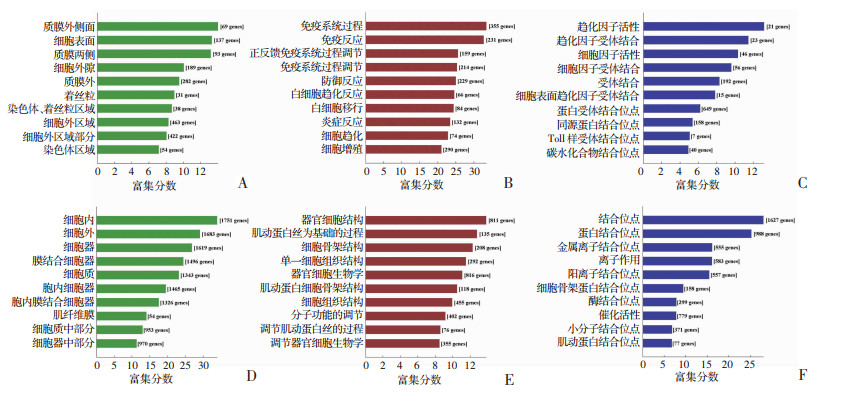
对差异表达的mRNAs从细胞组件(cellular component,CC)、分子功能(molecular function,MF)、生物学进程(biological process,BP)三方面进行GO分析。结果显示:差异性表达的mRNAs参与包括细胞质膜外侧面、细胞质膜、细胞外基质、染色体等亚细胞部位(图 5A、D)。差异性表达的mRNAs在生物学进程方面主要有:免疫相关功能调节、防御反应、白细胞迁移、趋化、炎症反应、细胞组分组织或结合进程、肌动蛋白肌丝调节、细胞骨架组织等(图 5B、E)。差异性表达的mRNAs参与的分子功能主要有:趋化功能、细胞因子调控、受体蛋白结合、糖类结合、离子结合、催化活性等(图 5C、F)。
|
| A、D:分别为细胞组件方面差异性上调和下调的mRNAs;B、E:分别为生物学进程方面差异性上调和下调的mRNAs;C、F:分别为分子功能方面差异性上调和下调的mRNAs 图 5 GO分析差异性上调和下调mRNAs富集的Top10分子功能 |
2.5.2 差异性mRNAs的KEGG Pathway分析
差异mRNAs分别富集到了KEGG Pathway数据库的146条生物学通路中。上调的mRNAs主要富集在肌动蛋白细胞骨架的调节、血管平滑肌收缩和过氧化物酶体等方面,而下调的mRNAs主要富集在细胞因子受体相互作用、趋化因子信号通路和细胞周期等方面,而其中包括血管平滑肌收缩、肌动蛋白肌丝调节、细胞周期等广泛报道的与球囊损伤后内膜增生相关的通路(图 6)。

|
| A:差异性上调的mRNAs通路;B:差异性下调的mRNAs通路基因数为富集到该通路的mRNAs靶基因数量 图 6 差异表达的mRNAs靶基因富集的Top10信号通路 |
2.6 BMSCs源外泌体可能通过XR_602080、XR_602012、XR_591017调控球囊损伤后血管内膜增殖
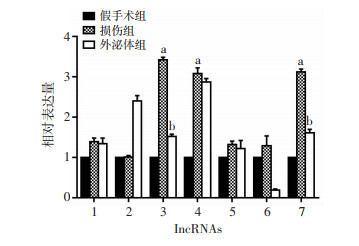
结合生物信息学分析,综合考虑lncRNAs在假手术组大鼠及球囊损伤后大鼠颈动脉中的表达倍数、表达量及P值,再结合文献报道与内膜增生、炎症相关的lncRNAs及其靶基因。在差异lncRNAs里选取7个作为候选lncRNAs进行qRT-PCR验证,且均在损伤组中表达上调。qRT-PCR结果显示:10例球囊损伤大鼠颈动脉上述lncRNAs检测发现XR_591265、XR_602080、ENSRNOT00000029509、XR_601081、XR_602012、XR_591017均存在差异表达,且表达趋势和芯片结果相同,可作为候选lncRNAs。XR_593268在损伤组大鼠双侧颈动脉中的表达无差异(P>0.05)。而外泌体组相比损伤组,XR_593268上调(P < 0.05),XR_602080、XR_602012、XR_591017均发生下调(P < 0.05,图 7)。提示,BMSCs源外泌体调控球囊损伤后血管内膜增殖及再内皮化可能通过XR_602080、XR_602012、XR_591017发挥作用。
|
| 1:XR_591265;2:XR_593268;3:XR_602080;4:ENSRNOT00000029509;5:XR_601081;6:XR_602012;7:XR_591017;a:P < 0.05,与假手术组比较;b:P < 0.05,与损伤组比较 图 7 qRT-PCR检测各组大鼠颈动脉组织中7个候选lncRNAs的表达(n=10) |
2.7 基因共表达网络分析XR_602080、XR_591017与细胞周期调控相关
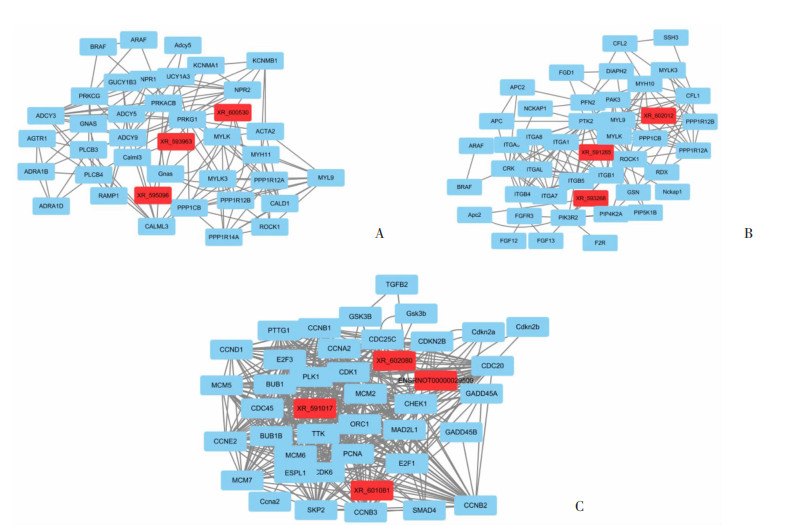
采用lncRNA-mRNA共表达谱分析,通过关联GO和KEGG对应的mRNAs来研究lncRNAs的功能。按功能将GO和KEGG pathway分为3大类:血管平滑肌收缩、肌动蛋白细胞骨架的调节和细胞周期。lncRNA-mRNA共表达谱分析结果表明,与血管平滑肌收缩调节有潜在作用关系的mRNAs主要包括Adcy5、Gnas、Calml3等,而与这些mRNAs有直接相邻的lncRNAs包括XR_595096、XR_600530、XR_593963等。与肌动蛋白细胞骨架的调节过程有潜在作用关系的mRNAs主要包括Apc2、PPP1R12B、PPP1R12A、Nckap1等,而与这些mRNAs有直接相邻的lncRNAs包括XR_593268、XR_602012、XR_591265等。与细胞周期调节过程有潜在作用关系的mRNAs主要包括Gsk3b、Cdkn2b、Ccna2等,而与这些mRNAs有直接相邻的lncRNAs包括XR_602080、XR_601081、XR_591017、ENSRNOT00000029509等。本研究筛选出所有与上述mRNAs直接相邻的lncRNAs,分别构建以lncRNAs为中心的lncRNA-mRNA共表达谱网络(图 8)。
|
| A:血管平滑肌收缩;B:肌动蛋白细胞骨架的调节;C:细胞周期 图 8 血管再狭窄相关lncRNA-mRNA共表达谱网络 |
3 讨论
冠心病PCI术的出现极大地改善了患者的预后及生活质量,同时也带来支架内再狭窄的问题。其病理生理机制包括:血管内皮细胞损伤脱落、炎症、平滑肌细胞过度增生[9]。研究表明,血管平滑肌细胞过度增殖与迁移在支架内再狭窄中占据重要地位。生理状态下, VMSCs以收缩表型为主。血管损伤等各种因素刺激后,其由收缩表型转化为合成表型,合成和分泌多种血管活性物质。此阶段VSMCs增殖、迁移能力显著增强,导致新生内膜增生,最终引起血管壁增厚,管腔狭窄[10]。目前,引起VSMCs增殖、迁移的分子机制尚未完全明确,仍缺乏有效的干预措施。
外泌体作为由脂质双分子包裹的微囊泡结构,广泛存在于生物体体液、尿液、唾液及血液中。外泌体内携带大量蛋白质、脂质及核酸,参与机体炎症、免疫、血管再生等多种病理生理过程[11-12]。研究结果显示,VMSCs可摄取间充质干细胞所分泌的外泌体,通过调控细胞凋亡基因的变化,促进平滑肌细胞增殖[13]。而本研究结果显示BMSCs源外泌体可显著抑制大鼠球囊损伤后新生内膜增生。那么,其具体分子机制如何呢?
外泌体可通过囊泡结构包裹微小非编码RNA (microRNAs,miRNAs),抑制其降解,并将其传递至其他细胞或血液、体液中,进而发挥生物学效应。除miRNAs外,外泌体中富含多种lncRNAs。研究表明,lncRNAs与心衰[14]、动脉粥样硬化[15]、心肌梗死[16]、缺血再灌注损伤[17]、心脏发育[18]、心肌肥厚[19]等的发生、发展密切相关,认为lncRNAs可作为诊断心血管疾病的新型生物标记物。其中心衰相关的有H19-AS、DGCRS、HOTAIR、LIPCAR[20-22];冠状动脉疾病相关的有ANRIL[23];心肌梗死相关的有MIAT、APF、ANRIL、MIRT1、MIRT2[24-27];动脉粥样硬化相关的有DYN-LRB2-2、RPS-833A20.1[28];心肌肥厚相关的有HRF、MHRT[29-30];心脏发育相关的有BVHT、TERMINATOR、ALIEN、FENDRR等[31]。那么,外泌体中的lncRNAs是否参与平滑肌细胞增殖、迁移的调节与调控呢?
本研究通过送检大鼠颈动脉组织lncRNAs测序及聚类分析,得到假手术组、损伤组中差异性表达的lncRNAs:XR_595298、XR_589283、XR_592702、XR_595502、ENSRNOT00000077007、XR_593112、XR_338773等,并通过GO及KEGG等生物信息学方法分析其对应靶基因富集的生物学过程及可能参与的通路;随后,通过qRT-PCR分别检测假手术组、损伤组、外泌体组中上述差异性表达的lncRNAs,进一步筛选出外泌体处理后有差异性表达的lncRNAs:XR_593268上调,XR_602080、XR_602012、XR_591017下调。其中,XR_593268在外泌体处理后表达上调。这可能是由于BMSCs源外泌体中富含XR_593268,并将其传递至靶细胞所致,具体机制仍需进一步探究。综上,对假手术组、损伤组及外泌体组行qRT-PCR验证后,筛选出参与外泌体调控内膜增生的相关lncRNAs可能为XR_602080、XR_591017。
lncRNA-mRNA共表达芯片分析发现球囊损伤后大鼠颈动脉组织中lncRNAs和mRNAs表达水平的改变。GO分析结果发现,上调的转录本多与免疫系统进程、炎症反应、细胞趋化和细胞增殖等有关;而下调的转录本多与肌动蛋白肌丝调节和分子功能调节等有关。KEGG通路分析发现,上调的转录本主要富集在肌动蛋白细胞骨架的调节、血管平滑肌收缩和过氧化物酶体等方面,而下调的转录本主要富集在细胞因子受体相互作用、趋化因子信号通路和细胞周期等方面,而其中包括血管平滑肌收缩(35个靶基因)、肌动蛋白细胞骨架调节(41个靶基因)、细胞周期(34个靶基因)等广泛报道的与球囊损伤后内膜增生相关的通路。这表明,差异表达的lncRNAs和mRNAs可能参与球囊损伤后血管再狭窄进程。
按功能将GO和KEGG分为血管平滑肌收缩、肌动蛋白细胞骨架调节和细胞周期三大类进行编码-非编码基因共表达生物信息学分析。其中,参与调控细胞周期这一过程的lncRNAs包括XR_602080、XR_601081、XR_591017、ENSRNOT00000029509等,而这些lncRNAs与Gsk3b、细胞周期依赖激酶抑制剂2b(Cdkn2b)、Ccna2等直接相邻。Cdkn2b与Cdkn2a相邻,可编码一种与CDK4或CDK6形成复合物的细胞周期蛋白依赖激酶抑制剂,并阻止CDK激酶的激活,因此编码蛋白作为控制细胞周期G1进展的细胞生长调节剂发挥作用。Ccna2即重组人细胞周期素A2,作为细胞周期素家族成员之一,能调控细胞周期过渡,因此被认为是细胞周期调控中的核心因子。总之,本研究采用lncRNA,V2.0芯片技术分析外泌体干预对大鼠颈动脉球囊损伤后血管组织中lncRNA和mRNA表达影响,成功建立了外泌体干预后的大鼠颈动脉球囊损伤组织中差异变化的lncRNA基因表达谱,为后续相关领域提供了重要的数据基础。GO富集出调控“细胞周期”是其参与外泌体干预大鼠颈动脉球囊损伤的主要方式,CNC分析出差异表达的lncRNA和细胞周期基因间有着密切的共表达网络关系,构建出高度相关的lncRNA-细胞周期相关mRNA关系对,可为后续深入研究差异表达lncRNA的功能和机制提供方向。
综上所述,本研究显示BMSCs源外泌体中XR_602080、XR_591017可能通过Gsk3b、Cdkn2b、Ccna2等分子调控平滑肌细胞周期变化,最终起到抑制新生内膜过度增殖的生物学功能。其具体调控的分子机制有待进一步探索发现。
| [1] |
XU R, ZHANG F, CHAI R, et al. Exosomes derived from pro-inflammatory bone marrow-derived mesenchymal stem cells reduce inflammation and myocardial injury via mediating macrophage polarization[J]. J Cell Mol Med, 2019, 23(11): 7617-7631. DOI:10.1111/jcmm.14635 |
| [2] |
LIU Y, ZHAO S, LUO L, et al. Mesenchymal stem cell-derived exosomes ameliorate erection by reducing oxidative stress damage of corpus cavernosum in a rat model of artery injury[J]. J Cell Mol Med, 2019, 23(11): 7462-7473. DOI:10.1111/jcmm.14615 |
| [3] |
ZHANG S, LIU X, GE L L, et al. Mesenchymal stromal cell-derived exosomes improve pulmonary hypertension through inhibition of pulmonary vascular remodeling[J]. Respir Res, 2020, 21(1): 71. DOI:10.1186/s12931-020-1331-4 |
| [4] |
CHEN Q, LIU Y, DING X, et al. Bone marrow mesenchymal stem cell-secreted exosomes carrying microRNA-125b protect against myocardial ischemia reperfusion injury via targeting SIRT7[J]. Mol Cell Biochem, 2020, 465(1/2): 103-114. DOI:10.1007/s11010-019-03671-z |
| [5] |
MAGUIRE E M, XIAO Q Z. Noncoding RNAs in vascular smooth muscle cell function and neointimal hyperplasia[J]. FEBS J, 2020.[Online ahead of print].DOI: 10.1111/febs.15357.
|
| [6] |
LV J, WU Y, MAI Y F, et al. Noncoding RNAs in diabetic nephropathy: pathogenesis, biomarkers, and therapy[J]. J Diabetes Res, 2020, 2020: 1-10. DOI:10.1155/2020/3960857 |
| [7] |
WANG Y, ZHAO R, LIU D, et al. Exosomes derived from miR-214-enriched bone marrow-derived mesenchymal stem cells regulate oxidative damage in cardiac stem cells by targeting CaMKⅡ[J]. Oxid Med Cell Longev, 2018, 2018: 4971261. DOI:10.1155/2018/4971261 |
| [8] |
李朝富, 王艳, 赵然尊, 等. 骨髓间充质干细胞源外泌体调控心肌微血管内皮细胞增殖的机制研究[J]. 第三军医大学学报, 2019, 41(23): 2313-2321. LI C F, WANG Y, ZHAO R Z, et al. Mechanism of exosomes released from bone marrow stem cells regulating proliferation of cardiac microvascular endothelial cells[J]. J Third Mil Med Univ, 2019, 41(23): 2313-2321. DOI:10.16016/j.1000-5404.201907063 |
| [9] |
KANG S J, MINTZ G S, PARK D W, et al. Mechanisms of in-stent restenosis after drug-eluting stent implantation: intravascular ultrasound analysis[J]. Circ Cardiovasc Interv, 2011, 4(1): 9-14. DOI:10.1161/circinterventions.110.940320 |
| [10] |
ZHU H, ZHANG Y. Life and death partners in post-PCI restenosis: apoptosis, autophagy, and the cross-talk between them[J]. Curr Drug Targets, 2018, 19(9): 1003-1008. DOI:10.2174/1389450117666160625072521 |
| [11] |
PANAGIOTOU N, NEYTCHEV O, SELMAN C, et al. Extracellular vesicles, ageing, and therapeutic interventions[J]. Cells, 2018, 7(8): 110. DOI:10.3390/cells7080110 |
| [12] |
IBRAHIM A, MARBÁN E. Exosomes: fundamental biology and roles in cardiovascular physiology[J]. Annu Rev Physiol, 2016, 78: 67-83. DOI:10.1146/annurev-physiol-021115-104929 |
| [13] |
GUO Y, BAO S, GUO W, et al. Bone marrow mesenchymal stem cell-derived exosomes alleviate high phosphorus-induced vascular smooth muscle cells calcification by modifying microRNA profiles[J]. Funct Integr Genomics, 2019, 19(4): 633-643. DOI:10.1007/s10142-019-00669-0 |
| [14] |
PONNUSAMY M, LIU F, ZHANG Y H, et al. Long noncoding RNA CPR (cardiomyocyte proliferation regulator) regulates cardiomyocyte proliferation and cardiac repair[J]. Circulation, 2019, 139(23): 2668-2684. DOI:10.1161/circulationaha.118.035832 |
| [15] |
Correction to: hematopoietic deficiency of the long noncoding RNA MALAT1 promotes atherosclerosis and plaque inflammation[J]. Circulation, 2019, 140(3): e161. DOI: 10.1161/cir.0000000000000706.
|
| [16] |
VAUSORT M, WAGNER D R, DEVAUX Y. Long noncoding RNAs in patients with acute myocardial infarction[J]. Circ Res, 2014, 115(7): 668-677. DOI:10.1161/circresaha.115.303836 |
| [17] |
WANG K, LIU F, LIU C Y, et al. The long noncoding RNA NRF regulates programmed necrosis and myocardial injury during ischemia and reperfusion by targeting miR-873[J]. Cell Death Differ, 2016, 23(8): 1394-1405. DOI:10.1038/cdd.2016.28 |
| [18] |
WANG J, CHEN X, SHEN D, et al. A long noncoding RNA NR_045363 controls cardiomyocyte proliferation and cardiac repair[J]. J Mol Cell Cardiol, 2019, 127: 105-114. DOI:10.1016/j.yjmcc.2018.12.005 |
| [19] |
YU J Y, YANG Y, XU Z C, et al. Long noncoding RNA ahit protects against cardiac hypertrophy through SUZ12 (suppressor of zeste 12 protein homolog)-mediated downregulation of MEF2A (myocyte enhancer factor 2A)[J]. Circ Heart Fail, 2020, 13(1): 006525. DOI:10.1161/circheartfailure.119.006525 |
| [20] |
DANGWAL S, SCHIMMEL K, FOINQUINOS A, et al. Noncoding RNAs in heart failure[J]. Handb Exp Pharmacol, 2017, 243: 423-445. DOI:10.1007/164_2016_99 |
| [21] |
HU M X, FU Q, JING C, et al. LncRNA HOTAIR knockdown inhibits glycolysis by regulating miR-130a-3p/HIF1A in hepatocellular carcinoma under hypoxia[J]. Biomed Pharmacother, 2020, 125: 109703. DOI:10.1016/j.biopha.2019.109703 |
| [22] |
SANTER L, LÓPEZ B, RAVASSA S, et al. Circulating long noncoding RNA LIPCAR predicts heart failure outcomes in patients without chronic kidney disease[J]. Hypertension, 2019, 73(4): 820-828. DOI:10.1161/hypertensionaha.118.12261 |
| [23] |
GUO Z L, LI L L, GAO Y, et al. RETRACTED ARTICLE: Overexpression of lncRNA ANRIL aggravated hydrogen peroxide-disposed injury in PC-12 cells via inhibiting miR-499a/PDCD4 axis-mediated PI3K/Akt/mTOR/p70S6K pathway[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 2624-2633. DOI:10.1080/21691401.2019.1629953 |
| [24] |
YU C, YANG K, MENG X X, et al. Downregulation of long noncoding RNA MIAT in the retina of diabetic rats with tail-vein injection of human umbilical-cord mesenchymal stem cells[J]. Int J Med Sci, 2020, 17(5): 591-598. DOI:10.7150/ijms.38078 |
| [25] |
WANG K, LIU C Y, ZHOU L Y, et al. APF lncRNA regulates autophagy and myocardial infarction by targeting miR-188-3p[J]. Nat Commun, 2015, 6(1): 6779. DOI:10.1038/ncomms7779 |
| [26] |
LI X, ZHOU J, HUANG K. Inhibition of the lncRNA Mirt1 attenuates acute myocardial infarction by suppressing NF-κB activation[J]. Cell Physiol Biochem, 2017, 42(3): 1153-1164. DOI:10.1159/000478870 |
| [27] |
BAI C, NIE N N, LI Y S, et al. Long noncoding RNA Mirt2 prohibits lipopolysaccharide-evoked HK-2 cell injury via modulation of microRNA-126[J]. BioFactors, 2020, 46(3): 465-474. DOI:10.1002/biof.1602 |
| [28] |
LI Y Q, SHEN S X, DING S K, et al. LincRNA DYN-LRB2-2 upregulates cholesterol efflux by decreasing TLR2 expression in macrophages[J]. J Cell Biochem, 2018, 119(2): 1911-1921. DOI:10.1002/jcb.26352 |
| [29] |
YU C, SHI D, LI Z, et al. Long noncoding RNA CHRF exacerbates IL-6-induced inflammatory damages by downregulating microRNA-146a in ATDC5 cells[J]. J Cell Physiol, 2019, 234(12): 21851-21859. DOI:10.1002/jcp.28749 |
| [30] |
ZHANG L, WU Y J, ZHANG S L. Circulating lncRNA MHRT predicts survival of patients with chronic heart failure[J]. J Geriatr Cardiol, 2019, 16(11): 818-821. DOI:10.11909/j.issn.1671-5411.2019.11.006 |
| [31] |
HOU J, LONG H, ZHOU C, et al. Long noncoding RNA Braveheart promotes cardiogenic differentiation of mesenchymal stem cells in vitro[J]. Stem Cell Res Ther, 2017, 8(1): 4. DOI:10.1186/s13287-016-0454-5 |



