炎症反应在糖尿病肾病(diabetic nephropathy,DN)的发病中具有重要作用,目前无有效手段改善异常的炎症反应[1]。血栓调节蛋白(thrombomodulin,TM)是一种跨膜糖蛋白, TM的凝集素样结构域可减轻DN小鼠尿蛋白,但具体机制不完全清楚[2]。TM一方面通过其抗凝功能发挥抗炎作用, 另一方面通过促进活化蛋白C形成及抑制高迁移率族蛋白l等途径发挥重要的内源性抗炎功能[3], 近期发现TM在抗炎的同时还具有下调凝血因子Ⅲ的A亚单位(coagulation factor Ⅲ-A,FXⅢ-A)表达的作用[4-5],FXⅢ又称为人凝血因子XⅢ,是参与凝血级联反应的最后一个凝血因子, FXⅢ是一种酶原, 其活化形式是FXⅢ-A, 后者是一种转谷氨酰胺酶, FXⅢ-A作用于凝血末期, 交联并稳定沉积的纤维蛋白, 并具有促进M2型巨噬细胞极化的作用[6],最新研究发现FXⅢ-A基因敲除小鼠可防止胰岛素抵抗[7],但TM与FXⅢ-A在DN中的表达以及相互影响尚不清楚。
上述研究结果提示:干预DN肾组织TM表达可能会影响DN炎症反应、肾组织FXⅢ-A表达、M2型巨噬细胞浸润以及尿蛋白水平。凝血酶、血管内皮生长因子、1, 25-二羟维生素D3、维甲酸、他汀类药物等虽然可以上调TM表达[8],但并不能延缓DN进展。本课题组之前发现肾小球内皮细胞上的TM在肝X受体(liver X receptor,LXR)激动剂T0901317作用下表达升高并抑制高糖条件下内皮细胞分泌炎症介质[9],同时发现T0901317通过活化db/db小鼠肾组织LXR-α亚型而降低小鼠血肌酐并改善肾病理损伤[10-11],提示LXR激动剂T0901317可能通过上调DN肾组织TM表达减轻肾损伤。
因此,本研究拟首先检测LXR-α、TM、FXⅢ-A和M2型巨噬细胞标志物CD163在DN患者肾穿刺组织中的表达,然后分别观察T0901317上调TM表达及TM干扰RNA重组腺病毒Ad-TM shRNA下调TM表达后,db/db小鼠血炎症介质、尿微量白蛋白和肾组织LXR-α、TM、FXⅢ-A、CD163表达变化,以期明确干预TM表达是否减少炎症介质水平以及FXⅢ-A和CD163表达并改善DN肾损伤,为DN的发病机制和治疗提供实验依据。
1 资料与方法 1.1 研究对象、实验动物和主要试剂材料选取2015-2019年在我科经肾脏穿刺活检确诊为糖尿病肾病的患者25例(DN组),其中男性14例,女性11例,年龄(39±15)岁,排除原发性肾病和其他继发性肾病。患者估算的肾小球滤过率(eGFR)是基于CKD-EPI公式计算而得,eGFR和24 h尿蛋白定量均为肾穿刺之前由本院检验科检测而得。本研究获得四川省人民医院伦理委员会审查批准(2020392),所有研究对象签署知情同意书。对照组(Control)6例,选自因肾脏肿瘤而行肾脏切除术的患者,所取肾组织标本远离肿瘤部分。
8周龄雄性db/db小鼠购于南京君科生物有限责任公司,与本实验室8周龄雄性C57BL6小鼠均饲养于四川省人民医院动物实验中心(SPF级),20~24 ℃、12 h光暗周期并且自由进食。兔抗小鼠/抗人TM多克隆抗体(sc271804)购于美国Santa Cruz Biotechnology公司,兔抗小鼠/抗人FXⅢ-A抗体(#ab76105)和兔抗小鼠/抗人CD163(#9052821)购于北京中杉金桥生物公司,小鼠肿瘤坏死因子α(TNF-α)和小鼠白介素-6(IL-6)ELISA试剂盒购于武汉华美公司,T0901317购于美国Sigma公司,重组腺病毒Ad-TM shRNA和重组腺病毒空载体对照Ad-Ctrl shRNA(简称Ad-Ctrl)由成都帝肯科技有限公司合成并验证。
1.2 实验动物分组根据前期实验,本研究选择出现了显著DN特征的24只12周龄雄性db/db小鼠为实验对象,平均分为4组:DN生理盐水组、Ad-ctrl+DN组、T0901317+DN组和Ad-TM shRNA+DN组,同周龄雄性野生C57BL6小鼠(WT组)与DN生理盐水组小鼠给予0.5 mg/(kg·d)生理盐水灌胃,根据预实验结果,以可以明显降低肾组织TM表达的2.5×109 pfu Ad-TM shRNA尾静脉注射小鼠,以可显著提高肾组织TM表达的0.5 mg/(kg·d)T0901317灌胃,Ad-TMshRNA或Ad-ctrl给药后1周,再以T0901317连续给药7 d,于末次给药后4周收集随机尿,以安乐死处死小鼠后收集肾组织样本和血样。
1.3 免疫组化检测患者肾组织TM、LXR-α、FXⅢ-A和CD163表达选取我院2015-2019年诊断为DN的患者的肾穿刺组织,常规石蜡包埋切片为4 μm,常规脱蜡、水洗后,3% H2O2室温15 min,行EDTA微波修复,分别滴加TM抗体(1 :100)、LXR-α抗体(1 :100)、FXⅢ-A抗体(1 :500)和CD163抗体(1 :500),4 ℃过夜。次日0.01 mol/L PBS洗5 min×3次后,即按照超敏SP免疫组化试剂盒说明书进行操作,DAB显色,苏木精复染细胞核。阴性对照以PBS代替一抗,同法操作。
1.4 小鼠尿微量白蛋白检测将收集的尿样本离心后送四川省人民医院检验科行尿微量白蛋白检测。
1.5 ELISA观察小鼠外周血TNF-α、IL-6水平按照试剂盒说明书操作,样本孔按10 :1比例加待检血清,后再以40 :1比例加稀释液,再加TNF-α抗体(100 :1)和IL-6抗体(200 :1);空白孔不加任何试剂;酶标仪上450 nm处,用空白对照孔为标准,测各孔光密度值D(450)。用Curve软件绘制出标准品线性回归曲线,再用D(450)值按Curve软件的方程,计算各浓度,每个样本各设5孔,每个实验组重复3次。
1.6 Western blot检测小鼠肾组织TM和FXⅢ-A表达提取各组小鼠肾组织总蛋白,检测细胞总蛋白浓度后,取50 μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,将凝胶中蛋白质转移至聚偏二氟乙烯膜上。将标记好的膜转入牛奶中,封闭1 h,分别滴加一抗(TM抗体1 :1 000、FXⅢ-A抗体1 :1 000),4 ℃摇床孵育过夜后将膜放到各个对应的二抗(用TBST按1 :1 000比例)孵育1 h。在膜上均匀滴加曝光液并显色曝光,每组重复3次。Western blot条带采用Image J图像分析软件分析光密度,以目的条带和β-actin条带积分光密度值的比值代表目的蛋白的相对表达量,每组重复3次。
1.7 免疫组化阳性细胞结果判断肾小球或间质血管中TM的染色强度分为以下等级:0为阴性;1+为≤25%的毛细血管袢或间质血管阳性;2+为26%~50%的毛细血管袢或间质血管阳性;3+为51%~75%的毛细血管袢或间质血管阳性,4+为>75%的毛细血管袢或间质血管呈阳性。肾组织LXR-α染色强度分为:0级为阴性;1级为弱阳性;2级为中度阳性;3级为强阳性。肾小球中浸润的CD163+和FXⅢ-A+细胞数以每个肾小球阳性细胞数表达,0为0个阳性细胞,1为1~4个阳性细胞,2为5~10个阳性细胞,3为>10个阳性细胞。肾小管间质中浸润的CD163+和FXⅢA+细胞数在0到4+的范围内进行半定量评估:0为无染色;1+为≤25%的细胞染色;2+为26%~50%的细胞染色;3+为51%~75%的细胞染色;4+为>75%的细胞染色。分别取10个不重叠的高倍视野下肾小球或肾小管间质中TM、LXR-α、FXⅢ-A和CD163阳性染色的平均值作为该例样本的得分[12]。
1.8 统计学分析以SPSS 25.0统计软件处理数据。计量资料数据以x±s表示,正态计量资料采用单因素方差分析和独立样本t检验。采用非参数检验(Spearman秩相关)分析各指标之间的相关性。P < 0.05为差异具有统计学意义。
2 结果 2.1 DN患者临床特点DN组患者肾小球滤过率(eGFR)和24 h尿蛋白水平分别为(61.59±32.36)mL/(min·1.73m2)和(4.2±1.2)g/24 h,对照组eGFR水平为(97.5±10.8) mL/(min·1.73m2)。
2.2 DN患者肾组织TM、LXR-α、FXⅢ-A、CD163表达及其与临床指标相关性分析免疫组化显示:在DN患者肾组织中,TM+细胞主要分布于肾小球毛细血管和管周毛细血管(图 1A),LXR-α+细胞主要分布于肾小球细胞和肾小管上皮细胞(图 1A),FXⅢ-A+细胞和CD163+细胞主要分布在肾小管间质(图 1B),半定量分析显示:DN患者的TM+细胞和LXR-α+细胞数量较正常肾组织表达量减少、FXⅢ-A+细胞和CD163+细胞表达增加(图 1C、D)。相关性分析发现:肾小球和肾小管间质的TM+细胞分值分别与肾小球和肾小管间质的LXR-α+细胞评分呈正相关(r=0.84,P < 0.001;r=0.67,P=0.004),肾小球、肾小管间质的TM+和LXR-α+细胞数均与尿蛋白负相关(r=-0.64、-0.71、-0.60、-0.82,P均 < 0.01);肾小球、肾小管间质的TM+细胞评分和LXR-a+细胞评分均与eGFR水平呈正相关(r=0.97、0.85、0.86、0.85;P均 < 0.001)。肾小球、肾小管间质FXⅢ-A+细胞、CD163+细胞计分分别与eGFR负相关(r=-0.71、-0.89、-0.95、-0.93,P均 < 0.01), FXⅢ-A+细胞、CD163+细胞计分与尿蛋白水平无相关性(数据未显示)。
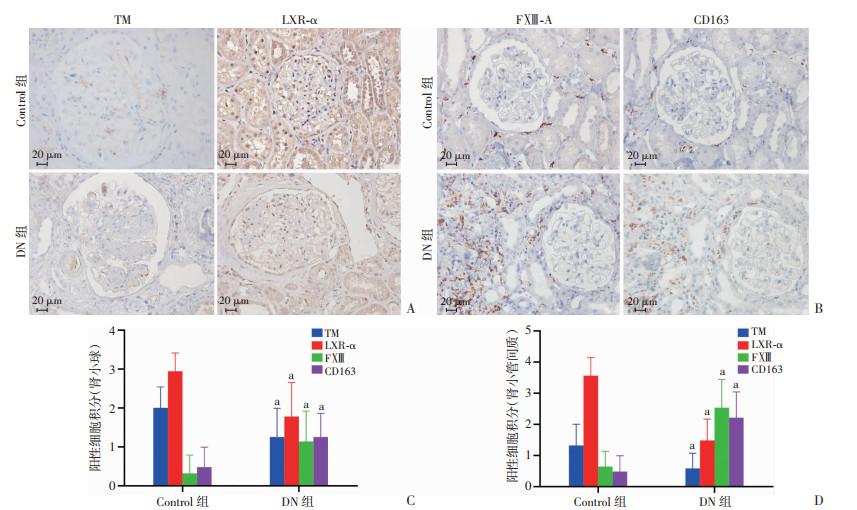
|
| A:免疫组化检测TM和LXR-α表达(S-P);B:免疫组化检测FXⅢ-A和CD163表达(S-P);C、D:分别为肾小球和肾小管间质TM+、LXR-α+、FXⅢ-A+、CD163+细胞分值比较(n=6) a: P < 0.05,与Control组比较 图 1 免疫组化检测对照组和DN患者肾组织TM、LXR-α、FXⅢ-A、CD163表达及定量分析 |
2.3 干预db/db小鼠肾组织TM表达对TM、LXR-α、FXⅢ-A和CD163表达的影响
预实验及Western blot检测结果显示:与DN生理盐水组小鼠比较,LXR-α激动剂T0901317成功上调db/db小鼠肾组织TM表达,而Ad-TM shRNA成功下调TM表达;伴随TM表达上调的同时,FXⅢ-A表达下降(图 2)。免疫组化显示:TM+细胞主要分布于肾小球毛细血管和管周毛细血管,LXR-α+细胞主要分布于肾小管上皮细胞和肾小球细胞,FXⅢ-A+细胞和CD163+细胞在野生鼠肾组织表达较少,但db/db小鼠肾组织中存在大量FXⅢ-A+细胞和CD163+细胞(图 3A);半定量分析发现:DN生理盐水组与野生小鼠相比、Ad-TM shRNA沉默TM组与DN生理盐水组相比,均表现为肾组织TM和LXR-α表达减少、FXⅢ-A和CD163表达增加(P < 0.05),而T0901317上调TM表达同时,伴随LXR-α表达增加,FXⅢ-A和CD163表达减少(图 3B、C)。
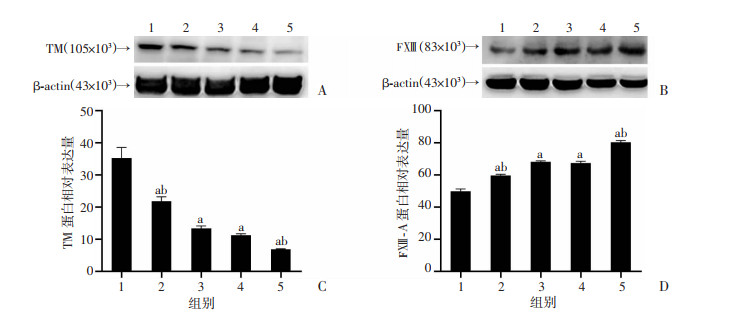
|
| A、B:分别为Western blot检测TM和FXⅢ-A表达;C、D:分别为TM和FXⅢ-A表达半定量分析(n=6) 1:WT组;2:T0901317+DN组;3:DN生理盐水组;4:Ad-ctrl shRNA+DN组;5:Ad-TM shRNA+DN组;a: P < 0.05,与WT组比较;b: P < 0.05,与DN生理盐水组和Ad-ctrl shRNA+DN组比较 图 2 Western blot检测野生鼠和db/db小鼠肾组织TM和FXⅢ-A表达 |
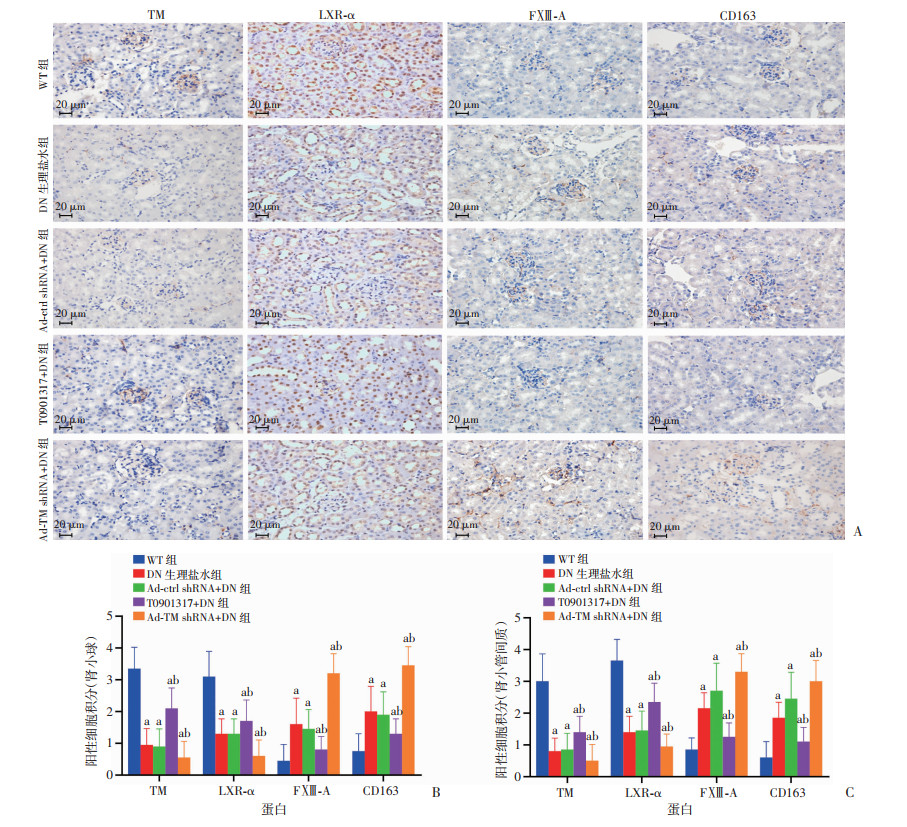
|
| A:免疫组化检测(S-P);B、C:分别为肾小球、肾小管间质TM+、LXR-α+、FXⅢ-A+、CD163+细胞分值比较(n=6) a: P < 0.05,与WT组比较;b: P < 0.05,与DN生理盐水组和Ad-ctrl shRNA+DN组比较 图 3 免疫组化检测野生鼠和db/db小鼠肾组织TM、LXR-α、FXⅢ-A和CD163表达及定量分析 |
2.4 干预db/db小鼠肾组织TM表达对尿微量白蛋白的影响
野生小鼠的尿微量白蛋白水平是(0.61±0.07)mg/L,DN生理盐水组和Ad-ctrl+DN组小鼠尿微量白蛋白水平分别增加至(1.25±0.12)mg/L和(1.25±0.13)mg/L,与DN生理盐水组比较,沉默TM后小鼠尿微量白蛋白增至(1.78±0.11)mg/L(P < 0.05),而T0901317刺激TM表达后尿微量白蛋白降至(0.77±0.11)mg/L(P < 0.05)。
2.5 干预db/db小鼠肾组织TM表达对外周血TNF-α和IL-6水平的影响ELISA检测结果显示:DN生理盐水组较野生小鼠组,其外周血TNF-α和IL-6水平均下降(P < 0.05),与DN生理盐水组比较,沉默TM后小鼠外周血TNF-α和IL-6水平增加(P < 0.05),而T0901317上调TM表达后TNF-α和IL-6的水平明显减少(P < 0.05,图 4)。
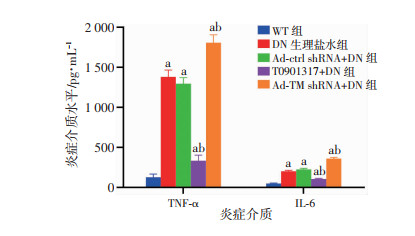
|
| a: P < 0.05,与WT组比较;b: P < 0.05,与DN生理盐水组和Ad-ctrl shRNA+DN比较 图 4 ELISA检测各组小鼠外周血TNF-α和IL-6水平(n=6,x±s) |
3 讨论
为探讨干预TM表达对DN肾损伤的影响及是否与炎症反应有关,本研究首先利用免疫组化检测DN患者肾组织中TM、LXR-α、FXⅢ-A和CD163表达,结果发现DN患者肾组织TM、LXR-α表达量较对照组下降,与肾小球滤过率正相关;而FXⅢ-A和CD163表达较对照组升高,且与肾小球滤过率负相关,提示干预TM表达可能会通过影响炎症介质表达而改善DN肾损伤。故以db/db糖尿病肾病小鼠为模型,探讨在体调控TM表达后对肾组织FXⅢ-A、CD163表达、尿蛋白以及血炎症介质水平的影响,结果发现:LXR-α激动剂T0901317上调db/db小鼠肾组织TM表达后,伴随肾组织FXⅢ-A和CD163表达较db/db对照组下降,而尿微量白蛋白以及血炎症介质TNF-α、IL-6水平均下降;在Ad-TM shRNA沉默db/db小鼠TM表达后,肾组织FXⅢ-A和CD163表达量较DN生理盐水组升高、尿微量白蛋白和血炎症介质水平升高。上述结果提示TM可能通过下调FXⅢ-A表达、抑制炎症介质分泌而改善db/db小鼠尿微量白蛋白水平。
TM最初发现于血管内皮细胞,最近发现TM亦存在于血小板、单核细胞、中性粒细胞、平滑肌细胞和肿瘤细胞等多个细胞上。在炎症反应以及氧化应激作用下,内皮细胞受损,TM胞外段从内皮细胞脱落而释放入血[4],DN患者血可溶性TM表达升高[13], 上调TM表达可能是炎症所致DN微血管疾病的潜在治疗方法。TM从细胞外到细胞内,分别是N末端血凝素样结构区、内皮生长因子样结构区、富含丝氨酸/苏氨酸结构区、跨膜结构区及胞内结构区,已有的研究发现:缺乏TM凝集素样结构域的糖尿病小鼠肾病更严重,而重组凝集素样结构域能减少尿蛋白和巨噬细胞进入肾脏,改善肾小管上皮细胞和肾小球内皮细胞凋亡[2]。本研究发现在DN患者肾组织和db/db小鼠中,TM+细胞主要表达于肾小球毛细血管和管周血管,LXR-α+细胞主要表达于肾小管上皮细胞和肾小球细胞中,TM和LXR-α表达部位相接近,且二者的表达量呈正相关;进一步进行体内实验发现:T0901317促进db/db小鼠肾组织TM表达后,血炎症介质和尿蛋白水平下降,沉默TM后血炎症介质水平和尿蛋白上升,提示T0901317可能通过间接接触机制上调TM表达并减轻DN炎症反应和降低尿蛋白水平。
巨噬细胞通过多重机制参与DN的发病[14],巨噬细胞在组织微环境的刺激作用下获得多种表型功能。目前公认的巨噬细胞表型有两种, 即经典激活巨噬细胞Ml和替代激活巨噬细胞M2[15]。巨噬细胞从早期促炎、促损伤的Ml活化状态逐渐向晚期抗炎、参与组织修复作用的M2表型转化,故巨噬细胞表型并不是一成不变的, 随着疾病的进展, 巨噬细胞表型和功能发生持续的变化, 以适应其所处的微环境, 发挥相应的生物学效应,CD163是M2型巨噬细胞的标志物。本研究发现FXⅢ-A+细胞在DN患者和db/db小鼠肾组织CD163+细胞附近表达,表明FXⅢ-A的表达可能局限于M2亚型巨噬细胞,针对环状肉芽肿病变的研究也证实了FXⅢ-A和CD163可共表达在巨噬细胞[16]。既往研究认为FXⅢ-A调节伤口愈合[17]、血管生成[18]、内皮屏障[19]以及细胞吞噬、迁移等免疫功能[20],FXⅢ-A在M2巨噬细胞中的选择性表达与FXⅢ-A作为抗炎和促进伤口愈合分子的能力相一致[20],但本研究发现DN患者肾组织中FXⅢ-A+细胞水平与eGFR呈负相关,与野生鼠相比,db/db小鼠肾组织中存在大量FXⅢ-A+和CD163+细胞,沉默TM后,肾组织FXⅢ-A、CD163表达和尿微量白蛋白均增加,而T0901317上调TM表达后,FXⅢ-A、CD163表达和尿微量白蛋白水平均下降,提示干预TM表达可影响FXⅢ-A表达。结合已有的研究,我们推测FXⅢ-A可能通过促进M2型巨噬细胞极化以及促进细胞外纤维蛋白沉积而加重DN肾损伤。
关于TM调控FXⅢ-A表达的机制,目前报道的较少。针对环状肉芽肿和类脂坏死菌的样本进行的研究显示,由于纤维蛋白与凝血酶外显子1中氨基酸侧链的结合对凝血酶截断FXⅢ上的辅因子活性至关重要,因此,TM通过竞争性结合凝血酶而抑制纤维蛋白表面FXⅢ-A激活和表达[5]。另外,TM与凝血酶结合后可降低凝血酶的凝血活性而加强其激活蛋白C的活性,活化蛋白C可裂解FXⅢ-A而导致FXⅢ-A表达减少[5]。
综上所述,TM可能通过下调FXⅢ-A表达、抑制炎症介质分泌而改善db/db小鼠尿蛋白。进一步研究需要明确TM调控FXⅢ-A表达的具体信号通路以及FXⅢ-A和M2型巨噬细胞不同亚型M2a、M2b、M2c的表达对DN患者预后的影响。
| [1] |
ANDERS H J, HUBER T B, ISERMANN B, et al. CKD in diabetes: diabetic kidney disease versus nondiabetic kidney disease[J]. Nat Rev Nephrol, 2018, 14(6): 361-377. DOI:10.1038/s41581-018-0001-y |
| [2] |
LOGHMANI H, CONWAY E M. Exploring traditional and nontraditional roles for thrombomodulin[J]. Blood, 2018, 132(2): 148-158. DOI:10.1182/blood-2017-12-768994 |
| [3] |
FIUZA C, BUSTIN M, TALWAR S, et al. Inflammation-promoting activity of HMGB1 on human microvascular endothelial cells[J]. Blood, 2003, 101(7): 2652-2660. DOI:10.1182/blood-2002-05-1300 |
| [4] |
DROŻDŻ D, ŁĄTKA M, DROŻDŻ T, et al. Thrombomodulin as a new marker of endothelial dysfunction in chronic kidney disease in children[J]. Oxid Med Cell Longev, 2018, 2018: 1619293. DOI:10.1155/2018/1619293 |
| [5] |
PHILIPPOU H, RANCE J, MYLES T, et al. Roles of low specificity and cofactor interaction sites on thrombin during factor XⅢ activation. Competition for cofactor sites on thrombin determines its fate[J]. J Biol Chem, 2003, 278(34): 32020-32026. DOI:10.1074/jbc.m305364200 |
| [6] |
TÖRÖCSIK D, BÁRDOS H, NAGY L, et al. Identification of factor XⅢ-A as a marker of alternative macrophage activation[J]. Cell Mol Life Sci, 2005, 62(18): 2132-2139. DOI:10.1007/s00018-005-5242-9 |
| [7] |
MYNENI V D, MOUSA A S, KAARTINEN M T. Factor XⅢ-A transglutaminase deficient mice show signs of metabolically healthy obesity on high fat diet[J]. Sci Rep, 2016, 6: 35574. DOI:10.1038/srep35574 |
| [8] |
PALOMER X, GONZÁLEZ-CLEMENTE J M, BLANCO-VACA F, et al. Role of vitamin D in the pathogenesis of type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2008, 10(3): 185-197. DOI:10.1111/j.1463-1326.2007.00710.x |
| [9] |
DING H, LI Y, FENG Y, et al. LXR agonist T0901317 upregulates thrombomodulin expression in glomerular endothelial cells by inhibition of nuclear factor-κB[J]. Mol Med Rep, 2016, 13(6): 4888-4896. DOI:10.3892/mmr.2016.5138 |
| [10] |
吴松, 李怡, 陈惠宇, 等. 肝X受体激动剂对db、db鼠肾脏肝X受体表达及其活性的影响[J]. 实用医院临床杂志, 2018, 15(2): 1-3. WU S, LI Y, CHEN H Y, et al. The effect of liver X receptor agonists on expressions and activity of liver X receptors in the kidney of db/db mice[J]. Pract J Clin Med, 2018, 15(2): 1-3. |
| [11] |
吴松, 杜亚琴, 张萍, 等. T0901317激活肝X受体α改善db/db小鼠肾损伤[J]. 第三军医大学学报, 2020, 42(1): 75-80. WU S, DU Y Q, ZHANG P, et al. T0901317 improves renal injury in db /db mice by activating liver X receptor α[J]. J Third Mil Med Univ, 2020, 42(1): 75-80. DOI:10.16016/j.1000-5404.201907232 |
| [12] |
PALLER M S, HOIDAL J R, FERRIS T F. Oxygen free radicals in ischemic acute renal failure in the rat[J]. J Clin Invest, 1984, 74(4): 1156-1164. DOI:10.1172/jci111524 |
| [13] |
ISERMANN B, VINNIKOV I A, MADHUSUDHAN T, et al. Activated protein C protects against diabetic nephropathy by inhibiting endothelial and podocyte apoptosis[J]. Nat Med, 2007, 13(11): 1349-1358. DOI:10.1038/nm1667 |
| [14] |
GUITERAS R, SOLA A, FLAQUER M, et al. Exploring macrophage cell therapy on diabetic kidney disease[J]. J Cell Mol Med, 2019, 23(2): 841-851. DOI:10.1111/jcmm.13983 |
| [15] |
TESCH G H. Role of macrophages in complications of type 2 diabetes[J]. Clin Exp Pharmacol Physiol, 2007, 34(10): 1016-1019. DOI:10.1111/j.1440-1681.2007.04729.x |
| [16] |
TÖRÖCSIK D, BÁRDOS H, HATALYÁK Z, et al. Detection of factor XⅢ-A is a valuable tool for distinguishing dendritic cells and tissue macrophages in granuloma annulare and necrobiosis lipoidica[J]. J Eur Acad Dermatol Venereol, 2014, 28(8): 1087-1096. DOI:10.1111/jdv.12290 |
| [17] |
DICKNEITE G, HERWALD H, KORTE W, et al. Coagulation factor XⅢ: a multifunctional transglutaminase with clinical potential in a range of conditions[J]. Thromb Haemost, 2015, 113(4): 686-697. DOI:10.1160/th14-07-0625 |
| [18] |
DARDIK R, LOSCALZO J, ESKARAEV R, et al. Molecular mechanisms underlying the proangiogenic effect of factor XⅢ[J]. Arterioscler Thromb Vasc Biol, 2005, 25(3): 526-532. DOI:10.1161/01.atv.0000154137.21230.80 |
| [19] |
ZAETS S B, XU D Z, LU Q, et al. Recombinant factor XⅢ mitigates hemorrhagic shock-induced organ dysfunction[J]. J Surg Res, 2011, 166(2): e135-e142. DOI:10.1016/j.jss.2010.12.001 |
| [20] |
LOOF T G, MÖRGELIN M, JOHANSSON L, et al. Coagulation, an ancestral serine protease cascade, exerts a novel function in early immune defense[J]. Blood, 2011, 118(9): 2589-2598. DOI:10.1182/blood-2011-02-337568 |




