2. .400038 重庆,陆军军医大学(第三军医大学)预防医学院毒理学研究所;
3. 463000 河南 驻马店,中国人民解放军第990医院泌尿外科
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Urology, NO. 990 Hospital of PLA, Zhumadian, Henan Province, 463000, China
精子的运动是通过其鞭毛的激活实现的。完整的鞭毛结构形成对于精子的获能、运动以及能量的产生均极为重要。与精子鞭毛形成有关的基因突变可导致精子运动障碍,从而导致男性不育[1-2]。纤维鞘作为精子鞭毛的一个重要支撑结构,不但发挥重要的结构性支撑作用,而且是多种重要信号传导通路和代谢通路的支架,在为精子鞭毛运动提供能量方面发挥重要作用[3-6]。纤维鞘相关基因的缺陷可能影响精子正常的鞭毛结构形成和精子的运动[6-10]。钙结合酪氨酸磷酸化调节蛋白(calcium-binding tyrosine phosphorylation-regulated protein,CABYR)和纤维鞘CABYR结合蛋白(fibrous sheath CABYR binding,FSCB)均是在精子形成过程中特异性表达和装配于纤维鞘上的蛋白,两者均既具有钙结合能力,又可在获能过程中发生磷酸化调节。推测CABYR、FSCB蛋白可通过直接或间接互相作用,装配于纤维鞘的支架蛋白AKAPs上,形成巨分子蛋白复合物,共同发挥纤维鞘的生理功能[11]。为深入探讨CABYR和FSCB在纤维鞘中生理功能,本研究组前期已经获得了Fscb基因敲除小鼠,并对雄性小鼠生殖功能进行了观察,结果发现Fscb基因敲除雄性小鼠的精子运动功能及体内外受精能力均无明显影响,提示该基因所编码的FSCB蛋白对于精子的运动和授精能力的维持可能是非必需的或可被替代的,FSCB可能并不独立发挥作用[12-13]。因此,本课题组前期建立了Fscb/Cabyr双基因敲除小鼠模型[14],本研究通过观察该模型雄性小鼠的精子形态学改变及体内外授精能力,探讨FSCB和CABYR蛋白在精子纤维鞘中的生理功能。
1 材料与方法 1.1 主要材料Fscb/Cabyr(--/--)双基因敲除小鼠由本课题组前期研究制备[14],H-7500透射电镜购自日本Hitachi公司,计算机辅助精液分析系统(computer assisted sperm analysis, CASA)购自英国ELGA公司,BX53F荧光显微镜购自日本Olympus公司。
1.2 方法 1.2.1 双基因敲除小鼠睾丸生精功能的分析将Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)3种基因型雄性小鼠睾丸取出后,放入4%多聚甲醛固定,切片后行HE染色,显微镜下观察拍照,分析各基因型小鼠睾丸中各级生精细胞数量及分布情况。
1.2.2 双基因敲除小鼠睾丸、附睾脏体比分析取Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)等5种基因型雄性小鼠各3只,称量后脱颈法处死,迅速取出睾丸及附睾,分别称量,比较睾丸、附睾的脏体比。
1.2.3 精子活力分析取Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)等5种基因型雄性小鼠各3只,腹腔注射1%戊巴比妥钠7.5 mL/kg进行麻醉,称量并记录后断颈处死,取出睾丸、双侧附睾称量记录。将附睾迅速放进含300 μL的37 ℃水浴箱预孵的人类输卵管液(human tubal fluid, HTF)中,用眼科剪剪开附睾尾部,用镊子轻轻晃动附睾使成熟精子游离到HTF中。加样枪取10 μL含小鼠精子的HTF加入到精液质量分析孔板中,在CASA显微镜下,随机抓取视频,基于CASA系统分析精子密度及精子运动参数。包括快速、中速前向运动精子比例(progressive motility rate,PR), 非前向运动精子比例(non-progressive motility rate,NP)以及不动精子比例;以PR+NP表示运动精子比例。还包括平均曲线运动速度(curvilinear velocity,VCL)、平均直线运动速度(straight-line velocity,VSL)、平均路径运动速度(average path velocity,VAP)、精子平均鞭打频率(beat cross frequency,BCF)和平均头部侧摆幅值(amplitude of lateral head displacement,ALH)等。
1.2.4 精子形态学改变分析取上述含精子的HTF10 μL均匀涂涂于载玻片上,充分干燥后95%乙醇固定30 min,再于室温干燥后,将样本放置于2%伊红染液中30 min,自来水轻轻冲洗10 min后室温晾干,再将染色好的样本置于显微镜下随机选取视野拍照,每个样本计数1 000个精子中胖头精子、小头精子、双头精子、无钩精子、香蕉头精子、不规则头型精子、颈折叠精子、双颈精子、体折叠精子、双体精子、双尾精子、尾折叠精子等畸形精子总数,每组基因型小鼠至少统计3个样本。
1.2.5 小鼠精子化学趋向性分析取附睾中游出的精子置于含0.25% BSA的HTF中,37 ℃培养箱培养45 min使精子获能;取20 μL获能后含精子的HTF液,加入20 μL 150 μmol/L孕酮,37 ℃水浴箱中孵育15 min以促使精子发生顶体反应。取样本20 μL,等体积加入20 μL 250 μmol/L金霉素染色,37 ℃水浴箱中孵育15 min后,加入0.2 μL Hochest染色孵育2 min。染色完成后,迅速加入3.5 μL 12.5%戊二醛,轻轻混合均匀后立即涂于载玻片上,室温干燥60 min。将制作好的样本置于荧光显微镜下随机选取视野拍照,每个样本计数1 000个精子中F型(未获能精子)、B型(获能但未发生顶体反应的精子)及AR型(发生顶体反应的精子)精子的个数,每组至少计数3个样本。
1.2.6 各基因型小鼠精子透射电镜超微结构分析将上述各基因型雄性小鼠附睾置于2%戊二醛固定液中,以1 mL注射器将固定液注射于附睾内,待附睾充分固定后,每只附睾以眼科剪取直径1 mm附睾组织3块,置入盛有2%的戊二醛固定液的EP管中;将固定好的样本送至陆军军医大学实验中心电镜室,完成后续制片及拍照。
1.3 统计学分析采用SPSS 23.0统计学软件进行分析。计量资料以x±s表示,根据方差齐性结果采用单因素方差分析或Kruskal-Wallis秩和检验分析比较各组间结果的差异;计数资料采用χ2检验进行组间分析,检验水准α=0.05。
2 结果 2.1 基因敲除小鼠睾丸生精功能Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)3种基因型雄性小鼠睾丸切片HE染色结果显示(图 1):雄性小鼠睾丸曲细精管结构清楚,管壁基膜完整,各级生精细胞排列紧密规则,管腔内充满成熟精子,三者无明显差异。

|
| A:Fscb/Cabyr(--/--);B:Fscb/Cabyr(++/--);C:Fscb/Cabyr(++/++) 图 1 多种基因型小鼠睾丸生精功能组织学分析(HE ×100) |
2.2 基因敲除小鼠睾丸、附睾脏体比
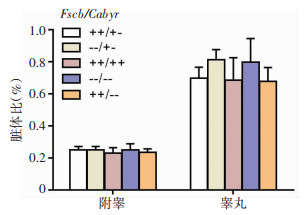
Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)5种基因型雄性小鼠的睾丸、附睾的平均脏体比见图 2。5种基因型之间各脏体比差异无统计学意义(P>0.05),但Fscb/Cabyr(--/+-)及Fscb/Cabyr (--/--)的雄性小鼠睾丸脏体比较Fscb/Cabyr(++/++)野生型雄性小鼠有升高的趋势。
|
| 图 2 多种基因型雄性小鼠的睾丸、附睾脏体比(n=3,x±s) |
2.3 精子活力分析
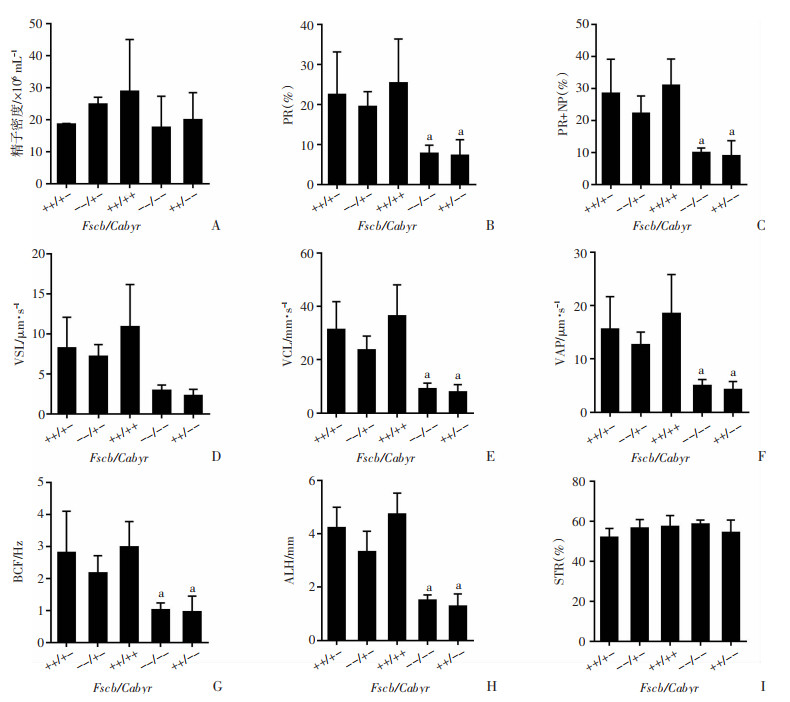
Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)5种基因型雄性小鼠附睾液基于CASA系统分析结果见图 3。精子密度在5种基因型间差异无统计学意义(P>0.05)。Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)3种基因型雄性小鼠的精子运动参数比较,除Fscb/Cabyr(--/+-)型雄性小鼠精子的平均曲线运动速度(VCL)和精子平均头部侧摆幅值(ALH)明显低于野生型外,其他各项指标与野生型差异均无统计学意义。而Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)基因型雄性小鼠精子的前向运动精子比率(PR)和运动精子比率(PR+NP)、VCL、平均直线运动速度(VSL)、平均路径运动速度(VAP)、精子平均鞭打频率(BCF)、ALH均较Fscb/ Cabyr(++/++)野生型雄性小鼠显著降低(P < 0.01),但Fscb/Cabyr(--/--)和Fscb/Cabyr(++/--)两种基因型雄性小鼠精子间的各运动参数差异无统计学意义(P>0.05),同时,上述5种基因型雄性小鼠精子间的运动前向性(STR)差异无统计学意义(P>0.05)。
|
|
a:P < 0.01,与Fscb/Cabyr(++/++)比较 A:精子密度;B:前向运动精子比率(PR);C:运动精子比率(PR+NP);D:平均直线运动速度(VSL);E:平均曲线运动速度(VCL);F:平均路径运动速度(VAP);G:精子平均鞭打频率(BCF);H:精子平均头部侧摆幅值(ALH);I:运动的前向性(STR) 图 3 多种基因型雄性小鼠精子运动各参数分析(n=3,x±s) |
2.4 精子形态学改变
对Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--) 3种基因型雄性小鼠(每种基因型各3只,每只雄性小鼠样本观察1000条精子)精子各类畸形情况分析结果如表 1所示。与野生型小鼠精子相比,Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)小鼠正常精子百分率显著降低(P < 0.01),精子尾折叠比例显著增高(P < 0.01),无定型精子比例明显增高(P < 0.05)。
| 精子畸 形情况 |
Fscb/Cabyr (++/++) |
Fscb/Cabyr (--/--) |
Fscb/Cabyr (++/--) |
| 正常 | 66.46±0.73 | 49.61±1.45b | 53.22±3.51b |
| 双头 | 1.08±0.24 | 1.44±0.24 | 1.19±0.28 |
| 小头 | 4.41±0.46 | 5.10±0.45 | 4.25±0.33 |
| 胖头 | 3.12±0.29 | 2.81±0.25 | 3.06±0.05 |
| 无钩 | 2.79±0.30 | 2.37±0.03 | 2.64±0.16 |
| 香蕉形 | 2.20±0.17 | 2.09±0.13 | 1.96±0.12 |
| 头弯曲 | 8.23±0.45 | 7.10±0.33 | 7.16±0.26 |
| 尾折叠 | 5.74±0.72 | 20.96±0.43b | 20.73±0.21b |
| 双尾 | 0.21±0.06 | 0.20±0.05 | 0.12±0.07 |
| 体折叠 | 2.20±0.53 | 2.29±0.38 | 2.39±0.38 |
| 无定型 | 3.57±0.24 | 6.07±0.80a | 5.45±0.13a |
| a: P < 0.05,b: P < 0.01,与野生型比较 | |||
2.5 小鼠精子化学趋向性分析
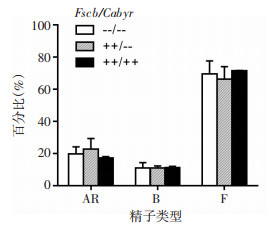
为了评价相关基因敲除对小鼠精子获能及顶体反应能力的影响,利用金霉素(chlorotetracycline, CTC)结合Hoechst染色法观察基因敲除后小鼠精子获能及顶体反应能力的变化。AR型为获能并发生顶体反应精子,头部顶体后半区CTC着色;B型为获能但未发生顶体反应精子,头部顶体后半区CTC未着色;F型为未获能精子,整个头部CTC及Hoechst着色。结果显示:Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)、Fscb/Cabyr(++/++)3种基因型雄性小鼠的F型(未获能精子)、B型(获能但未发生顶体反应的精子)及AR型(发生顶体反应的精子)精子所占比例均无统计学差异(图 4)。
|
| F型:未获能精子;B型:获能但未发生顶体反应的精子;AR型:发生顶体反应的精子 图 4 各基因型雄性小鼠精子顶体反应分析(n=3,x±s) |
2.6 各基因型小鼠精子透射电镜超微结构分析
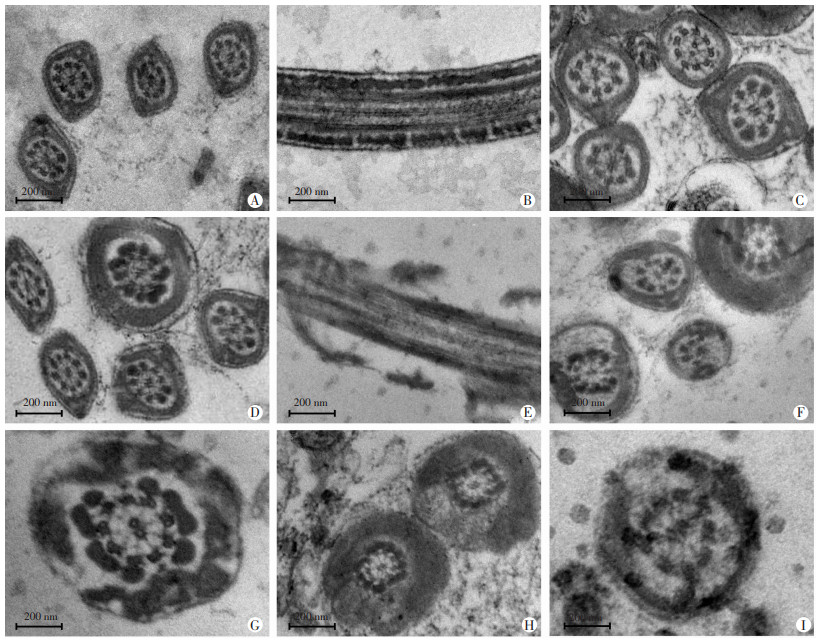
各基因型雄性小鼠附睾原位固定后,透射电镜下观察精子超微结构(图 5),结果显示:Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)3种基因型雄性小鼠精子鞭毛超微结构中9+2的双联微管结构完整且排列均匀,与第3、8双联微管对应的纤维鞘纵行柱状体呈明显圆锥样隆起,环形肋板规则均匀分布,结构清晰完整。Fscb/Cabyr(--/--)、Fscb/Cabyr (++/--)两种基因型雄性小鼠精子鞭毛中的纤维鞘结构出现显著异常,主要表现为大部分精子鞭毛中正常的纤维鞘纵行柱状体结构消失,环形肋板结构紊乱,呈不规则、不均匀分布,且存在不规则缺失,电子密度不均匀降低,在精子尾部横断面和纵切面上纤维鞘呈显著疏松或增厚的表现。纤维鞘与外致密纤维间间隙不规则增大。同时,见部分精子的双联微管结构排列不规则,存在个别缺失和中心双联微管分离现象。
|
| A:Fscb/Cabyr(++/++)野生型小鼠精子鞭毛横断面示中央规则排列的9+2双联微管结构,表面包绕均匀致密的纤维鞘结构,与第3、8双联微管相邻的纤维鞘显著圆锥形隆起为纵行柱状体;B:Fscb/Cabyr(++/++)野生型小鼠精子鞭毛纵切面示环形肋板规则均匀分布,结构清晰完整;C:Fscb/Cabyr(--/+-)型小鼠精子鞭毛纤维鞘结构清晰完整;D:Fscb/Cabyr(++/+-)型小鼠精子鞭毛纤维鞘结构清晰完整;E~G:Fscb/Cabyr(++/--)型小鼠精子鞭毛纵切面和横断面示纤维鞘纵行柱状体结构消失,环形肋板明显结构疏松、排列紊乱,呈明显不规则不均匀分布,纤维鞘与双联微管间间隙不规则增大,部分鞭毛内见双联微管缺失;H、I:分别为Fscb/Cabyr(--/--)型与Fscb/Cabyr(++/--)型小鼠精子纤维鞘环形肋板呈显著疏松,增厚和不规则表现,可见不规则缺损 图 5 各基因型小鼠附睾内精子的透射电镜下超微结构特征 |
3 讨论
临床上导致男性不育的常见原因之一是精子运动能力降低,而精子尾部鞭毛结构是影响精子运动能力的关键因素。正常精子尾部鞭毛主要是由含一对中央双联微管(CP)和环绕外周的9个双联微管(OD)构成的9+2轴丝结构,以及包绕于轴丝表面的外周致密纤维(ODF)和纤维鞘(FS)构成[15]。研究表明位于精子尾部主段的纤维鞘这一独特细胞骨架结构在精子运动中调节鞭毛的柔韧度、摆动方向及幅度[16]。且基于大多数糖酵解酶和多种重要信号传导通路和代谢通路的成分定位于纤维鞘上,因而,纤维鞘在为精子鞭毛运动提供能量和信号转导通路方面具有重要作用[3-6]。纤维鞘相关蛋白的正常表达和装配对于精子正常运动功能至关重要,相关基因遗传缺陷或突变可能会影响精子纤维鞘的正常结构,从而影响精子的运动功能[6-10]。
纤维鞘相关蛋白CABYR和FSCB的生物学特性和功能研究一直是本课题组研究的重点方向之一。CABYR和FSCB两种蛋白均是在精子形成后期表达并逐渐特异性迁移至精子纤维鞘上。二者均具有钙结合能力,并在获能过程中发生磷酸化调节。研究证实,CABYR蛋白和纤维鞘骨架蛋白AKAP3、AKAP4及Rho信号通路蛋白ROPN1均具有明确的相互作用,可能形成巨分子复合物,参与精子鞭毛运动[4-5]。同时,FSCB蛋白也是本课题组进行CABYR及其巨分子复合物研究中率先发现和鉴定的一种与CABYR结合的纤维鞘蛋白[11]。上述研究表明在纤维鞘中,结构蛋白、信号通路蛋白、钙结合蛋白等多类蛋白之间具有复杂而紧密的相互作用关系,共同发挥纤维鞘的生理功能。而CABYR和FSCB蛋白可能在鞭毛纤维鞘上作为蛋白复合体的一部分发挥作用。为进一步深入探讨FSCB和CABYR蛋白复合物在精子纤维鞘中的生理作用,以及该两种蛋白缺失可能对精子相关结构和功能造成的影响及其发生机制,本课题组在构建Fscb单基因敲除小鼠的基础上,进一步进行了Cabyr基因的敲除,并构建了Fscb/Cabyr(--/--)双基因敲除小鼠[14]。本研究通过对单基因和双基因敲除小鼠精子的光镜及电镜下的形态学特征改变和精子运动参数的改变,探讨了FSCB和CABYR蛋白复合物在精子纤维鞘结构和精子运动功能中的作用。
本研究结果显示,Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)3种基因型雄性小鼠睾丸的曲细精管结构均清晰、完整,各级生精细胞排列紧密规则,管腔内充满成熟精子,三者无明显差异。结合通过附睾取精进行的精子密度观察,也显示单基因或双基因敲除小鼠的精子密度同野生型小鼠相比均无明显变化。这表明Fscb/Cabyr(--/--)双基因敲除对精子形成的数量并不造成明显影响。但通过精子运动参数的深入分析发现,无论是Fscb/Cabyr(++/--)型还是Fscb/Cabyr(--/--)型小鼠均显示其PR和PR+NP显著降低,同时,VCL、VSL、VAP、BCF、ALH等各运动参数均较Fscb/Cabyr(++/++)野生型雄性小鼠显著降低。这表明纤维鞘相关重要蛋白CABYR的正常表达和纤维鞘结构的完整装配对于精子运动功能的维持至关重要。纤维鞘蛋白是维持正常纤维鞘功能所必须的重要蛋白。同时,本研究结果还发现,Fscb/Cabyr(--/+-)型小鼠精子与Fscb/Cabyr(++/++)野生型小鼠精子相比,仅VCL和ALH两项参数明显降低,其他各项指标均无显著差别。这表明单纯FSCB蛋白的缺失对精子运动功能影响轻微,结合本课题组前期所发现的单纯敲除Fscb后雄性小鼠生育能力无异常的现象,表明FSCB蛋白在纤维鞘结构和功能中的价值较小,或可能存在其他蛋白的代偿,从而使单敲除该基因的纯合子雄性小鼠未表现出精子运动参数和受精功能的明显改变。
在精子形成过程中,正常鞭毛结构的构建有赖于数以百计的蛋白质的正常合成、转运、重新编排、组装,使其合理有序地定位于特定的亚细胞结构中,从而形成极为精确严密的特定亚细胞结构[17],满足精子的特定生物学功能。在小鼠中使用靶向基因缺失的研究已经揭示了许多基因的功能,显示这些基因对精子的形态发生和生育能力极为重要[1-2];然而,尽管经过几十年的研究,人们至今尚不清楚发育中的精子细胞如何协调大量蛋白质的合成和各种亚细胞结构的形成,以及哪些信号通路参与其中对这些过程进行调控。也不清楚精子不同亚细胞结构的形成是协同进行的,还是各自通过独立的途径构建的。但前期有关影响精子形态的某些基因突变研究显示,通常单个基因表达缺陷会导致不止一个亚细胞结构的缺陷,表明精子的细胞形态发生更可能是一个系统调节的过程[9]。正常小鼠从圆精细胞到形成精子需经历16个不同的步骤[18-19]。将小鼠CABYR的表达和定位模式与其他FS蛋白进行比较,表明CABYR可能是在其他多种FS蛋白组装后被整合到FS表面的[5]。如纤维鞘主要蛋白AKAP3是在精子形成的第4步首先表达于圆精细胞细胞质内,在第9步最初出现于长精细胞的鞭毛内[20]。而研究已经显示CABYR蛋白及FSCB蛋白的最初表达与APAP4的时相性特征[20]极为相似,发生在精子形成的第11步,在精子形成的第12~15步逐渐增加。在14~16步逐渐迁移到精子鞭毛并定位到纤维鞘[5, 11]。表明在正常生理情况下,CABYR蛋白及FSCB蛋白的表达和装配是处于纤维鞘形成的后期阶段。为进一步明确Cabyr和/或Fscb基因敲除对精子形态学特征的影响,本研究分别在光镜和电镜下对精子的形态特征进行观察,结果发现与野生型小鼠相比,Fscb/Cabyr(++/--)型和Fscb/Cabyr(--/--)型小鼠正常精子比例显著降低,高达20%以上的精子出现显著的尾折叠表现,其比例显著增高,无定型精子比例也明显增高。这表明CABYR蛋白表达的缺失同CABYR及FSCB两种蛋白表达的缺失一样,均导致精子尾部结构的形成障碍,从而导致精子尾部形态显著改变。结合电镜下的精子超微结构改变,发现上述单敲除Cabyr基因和Fscb/Cabyr双敲除的纯合子小鼠精子均表现为大部分精子鞭毛中正常的纤维鞘纵行柱状体结构消失,环形肋板结构紊乱,呈明显不规则、不均匀分布,且存在大片状不规则缺失,纤维鞘呈显著疏松或增厚的表现。同时,部分精子纤维鞘与外致密纤维间隙不规则增大。部分精子呈双联微管排列不规则、缺失和中央两个微管分离现象。表明CABYR及FSCB两种蛋白不但参与了精子纤维鞘完整结构的形成,同时还可能影响到轴丝正常装配和形成,最终严重影响精子的运动特征和功能。
| [1] |
KRAUSZ C, RIERA-ESCAMILLA A. Genetics of male infertility[J]. Nat Rev Urol, 2018, 15(6): 369-384. DOI:10.1038/s41585-018-0003-3 |
| [2] |
MATZUK M M, LAMB D J. The biology of infertility: research advances and clinical challenges[J]. Nat Med, 2008, 14(11): 1197-1213. DOI:10.1038/nm.f.1895 |
| [3] |
MIKI K, WILLIS W D, BROWN P R, et al. Targeted disruption of the Akap4 gene causes defects in sperm flagellum and motility[J]. Dev Biol, 2002, 248(2): 331-342. DOI:10.1006/dbio.2002.0728 |
| [4] |
LI Y F, HE W, MANDAL A, et al. CABYR binds to AKAP3 and Ropporin in the human sperm fibrous sheath[J]. Asian J Androl, 2011, 13(2): 266-274. DOI:10.1038/aja.2010.149 |
| [5] |
LI Y F, HE W, KIM Y H, et al. CABYR isoforms expressed in late steps of spermiogenesis bind with AKAPs and ropporin in mouse sperm fibrous sheath[J]. Reprod Biol Endocrinol, 2010, 8: 101. DOI:10.1186/1477-7827-8-101 |
| [6] |
NAKAMURA N, DAI Q, WILLIAMS J, et al. Disruption of a spermatogenic cell-specific mouse enolase 4 (eno4) gene causes sperm structural defects and male infertility[J]. Biol Reprod, 2013, 88(4): 90. DOI:10.1095/biolreprod.112.107128 |
| [7] |
BACCETTI B, COLLODEL G, ESTENOZ M, et al. Gene deletions in an infertile man with sperm fibrous sheath dysplasia[J]. Hum Reprod, 2005, 20(10): 2790-2794. DOI:10.1093/humrep/dei126 |
| [8] |
FIEDLER S E, DUDIKI T, VIJAYARAGHAVAN S, et al. Loss of R2D2 proteins ROPN1 and ROPN1L causes defects in murine sperm motility, phosphorylation, and fibrous sheath integrity[J]. Biol Reprod, 2013, 88(2): 41. DOI:10.1095/biolreprod.112.105262 |
| [9] |
XU K, YANG L, ZHANG L, et al. Lack of AKAP3 disrupts integrity of the subcellular structure and proteome of mouse sperm and causes male sterility[J]. Development, 2020, 147(2): dev181057. DOI:10.1242/dev.181057 |
| [10] |
YOUNG S A, MIYATA H, SATOUH Y, et al. CABYR is essential for fibrous sheath integrity and progressive motility in mouse spermatozoa[J]. J Cell Sci, 2016, 129(23): 4379-4387. DOI:10.1242/jcs.193151 |
| [11] |
LI Y F, HE W, JHA K N, et al. FSCB, a novel protein kinase A-phosphorylated calcium-binding protein, is a CABYR-binding partner involved in late steps of fibrous sheath biogenesis[J]. J Biol Chem, 2007, 282(47): 34104-34119. DOI:10.1074/jbc.m702238200 |
| [12] |
周庭友, 张勇, 张军, 等. FSCB基因敲除对雄性小鼠生殖功能的影响[J]. 第三军医大学学报, 2016, 38(15): 1729-1734. ZHOU T Y, ZHANG Y, ZHANG J, et al. Knockout of fibrous sheath CABYR-binding on reproductive function in male mice[J]. J Third Mil Med Univ, 2016, 38(15): 1729-1734. DOI:10.16016/j.1000-5404.201511059 |
| [13] |
周庭友, 孙中义, 张勇, 等. 鼠fscb基因靶向敲除载体的构建及动物模型的建立[J]. 第三军医大学学报, 2015, 37(15): 1527-1533. ZHOU T Y, SUN Z Y, ZHANG Y, et al. Construction of targeting vectors using CRISPR/Cas9 system and the generation of fscb knockout mice[J]. J Third Mil Med Univ, 2015, 37(15): 1527-1533. DOI:10.16016/j.1000-5404.201503197 |
| [14] |
李中泰, 李彦锋, 刘晋祎, 等. 鼠Fscb/Cabyr双基因靶向敲除动物模型的建立和鉴定[J]. 第三军医大学学报, 2020, 42(19): 1898-1906. LI Z T, LI Y F, LIU J Y, et al. Establishment and identification of a mouse model of Fscb/Cabyr double gene knockout[J]. J Third Mil Med Univ, 2020, 42(19): 1898-1906. DOI:10.16016/j.1000-5404.202005029 |
| [15] |
INABA K. Molecular architecture of the sperm flagella: molecules for motility and signaling[J]. Zool Sci, 2003, 20(9): 1043-1056. DOI:10.2108/zsj.20.1043 |
| [16] |
EDDY E M, TOSHIMORI K, O'BRIEN D A. Fibrous sheath of mammalian spermatozoa[J]. Microsc Res Tech, 2003, 61(1): 103-115. DOI:10.1002/jemt.10320 |
| [17] |
IGUCHI N, TOBIAS J W, HECHT N B. Expression profiling reveals meiotic male germ cell mRNAs that are translationally up-and down-regulated[J]. Proc Natl Acad Sci USA, 2006, 103(20): 7712-7717. DOI:10.1073/pnas.0510999103 |
| [18] |
OAKBERG E F. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium[J]. Am J Anat, 1956, 99(3): 507-516. DOI:10.1002/aja.1000990307 |
| [19] |
CLERMONT Y, TROTT M. Duration of the cycle of the seminiferous epithelium in the mouse and hamster determined by means of 3H-thymidine and radioautography[J]. Fertil Steril, 1969, 20(5): 805-817. DOI:10.1016/s0015-0282(16)37153-9 |
| [20] |
BROWN P R, MIKI K, HARPER D B, et al. A-kinase anchoring protein 4 binding proteins in the fibrous sheath of the sperm flagellum[J]. Biol Reprod, 2003, 68(6): 2241-2248. DOI:10.1095/biolreprod.102.013466 |




