2. 610041 成都,四川大学华西医院重症医学科
2. Department of Critical Care Medicine, West China Hospital, Sichuan University, Chengdu, Sichuan Province, 610041, China
体外循环作为关键技术手段,为心内直视手术的广泛开展保驾护航。但体外循环过程相关炎症反应错综复杂,存在各种炎症因子的释放和炎症细胞聚集。它们交错存在,相互影响,协同作用,常导致靶器官功能受损[1],明显影响患者预后[2-4]。关注体外循环过程各种炎症因子的来源、致炎作用以及与其他炎症细胞的关系,有助于体外循环炎症反应机制的研究,并最终可能改善患者预后。
mtDNA作为新近热点炎症因子,其释放机制和致炎作用是近期关注焦点。在创伤或急性心肌梗死导致的严重组织损伤过程中,血浆mtDNA水平的升高提示其释放的关键是不可控的细胞应激和死亡[5-7]。在脂肪肝、系统性红斑狼疮等疾病过程中出现血浆mtDNA水平的增加,说明其致炎作用可能参与自体异常免疫和炎症反应[8]。在体外循环过程中也存在大量细胞应激和炎症反应,mtDNA与体外循环相关炎症反应关系如何,尚无定论。已有研究发现体外循环心脏术后血浆mtDNA水平随时间推移逐渐升高,至术后24 h达到峰值,然后逐渐下降,推测mtDNA可能积极参与了体外循环过程的炎症反应[9]。关注mtDNA与体外循环术后早期炎症细胞和炎症因子之间的联系,有助于探究mtDNA与体外循环相关炎症反应的关联,以及在此过程中可能的来源和潜在功能作用。
1 资料与方法 1.1 研究对象2015年9月1日到2016年12月1日,在华西医院心脏大血管外科接受体外循环心脏手术患者,年龄≥18岁,签署患者知情同意书,且术后入住成人心脏外科监护室的。本研究获得华西医院伦理委员会的批准(华西医院2015年审83号)。
1.2 方法 1.2.1 标本的采集(1) 时间:体外循环心脏手术结束返回ICU后半小时内。
(2) 方法:EDTA抗凝采血管采集外周静脉血4 mL;忌用力抽吸;即刻于4 ℃离心机离心(7 000 r/min,15 min);将上清液(血浆)放于1.5 mL规格的EP管中,于-20 ℃冰箱保存备用。
(3) 检测内容:血常规、肝功和肾功、NT-proBNP、IL-6、CRP、PCT和mtDNA。
1.2.2 mtDNA的检测和浓度计算(1) 检测按照荧光定量聚合酶链式反应(PCR)标准方法进行。
(2) 提取mtDNA,使用NanoDrop© ND-1000测定提取DNA的浓度和纯度,采用10倍稀释序列,制备标准曲线。
(3) 使用标准的转换系统将mtDNA浓度单位转换成拷贝数(copies)。
(4) 血浆mtDNA浓度的计算公式为:c=Q×VDNA/VPCR×1/VEXT [c为血浆mtDNA浓度;Q为荧光定量PCR检测的样本中mtDNA的拷贝数;VDNA为提取DNA过程中最后一步AE缓冲液的体积(200 μL);VPCR为荧光定量PCR配置体系中加入样本的体积(1 μL);VEXT为提取DNA过程中第一步使用的血浆总量(50 μL)]。
1.3 统计学方法经正态性检验,血浆mtDNA水平、血小板活化水平、中性粒细胞绝对值、IL-6水平、CRP水平均不服从正态分布。血浆mtDNA水平、血小板活化程度、IL-6水平、经自然对数转换后服从正态分布;中性粒细胞绝对值经开平方根转换后服从正态分布;CRP水平经取倒数转换后服从正态分布。经过数据转换后相关性分析采用直线相关,以皮尔逊积矩相关系数(Pearson product-moment correlation coefficient,PPMCC或PCCs)r来表示相关程度;当数据缺失率 < 10%时,采用多重填补(multiple imputation)方法处理缺失数据;当数据缺失率>10%时,该指标不纳入研究。
所有的统计学处理采用SAS 9.4,R 3.2.4,SPSS 21.0统计软件。检验水准α=0.05。
2 结果 2.1 病例资料基本情况本研究共纳入962名患者,其中男性459名,女性503名,年龄18~75.8 (51.6±12.5)岁;BMI为14.8~34.9 (22.9±3.29) kg/m2;机械通气时间2~232.5 (30.27±36.99) h;住ICU时间1~12 d[(2.88±1.79) h]。手术方式均为体外循环下心脏手术,其中瓣膜手术692例(其中二尖瓣置换术198例,主动脉瓣置换术224例,双瓣膜置换术261例,三尖瓣置换术9例),单纯冠状动脉旁路移植手术83例,冠状动脉旁路移植加换瓣手术58例,大血管手术79例,简单先心手术35例(其中房中隔缺损15例,室中隔缺损20例),其他手术15例。
2.2 血浆mtDNA水平与体外循环心脏术后炎症细胞的相关性分析 2.2.1 血浆mtDNA水平与体外循环心脏术后血小板活化程度相关性数据本身不服从正态分布,经自然对数转换后,两变量之间相关系数r=0.102 7,P=0.002 8,血浆mtDNA水平对数值与体外循环心脏术后血小板活化程度对数值之间存在直线相关(图 1,表 1),即血小板活化程度越高,相应血浆mtDNA水平越高。

|
| 相关分析r=0.102 7,P=0.002 8;血小板活化水平=平均血小板体积/血小板计数 图 1 血浆mtDNA水平和体外循环心脏术后血小板活化程度的散点图 |
| 因子指标 | r | P |
| 血小板活化水平 | 0.1027 | 0.0028 |
| 中性粒细胞计数 | 0.1069 | 0.0040 |
| IL-6 | 0.0798 | 0.0453 |
| CRP | 0.0565 | 0.5968 |
2.2.2 血浆mtDNA水平与体外循环心脏术后中性粒细胞绝对值相关性
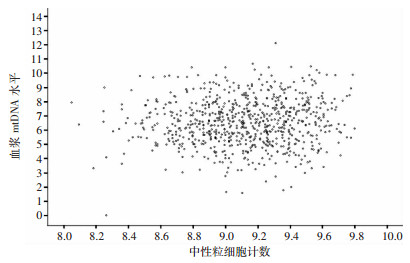
数据本身不服从正态分布,经开平方根转换后,两变量之间相关系数r=0.106 9,P=0.004 0,血浆mtDNA水平平方根数值与体外循环心脏术后中性粒细胞绝对值平方根数值之间存在直线相关(图 2,表 1),即中性粒细胞绝对值越大,相应血浆mtDNA水平越高。
|
| 相关分析r=0.106 9,P=0.004 0 图 2 血浆mtDNA水平和体外循环心脏术后中性粒细胞绝对值的散点图 |
2.3 血浆mtDNA水平与体外循环心脏术后炎症因子的相关性分析 2.3.1 血浆mtDNA水平与体外循环心脏术后IL-6相关性
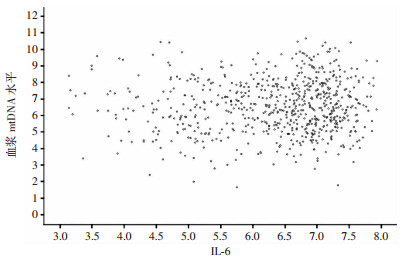
数据本身不服从正态分布,经自然对数转换后,两变量之间相关系数r=0.079 8,P=0.045 3,血浆mtDNA水平对数值与体外循环心脏术后IL-6对数值之间存在直线相关(图 3,表 1),即IL-6水平越高,相应血浆mtDNA水平越高。
|
| 相关分析r=0.079 8,P=0.045 3 图 3 血浆mtDNA水平和体外循环心脏术后IL-6的散点图 |
2.3.2 血浆mtDNA水平与体外循环心脏术后CRP相关性
数据本身不服从正态分布,经mtDNA自然对数转换,C反应蛋白取倒数转换后,两变量之间相关系数r=0.056 5,P=0.596 8,血浆mtDNA水平对数值与体外循环心脏术后CRP倒数值之间不存在直线相关,即二者水平变化趋势之间不存在相关性。
3 讨论体外循环过程中,炎症反应错综复杂,存在大量炎症细胞激活和细胞因子水平变化。活化炎症细胞可以释放各种炎症因子,引起和放大炎症反应。探究血浆mtDNA水平与体外循环心脏术后早期ICU患者炎症细胞计数和炎症因子表达之间的关系有助于揭示mtDNA与体外循环相关炎症反应的联系,以及在此过程中它的可能来源和潜在功能作用。本文将标本采集时间设置在患者返回监护室后的半小时内,这个时间点处于体外循环心脏术后炎症反应的高峰时段内,也是已有研究发现的血浆mtDNA水平的迅速上升期[9-12],在此敏感时间段的标本采集更利于发现血浆mtDNA水平与体外循环心脏术后各种炎症细胞计数和炎症因子表达之间的联系。在大量临床数据分析的基础之上,我们发现血浆mtDNA水平与体外循环心脏术后早期血小板活化程度、中性粒细胞绝对值和IL-6之间具有稳定相关性。它们之间的这种关联不仅提示了血浆mtDNA在此过程中的可能来源和致炎作用,更反映了血浆mtDNA与体外循环心脏术后ICU患者的全身炎症反应之间的密切联系。
本研究发现血浆mtDNA水平与体外循环心脏术后血小板活化程度之间有相关性。血小板活化程度是目前常用的用于反映血小板作为炎症细胞在体外循环过程中活化情况的指标,以平均血小板体积/血小板计数来表示[13],这主要是考虑到体外循环过程中血小板可能出现严重的功能障碍和数量减少[14]。已有研究发现,体外循环过程中血小板活化程度峰值在血浆mtDNA水平峰值之前出现,且二者峰值变化具有相关性[15]。这个研究揭示了血小板活化与血浆mtDNA水平之间的可能联系,提示体外循环过程中血小板活化可能是血浆mtDNA的来源之一。本研究通过更大样本量的相关性研究也发现了类似的关联,这个结果提示了血小板活化可能是血浆mtDNA的来源之一,以及一种可能的体外循环炎症反应机制。
其实,许多研究已经发现血小板可以参与炎症反应。血小板内包含活性成分,如细胞因子、黏附因子和凝血因子等[16]。这些成分是血小板参与炎症反应的基础。它们可以直接作用于其他血小板、白细胞和内皮细胞等,也可以通过促进这些细胞激活引起炎症。因而,血小板活化后可以释放炎症因子[17]参与炎症反应,也可以通过与炎症细胞交互作用,放大炎症反应。已有研究发现心肌损伤和某些急性心血管事件都与血小板的过度活化密切相关[18]。同时也有研究发现,活化血小板也可以将mtDNA释放到循环中,并通过作为磷脂酶A2 ⅡA的底物来促进炎症[19]。而体外循环过程本身存在血小板激活,因此,体外循环心脏术后存在活化血小板释放mtDNA的可能性。
体外循环过程存在中性粒细胞的激活和清除延迟。活化的中性粒细胞可以释放蛋白酶、氧自由基等引起组织损伤,也可以激活更多炎症细胞加重组织损伤。中性粒细胞的过度激活和清除延迟导致炎症反应和器官功能障碍,是体外循环心脏术后肺损伤发生的主要机制[2, 20-21]。研究发现中性粒细胞可以释放mtDNA形成中性粒细胞外陷阱(NET)[22],参与捕获和消灭循环中的病原微生物,包括细菌、真菌和病毒等[23]。NET由mtDNA单独组成,说明特殊炎症情况下,中性粒细胞可能是循环mtDNA的主要来源。本研究发现血浆mtDNA水平与体外循环心脏术后中性粒细胞绝对值有相关性,这个初步发现提示在体外循环的炎症环境中二者之间存在联系,活化中性粒细胞可能是血浆mtDNA的来源之一。当然,也有研究发现mtDNA可以引起中性粒细胞激活,并可以通过TLR9、MAPK p38的激活等引起严重的免疫反应[24]。本研究初步发现这个相关性的存在,至于二者的因果关系还需要进一步的基础研究进行明确。
在炎症因子方面,本研究发现血浆mtDNA水平与IL-6水平具有相关性,并没有发现其与CRP之间的联系。这可能与不同炎症因子的作用和释放时间不同有关。IL-6是体外循环术后早期释放的重要促炎因子之一,其释放时点与我们抽取mtDNA的时点比较接近。因此,二者之间的这种关联提示mtDNA与IL-6具有相近的释放时段,也说明它们在致炎作用方面的相关性。CRP是感染和应激状态下机体产生的急性蛋白[25],通过激活补体和清除凋亡细胞参与炎症反应。CRP水平升高相对较晚,一般在体外循环术后24 h左右。没有发现二者相关性的可能原因有两个,一是mtDNA采血时点与CRP释放时段没有重合,二是CRP的作用不仅限于炎症,更是一个提示感染的敏感指标。
综上所述,本研究通过大量临床数据的分析,发现了血浆mtDNA水平与体外循环心脏术后血小板活化程度和中性粒细胞绝对值这两个炎症细胞之间的相关关系,也发现了血浆mtDNA水平与炎症因子IL-6之间的联系。既往其他研究发现这些炎症细胞激活后都可以释放mtDNA,因而体外循环过程中它们也可能是血浆mtDNA的释放来源。血浆mtDNA水平与炎症细胞和炎症因子之间的相关关系更表明了它与体外循环心脏术后早期ICU患者全身炎症反应之间的密切联系。
| [1] |
LANDIS R C. Redefining the systemic inflammatory response[J]. Semin Cardiothorac Vasc Anesth, 2009, 13(2): 87-94. DOI:10.1177/1089253209337743 |
| [2] |
HUFFMYER J L, GROVES D S. Pulmonary complications of cardiopulmonary bypass[J]. Best Pract Res Clin Anaesthesiol, 2015, 29(2): 163-175. DOI:10.1016/j.bpa.2015.04.002 |
| [3] |
HERBERT C, PATEL M, NUGENT A, et al. Serum cystatin C as an early marker of neutrophil gelatinase-associatedlipocalin-positive acute kidney injury resulting from cardiopulmonary bypass in infants with congenital heart disease[J]. Congenit Heart Dis, 2015, 10(4): E180-E188. DOI:10.1111/chd.12253 |
| [4] |
GANUSHCHAK Y M, FRANSEN E J, VISSER C, et al. Neurological complications after coronary artery bypass grafting related to the performance of cardiopulmonary bypass[J]. Chest, 2004, 125(6): 2196-2205. DOI:10.1378/chest.125.6.2196 |
| [5] |
BLIKSØEN M, MARIERO L H, OHM I K, et al. Increased circulating mitochondrial DNA after myocardial infarction[J]. Int J Cardiol, 2012, 158(1): 132-134. DOI:10.1016/j.ijcard.2012.04.047 |
| [6] |
WANG L, XIE L, ZHANG Q G, et al. Plasma nuclear and mitochondrial DNA levels in acute myocardial infarction patients[J]. Coron Artery Dis, 2015, 26(4): 296-300. DOI:10.1097/MCA.0000000000000231 |
| [7] |
QIN C Y, GU J, LIU R Q, et al. Release of mitochondrial DNA correlates with peak inflammatory cytokines in patients with acute myocardial infarction[J]. Anatol J Cardiol, 2017, 17(3): 224-228. DOI:10.14744/AnatolJCardiol.2016.7209 |
| [8] |
CAIELLI S, ATHALE S, DOMIC B, et al. Oxidized mitochondrial nucleoids released by neutrophils drive type I interferon production in human lupus[J]. J Exp Med, 2016, 213(5): 697-713. DOI:10.1084/jem.20151876 |
| [9] |
秦超毅, 古君, 钱宏, 等. 体外循环围手术期血液中线粒体DNA浓度变化[J]. 中国胸心血管外科临床杂志, 2015, 22(3): 241-244. QIN C Y, GU J, QIAN H, et al. Variation of perioperative mitochondrial DNA concentration after cardiopulmonary bypass[J]. Chin J Clin Thorac Cardiovasc Surg, 2015, 22(3): 241-244. |
| [10] |
NISSANKA N, MORAES C T. Mitochondrial DNAheteroplasmy in disease and targeted nuclease-based therapeutic approaches[J]. EMBO Rep, 2020, 21(3): e49612. DOI:10.15252/embr.201949612 |
| [11] |
范景秀, 朱慧莉. 线粒体DNA致病作用的研究进展[J]. 中国胸心血管外科临床杂志, 2020, 27(10): 1242-1246. FAN J X, ZHU H L. Research progress of mitochondrial DNA as a pathogenic factor in diseases[J]. Chin J Clin Thorac Cardiov Surg, 2020, 27(10): 1242-1246. |
| [12] |
BAYSA A, FEDOROV A, KONDRATOV K, et al. Release of mitochondrial and nuclear DNA during on-pump heart surgery: Kinetics and relation to extracellular vesicles[J]. J Cardiovasc Transl Res, 2019, 12(3): 184-192. DOI:10.1007/s12265-018-9848-3 |
| [13] |
CHO S Y, JEON Y L, KIM W, et al. Mean platelet volume and mean platelet volume/platelet count ratio in infective endocarditis[J]. Platelets, 2014, 25(8): 559-561. DOI:10.3109/09537104.2013.857394 |
| [14] |
SNIECINSKI R M, CHANDLER W L. Activation of the hemostatic system during cardiopulmonary bypass[J]. Anesth Analg, 2011, 113(6): 1319-1333. DOI:10.1213/ANE.0b013e3182354b7e |
| [15] |
QIN C Y, GU J, HU J, et al. Platelets activation is associated with elevated plasma mitochondrial DNA during cardiopulmonary bypass[J]. J Cardiothorac Surg, 2016, 11(1): 1-9. DOI:10.1186/s13019-016-0481-4 |
| [16] |
ZARBOCK A, POLANOWSKA-GRABOWSKA R K, LEY K. Platelet-neutrophil-interactions: linking hemostasis and inflammation[J]. Blood Rev, 2007, 21(2): 99-111. DOI:10.1016/j.blre.2006.06.001 |
| [17] |
VARON D, SHAI E. Platelets and their microparticles as key players in pathophysiological responses[J]. J Thromb Haemost, 2015, 13: S40-S46. DOI:10.1111/jth.12976 |
| [18] |
CANGEMI R, CASCIARO M, ROSSI E, et al. Platelet activation is associated with myocardial infarction in patients with pneumonia[J]. J Am Coll Cardiol, 2014, 64(18): 1917-1925. DOI:10.1016/j.jacc.2014.07.985 |
| [19] |
BOUDREAU L H, DUCHEZ A C, CLOUTIER N, et al. Platelets release mitochondria serving as substrate for bactericidal group ⅡA-secreted phospholipase A2 to promote inflammation[J]. Blood, 2014, 124(14): 2173-2183. DOI:10.1182/blood-2014-05-573543 |
| [20] |
INOUE N, OKA N, KITAMURA T, et al. Neutrophil elastase inhibitor sivelestat attenuates perioperative inflammatory response in pediatric heart surgery with cardiopulmonary bypass[J]. Int Heart J, 2013, 54(3): 149-153. DOI:10.1536/ihj.54.149 |
| [21] |
RINDER C S, SMITH M J, RINDER H M, et al. Leukocyte effects of C5a-receptor blockade during simulated extracorporeal circulation[J]. Ann Thorac Surg, 2007, 83(1): 146-152. DOI:10.1016/j.athoracsur.2006.08.019 |
| [22] |
YOUSEFI S, MIHALACHE C, KOZLOWSKI E, et al. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps[J]. Cell Death Differ, 2009, 16(11): 1438-1444. DOI:10.1038/cdd.2009.96 |
| [23] |
BRINKMANN V, ZYCHLINSKY A. Neutrophil extracellular traps: is immunity the second function of chromatin?[J]. J Cell Biol, 2012, 198(5): 773-783. DOI:10.1083/jcb.201203170 |
| [24] |
KRYCHTIUK K A, RUHITTEL S, HOHENSINNER P J, et al. Mitochondrial DNA and toll-like receptor-9 are associated with mortality in critically ill patients[J]. Crit Care Med, 2015, 43(12): 2633-2641. DOI:10.1097/CCM.0000000000001311 |
| [25] |
TAMURA Y, NOMURA A, YOSHIDA S, et al. Quick Sepsis-related organ failure assessment score as a possible predictor for in-hospital adverse events in infective endocarditis[J]. Acute Med Surg, 2019, 6(2): 138-144. DOI:10.1002/ams2.393 |




