肺部结节是常见的肺部疾病,影像学检查显示肺实质内出现单个或多个圆形或与肺不张及局部淋巴结肿大相关的椭圆形致密阴影,直径通常小于3 cm。随着影像学技术的不断发展,胸部X线片、高分辨率CT的应用,肺部结节(包括磨玻璃结节)的检出率逐年上升[1]。根据影像学特征,肺部结节主要分为非实性、部分实性和实性结节,同时根据与周围组织的外部形态关系,可表现为边界是否光滑、规则,有无明显的分叶和毛刺等特征。虽然可根据结节的影像学特点评估结节性质,但在实际临床诊断中发现,该方法存在明显不足,需要其他检查辅助诊断。且对于微小结节(直径≤1 cm)而言,影像学方法难以区分较小的肺部结节良恶性质[2]。低剂量螺旋CT、PET-CT容易受结节过小、低肿瘤代谢活性和高血糖等因素干扰,假阳性率较高[3]。因此,很多患者选择定期随访,耽误了及早治疗的时机;虽通过穿刺或钳取等手段对病变的性质进行鉴定,但这些方式是有创的,部分患者不能耐受。当结节较小,位置复杂时,手术难以进行,对肺部结节病变的管理存在困难[2]。
叶酸受体(folate receptor, FR)是一种糖基磷脂酰肌醇偶联蛋白,正常人血液细胞(除巨噬细胞)中FR受体一般无表达,是理想的肺癌循环肿瘤细胞(circulating tumor cell, CTC)检测靶点[4]。研究表明大部分非小细胞肺癌(non-small cell lung cancer, NSCLC)中FR表达显著上调,每个肺癌肿瘤细胞表面约有50万个FR受体[5-6]。FR作为肿瘤靶点在核医学显像诊断与肿瘤治疗方面已有较为广泛的应用[7],市面上已有开发的针对FR受体的CTC商业化检测试剂盒。其原理是通过负向富集法去除血液中可能干扰的白细胞,结合特异性叶酸配体-寡聚核苷酸偶合物标记、聚合酶链式反应(PCR)技术,实现外周血CTC定量的检测技术。利用FR特异性抗体靶向识别肿瘤细胞,通过两次信号放大,该方法检测灵敏度显著提高,使血液中数量稀少的CTC检出率大幅上升。为了验证CTC检测在肺癌辅助诊断中的价值,本研究对288例肺部结节病患者采用靶向FR CTC检测技术,结合患者的病理检查结果进行回顾性分析,评价该检测方法在肺癌辅助诊断中的可靠性。本研究采用回顾性分析探讨该方法在肺癌早期辅助诊断中的可行性,以及存在的不足之处。
1 资料与方法 1.1 研究对象选取本院2017年5月至2018年4月收治的肺部检查结节患者288例进行回顾性分析,其中男性163例,女性125例,年龄20~85岁,平均53.8岁。所有患者行胸部CT检查发现肺上有性质不明的结节,未确诊前均行靶向FR CTC检测。结合患者术后病理诊断报告评估该CTC检测对早期肺部结节的诊断准确性。对于部分未行手术病理检查的病例的阴性判读标准评价标准为:随访1年以上结节消失或无明显增大,患者无明显不适症状。
纳入标准:①年龄20~85岁;②肺部CT检查发现阴影结节,结节良恶性质不明;③入组血液样本釆集时,患者未接受肿瘤相关治疗;④采集血液时血常规中白细胞含量正常;⑤既往无其他恶性肿瘤病史。排除标准:①有对比剂过敏、禁忌史(比如青光眼、前列腺肥大);②严重肝、肾功能不全病史(GFR<60 mL/min);③检查前接受分子靶向药物治疗或(和)手术治疗者;④怀孕或育龄、哺乳期妇女;⑤图像质量差者。
1.2 检测方法采用格诺斯博公司开发的CTC检测试剂盒。简要的样本处理程序如下:①取临床标本全血3 mL,加入12 mL细胞裂解液裂解红细胞,离心弃上清。②加入缓冲液重悬细胞后,加入去除磁珠A、B液去除样本中的白细胞(CD45+)。③加入10 μL FR小分子探针抗体标记液,室温孵育40 min;加入洗涤液洗涤后,离心收集细胞。④PCR扩增离心收集细胞,计算校准样本CT值。对于CTC阳性的判定,主要根据多中心受试者临床试验结果,即CTC数值≥8.7 Folate Units/3 mL作为CTC的阳性界定值[8]。其核心技术是采用负向免疫磁珠富集去除血液中的白细胞,通过特异性叶酸配体-寡聚核苷酸偶合物标记和聚合酶链式反应(PCR)技术,两次信号放大实现外周血CTC定量的目的。检出值以Folate Units/3 mL为单位计量,可显示3 mL血液中CTC的相对含量。
1.3 统计学分析采用SPSS 25.0、GraphPad Prism 7软件进行分析,两种病变间CTC检测资料的比较,采用独立样本t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 肺部结节患者基本资料288例肺部结节病患者年龄分布较广,在20~85岁之间,中位年龄53.8岁。40~70岁是肺部结节患者高发年龄,共计231例,占比80.2%。经独立样本t检验发现,男性/女性肺部结节患者CTC检出值差异无统计学意义(P>0.05)。确诊恶性肿瘤136例,良性病变152例。肺部恶性肿瘤136例中含肺腺癌114例、肺鳞癌9例、肺小细胞癌2例、淋巴瘤1例、10例肿瘤不能区分具体的病理类型,肺腺癌占比85%(表 1)。
| 临床特征 | 病例数 | FR阳性CTC例数 | FR阳性CTC比例(%) | P值 |
| 性别 | ||||
| 男性 | 163 | 83 | 50.92 | 0.537 |
| 女性 | 125 | 68 | 54.40 | |
| 肺结节 | ||||
| 恶性 | 136 | 107 | 78.67 | 0.029 |
| 良性 | 152 | 44 | 28.94 | |
| 病理分型 | ||||
| 腺癌 | 114 | 86 | 75.44 | <0.001 |
| 鳞癌 | 9 | 9 | 100.00 | <0.001 |
| 小细胞癌 | 2 | 2 | 100.00 | |
| 其他恶性肿瘤 | 11 | 9 | 81.82 | |
| 临床分期 | ||||
| Ⅰ期 | 91 | 70 | 76.92 | <0.001 |
| Ⅱ~Ⅳ期 | 44 | 28 | 86.36 | <0.001 |
| TNM分期 | ||||
| T1 | 59 | 42 | 71.19 | 0.019 |
| T2 | 45 | 37 | 82.22 | <0.001 |
| T3 | 16 | 13 | 81.25 | <0.001 |
| T4 | 15 | 14 | 93.33 | <0.001 |
| N0 | 93 | 71 | 76.34 | <0.001 |
| N1-3 | 41 | 34 | 82.93 | |
| M0 | 102 | 78 | 76.47 | 0.002 |
| M1 | 30 | 25 | 83.33 | |
| CT影像 | ||||
| 结节≤1 cm | 52 | 38 | 73.08 | 0.029 |
2.2 肺结节患者CTC检出值与临床分期
良性结节病变患者CTC平均水平为8.61(3.10~ 28.70),肺癌组CTC平均水平为11.61 (3.40~38.69),肺癌患者检出CTC值显著高于良性结节患者(P < 0.05)。在123例非小细胞肺癌患者中,Ⅰ期肺癌患者91例,占比73.9%,灵敏度达到76.9%。早期肺部结节通过影像学检查良恶性质难以判断,大部分患者需要行靶向FR CTC检测来辅助诊断。Ⅰ~Ⅳ期肺癌患者中,总体上临床分期越晚,检出CTC数值越高(P < 0.01),检出率也随之小幅上升(图 1)。根据TNM分期,T1~4期结节患者肺癌CTC阳性率分别为71.19%、82.22%、81.25%、93.33%,临床分期越晚,检出CTC数值越高(P < 0.05);有淋巴结和远端转移的患者,总体上CTC检出数值高于无淋巴结和远端转移的患者,阳性率也有较为明显的升高(P < 0.01)。进一步分析发现,91例Ⅰ期肺癌患者CTC水平为10.49 (3.40~26.00),也显著高于肺良性结节患者(P < 0.01)。肺癌患者中9例原位癌CTC检测均为阳性,其中3例低剂量螺旋CT检查未发现问题,但患者CTC检出值显著高于阈值8.7,分别在7~9个月后经组织学诊断确诊为肺原位癌。136例肺部恶性肿瘤患者中,CT影像≤1 cm的微小结节肺癌患者52例,占比38.2%。微小结节肺癌患者CTC中位数值9.87(3.40~20.80),检出CTC值高于阈值患者38例,检出率73.08%。
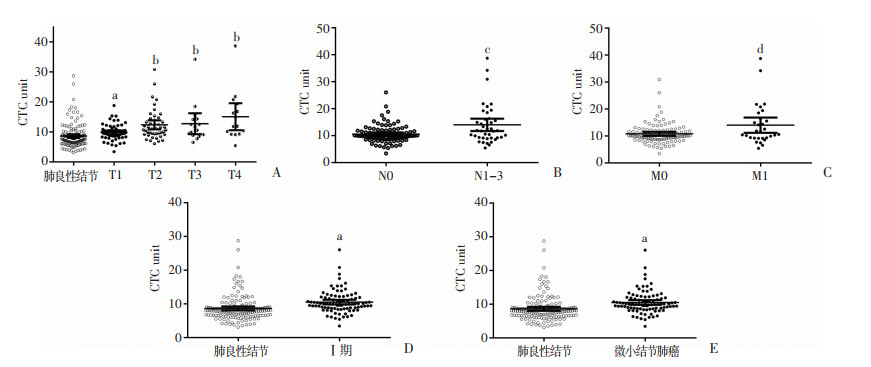
|
| A~C:分别为TNM不同分期肺癌患者CTC水平 a:P < 0.05,b:P < 0.001,与肺良性结节比较;c:P < 0.001,与N0比较;d:P < 0.01,与M0比较;D:良性结节、肺癌Ⅰ期患者CTC水平 a:P < 0.001,与肺良性结节比较;E:良性结节、微小结节肺癌(影像学直径≤1 cm)患者CTC水平a:P < 0.05,与肺良性结节比较 图 1 肺良性结节、肺癌患者CTC水平 |
2.3 干扰靶向FR CTC检测的因素
152例肺部良性病变结节患者中,假阳性病例44例,病理诊断结果主要为结核杆菌感染、慢性炎或者炎性假瘤、非典型性腺瘤样增生,假阳性率28.9%。病理诊断为结核杆菌感染、慢性炎或者炎性假瘤患者CTC检出均值分别达到12.40、13.09,去除结核感染和慢性炎患者40例,良性病变组平均CTC数值为7.32,显著低于肺部恶性肿瘤患者(11.61,P < 0.01)。
3 讨论肺癌是全球发病率、死亡率最高的恶性肿瘤[9]。在中国,很多患者发现时已是中晚期或已发生淋巴结和远端转移,外科手术切除不能达到根治的效果,约80%的术后患者存在复发和转移。确诊时临床分期越晚,行肺癌切除或有效的化疗效果越差,Ⅰ期患者5年生存率可达到70%,而Ⅳ期患者总体5年生存率只有约10%。因此,肺癌患者要想获得良好的治疗效果,早诊断、早治疗成为改善预后的关键所在[10]。早期的肺癌没有临床症状或症状较轻微,不易被发现。因此对于早期肺部病变,尤其是肺部结节良恶性的判定至关重要,对肺癌的早期诊断具有十分重要的意义。肺部是结节病的常见侵犯器官,大部分肺部结节是良性病变,且临床症状都是常见的咳嗽、气短等,不易与肺部恶性肿瘤区分。
外周血CTC是指主动或被动从实体肿瘤或转移灶脱离,释放入血的肿瘤细胞或细胞团。从首次发现以来逐渐成为肿瘤学科中的研究热点[11],在肿瘤发生的早期就可释放入血,条件适合可在特定器官种植、生长,是导致患者预后差、复发的主要原因。CTC在外周血液中数量极少,一般每106~107单核细胞中存在1个CTC。因此,对检测方法的敏感度及特异性要求较高。目前在肺癌、前列腺癌、肝癌、结直肠癌等领域中CTC检测已有不少初步的研究和临床应用,但是这些方法仍然存在检出率不高、结果判读难等问题[12]。目前CTC分离有物理分离法和免疫分离法。物理分离是基于细胞大小和密度进行,肿瘤细胞一般较大,密度较高,可以使用分离网筛或密度梯度离心的方法获取肿瘤细胞。缺点是肿瘤细胞可塑性强,易变形,易通过分离网筛。另外白细胞体积与肿瘤细胞体积相当,使分离得到的极微量异型细胞鉴定存在较大困难。免疫学分离法又细分为正向分离法和负向分离法(去除白细胞)。基于肿瘤细胞表面存在的上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)的EpCAM正向分离法,利用免疫磁珠分离肿瘤细胞,不足之处是肿瘤细胞上皮细胞黏附分子表达率只有约30%[13],且受上皮间质转换(epithelial-mesenchymal transition, EMT)作用等影响。负向分离法虽然分离到的肿瘤细胞纯度低,但回收率较高,再结合核酸扩增等技术, 敏感度显著提高。
肺癌早期,当结节较小时,常规CT、血液肿瘤标记等手段难以发现,需要CTC检测等多种手段辅助, 综合判断结节性质[14]。虽然CTC在肿瘤早期就可释放入血,但在肺癌中存在广泛的EMT作用,肿瘤细胞丢失上皮标记物而致使市面上多数CTC检测方法无效[15]。因此,开发针对肺部肿瘤的CTC检测技术,对肺癌的早期诊断、复发监测、治疗效果评估等十分必要。
FR是一种细胞表面受体蛋白,最早发现在卵巢癌中高表达,后来发现在肺癌、结直肠癌等多种肿瘤中高表达,是包括NSCLC在内多种癌症的CTC检测的一个潜在靶点[4]。FR在约80%的肺癌细胞高表达,但血液中绝大部分细胞不表达FR,为肺癌血液靶向FR CTC检测提供了理想的条件。在NSCLC患者中,每一个循环肿瘤细胞可表达50万个叶酸受体,再通过PCR扩增可实现信号两级放大,因此可以检测到3 mL血液样本中极少量的CTC[8]。此外,该方法采用负向分离技术,肿瘤细胞回收率较其他CTC检测方法高,且不受EMT作用影响,使其具有独特的优势[8]。目前在临床上,靶向FR CTC方法在肺癌患者手术方案选择[16]、术后治疗方案评估[17]等领域均有初步的探索,取得了较好的结果。也有研究正在探讨该方法在肺部性质不明结节的辅助诊断中的可能应用[18],以期将该方法更好地应用到肿瘤早期诊断和术后监测等方面。
本回顾性研究发现肺部良性结节性病变患者CTC平均水平显著低于肺癌患者(P < 0.05)。136例恶性肿瘤FR阳性CTC 107例,152例良性结节FR假阳性CTC 44例,总体上靶向FR CTC检测技术对肺部恶性肿瘤的检测灵敏度为78.7%,特异性为71.1%。我院检测数据与该技术在肺癌大型临床研究中的检测灵敏度(79.6%)、特异性(88.2%)整体相当[8]。特别是在91例Ⅰ期肺癌灵敏度达到76.9%,比肿瘤标志物、CT等检查提高数倍,靶向FR CTC检测在早期肺癌辅助诊断可作为有效手段。值得注意的是本研究发现9例原位肺癌,CTC检测均为阳性,有3例患者临床评估结节风险较低,但患者CTC检出值高于阈值,最终在随访半年后确诊为肺癌。总体上随着肿瘤的增大、临床分期越晚,CTC检测值越高。病理科CTC送检血样主要是结节性质不明和术后监测(本研究不做探讨)患者,肺部结节较小时,高分辨率CT和肿瘤标记物检查难以明确结节良恶性质,需要CTC检测等其他手段辅助诊断。本研究回顾性分析中晚期肺癌患者(Ⅱ~Ⅳ期)总计44例,占比32.6%,多数中晚期患者未行CTC检测就直接手术或者进行治疗。本研究还统计了CTC检测在微小结节患者中的应用价值,在52例CT影像≤1 cm的肺癌结节患者中,CTC中位数值为9.87(3.40~20.80),检出CTC值高于阈值患者38例,检出率73.08%,差异有统计学意义,显示靶向FR CTC检测在早期肺癌,尤其是肺腺癌诊断中具有较好的应用价值,可作为临床辅助诊断的一项重要指标。本研究肺癌患者中,含肺鳞癌样本9例,CTC检测均为阳性,符合率100%,但样本量太小,不具有统计学意义,需要纳入更多病例后才能评价。
值得注意的是良性结节病变患者中确诊为结核杆菌感染(CTC=12.40)、慢性炎或者炎性假瘤(CTC=13.10)的CTC检出值较高,占良性结节患者假阳性的90%以上,对肺癌的诊断造成干扰[6, 19]。结核杆菌感染与炎症密切相关,常表现为炎性肉芽肿性病变,与慢性炎症导致靶向CTC检出值升高的机制应该是一致的。可能的原因有:①结核感染和慢性炎症均能引起上皮细胞脱落入血,肺上皮细胞也能表达叶酸受体,造成检出值升高;②虽然患者行CTC检测前会查看白细胞含量是否正常(白细胞干扰检测),但是血常规检测结果不能反映外周血中活化巨噬细胞含量,结核感染和慢性炎症患者外周血活化巨噬细胞可能增多造成检测值升高。去除结核感染和慢性炎症患者后,良性病变组平均CTC数值为7.32,显著低于肺部恶性肿瘤患者(P < 0.01)。此外,部分肺癌肿瘤细胞叶酸受体蛋白表达不升高,CTC检测结果可能假阴性,也使包括该方法在内的通过特定抗原抗体反应获取肿瘤细胞的方法存在一定局限性[20]。
外周血中含有CTC是包括肺癌在内大多数肿瘤发生、发展始终伴随的状态,并不一定意味着患者已经存在远处转移,但却为肿瘤的早期诊断、复发监测、疗效评估提供了很好的切入点[21]。在肿瘤的发生、发展过程中,释放入血的CTC存在多种免疫学、功能学改变,单一的CTC检测技术不容易捕获血液中含量极其微小的CTC[22]。本研究发现靶向FR CTC检测在肺癌早期辅助诊断中具有较好的可行性,但后续需要优化检测,排除结核杆菌感染等引起的慢性炎症的干扰。
综上所述,靶向FR CTC检测用于肺部结节辅助诊断,对于早期肺部结节良恶性的判断有十分重要的意义。根据CTC检测结果进一步评估结节的风险,可及早对结节进行管理干预,很大程度上可缩短肺部恶性结节的确诊时间,并根据诊断结果制定治疗方案提高肺癌患者的预后。
利益冲突声明 本研究与CTC检测试剂盒开发公司不存在利益冲突
| [1] |
李国仁, 戴建华. 我国肺部结节精准诊断的现状及研究进展[J]. 中华胸心血管外科杂志, 2019, 35(9): 566-572. LI G R, DAI J H. Status and research progress of precision diagnosis of pulmonary nodules[J]. Chin J Thorac Cardiovasc Surg, 2019, 35(9): 566-572. DOI:10.3760/cma.j.issn.1001-4497.2019.09.015 |
| [2] |
黄静, 沈庆, 陈元澜, 等. 肺部结节管理策略研究进展[J]. 中国呼吸与危重监护杂志, 2018, 17(1): 97-101. HUANG J, SHEN Q, CHEN Y L, et al. Research progress of pulmonary nodule management strategy[J]. Chin J Respir Crit Care Med, 2018, 17(1): 97-101. DOI:10.7507/1671-6205.201706020 |
| [3] |
WANG Y J, GONG J, SUZUKI K, et al. Evidence based imaging strategies for solitary pulmonary nodule[J]. J Thorac Dis, 2014, 6(7): 872-887. DOI:10.3978/j.issn.2072-1439.2014.07.26 |
| [4] |
ZHOU Q, GENG Q, WANG L, et al. Value of folate receptor-positive circulating tumour cells in the clinical management of indeterminate lung nodules: a non-invasive biomarker for predicting malignancy and tumour invasiveness[J]. EBioMedicine, 2019, 41: 236-243. DOI:10.1016/j.ebiom.2019.02.028 |
| [5] |
YU Y, CHEN Z, DONG J, et al. Folate receptor-positive circulating tumor cells as a novel diagnostic biomarker in non-small cell lung cancer[J]. Transl Oncol, 2013, 6(6): 697-702. DOI:10.1593/tlo.13535 |
| [6] |
LOW P S, ANTONY A C. Folate receptor-targeted drugs for cancer and inflammatory diseases[J]. Adv Drug Deliv Rev, 2004, 56(8): 1055-1058. DOI:10.1016/j.addr.2004.02.003 |
| [7] |
CHEN X, ZHOU F, LI X, et al. Folate receptor-positive circulating tumour cells as a predictive biomarker for the efficacy of first-line pemetrexed-based therapy in patients with non-squamous non-small cell lung cancer[J]. Ann Oncol, 2019, 30: v643-v644. DOI:10.1093/annonc/mdz260.084 |
| [8] |
YIN W, ZHU J J, MA B T, et al. Overcoming obstacles in pathological diagnosis of pulmonary nodules through circulating tumor cell enrichment[J]. Small, 2020, 16(25): 2001695. DOI:10.1002/smll.202001695 |
| [9] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [10] |
SIMMONS J, GOULD M K, IACCARINO J, et al. Systems-level resources for pulmonary nodule evaluation in the United States: a national survey[J]. Am J Respir Crit Care Med, 2016, 193(9): 1063-1065. DOI:10.1164/rccm.201511-2163le |
| [11] |
PANTEL K, ALIX-PANABIÈRES C. Liquid biopsy and minimal residual disease-latest advances and implications for cure[J]. Nat Rev Clin Oncol, 2019, 16(7): 409-424. DOI:10.1038/s41571-019-0187-3 |
| [12] |
REÁTEGUI E, ACETO N, LIM E J, et al. Tunable nanostructured coating for the capture and selective release of viable circulating tumor cells[J]. Adv Mater, 2015, 27(9): 1593-1599. DOI:10.1002/adma.201404677 |
| [13] |
ACETO N, BARDIA A, MIYAMOTO D T, et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis[J]. Cell, 2014, 158(5): 1110-1122. DOI:10.1016/j.cell.2014.07.013 |
| [14] |
WAN J C M, MASSIE C, GARCIA-CORBACHO J, et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA[J]. Nat Rev Cancer, 2017, 17(4): 223-238. DOI:10.1038/nrc.2017.7 |
| [15] |
LECHARPENTIER A, VIELH P, PEREZ-MORENO P, et al. Detection of circulating tumour cells with a hybrid (epithelial/mesenchymal) phenotype in patients with metastatic non-small cell lung cancer[J]. Br J Cancer, 2011, 105(9): 1338-1341. DOI:10.1038/bjc.2011.405 |
| [16] |
WEI S, GUO C, HE J, et al. Effect of vein-first vs artery-first surgical technique on circulating tumor cells and survival in patients with non-small cell lung cancer: a randomized clinical trial and registry-based propensity score matching analysis[J]. JAMA Surg, 2019, 154(7): e190972. DOI:10.1001/jamasurg.2019.0972 |
| [17] |
JIANG T, ZHAO J, ZHAO C, et al. Dynamic monitoring and predictive value of circulating tumor cells in EGFR-mutated advanced non-small-cell lung cancer patients treated with first-line EGFR tyrosine kinase inhibitors[J]. Clin Lung Cancer, 2019, 20(2): 124-133. DOI:10.1016/j.cllc.2018.11.014 |
| [18] |
CHEN X, ZHOU F, LI X, et al. Folate receptor-positive circulating tumor cell detected by LT-PCR-based method as a diagnostic biomarker for non-small-cell lung cancer[J]. J Thorac Oncol, 2015, 10(8): 1163-1171. DOI:10.1097/jto.0000000000000606 |
| [19] |
YI Y. Folate receptor-targeted diagnostics and therapeutics for inflammatory diseases[J]. Immune Netw, 2016, 16(6): 337-343. DOI:10.4110/in.2016.16.6.337 |
| [20] |
NUNEZ M I, BEHRENS C, WOODS D M, et al. High expression of folate receptor alpha in lung cancer correlates with adenocarcinoma histology and mutation[J]. J Thorac Oncol, 2012, 7(5): 833-840. DOI:10.1097/jto.0b013e31824de09c |
| [21] |
ZHANG W, XIA W, LV Z, et al. Liquid biopsy for cancer: circulating tumor cells, circulating free DNA or exosomes?[J]. Cell Physiol Biochem, 2017, 41(2): 755-768. DOI:10.1159/000458736 |
| [22] |
BARRIÈRE G, TARTARY M, RIGAUD M. Epithelial mesenchymal transition: a new insight into the detection of circulating tumor cells[J]. ISRN Oncol, 2012, 2012: 382010. DOI:10.5402/2012/382010 |



