卵巢癌是最致命的女性生殖系统恶性肿瘤,而卵巢浆液性癌是其最常见的病理类型[1]。卵巢癌整体预后较差,由于疾病早期的非特异性症状和临床上缺乏有效的筛查技术,大多数患者在就诊时已处于晚期,肿瘤细胞扩散到骨盆以外,导致预后不良。近年来,临床上虽然在诊断和治疗策略上有了很大的改善,然而其5年生存率仍不足45%[2]。因此,探索有效的早期诊断以及临床治疗靶点对于卵巢浆液性癌的防治具有重要意义。
大量的研究表明,miRNAs与肿瘤的发生、发展密切相关,可作为肿瘤早期诊断和预后标志。在机制上,其通过与靶基因mRNA 3’UTRs区完全或不完全互补结合,导致mRNA内切或翻译抑制,进而调控基因表达[3]。而当miRNA表达偏离正常模式后,其作为肿瘤抑癌因子或促癌因子调节肿瘤细胞增殖、侵袭和迁移等诸多恶性生物学行为的发生。近年来,研究显示miR-409-3p作为肿瘤抑癌因子,在乳腺癌[4]、胃癌[5]、宫颈癌[6]、结肠癌[7]和膀胱癌[8]等多种实体瘤中发挥重要作用。然而,miR-409-3p在卵巢浆液性癌中报道较少。因此,本研究通过检测miR-409-3p在正常卵巢和卵巢浆液性癌组织中的表达,探讨其与患者临床病理参数之间的相关性,同时在细胞水平通过转染miR-409-3p mimics分析其对HO-8910细胞恶性生物学行为的影响,以期阐明miR-409-3p在卵巢浆液性癌发生、发展中的作用。
1 材料与方法 1.1 一般资料病理组织取自2014年我科收治行手术治疗的卵巢浆液性癌患者40例,所有患者经术后病理确诊,排除其他类型卵巢癌,临床病理资料完整。患者年龄35~81岁,平均53.4岁,年龄≥50岁者27例,<50岁者13例;国际妇产科联合会(international federation of gynecology and obstetrics, FIGO)分期Ⅰ/Ⅱ者16例,Ⅲ/Ⅳ者24例;高级别卵巢浆液性癌31例,低级别卵巢浆液性癌9例;发生大网膜转移者23例,未发生大网膜转移者17例;糖类抗原CA125≥600者23例,CA125<600者17例。患者手术前均未接受激素、药物化疗或行院外手术治疗。20例卵巢正常组织标本取自绝经后女性,因子宫肌瘤、子宫腺肌症、子宫腺肌瘤等妇科良性疾病经手术切除的子宫双附件者,年龄46~66岁,平均51.6岁。术前所有患者签署知情同意书,本研究通过我院伦理委员会批准(2018-研第004-01)。
1.2 细胞培养及分组人卵巢浆液性癌细胞HO-8910和SKOV3以及卵巢表皮细胞IOSE80由本院中心实验室保存并传代,细胞采用含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的RPMI 1640培养液于37 ℃、5% CO2细胞培养箱中进行培养。
待细胞汇合度至70%~80%时进行传代,以1× 105/孔接种于6孔细胞培养板中,培养过夜后,按Lipo-fectamineTM 2000产品操作说明书,分别将miR-409-3p mimics(120 nmol/L)和miR-NC mimics转染入HO-8910细胞中,6 h后更换RPMI 1640新鲜培养液,48 h后检测目的基因表达。实验分组为:空白对照组(未转染组)、阴性对照组(miR-NC mimics转染组)和miR-409-3p过表达组(miR-409-3p mimics转染组)。
1.3 RT-qPCR检测采用Trizol法提取组织和细胞总RNA, 1%琼脂糖凝胶电泳检测RNA完整性,并按PrimeScript RT试剂盒操作说明书进行反转录获得cDNA。以U6 snRNA作为内参,采用SYBR Green法进行RT-qPCR检测组织或细胞内miR-409-3p表达。用于miR-409-3p扩增的上游引物:5′-GCGAATGTTGCTCGG TGA-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-ACGCTTCA-CGAATTTGCGT-3′;反应条件为:预变性95 ℃ 10 min,变性95 ℃ 10 s,退火65 ℃ 30 s,延伸72 ℃ 30 s,共40个循环。待反应结束后,实验结果采用2-ΔΔCt法计算并分析。
1.4 CCK8法检测细胞增殖能力的变化将转染48 h后的各组HO-8910细胞以3×103/孔接种于96孔细胞培养板,待细胞贴壁后记为0 h,分别于24、48、72 h各时间点加入10 μL CCK-8溶液, 37 ℃, 5% CO2细胞培养箱中孵育2 h后,采用酶标仪分别检测各孔细胞450 nm波长处的光密度值[D(450)]。
1.5 流式细胞术检测细胞凋亡水平的改变将转染48 h后的各组细胞吸去培养液,采用PBS漂洗2~3次,加入适量0.25%胰蛋白酶室温消化1 min,加入新鲜细胞培养液终止反应,并重悬细胞至1.5 mL EP管中,离心后弃去上清培养液,再次采用PBS漂洗细胞2~3次,采用试剂盒中结合缓冲液重选细胞后,加入Annexin-Ⅴ-R-PE混匀,避光冰浴30 min,再加入PI混匀后,采用流式细胞仪检测各组细胞凋亡情况。
1.6 Transwell实验检测细胞侵袭能力的变化将8 μm Transwell小室置于24孔细胞培养板中,铺入预先配置好的基质胶60 μL(Matrigel与预冷的无血清培养液按1 :8冰上混匀),采用无血清培养液重悬转染48 h后的各组细胞,按1×104/孔接种于小室上室,下室加入含15%胎牛血清的RPMI 1640培养液,于37 ℃、5% CO2细胞培养箱中连续培养24 h后取出上室,采用4%多聚甲醛固定15 min,PBS清洗2~3次后,0.1%结晶紫于室温染色20 min,棉签去除小室内未迁移细胞,于显微镜下观察并拍照计数。
1.8 统计学分析采用GraphPad Prism 8软件进行统计学分析,计量资料以x±s表示,卵巢浆液性癌组织与正常卵巢组织中miR-409-3p表达的比较采用t检验;卵巢癌组织miR-409-3p表达和临床病理参数之间的关系采用χ2检验;采用Kaplan-Meier法绘制患者生存曲线,Log-rank检验分析miR-409-3p表达水平和患者生存期的相关性;多组间数据比较采用单因素方差分析,两两多重比较采用LSD-t检验。
2 结果 2.1 miR-409-3p在正常卵巢及卵巢浆液性癌组织中的表达RT-qPCR结果显示,miR-409-3p在卵巢浆液性癌组织中的相对表达量显著低于其在卵巢正常组织中的表达水平(P < 0.001,图 1)。

|
| a: P < 0.001,与卵巢正常组织比较 图 1 RT-qPCR检测卵巢浆液性癌组织中miR-409-3p的表达 |
2.2 卵巢浆液性癌病理特征与miR-409-3p表达之间的关系
根据miR-409-3p表达的中位数将40例卵巢浆液性癌患者分为高表达组和低表达组。结果显示,miR-409-3p低表达与卵巢浆液性癌患者FIGO分期,大网膜转移密切相关(P < 0.05),与患者年龄、组织学分级和CA125指标无显著相关性(P>0.05,表 1)。此外,通过Kaplan-Meier法绘制生存曲线,分析miR-409-3p表达与卵巢浆液性癌预后的关系,结果显示miR-409-3p高表达组患者的总生存期明显高于低表达组患者(P < 0.05,图 2),表明miR-409-3p表达越低,卵巢浆液性癌患者预后越差。
| 临床指标 | n | miR-409-3p表达 | P | |
| 高表达 | 低表达 | |||
| 年龄/岁 | ||||
| ≥50 | 27 | 11 | 16 | 0.217 |
| < 50 | 13 | 8 | 5 | |
| FIGO分期 | ||||
| Ⅰ/Ⅱ | 16 | 11 | 5 | 0.028 |
| Ⅲ/Ⅳ | 24 | 8 | 16 | |
| 组织学分级 | ||||
| 高级别 | 31 | 13 | 18 | 0.191 |
| 低级别 | 9 | 6 | 3 | |
| CA125 | ||||
| ≥600 | 23 | 9 | 14 | 0.218 |
| < 600 | 17 | 10 | 7 | |
| 大网膜转移 | ||||
| 是 | 23 | 7 | 16 | 0.012 |
| 否 | 17 | 12 | 5 | |

|
| a: P < 0.05, 与miR-409-3p高表达组比较 图 2 卵巢浆液性癌患者不同miR-409-3p表达的生存曲线 |
2.3 miR-409-3p在人卵巢浆液性癌细胞中的表达
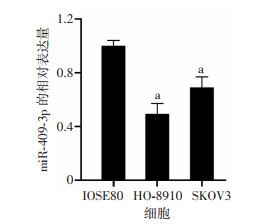
采用RT-qPCR分别检测人卵巢浆液性癌细胞SKOV3和HO-8910以及卵巢表皮细胞IOSE80中miR-409-3p的表达。结果显示,与IOSE80细胞相比,miR-409-3p在SKOV3和HO-8910细胞中的相对表达量显著减少(P < 0.05,图 3)。
|
| a: P < 0.05, 与IOSE80细胞比较 图 3 RT-qPCR检测miR-409-3p在人卵巢浆液性癌细胞中的表达 |
2.4 miR-409-3p mimics转染效率验证
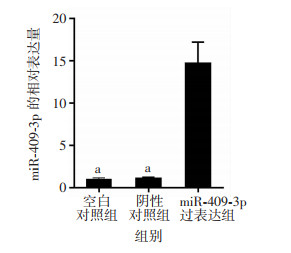
结果显示,与空白对照组和阴性对照组相比,转染miR-409-3p mimics后,HO-8910细胞中miR-409-3p表达明显增加(P < 0.05,图 4)。
|
| a: P < 0.05, 与miR-409-3p过表达组比较 图 4 HO-8910细胞中miR-409-3p mimics转染效率验证 |
2.5 转染miR-409-3p mimics后,对HO-8910细胞增殖能力的影响
结果显示,与空白对照组和阴性对照组相比,转染miR-409-3p mimics后,HO-8910细胞增殖能力明显降低(P < 0.05,图 5)。

|
| a: P < 0.05, 与miR-409-3p过表达组比较 图 5 CCK-8检测转染miR-409-3p mimics对HO-8910细胞增殖的影响 |
2.6 转染miR-409-3p mimics后,对HO-8910细胞凋亡的影响
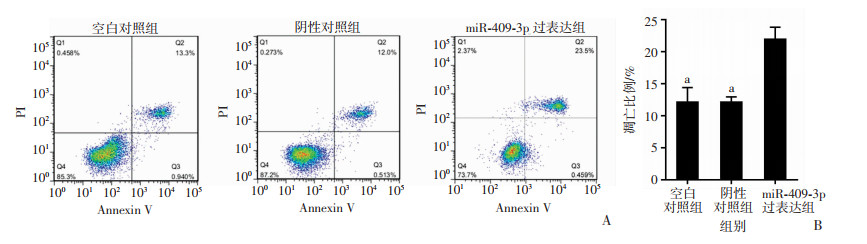
结果显示,与空白对照组和阴性对照组相比,转染miR-409-3p mimics后,HO-8910细胞凋亡比例明显增加(P < 0.05,图 6)。
|
| A:流式细胞术检测结果;B:各组凋亡比例a: P < 0.05, 与miR-409-3p过表达组比较 图 6 流式细胞术检测转染miR-409-3p mimics对HO-8910细胞凋亡比例的影响 |
2.7 转染miR-409-3p mimics后,对HO-8910细胞侵袭的影响
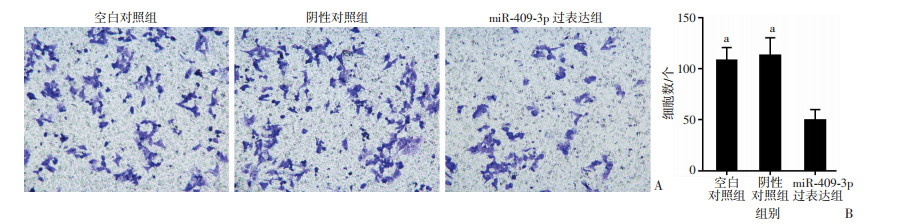
Transwell侵袭实验结果显示,与空白对照组和阴性对照组相比,转染miR-409-3p mimics后,穿过基底膜的HO-8910细胞数量明显减少(P < 0.05,图 7)。
|
| A: Transwell实验检测结果(结晶紫×200);B:各组侵袭细胞数a: P < 0.05, 与miR-409-3p过表达组比较 图 7 Transwell实验检测转染miR-409-3p mimics对HO-8910细胞侵袭能力的影响 |
3 讨论
miRNAs作为一类内源性非编码单链RNA,由18~25个核苷酸构成,通过与目标基因的mRNA相互作用调控基因表达,继而在生物体内发挥着重要的生物学功能,与人类多种疾病包括内分泌疾病、自身免疫性疾病,心血管疾病、肿瘤性疾病等的发生、发展存在密切关系[9]。在恶性肿瘤性疾病中,其作为抑癌因子或促癌因子,参与了肿瘤细胞增殖、凋亡、分化、侵袭转移等诸多恶性生物学行为。大量的研究表明miRNAs在肿瘤的早期诊断、预后评价中具有重要的应用价值[10-12]。在卵巢癌中,有学者通过基因芯片分析正常人和卵巢浆液性腺癌患者血清中的miRNA发现,包括miR-22、miR-122-5p、miR-93、miR-409和miR-let-7a等在内的43种存在显著差异表达的miRNA[13],此后的一些相关性研究发现,这些miRNA通过作用于不同的信号通路或多个基因的调控参与了卵巢浆液性癌的恶性转化[14-15]。此外,一项基于TCGA数据库的卵巢浆液性癌miRNA筛选发现包括miR-148a、miR-let-7b、miR-410、miR-381和miR-202等9种miRNA与患者不良预后密切相关[16]。在本研究中,我们着重对miR-409-3p在卵巢浆液性癌中的表达以及对卵巢癌恶性生物学行为的影响进行研究。
先前的研究显示,miR-409-3p可能作为一种早期诊断和不良预后的重要指标,在包括乳腺癌、胃癌、膀胱癌等诸多实体瘤中的发生、发展中发挥重要的生物学功能。在胃癌中,miR-409-3p在胃癌组织中表达明显下调,与胃癌的浸润转移和腹腔转移显著相关,通过抑制癌基因PHF10 mRNA翻译,进而参与caspase-3的转录调控,抑制胃癌细胞的凋亡[17]。在乳腺癌中,ZHANG等[18]证实miR-409-3p表达与淋巴结转移情况、肿瘤大小密切相关,其通过直接调控靶基因AKT1表达,降低肿瘤细胞的侵袭能力。在卵巢癌中,miR-409-3p与卵巢癌的紫杉醇耐药有关[19]。此外,有研究证实在卵巢癌低表达的miR-409-3p降低了卵巢癌细胞的顺铂敏感性,过表达miR-409-3p可通过阻断Fip200介导的自噬作用,改善卵巢癌细胞对顺铂的敏感性[20]。在本研究中,我们证实与卵巢正常组织相比,miR-409-3p在卵巢浆液性癌组织和细胞中呈低表达状态,且在人卵巢浆液性癌细胞SKOV3和HO-8910中的表达也显著低于卵巢表皮细胞IOSE80,这一结果与先前在卵巢癌细胞与正常卵巢上皮细胞中筛查到的结果一致[21]。同时,相关性研究表明,低表达的miR-409-3p与卵巢浆液性癌患者的FIGO分期和大网膜转移密切相关,提示miR-409-3p可能参与了卵巢浆液性癌的发生和恶性进展。此外,低表达的miR-409-3p与肿瘤患者的总生存期显著相关,miR-409-3p表达越低, 卵巢浆液性癌患者预后越差,进一步表明miR-409-3p可能是卵巢浆液性癌的不良预后指标之一。
细胞增殖、凋亡比例失调和侵袭与转移是肿瘤细胞主要的恶性生物学行为,在本研究中,我们通过设计、合成miR-409-3p mimics,并采用脂质体体外转染入HO-8910细胞中,分别采用CCK-8、流式细胞术和Transwell侵袭实验检测过表达miR-409-3p对卵巢癌细胞的增殖、凋亡以及侵袭能力的影响。研究结果显示,过表达miR-409-3p后,HO-8910细胞增殖与侵袭能力明显降低,细胞凋亡比例增加,提示过表达miR-409-3p具有抗肿瘤形成和恶性进展的能力。先前的研究证实miR-409-3p可通过直接与相关靶基因ZEB1、RDX、ELF2和AKT1等相互作用,参与调控骨肉瘤、舌鳞状细胞癌、乳腺癌等肿瘤细胞的恶性生物学行为[19, 22-24]。然而其在卵巢浆液性癌中是否发挥相同的作用目前尚不明确。此外,卵巢浆液性癌的发生是多基因变异、多因素、多途径相互促进的复杂过程,在肿瘤细胞中,异常的细胞信号传导往往是导致肿瘤细胞恶性增殖、反凋亡程序激活和侵袭迁移的根本原因。有研究报道,miR-409-3p靶基因于PI3K/AKT信号通路存在显著的富集现象[25]。因此,我们推测miR-409-3p可能通过调控PI3K/AKT信号通路参与卵巢浆液性癌的恶性生物学行为,这一推测仍有待于进一步研究探索。
综上所述,本研究证实miR-409-3p在卵巢浆液性癌组织和细胞中表达显著下调,低表达的miR-409-3p与卵巢浆液性癌患者FGIO分期、大网膜转移和总生存期显著相关,且参与肿瘤细胞的增殖、凋亡以及侵袭等恶性生物学行为,可能是卵巢浆液性癌一个潜在的预后和治疗靶点。
| [1] |
HATANO Y, HATANO K, TAMADA M, et al. A comprehensive review of ovarian serous carcinoma[J]. Adv Anat Pathol, 2019, 26(5): 329-339. DOI:10.1097/pap.0000000000000243 |
| [2] |
WEBB P M, JORDAN S J. Epidemiology of epithelial ovarian cancer[J]. Best Pract Res Clin Obstet Gynaecol, 2017, 41: 3-14. DOI:10.1016/j.bpobgyn.2016.08.006 |
| [3] |
CAI Y, YU X, HU S, et al. A brief review on the mechanisms of miRNA regulation[J]. Genom Proteom Bioinf, 2009, 7(4): 147-154. DOI:10.1016/s1672-0229(08)60044-3 |
| [4] |
MA Z, LI Y, XU J, et al. MicroRNA-409-3p regulates cell invasion and metastasis by targeting ZEB1 in breast cancer[J]. IUBMB Life, 2016, 68(5): 394-402. DOI:10.1002/iub.1494 |
| [5] |
ZHENG B, LIANG L, HUANG S, et al. MicroRNA-409 suppresses tumour cell invasion and metastasis by directly targeting radixin in gastric cancers[J]. Oncogene, 2012, 31(42): 4509-4516. DOI:10.1038/onc.2011.581 |
| [6] |
SHUKLA V, VARGHESE V K, KABEKKODU S P, et al. Enumeration of deregulated miRNAs in liquid and tissue biopsies of cervical cancer[J]. Gynecol Oncol, 2019, 155(1): 135-143. DOI:10.1016/j.ygyno.2019.08.012 |
| [7] |
TAN S, SHI H, BA M, et al. miR-409-3p sensitizes colon cancer cells to oxaliplatin by inhibiting Beclin-1-mediated autophagy[J]. Int J Mol Med, 2016, 37(4): 1030-1038. DOI:10.3892/ijmm.2016.2492 |
| [8] |
XU X L, ZHU Y, LIANG Z, et al. C-Met and CREB1 are involved in miR-433-mediated inhibition of the epithelial-mesenchymal transition in bladder cancer by regulating Akt/GSK-3β/Snail signaling[J]. Cell Death Dis, 2016, 7: e2088. DOI:10.1038/cddis.2015.274 |
| [9] |
VISHNOI A, RANI S. MiRNA biogenesis and regulation of diseases: an overview[J]. Methods Mol Biol, 2017, 1509: 1-10. DOI:10.1007/978-1-4939-6524-3_1 |
| [10] |
NASSAR F J, NASR R, TALHOUK R. MicroRNAs as biomarkers for early breast cancer diagnosis, prognosis and therapy prediction[J]. Pharmacol Ther, 2017, 172: 34-49. DOI:10.1016/j.pharmthera.2016.11.012 |
| [11] |
QADIR M I, FAHEEM A. miRNA: a diagnostic and therapeutic tool for pancreatic cancer[J]. Crit Rev Eukaryot Gene Expr, 2017, 27(3): 197-204. DOI:10.1615/critreveukaryotgeneexpr.2017019494 |
| [12] |
IORIO M V, CROCE C M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4(3): 143-159. DOI:10.1002/emmm.201100209 |
| [13] |
汪春年, 李征, 方建晨, 等. 卵巢浆液性腺癌血清miRNA差异表达及其临床意义[J]. 浙江实用医学, 2015, 20(6): 406-408, 412. WANG C N, LI Z, FANG J C, et al. Differential expression of serum miRNA in ovarian serous adenocarcinoma and its clinical significance[J]. Zhejiang Pract Med, 2015, 20(6): 406-408, 412. |
| [14] |
WILCZYŃSKI M, ŻYTKO E, DANIELSKA J, et al. Clinical significance of miRNA-21, -103, -129, -150 in serous ovarian cancer[J]. Arch Gynecol Obstet, 2018, 297(3): 741-748. DOI:10.1007/s00404-018-4660-5 |
| [15] |
ZHOU J, GONG G, TAN H, et al. Urinary microRNA-30a-5p is a potential biomarker for ovarian serous adenocarcinoma[J]. Oncol Rep, 2015, 33(6): 2915-2923. DOI:10.3892/or.2015.3937 |
| [16] |
王莎莎, 张莹, 陶林, 等. 基于TCGA数据的卵巢浆液性癌预后相关miRNAs筛选[J]. 临床与实验病理学杂志, 2018, 34(12): 1311-1314. WANG S S, ZHANG Y, TAO L, et al. Screening of prognosis-related miRNAs in serous ovarian carcinoma based on TCGA database[J]. Chin J Clin Exp Pathol, 2018, 34(12): 1311-1314. |
| [17] |
冯金鑫, 张相良. miR-409-3p与胃癌关系的研究进展[J]. 消化肿瘤杂志(电子版), 2018, 10(2): 75-78. FENG J X, ZHANG X L. Research progress of microRNA miR-409-3p in gastric cancer[J]. J Dig Oncol (Electron Version), 2018, 10(2): 75-78. DOI:10.3969/j.issn.1673-534X.2015.03.003 |
| [18] |
ZHANG G, LIU Z, XU H, et al. miR-409-3p suppresses breast cancer cell growth and invasion by targeting Akt1[J]. Biochem Biophys Res Commun, 2016, 469(2): 189-195. DOI:10.1016/j.bbrc.2015.11.099 |
| [19] |
KIM Y W, KIM E Y, JEON D, et al. Differential microRNA expression signatures and cell type-specific association with Taxol resistance in ovarian cancer cells[J]. Drug Des Devel Ther, 2014, 8: 293-314. DOI:10.2147/dddt.s51969 |
| [20] |
CHENG Y, BAN R W, LIU W, et al. MiRNA-409-3p enhances cisplatin-sensitivity of ovarian cancer cells by blocking the autophagy mediated by Fip200[J]. Oncol Res, 2018.[Online ahead of print]. DOI: 10.3727/096504017x15138991620238.
|
| [21] |
ZHANG S, ZHANG X, FU X, et al. Identification of common differentially-expressed miRNAs in ovarian cancer cells and their exosomes compared with normal ovarian surface epithelial cell cells[J]. Oncol Lett, 2018, 16(2): 2391-2401. DOI:10.3892/ol.2018.8954 |
| [22] |
ZHANG J, HOU W, JIA J, et al. MiR-409-3p regulates cell proliferation and tumor growth by targeting E74-like factor 2 in osteosarcoma[J]. FEBS Open Bio, 2017, 7(3): 348-357. DOI:10.1002/2211-5463.12177 |
| [23] |
CHEN H, DAI J. miR-409-3p suppresses the proliferation, invasion and migration of tongue squamous cell carcinoma via targeting RDX[J]. Oncol Lett, 2018, 16(1): 543-551. DOI:10.3892/ol.2018.8687 |
| [24] |
WU L, ZHANG Y, HUANG Z, et al. MiR-409-3p inhibits cell proliferation and invasion of osteosarcoma by targeting zinc-finger E-box-binding homeobox-1[J]. Front Pharmacol, 2019, 10: 137. DOI:10.3389/fphar.2019.00137 |
| [25] |
时伟丽, 王鑫, 廖世秀. 人类微小RNA-409-3p靶基因预测及生物信息学分析[J]. 中国优生与遗传杂志, 2017, 25(11): 18-19, 66. SHI W L, WANG X, LIAO S X. Prediction of target genes of Homo sapiens miroRNA-409-3p and bioinformatics analysis[J]. Chin J Birth Heal Hered, 2017, 25(11): 18-19, 66. |



