2. 230031 合肥,安徽医科大学第一附属医院肾内科
2. Department of Nephrology, First Affiliated Hospital of Anhui Medical University, Anhui, Hefei Province, 230031, China
糖尿病肾病(diabetic nephropathy, DN)是引起终末期肾病最主要的原因之一,其确切发病机制尚未阐明。已有研究表明巨噬细胞活化介导的炎症在DN进展中起着极其重要的作用[1-2]。巨噬细胞在高糖环境中的活化机制很多,然而M2型丙酮酸激酶(pyruvate kinase M2, PKM2)介导的糖酵解对巨噬细胞激活及其机制研究目前尚未探明。丙酮酸激酶(pyruvate kinase,PK)是糖酵解代谢通路中的最后一个限速酶,PKM2是PK 4个亚型中的一种,在活化的免疫细胞中高表达[3]。有研究发现PKM2可介导Nod样受体蛋白3(nod- like receptor protein 3, NLRP3)和黑色素瘤缺乏因子2(absentin melanoma 2, AIM2)炎症小体引发TNF-α、IL-1β、HMGB1等炎症因子的释放,抑制PKM2的表达导致炎症小体激活受抑,巨噬细胞炎症反应减轻,使败血症和感染性休克小鼠死亡率降低[4]。由此我们推测PKM2及其所激发表达的糖酵解相关蛋白对巨噬细胞产生炎症反应是必需的。真核生物翻译起始因子2-α激酶2(eukaryotic translation initiation factor2-alpha kinase 2, EIF2AK2)可以发生磷酸化并与多个炎症小体组件相互反应,增强炎症小体活性[5]。因此我们推断,在DN的进展过程中,PKM2可以促进EIF2AK2的磷酸化,进而激活NLRP3和AIM2介导的炎症小体,从而促进巨噬细胞激活,并释放炎症因子。本研究收集经肾穿刺活检确诊为DN患者的肾组织标本,通过组织学检测发现肾脏中巨噬细胞浸润激活及糖酵解酶PKM2表达增加;进一步分离小鼠骨髓来源巨噬细胞检测NLRP3和AIM2炎症小体分泌的细胞因子,探寻PKM2- EIF2AK2信号通路在糖尿病肾病巨噬细胞炎症激活中的作用机制。
1 材料与方法 1.1 临床标本来源纳入30例DN患者作为DN组,并收集其血清及肾脏组织标本,同时招募20名健康志愿者收集其血清,招募20名肾癌患者收集其癌旁正常组织作为Normal组,血清样本均由安徽医科大学第一附属医院检验科提供,肾组织样本均安徽医科大学第一附属医院肾脏病理中心提供。DN纳入标准:①糖尿病诊断,空腹血糖≥126 mg/dL (7.0 mmol/L):空腹定义为至少8 h无热量摄入,或口服糖耐量试验时餐后2 h血糖≥200 mg/dL (11.1 mmol/L);②经肾穿刺活检确诊为糖尿病肾病。排除标准为:①1型糖尿病;②患有其他疾病或并发症,如合并原发性肾病及其他继发性肾病、心衰、恶性高血压、心肌梗死、脑血管意外、感染、肝功能障碍,丙氨酸转氨酶水平超过正常上限2倍;③孕妇、哺乳期妇女;④癌症;⑤其他原因导致数据不全。本研究经安徽医科大学第一附属医院伦理委员会审查获批(81470965,2018年11月)。
1.2 实验动物及试剂雄性SPF级C57BL/6J小鼠, 6~8周龄,体质量18~20 g,购自安徽医科大学实验动物中心, 兔抗CD68、MCP-1、IL-1β、TNF-α、iNOS、EIF2AK2、NLRP3、AIM2、p-EIF2AK2多克隆抗体购自美国Abcam公司,兔抗PKM2、小鼠抗β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG、羊抗小鼠IgG抗体购自武汉三鹰公司,小鼠肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、趋化因子-1(MCP-1)ELISA试剂盒购自美国R & D公司, DMEM低糖培养基、胎牛血清购自加拿大Wisent公司, PKM2 siRNA购自锐博生物公司, D-葡萄糖、糖酵解抑制剂(2-DG)购自美国Sigma公司, BCA蛋白测定试剂盒、SDS-PAGE凝胶试剂盒购自江苏碧云天公司, TRIzol试剂购自美国Life Technology公司, 反转录试剂盒购自美国Promega公司, 实时荧光定量PCR试剂盒购自美国Bio-Rad公司,ECL化学发光试剂盒购自美国Thermo Scientific公司。乳酸测定试剂盒购自南京建成生物有限公司,葡萄糖吸收试剂盒购自美国biovision公司,PCR引物由上海生工生物工程合成:序列如下:TNF-α上游:5′-ATGAGCACAGAAAGCATGATC-3′,TNF-α下游: 5′- TACAGGCTTGTCACTGGAATT-3′,IL-1β上游: 5′-CTCCATGAG-CTTTGTACAAGG-3′,IL-1β下游: 5′-TGCTGATGTACCAGTTGGGG-3′,MCP-1上游: 5′-CTTCTGGGCCTGCTGTTCA-3′,MCP-1下游: 5′-CCAGCCTACTCATTGGGA-TC-3′,GAPDH上游: 5′-GGTGAAGGTCGGTGTGAACG-3′,GAPDH下游: 5′-CTCGCTCCTGGAAGATGGTG-3′。
1.3 病理学分析选取30例DN患者的肾组织及20例肾癌患者癌旁正常肾组织PAS染色切片,在光学显微镜下随机拍摄10个视野,并使用Image-Pro Plus 6.0进行半定量分析,将肾小球系膜扩张和肾小管间质损伤的程度进行指数评分;使用莱卡超薄切片机将患者肾组织树脂块获得70~90 nm的肾活检切片标本,在透射电镜(日立HT7700)下随机选取10个视野测量基底膜直径并计算均值,将所有患者及正常对照组基底膜直径均值行统计学处理。
1.4 免疫组化检测肾组织切片常规脱蜡至水,依次通过高压法抗原修复,10%山羊血清封闭后,滴加一抗PKM2(1 :200)、CD68(1 :100)、TNF-α(1 :100)、iNOS(1 :100),并在37 ℃温箱中孵育1 h,后滴加二抗辣根过氧化物酶标记的山羊抗兔/小鼠IgG(1 :500),并在37℃温箱中孵育30 min,最后使用DAB显色液常温避光显色。所有切片在高倍镜视野(×400)下随机拍摄10个肾小球,并使用Image-Pro Plus 6.0软件计算各组肾小球内阳性细胞数及肾小管阳性面积百分比并计算均值,将所有患者及正常对照组阳性细胞数及阳性面积百分比均值进行统计学分析。
1.5 激光共聚焦观察肾组织切片常规脱蜡至水,依次通过高压法抗原修复,10%山羊血清封闭后,滴加一抗PKM2(1 :100)和CD68(1 :100)的混合液,并在37 ℃温箱中孵育1 h,随后滴加二抗鼠抗Alexa Fluor 594和兔抗Alexa Fluor 488(1 :100)并在37 ℃温箱中孵育30 min,最后滴加DAPI染色液染核5 min,甘油封片后在激光共聚焦显微镜下进行观察。
1.6 小鼠骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDMs)分离、培养及鉴定小鼠经颈椎脱臼法处死后,置于75%乙醇浸泡5 min,剪刀分离股骨和胫骨,70%乙醇浸泡5 min;移入超净台分离干骺端,用含2% FBS的预冷PBS反复冲洗至骨髓腔变白,经过细胞筛,裂解液去除红细胞,2 290 r/min离心后弃去上清,用含有10% FBS、1%双抗和15% L929细胞上清液的DMEM低糖培养基重悬,并在5%CO2、37 ℃的恒温箱中培养,第7天时收集贴壁细胞,并使用贝克曼流式细胞仪进行细胞纯度分析。
1.7 细胞分组及细胞活力测定低糖浓度选取5.5 mmol/L,高糖浓度选取30 mmol/L,根据实验目的应用简单随机化的方法将BMDMs分为甘露醇对照组(D-mannitol)、阴性siRNA对照组(control siRNA)、低糖对照组(control)、高糖刺激组(HG)、PKM2 siRNA+高糖刺激组(PKM2 siRNA+HG)、糖酵解抑制剂+高糖刺激组(2DG+HG)。2DG终浓度为2 nmol/L,高糖刺激于细胞预处理3 h后加入,观察各检查指标的变化并在处理完毕后收集细胞。将对数生长期的BMDMs放置于培养板中,孵育24 h使细胞状态同步化,加入CCK-8溶液孵育4 h,在酶标仪上测定450 nm波长处的光密度值[D(450)],细胞活力=D(450)实验组/D(450)对照组×100%。
1.8 ELISA检测收集DN患者血清30例、健康体检人血清20例及各组细胞上清液,加适量样品于反应孔中,随后加入新鲜稀释的酶标抗体0.1 mL,37 ℃孵育0.5~1.0 h,洗涤后加底物液显色,在酶标仪上检测450 nm波长处光密度值D(450),并绘制标准曲线,从曲线上得到TNF-α、IL-1β、MCP-1的浓度。
1.9 RT-PCR检测TRIzol法裂解细胞并提取总RNA,紫外分析仪检测RNA质量和浓度,要求D(260)/D(280)在1.8~2.0。cDNA在反转录试剂盒中生成。选用SYBR Green PCR试剂盒进行PCR,终体积为20 μL。每个样本设3个复孔。反应条件为:预变性95 ℃ 10 min,进入循环,95 ℃ 15 s,60 ℃ 30 s,35个循环。设置GAPDH内参照进行校正,用2-△△Ct方法计算目的基因的相对表达。
1.10 乳酸生成和葡萄糖吸收检测用乳酸测定试剂盒及葡萄糖吸收试剂盒分别检测各分组中巨噬细胞乳酸生成以及葡萄糖吸收量。待各组细胞培养24 h后,收集各分组细胞培养基和细胞,检测步骤参考说明书。
1.11 Western blot检测收集各组巨噬细胞,RIPA裂解提取蛋白并使用BCA法测定蛋白浓度。取40 μg蛋白样品上样,经SDS-聚丙烯酰胺凝胶中进行电泳分离后转移至硝酸纤维素膜(NC)上。5%脱脂奶粉室温封闭2 h。分别加一抗PKM2(1 :1 000)、p-EIF2AK2(1 :1 000)、EIF2AK2(1 :1 000)、NLRP3(1 :1 000)、AIM2(1 :1 000)、PKM2(1 :1 000)、β-actin(1 :35 000),4 ℃孵育12 h,洗膜后放入HRP标记的山羊抗兔或抗鼠二抗(1 :8 000)室温孵育1 h,TBST洗膜后滴加ECL显色剂在凝胶成像系统进行化学发光、照相,用Image J软件对条带进行定量分析。
1.12 流式细胞仪检测按组别处理后,分别收集成熟的BMMs细胞,每组细胞数达1×106个,2 500 r/min离心5 min, 弃去上清液,PBS(500 μL/管)重悬细胞, 加入CD16/CD32抗体,4 ℃孵育20 min后, 离心并弃去上清液, 再次以PBS(500 μL/管)重悬细胞, 加入FITC标记的F4/80、APC标记的CD11b, 充分混匀,于室温下避光孵育30 min。PBS洗涤2次, 再加入500 mL PBS重悬细胞, 上机进行巨噬细胞检测。
1.13 统计学分析采用SPSS 16.0统计软件。正态分布数据资料采用x±s的形式,两组间比较应用独立样本t检验,多组间比较应用单因素方差分析进行统计学处理,方差不齐应用Wilcoxon秩或检验或K-W检验,方差齐性应用Levene法检验。检验水准:α=0.05。
2 结果 2.1 DN患者肾小球系膜增殖、小管损伤及基底膜增厚加重PAS染色结果显示:DN组肾小球直径、系膜扩张指数和肾小管间质损伤指数评分显著高于正常组(P < 0.01);透射电镜结果显示:DN组基底膜厚度(GBM)明显高于正常组(P < 0.01),见图 1。
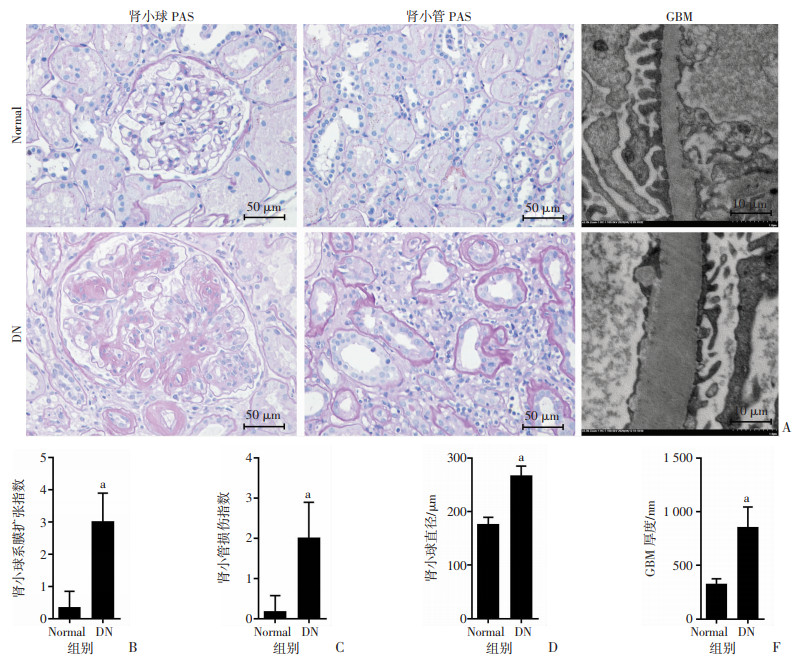
|
| A:PAS染色及电镜观察两组人肾组织病理改变;B:肾小球系膜扩张指数统计;C:肾小管损伤指数统计;D:肾小球直径统计;E:GBM厚度统计 a:P < 0.01, 与Normal组比较 图 1 Normal组(n=20)与DN组(n=30)人肾组织PAS染色及电镜病理分析(x±s) |
2.2 DN患者血清及肾脏中炎症加重,PKM2表达增加
ELISA结果显示:DN组血清TNF-α、IL-1β和MCP-1都较正常人升高(P < 0.01)。并且DN组肾脏内CD68浸润增加,PKM2及TNF-α表达增加,与正常组相比,差异有统计学意义(P < 0.01),提示DN患者血清和肾脏内炎症均加重,并且糖酵解酶PKM2被激活,见图 2。
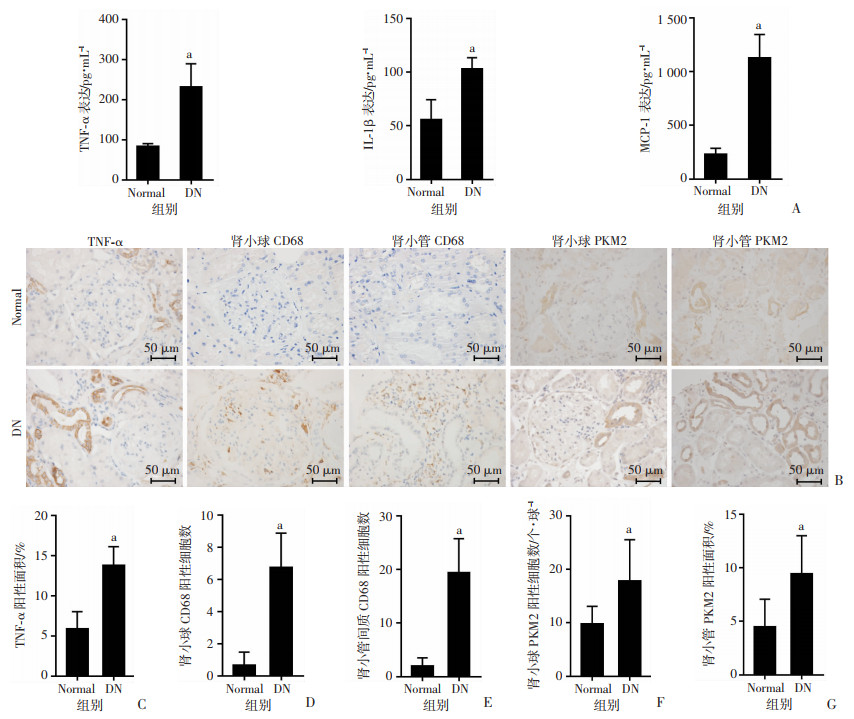
|
| A:ELISA检测两组人血清炎症因子TNF-α、IL-1β和MCP-1表达变化;B:免疫组化检测两组人肾组织中CD68、PKM2及TNF-α表达变化(S-P);C:肾组织TNF-α阳性面积统计;D:肾小球CD68阳性细胞数统计;E:肾小管间质CD68阳性细胞数统计;F:肾小球PKM2阳性细胞数统计;G:肾小管PKM2阳性面积统计a:P < 0.01,与Normal组比较 图 2 Normal组(n=20)与DN组(n=30)人血清和肾脏炎症水平变化及PKM2表达变化(x±s) |
2.3 DN患者肾脏巨噬细胞内PKM2表达增加
通过CD68与PKM2共染进一步观察肾脏巨噬细胞内PKM2表达。激光共聚焦结果显示DN组CD68及PKM2表达均高于Normal组,并且共表达的阳性细胞同样增加。提示DN患者肾脏巨噬细胞浸润增加,并且糖酵解通路被激活,见图 3。

|
| 图 3 激光共聚焦检测Normal组与DN组人肾组织中CD68与PKM2共表达变化 |
2.4 PKM2干扰后,高糖刺激的BMMs乳酸生成和葡萄糖吸收减少
为进一步观察PKM2在高糖诱导的巨噬细胞炎症中的作用,应用BMMs进行了体外实验。流式细胞仪检测结果显示:BMMs纯度达到了99.07%,符合进一步实验要求(图 4A)。CCK-8检测结果显示:HG和PKM2 siRNA对BMMs活性均无影响(图 4B)。乳酸生成和葡萄糖吸收实验显示:与Control组相比,HG组乳酸生成和葡萄糖吸收增加,而HG+PKM2 siRNA组较HG组乳酸生成和葡萄糖吸收减少(图 4C、D)。提示PKM2干扰后可以减少高糖环境下BMMs的葡萄糖吸收及乳酸释放。
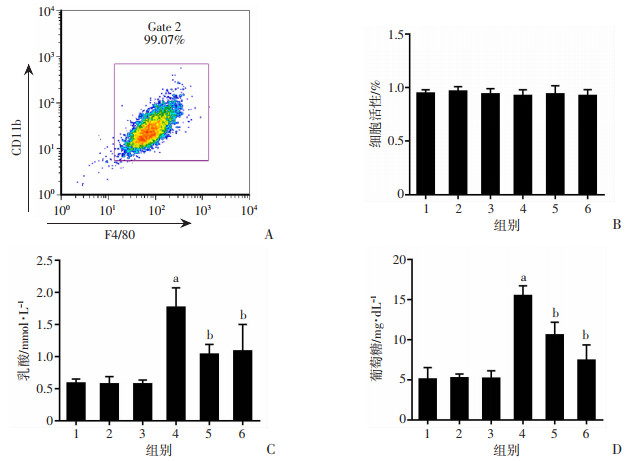
|
|
1: D-mannital组;2: Control siRNA组;3: Control组;4: HG组;5: HG+PKM2 siRNA组;6: HG+2DG组 A:流式细胞仪检测BMMs纯度;B:CCK-8检测高糖及PKM2 siRNA对BMMs活性的影响;C:乳酸生成试剂盒检测各组细胞乳酸水平变化;D:葡萄糖吸收试剂盒检测各组细胞葡萄糖吸收水平变化a: P < 0.01,与Control组比较;b: P < 0.01,与HG组比较 图 4 BMMs纯度及各组细胞乳酸生成和葡萄糖吸收测定(n=6,x±s) |
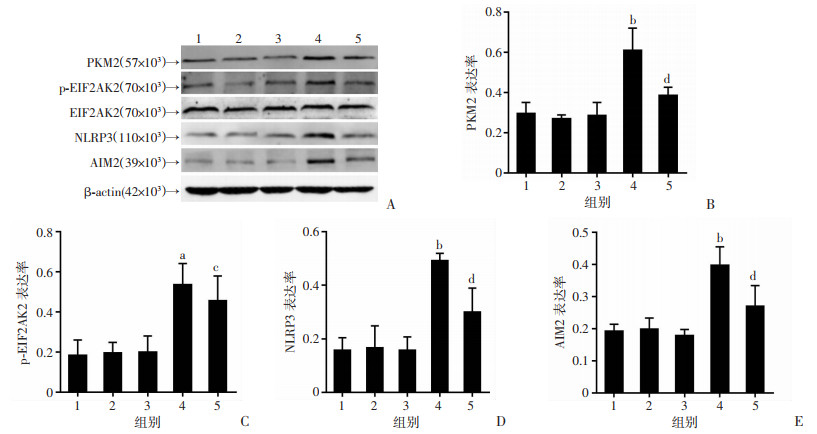
2.5 PKM2干扰减轻了高糖诱导的BMMs炎症反应,并减少EIF2AK2/NLRP3/AIM2信号通路蛋白表达
ELISA结果显示:与Control组相比,HG组细胞上清中炎症因子TNF-α、MCP-1和IL-1β水平明显增加(P < 0.01);而与HG组相比,HG+PKM2 siRNA组炎症因子水平明显减少(P < 0.01,图 5A)。RT-PCR再次观察细胞内炎症因子mRNA水平的变化,结果同样显示:与HG组相比,HG+PKM2 siRNA组TNF-α、MCP-1和IL-1β mRNA表达明显减少(P < 0.01,图 5B)。进一步检测EIF2AK2/NLRP3/AIM2信号通路相关蛋白表达,结果显示:与Control组相比,HG组PKM2,p-EIF2AK2,EIF2AK2,NLRP3和AIM2蛋白表达增加(P < 0.01);而与HG组相比,HG+PKM2 siRNA组信号通路相关蛋白明显减少(P < 0.01,图 6)。提示PKM2通过EIF2AK2/NLRP3/AIM2通路参与了高糖诱导的巨噬细胞炎症。
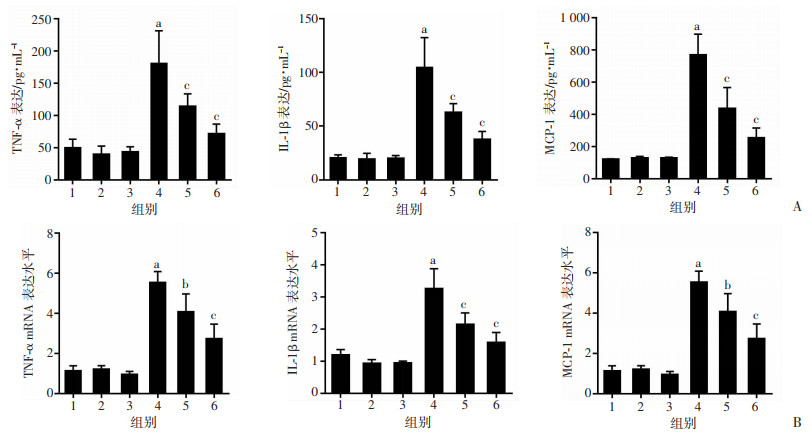
|
|
1: D-mannital组;2: Control siRNA组;3: Control组;4: HG组;5: HG+PKM2 siRNA组;6: HG+2DG组 A:ELISA检测各组细胞上清中炎症因子TNF-α,IL-1β和MCP-1水平变化;B:RT-PCR检测各组细胞中炎症因子TNF-α,IL-1β和MCP-1 mRNA水平变化;C:Western blot检测各组细胞中PKM2、p-EIF2AK2、EIF2AK2、NLRP3及AIM2蛋白表达变化a: P < 0.01,与Control组比较;b:P < 0.05,c:P < 0.01,与HG组比较 图 5 各组细胞炎症因子TNF-α、IL-1β和MCP-1表达变化及EIF2AK2/NLRP3/AIM2信号通路蛋白表达变化(n=6,x±s) |
|
|
1: D-mannital组;2: Control siRNA组;3: Control组;4: HG组;5: HG+PKM2 siRNA组 A:Western blot结果;B~E:PKM2、p-EIF2AK2、NIRP3、AIM2蛋白表达半定量结果a: P < 0.05,b: P < 0.01,与Control组比较;c: P < 0.05,d: P < 0.01,与HG组比较 图 6 Western blot检测各组细胞中PKM2、p-EIF2AK2、EIF2AK2、NLRP3及AIM2蛋白表达变化(n=6,x±s) |
3 讨论 3.1 M1型巨噬细胞与糖尿病肾病
DN是糖尿病患者最常见的一种微血管并发症。越来越多研究者认为DN的发生、发展除遗传与血流动力学紊乱因素外,以巨噬细胞浸润介导的肾内炎症为主要影响因素,但巨噬细胞的具体参与机制尚未完全明确[2, 6]。巨噬细胞具有表型可塑性较强的特点,浸润在糖尿病肾组织中的巨噬细胞受到高血糖、晚期糖基化终末产物、血流动力学改变、代谢失调或炎症细胞分泌的多种生长因子和促炎因子等刺激作用,可使M1型巨噬细胞增殖极化[1, 7]。M1型巨噬细胞增殖活化所产生的大量炎症因子和糖酵解酶的上调均可介导炎症反应[8-9]。本研究结果表明:DN肾组织内巨噬细胞浸润明显增加,并且肾脏中炎症介质的表达明显增加,这表明巨噬细胞可以参与DN的发展,在高糖环境下通过释放大量炎症介质参与肾脏的炎症反应。
3.2 M1型巨噬细胞与糖酵解糖酵解是葡萄糖代谢过程中的关键环节。当细胞受到刺激时,耗能速度加快,选择高速供能的糖酵解途径成为癌细胞代谢过程中最常见的现象。有氧条件下,葡萄糖的消耗加快,氧化磷酸化急剧降低,糖酵解途径中乳酸产生大量增加,进而在短时间内合成大量能量和代谢所需产物,经典活化的巨噬细胞代谢过程符合此种效应[8]。糖酵解对于炎症的调控近年来引起了广泛关注,并且NLRP3炎症小体可以被代谢依赖性的途径激活[10]。PKM2作为糖酵解过程中的限速酶之一,以二聚体的形式进入细胞核与缺氧诱导因子1α(hypoxia inducible factor-1α, HIF-1α)和IL-1β启动子结合,引起巨噬细胞发生M1型活化,激活相关糖代谢基因转录,引起过度糖酵解[3, 4]。与此同时,细胞中的氧化磷酸化被显著抑制[11]。研究证实PKM2可以通过HMGB1乙酰化、IL-1β转录或炎性小体激活等方式,介导巨噬细胞活化和炎症因子的释放[4, 8]。另外,PKM2可以与线粒体来源的ROS相互作用,抑制HIF-1α降解,激活NF-κB信号通路,并调控巨噬细胞NLRP3和AIM炎症小体的激活[12]。炎症小体是一种感知病原体和内源性危险信号的多分子复合物,通过caspase-1激活促进促炎因子的分泌[13-14]。有文献表明,炎症小体在生理状态下对于机体代谢稳态的维持具有重要的意义。但在慢性疾病如肥胖或高血脂中,炎症小体会发生异常激活,从而促进疾病的进展。年龄相关的炎症也可以改变NLRP3的激活,使NLRP3诱发内源性代谢改变,从而触发IL-1的释放,并且PKM2是NLRP3和AIM2炎症小体激活的关键环节[15]。
本研究通过进一步细胞实验发现:高糖可以刺激巨噬细胞中PKM2表达增加,并且炎症小体的表达和促炎因子释放增加;而PKM2干扰后,炎症因子分泌明显减少。这一实验结果与YANG等[16]一致,他们证明紫草素通过抑制PKM2,可以避免小鼠因感染休克而死亡。本研究同样观察到DN患者肾组织巨噬细胞中PKM2表达增加,因此我们推测高糖可以通过PKM2增强巨噬细胞糖酵解途径,进而诱导巨噬细胞的激活和炎症介质的释放。
3.3 PKM2- EIF2AK2信号通路与糖酵解乳酸是糖酵解的最终产物,增多的主要因素是活化的巨噬细胞内PKM2的高表达[13]。2型糖尿病患者和败血症、感染性休克患者均检测血清乳酸水平增高[4]。乳酸不仅是代谢过程的重要产物,也是炎症过程的重要参与者[17]。本研究表明:高糖刺激巨噬细胞乳酸生成增加,糖吸收能力增强,过度堆积的乳酸通过炎性小体激活巨噬细胞并促进炎症介质释放[13, 17]。EIF2AK2是一种病原识别受体,是由染色体2p22-p21上的EIF2AK2基因编码的胞内蛋白,具有两个RNA结合域和一个激酶结构域,其磷酸化是巨噬细胞炎性小体激活的重要途径[18]。EIF2AK2的磷酸化可以激活NLRP3和AIM炎症小体,并诱导其下游炎症因子IL-1β的分泌[5]。本研究发现高糖可以刺激巨噬细胞内PKM2、p-EIF2AK2、NLRP3、AIM2表达上调,同时炎症因子MCP-1、IL-1β、TNF-α分泌及mRNA表达增加,而PKM2干扰能减轻高糖诱导的炎症反应。这说明糖酵解限速酶PKM2或乳酸等糖酵解代谢物可能通过促进巨噬细胞中EIF2AK2的磷酸化和炎症小体NLRP3的激活进而调控炎症反应。
综上所述,本研究证实高糖可以刺激巨噬细胞内PKM2的表达,有助于巨噬细胞的激活和炎症因子的释放,其机制很可能与促进EIF2AK2磷酸化进而活化炎性小体有关,提示PKM2- EIF2AK2信号通路可能成为巨噬细胞参与DN肾脏损伤研究中的重要机制之一。本研究结果有助于揭示高糖导致肾脏炎症及纤维化的新机制,以期为DN的干预提供新的思路和方案。
| [1] |
FU J, AKAT K M, SUN Z, et al. Single-cell RNA profiling of glomerular cells shows dynamic changes in experimental diabetic kidney disease[J]. J Am Soc Nephrol, 2019, 30(4): 533-545. DOI:10.1681/asn.2018090896 |
| [2] |
BHATT K, LANTING L L, JIA Y, et al. Anti-inflammatory role of MicroRNA-146a in the pathogenesis of diabetic nephropathy[J]. J Am Soc Nephrol, 2016, 27(8): 2277-2288. DOI:10.1681/asn.2015010111 |
| [3] |
ANGIARI S, RUNTSCH M C, SUTTON C E, et al. Pharmacological activation of pyruvate kinase M2 inhibits CD4+T cell pathogenicity and suppresses autoimmunity[J]. Cell Metab, 2020, 31(2): 391-405. DOI:10.1016/j.cmet.2019.10.015 |
| [4] |
XIE M, YU Y, KANG R, et al. PKM2-dependent glycolysis promotes NLRP3 and AIM2 inflammasome activation[J]. Nat Commun, 2016, 7: 13280. DOI:10.1038/ncomms13280 |
| [5] |
鞠小丽, 王强. EIF2AK2和NLRP3相互作用影响细胞分泌IL-1β的研究[J]. 安徽医科大学学报, 2016, 51(11): 1565-1568. JU X L, WANG Q. Investigation of EIF2AK2 interaction with NLRP3 and effect on the release of IL-1β[J]. Acta Univ Med Anhui, 2016, 51(11): 1565-1568. |
| [6] |
CHOI S Y, LIM S W, SALIMI S, et al. Tonicity-responsive enhancer-binding protein mediates hyperglycemia-induced inflammation and vascular and renal injury[J]. J Am Soc Nephrol, 2018, 29(2): 492-504. DOI:10.1681/asn.2017070718 |
| [7] |
LINKERMANN A, PARMENTIER S P, HUGO C. We AIM2 inflame[J]. J Am Soc Nephrol, 2018, 29(4): 1077-1079. DOI:10.1681/asn.2018020116 |
| [8] |
PALSSON-MCDERMOTT E M, CURTIS A M, GOEL G, et al. Pyruvate kinase M2 regulates Hif-1α activity and IL-1β induction and is a critical determinant of the Warburg effect in LPS-activated macrophages[J]. Cell Metab, 2015, 21(1): 65-80. DOI:10.1016/j.cmet.2014.12.005 |
| [9] |
CALLE P, HOTTER G. Macrophage phenotype and fibrosis in diabetic nephropathy[J]. Int J Mol Sci, 2020, 21(8): 2806. DOI:10.3390/ijms21082806 |
| [10] |
PRÓCHNICKI T, LATZ E. Inflammasomes on the crossroads of innate immune recognition and metabolic control[J]. Cell Metab, 2017, 26(1): 71-93. DOI:10.1016/j.cmet.2017.06.018 |
| [11] |
CORCORAN S E, O'NEILL L A. HIF1α and metabolic reprogramming in inflammation[J]. J Clin Invest, 2016, 126(10): 3699-3707. DOI:10.1172/jci84431 |
| [12] |
周赟, 易竹君, 阙克婷, 等. 铁离子通过ROS-乙酰化P53促进巨噬细胞M1型极化[J]. 第三军医大学学报, 2018, 40(1): 45-52. ZHOU Y, YI Z J, QUE K T, et al. Iron ion polarizes macrophages to M1 subtype through ROS-acetyl-P53[J]. J Third Mil Med Univ, 2018, 40(1): 45-52. |
| [13] |
HUANG J, LIU K, ZHU S, et al. AMPK regulates immunometabolism in Sepsis[J]. Brain Behav Immun, 2018, 72: 89-100. DOI:10.1016/j.bbi.2017.11.003 |
| [14] |
CHO S J, MOON J S, NIKAHIRA K, et al. GLUT1-dependent glycolysis regulates exacerbation of fibrosis via AIM2 inflammasome activation[J]. Thorax, 2020, 75(3): 227-236. DOI:10.1136/thoraxjnl-2019-213571 |
| [15] |
HUGHES M M, O'NEILL L A J. Metabolic regulation of NLRP3[J]. Immunol Rev, 2018, 281(1): 88-98. DOI:10.1111/imr.12608 |
| [16] |
YANG L, XIE M, YANG M, et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis[J]. Nat Commun, 2014, 5: 4436. DOI:10.1038/ncomms5436 |
| [17] |
ERRA DÍAZ F, DANTAS E, GEFFNER J. Unravelling the interplay between extracellular acidosis and immune cells[J]. Mediators Inflamm, 2018, 2018: 1218297. DOI:10.1155/2018/1218297 |
| [18] |
LU B, NAKAMURA T, INOUYE K, et al. Novel role of PKR in inflammasome activation and HMGB1 release[J]. Nature, 2012, 488(7413): 670-674. DOI:10.1038/nature11290 |




