肝癌在全世界恶性肿瘤中发病率为第6位,据世界卫生组织估计,至2030年肝癌患者死亡人数将超过100万[1]。虽然近年来肝癌发病率增长速度变缓,但每年仍以2%~3%的速率持续缓慢上升[2]。肝癌病死率高,预后差,有研究显示肝癌的5年生存率仅为18%,是仅次于胰腺癌的第二大致命性肿瘤[3]。
临床上常将单个直径≤5 cm或数目不超过3个且最大直径≤3 cm的肝癌称为小肝癌[4-5],其治疗首选外科手术[6]。肝癌最常见病理类型为肝细胞癌,与直径>5 cm的肝癌患者比较,小肝癌具有手术切除率高、死亡率低、细胞分化好、包膜更完整等特点[7]。目前关于肝癌预后的研究有许多是关于肝移植、手术切除、射频消融等治疗之后的复发危险因素及生存分析[8-10],但部分研究没有纳入未手术治疗或合并淋巴结转移的病例[11],因此对肝癌整体预后的研究存在偏倚。肝癌复发是肝癌患者术后死亡的主要原因,即使是小肝癌患者也是如此[12]。所以临床上能对肝癌预后进行预测,尽早发现那些高风险患者,积极采取治疗措施显得尤为重要。列线图是一种用于肿瘤学相关预测的可视化工具,常用于预测和量化单个患者的生存率;因其能根据患者不同情况和疾病特征评估个性化风险,而广泛应用于癌症预后的研究[13]。阅读文献发现,关于肝癌的预测模型研究很多[14],但鲜见关于构建预测小肝癌患者预后列线图的研究。
因此,本研究进行了这项回顾性研究,进一步了解小肝癌患者的生存现状及影响其预后的危险因素。本研究拟建立预测小肝癌患者1、3、5年总生存率(overall survival, OS)以及癌症特异性生存率(cancer-specific survival,CSS)的预测模型,并对其预测性能进行验证。
1 资料与方法 1.1 研究人群纳入标准:①病理诊断为原发性肝细胞癌;②肿瘤直径≤5 cm;③临床资料完整。排除标准:合并其他肿瘤。利用SEER*Stat统计软件8.3.6版,从SEER数据库(https://seer.cancer.gov/data/)中提取2019年11月提交的2000-2014年诊断的74 675例肝癌患者的临床资料,其国际肿瘤学疾病编码(ICD-O-3)为8170-8175。临床资料包括性别、年龄、种族、肿瘤分化程度、肿瘤大小、SEER分期、治疗信息、随访时间及生存状态等信息,按照纳入、排除标准进行多次筛选。最后纳入1 916例符合研究标准的病例,并采用随机数字表法按1 :1比例分为训练组(n=958)和验证组(n=958),筛选流程见图 1。
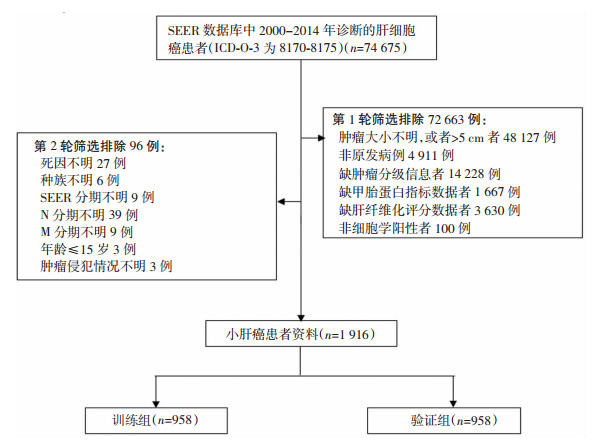
|
| 图 1 筛选小肝癌患者的流程图 |
1.2 随访信息
纳入SEER数据库中患者生存时间、生存状态及死亡原因等信息。OS的时间范围定义为从确诊之日起到死亡之日或最后1次随访之日,CSS的时间范围定义为从确诊之日起到因肝癌死亡之日或最后1次随访之日之间的间隔,随访截止时间为2019年11月。SEER数据库是公开访问的,本研究授权账户为11448-Nov2019,所提取的信息只包含匿名患者的临床资料,不涉及患者隐私。
1.3 统计学分析列线图能根据每个患者具体情况,将复杂的预测模型简化为对事件(如死亡或复发等)的概率估计;建立列线图的步骤是通过选择有统计学意义的变量,构建列线图并予以验证[15]。本研究在训练队列中按如下步骤建立列线图[16]:首先,运用单因素Cox回归分析筛选与OS和CSS可能相关的因素;其次,将单因素Cox分析中达到统计学意义的因素进行lasso Cox多因素回归分析,进一步筛选独立影响因素,并引入AIC信息准则(Akaike information criterion)进行评价;最后,基于筛选后的独立影响因素,使用glmnet、survivalROC、survival、rms等R程序包构建预测小肝癌患者OS和CSS的列线图,并在训练组和验证组中运用C指数、ROC曲线和校准曲线对列线图的预测能力进行验证。此外,根据列线图所得总分的中位数建立风险分层,将患者分为高风险组和低风险组。采用Kaplan-Meier分析和对数秩检验分析两个危险亚组间的生存差异。OS中,任何原因的死亡为事件发生,赋值为1,存活为0。CSS中,癌症相关的死亡为事件发生,赋值为1,存活或者非癌症相关的死亡赋值为0。所有分析均使用R软件3.6.1版本进行。P<0.05为差异有统计学意义。
2 结果 2.1 基线临床特征共纳入小肝癌患者1 916例,其中训练组958例,验证组958例,比例为1 :1,训练组中男性721例(75.3%),女性237例(24.7%)。所有病例确诊时年龄在15~85+岁,平均生存时间81.7个月,中位生存时间59.0个月,1、3、5总生存率分别为81.3%、60.7%、49.2%;1、3、5年癌症特异性生存率分别为85.2%、66.9%、56.9%。连续变量如年龄、肿瘤大小等被转换分类变量。训练组及验证组的临床特征见表 1。
| 可能的影响因素 | 总人群(n=1 916) | 训练组(n=958) | 验证组(n=958) | |||||
| 例数 | 占比(%) | 例数 | 占比(%) | 例数 | 占比(%) | |||
| 年龄 | ||||||||
| <60岁 | 942 | 49.2 | 464 | 48.4 | 478 | 49.9 | ||
| ≥60岁 | 974 | 50.8 | 494 | 51.6 | 480 | 50.1 | ||
| 种族 | ||||||||
| 白种人 | 1 280 | 66.8 | 657 | 68.6 | 623 | 65.1 | ||
| 黑种人 | 231 | 12.1 | 111 | 11.6 | 120 | 12.5 | ||
| 其他 | 405 | 21.1 | 190 | 19.8 | 215 | 22.4 | ||
| 性别 | ||||||||
| 女 | 429 | 22.4 | 237 | 24.7 | 192 | 20.0 | ||
| 男 | 1 487 | 77.6 | 721 | 75.3 | 766 | 80.0 | ||
| 分化程度 | ||||||||
| Ⅰ | 641 | 33.4 | 334 | 34.9 | 307 | 32.0 | ||
| Ⅱ | 992 | 51.8 | 498 | 52.0 | 494 | 51.6 | ||
| Ⅲ+Ⅳ | 283 | 14.8 | 126 | 13.1 | 157 | 16.4 | ||
| SEER分期a | ||||||||
| L | 1 472 | 76.8 | 728 | 76.0 | 744 | 77.7 | ||
| R | 395 | 20.6 | 206 | 21.5 | 189 | 19.7 | ||
| D | 49 | 2.6 | 24 | 2.5 | 25 | 2.6 | ||
| N分期 | ||||||||
| N0 | 1876 | 97.9 | 936 | 97.7 | 940 | 98.1 | ||
| N1 | 40 | 2.1 | 22 | 2.3 | 18 | 1.9 | ||
| M分期 | ||||||||
| M0 | 1 868 | 97.5 | 935 | 97.6 | 933 | 97.4 | ||
| M1 | 48 | 2.5 | 23 | 2.4 | 25 | 2.6 | ||
| 治疗方式 | ||||||||
| 未治疗 | 501 | 26.1 | 275 | 28.7 | 226 | 23.6 | ||
| 局部消融b | 350 | 18.3 | 168 | 17.5 | 182 | 19.0 | ||
| 肝切除 | 509 | 26.6 | 240 | 25.1 | 269 | 28.1 | ||
| 肝移植 | 556 | 29.0 | 275 | 28.7 | 281 | 29.3 | ||
| 肿瘤直径 | ||||||||
| <3 cm | 940 | 49.1 | 469 | 49.0 | 471 | 49.2 | ||
| ≥3 cm | 976 | 50.9 | 489 | 51.0 | 487 | 50.8 | ||
| 侵犯c | ||||||||
| 无 | 1 654 | 86.3 | 844 | 88.1 | 810 | 84.6 | ||
| 有 | 262 | 13.7 | 114 | 11.9 | 148 | 15.4 | ||
| AFPd | ||||||||
| 正常 | 633 | 33.0 | 309 | 32.3 | 324 | 33.8 | ||
| 升高 | 1 283 | 67.0 | 649 | 67.7 | 634 | 66.2 | ||
| 肝纤维化评分 | ||||||||
| 0~4分 | 425 | 22.2 | 193 | 20.1 | 232 | 24.2 | ||
| 5~6分 | 1 491 | 77.8 | 765 | 79.9 | 726 | 75.8 | ||
| a:SEER分期,L代表局部肿瘤(localized),R代表区域肿瘤(regional),D代表远处转移(distant);b:包括瘤内酒精注射、射频消融等;c:肉眼或影像学可见的大血管侵犯,如门静脉主干及左右分支、3支肝静脉主干、肝动脉主干或腔静脉等,不包括肝段分支,组织侵犯包括卫星灶、肝内转移、胆囊、网膜、胃、胰腺受侵犯等;d:甲胎蛋白(α-fetoprotein, AFP) | ||||||||
2.2 危险因素分析
对训练组中958例患者采用单因素Cox回归分析和多因素lasso Cox回归分析。在单因素分析中,初步显示年龄、种族、肿瘤分化程度、SEER分期、肿瘤大小、N分期、M分期、手术方式、AFP是与小肝癌患者OS和CSS有统计学意义的相关因素(均P<0.05),另外CSS还与是否合并大血管或组织侵犯有关(P<0.05,表 2)。对所有这些有统计学意义的因素采用lasso Cox回归分析,进一步筛选独立影响因素,年龄、肿瘤分化程度、SEER分期、肿瘤大小、治疗方式、N分期被确定为影响小肝癌患者OS和CSS共同的独立影响因素(均P<0.05),侵犯为构建预测CSS列线图的变量,而种族、M分期、AFP在变量筛选过程中被剔除(图 2)。
| 可能影响因素 | OS | CSS | |||
| HR(95%CI) | P值 | HR(95% CI) | P值 | ||
| 年龄 | |||||
| <60岁 | 参照 | 参照 | |||
| ≥60岁 | 1.493(1.257~1.774) | <0.001 | 1.557(1.281~1.893) | <0.001 | |
| 种族 | |||||
| 白种人 | 参照 | 参照 | |||
| 黑种人 | 1.355(1.054~1.743) | 0.017 | 1.355(1.022~1.796) | 0.034 | |
| 其他 | 0.782(0.623~0.981) | 0.032 | 0.765(0.591~0.991) | 0.041 | |
| 性别 | |||||
| 女 | 参照 | 参照 | |||
| 男 | 0.996(0.816~1.215) | 0.960 | 1.037(0.827~1.300) | 0.756 | |
| 分化程度 | |||||
| Ⅰ | 参照 | 参照 | |||
| Ⅱ | 0.959(0.794~1.158) | 0.665 | 1.073(0.864~1.334) | 0.521 | |
| Ⅲ+Ⅳ | 1.451(1.123~1.876) | 0.004 | 1.732(1.302~2.303) | <0.001 | |
| SEER分期 | |||||
| L | 参照 | 参照 | |||
| R | 1.536(1.260~1.873) | <0.001 | 1.734(1.395~2.157) | <0.001 | |
| D | 3.992(2.568~6.204) | <0.001 | 4.723(2.963~7.528) | <0.001 | |
| N分期 | |||||
| N0 | 参照 | 参照 | |||
| N1 | 4.612(2.966~7.169) | <0.001 | 5.350(3.357~8.525) | <0.001 | |
| M分期 | |||||
| M0 | 参照 | 参照 | |||
| M1 | 4.229(2.727~6.558) | <0.001 | 4.842(3.048~7.693) | <0.001 | |
| 治疗方式 | |||||
| 未治疗 | 参照 | 参照 | |||
| 局部消融 | 0.476(0.376~0.603) | <0.001 | 0.466(0.359~0.605) | <0.001 | |
| 肝切除 | 0.390(0.315~0.484) | <0.001 | 0.372(0.293~0.473) | <0.001 | |
| 肝移植 | 0.130(0.099~0.170) | <0.001 | 0.099(0.070~0.138) | <0.001 | |
| 肿瘤大小 | |||||
| <3 cm | 参照 | 参照 | |||
| ≥3 cm | 1.929(1.619~2.297) | <0.001 | 2.122(1.738~2.592) | <0.001 | |
| 侵犯 | |||||
| 无 | 参照 | 参照 | |||
| 有 | 1.268(0.986~1.630) | 0.062 | 1.407(1.070~1.849) | 0.014 | |
| AFP | |||||
| 正常 | 参照 | 参照 | |||
| 升高 | 1.265(1.050~1.523) | 0.013 | 1.319(1.067~1.631) | 0.010 | |
| 肝纤维化评分 | |||||
| 0~4分 | 参照 | 参照 | |||
| 5~6分 | 0.940(0.765~1.157) | 0.561 | 0.938(0.743~1.185) | 0.595 | |
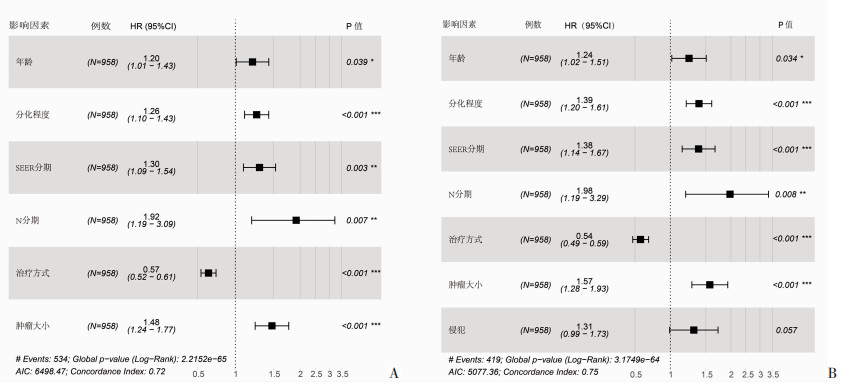
|
| 图 2 训练组OS(A)和CSS(B)的HR、95%CI及多因素lasso Cox回归分析的森林图 |
2.3 列线图的建立和验证
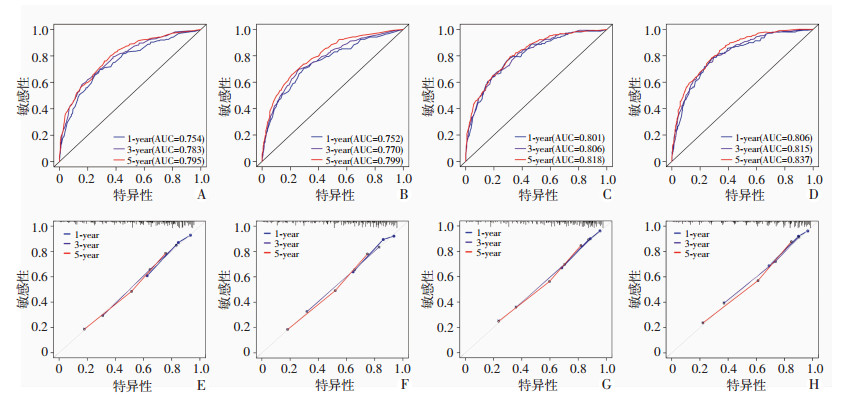
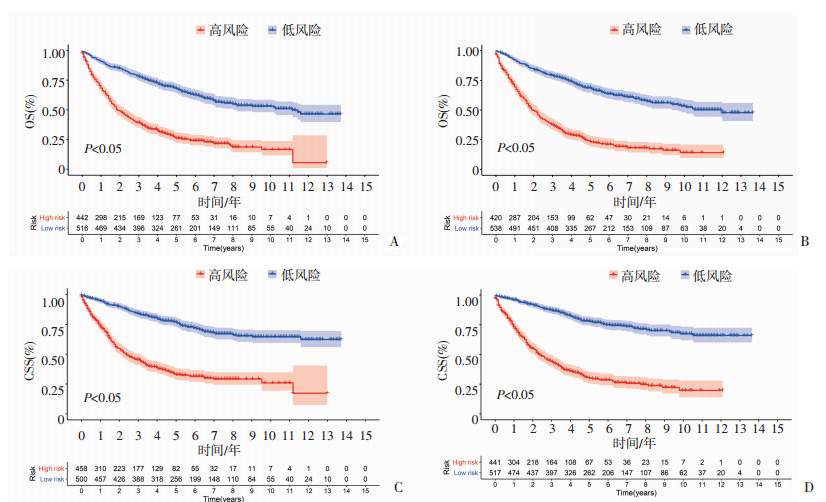
根据AIC信息准则进行筛选,纳入OS相关的6个独立影响因素构建预测小肝癌患者1、3、5年OS的列线图(图 3A);纳入CSS相关的6个独立影响因素以及1个相关因素构建预测小肝癌患者1、3、5年CSS的列线图(图 3B)。在训练组中构建OS和CSS的列线图预测C指数分别为0.727(95%CI:0.705~0.750)、0.753(95%CI:0.729~0.777);在验证组中分别为0.725(95%CI:0.702~0.749)、0.772(95%CI:0.748~ 0.795)。预测OS列线图在训练组中1、3、5年生存率的ROC曲线下面积分别为0.754,0.783,0.795 (图 4A);在验证组中分别为0.752、0.770、0.799(图 4B)。预测CSS列线图在训练组中1、3、5年生存率的ROC曲线下面积分别是0.801、0.806、0.818(图 4C);在验证组中分别为0.806、0.815、0.837(图 4D)。校准曲线显示,在两个队列中,本研究构建的预测OS及CSS的列线图预测的1、3、5年生存率与实际观察值有较高的一致性(图 4E~H)。建立的列线图通过C指数、ROC曲线、校准曲线评价,预测效果是令人满意的。基于建立的列线图,计算了训练组中每个患者的总分,以总分的中位数建立风险分层,将患者分为高风险组和低风险组。生存分析显示:在训练组和验证组中,低风险预后明显优于高风险组(均P<0.05,图 5)。当然,由于SEER数据库缺乏血生化指标、肝癌病因学指标、并发症等相关数据信息,本研究结果还需要进一步大样本量的研究来证实和改进。

|
| 红色分数为举例说明预测该患者1、3、5年OS和CSS的概率,方框大小表示在数据集中该亚组病例所占比重多少,*号数量越多表示该变量对结局影响较大 图 3 预测小肝癌患者1、3、5年OS(A)和CSS(B)的列线图 |
|
| A、B:OS列线图在训练组和验证组预测1、3、5年总生存率的ROC曲线;E、F:其校准曲线;C、D:CSS列线图在训练组和验证组预测1、3、5年癌症特异性生存率的ROC曲线;G、H:其校准曲线 校准曲线显示列线图的预测值与实际观察值一致 图 4 训练组和验证组患者ROC曲线和校准曲线 |
|
| A、B:预测OS列线图在训练组和验证组中风险分层;C、D:预测CSS列线图在训练组和验证组中风险分层 低风险组与高风险组预后差异具有统计学意义(均P<0.05),低风险预后明显优于高风险组 图 5 训练组和验证组患者风险分层分析 |
3 讨论
随着诊断技术的不断发展,结合CT、超声及血清学检查,可以较早发现10 mm以上的肝癌患者,以及对10 mm以下的结节进行随访[17]。影响肝癌预后的因素较多,在本研究中,年龄、肿瘤分化程度、SEER分期、肿瘤大小、治疗方式、局部淋巴结转移为影响小肝癌患者OS及CSS共同的独立影响因素,其中治疗方式是对预后影响较大的保护因素(OS:HR=0.57,95%CI:0.52~0.61,CSS:HR=0.54,95%CI:0.49~0.59)。
肝移植对于早期肝癌治疗获益最大,由于供肝短缺等原因,手术切除仍是目前首选的治疗方式[18],但肝癌总体预后很差,即使是早期肝癌患者,也只有5%~ 15%的患者符合手术切除的条件[19]。本研究结果显示,治疗方式是小肝癌预后的一个保护因素,肝移植治疗优于切除和局部射频等,未治疗的患者预后最差。即便发生远处转移,病情允许时采取手术治疗的患者生存期也要优于未手术治疗的患者[20]。近年来,射频消融等局部微创手术应用越来越广泛[21],但效果仍有争议,对于直径≤5 cm的肝癌患者,有随机对照研究显示:射频消融治疗在总生存率、无复发生存率方面不优于手术切除[22];但在术后并发症和缩短住院时间上消融治疗优于手术切除[23]。总的来说采取积极的治疗有利于延长生存时间。
SEER分期是一种按肿瘤的扩散距离进行分类的分期方法,较好地结合了疾病的临床和病理特征[24],在本研究数据中,局部肿瘤、区域肿瘤以及远处转移患者1、3、5年总生存率分别为85.1%、64.9%、53.3% vs 73.1%、50.6%、38.9% vs 34.7%、14.3%、0,预后差异明显。发生淋巴结转移的患者预后差[25],同时我们发现,虽然单因素分析表明N分期和M分期均是OS和CSS的影响因素,但多因素分析显示局部淋巴结转移与预后更显著相关(OS:HR=1.92,95%CI:1.19~3.09,CSS:HR=1.98,95%CI:1.19~3.29)。本研究结果显示小肝癌患者肿瘤分化程度越低预后越差,既往研究也证实分化较差者无复发生存率和总生存率均较低[26-27]。
在众多疾病当中,年龄与预后均存在显著的相关性[28],高龄患者器官功能衰退合并基础疾病较多,同时手术切除率低。有研究显示老年肝癌患者的肝切除率为0~14%;而年轻肝癌患者的肝切除率为12%~28%[29]。本研究也显示年龄是小肝癌患者预后的独立危险因素。既往表明生存率与肿瘤直径大小呈负相关[4-5],肿瘤直径≤5 cm患者较直径>5 cm患者预后要好[30]。本研究数据显示<3 cm与≥3 cm组1、3、5年总生存率分别为87.0%、70.3%、60.7% vs 75.9%、51.4%、38.8%,进一步证实小肝癌患者中不同肿瘤大小预后存在差异[31],其原因可能是肿瘤大于3 cm时,发生包膜侵犯、癌栓、卫星结节等不良预后的风险增加[32]。
本研究中单因素分析显示:AFP、M分期、种族等因素可能与预后有关,但对于预测模型的构建影响可能不如上述独立危险因素,所以在变量进一步筛选过程中被剔除。另外,既往的研究显示肝癌预后还与地域环境、个人史如吸烟和饮酒、乙肝病毒和丙肝病毒感染以及是否抗病毒治疗等因素有关[1];特别是合并微血管侵犯(MVI)的患者,即使对于小肝癌患者或接受移植治疗的患者,MVI仍然会增加肿瘤复发率和降低长期生存率[33]。遗憾的是,SEER数据库没有这部分数据,本次研究无法进行进一步的研究。
相对于既往类似的研究,本研究有如下优势:首先,SEER数据库为本研究提供了充足的样本量和临床数据,研究结果有较强的说服力;其次,研究纳入了包括未手术及合并淋巴结转移在内的所有小肝癌患者,这部分患者在许多模型中常常是被排除在外的;第三,经过lasso回归分析及多因素Cox回归分析筛选变量后建立的预测模型,具有性能好、变量少、便于临床使用的优点[34],还能防止模型过度拟合,提高了其临床适用性和准确性[35]。发生大血管或局部组织侵犯是肝癌患者不良预后因素[36],在本研究中虽然这个因素不是影响CSS的独立影响因素,但经过lasso Cox回归分析和AIC信息准则评价,该因素是构建癌症特异性生存率预测模型的重要变量。本研究建立的预测模型在训练组中预测OS和CSS的C指数分别为0.727、0.753,在验证组中为0.725、0.772,在统计学上高于日本肝癌研究组(C指数=0.64)、AJCC分期第7版(C指数=0.65)和BCLC分期(C指数=0.5)[11],ROC曲线下面积及校准曲线均显示性能良好。但本研究也有局限性:首先,SEER数据库未记录肝癌病因如病毒感染以及相关个人史等,也未详细记录肿瘤数目、血生化指标等临床因素以及疾病复发等相关资料,可能会对研究结果造成一定影响;其次,回顾性研究存在难以避免的潜在选择偏倚;第三,缺乏多中心、大样本量、前瞻性试验予以验证。这些局限将促使我们进行更完善的实验设计对模型进行改进和优化。
综上所述,本研究结果表明:年龄、肿瘤直径、SEER分期、局部淋巴结转移和肿瘤细胞分化程度可能是对小肝癌患者预后影响较大的不良影响因素。尽早手术干预可以为患者带来相对良好的长期生存预后。本研究建立的预测OS和CSS的列线图,经过C指数、ROC曲线、校准曲线和风险分层对其预测性能和临床应用进行评价,能有效地预测本数据集中小肝癌患者的OS和CSS,并准确对其进行风险分层,可协助外科医生进行临床决策。
| [1] |
VILLANUEVA A. Hepatocellular Carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI:10.1056/NEJMra1713263 |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [3] |
JEMAL A, WARD E M, JOHNSON C J, et al. Annual report to the nation on the status of cancer, 1975-2014, featuring survival[J]. J Natl Cancer Inst, 2017, 109(9): 1-22. DOI:10.1093/jnci/djx030 |
| [4] |
ZHANG W J, WANG X C, JIANG R Q, et al. Effect of tumor size on cancer-specific survival in small hepatocellularcarcinoma[J]. Mayo Clin Proc, 2015, 90(9): 1187-1195. DOI:10.1016/j.mayocp.2015.06.018 |
| [5] |
WEI YY, DAI F, YI Y X, et al. Impact of local tumor lesion treatments and preoperative indicators on the survival of patients with small hepatocellular carcinomas[J]. Oncol Lett, 2018, 16(4): 5050-5058. DOI:10.3892/ol.2018.9263 |
| [6] |
EL-SERAG H B, MARRERO J A, RUDOLPH L, et al. Diagnosis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2008, 134(6): 1752-1763. DOI:10.1053/j.gastro.2008.02.090 |
| [7] |
ZHOU X D, TANG Z Y, YANG B H, et al. Experience of 1000 patients who underwent hepatectomy for small hepatocellular carcinoma[J]. Cancer, 2001, 91(8): 1479-1486. DOI:10.1002/1097-0142(20010415)91:81479::aid-cncr1155>3.0.co;2-0 |
| [8] |
HONG S K, LEE K W, YOON K C, et al. Different prognostic factors and strategies for early and late recurrence after adult living donor liver transplantation for hepatocellular carcinoma[J]. Clin Transplant, 2019, 33(10): e13703. DOI:10.1111/ctr.13703 |
| [9] |
ZHENG J, CHOU J F, GÖNEN M, et al. Prediction of hepato- cellular carcinoma recurrence beyond Milan criteria after resection: validation of a clinical risk score in an internationalcohort[J]. Ann Surg, 2017, 266(4): 693-701. DOI:10.1097/SLA.0000000000002360 |
| [10] |
ZHU G Q, SUN M, LIAO W T, et al. Comparative efficacy and safety between ablative therapies or surgery for small hepatocellular carcinoma: a network meta-analysis[J]. Expert Rev Gastroenterol Hepatol, 2018, 12(9): 935-945. DOI:10.1080/17474124.2018.1503531 |
| [11] |
KIM J M, KWON C H D, JOH J W, et al. Nomograms in hepatectomy patients with hepatitis B virus-related hepatocellular carcinoma[J]. J Gastrointest Surg, 2019, 23(8): 1559-1567. DOI:10.1007/s11605-018-04074-z |
| [12] |
KAIBORI M, ISHIZAKI M, SAITO T, et al. Risk factors and outcome of early recurrence after resection of small hepatocellular carcinomas[J]. Am J Surg, 2009, 198(1): 39-45. DOI:10.1016/j.amjsurg.2008.07.051 |
| [13] |
BALACHANDRAN V P, GONEN M, SMITH J J, et al. Nomograms in oncology: more than meets the eye[J]. Lancet Oncol, 2015, 16(4): e173-e180. DOI:10.1016/S1470-2045(14)71116-7 |
| [14] |
LEE H W, AHN S H. Prediction models of hepatocellular carcinoma development in chronic hepatitis B patients[J]. World J Gastroenterol, 2016, 22(37): 8314-8321. DOI:10.3748/wjg.v22.i37.8314 |
| [15] |
IASONOS A, SCHRAG D, RAJ G V, et al. How to build and interpret anomogram for cancer prognosis[J]. J Clin Oncol, 2008, 26(8): 1364-1370. DOI:10.1200/JCO.2007.12.9791 |
| [16] |
ZHANG S L, WANG X, LI Z M, et al. Score for the overall survival probability of patients with first-diagnosed distantly metastatic cervical cancer: a novel nomogram-based risk assessment system[J]. Front Oncol, 2019, 9: 1106. DOI:10.3389/fonc.2019.01106 |
| [17] |
BRUIX J, REIG M, SHERMAN M. Evidence-based diagnosis, staging, and treatment of patients with hepatocellularcarcinoma[J]. Gastroenterology, 2016, 150(4): 835-853. DOI:10.1053/j.gastro.2015.12.041 |
| [18] |
KUTLU O C, CHAN J A, ALOIA T A, et al. Comparative effectiveness of first-line radiofrequency ablation versus surgical resection and transplantation for patients with early hepatocellular carcinoma[J]. Cancer, 2017, 123(10): 1817-1827. DOI:10.1002/cncr.30531 |
| [19] |
ANWANWAN D, SINGH S K, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873(1): 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [20] |
MAO K, YAN Y C, ZHANG J L, et al. The impact of liver resection on survival outcomes of hepatocellular carcinoma patients with extrahepatic metastases: a propensity score matching study[J]. Cancer Med, 2018, 7(9): 4475-4484. DOI:10.1002/cam4.1738 |
| [21] |
NAULT J C, SUTTER O, NAHON P, et al. Percutaneous treatment of hepatocellular carcinoma: State of the art and innovations[J]. J Hepatol, 2018, 68(4): 783-797. DOI:10.1016/j.jhep.2017.10.004 |
| [22] |
NG K K C, CHOK K S H, CHAN A C Y, et al. Randomized clinical trial of hepatic resection versus radiofrequency ablation for early-stage hepatocellular carcinoma[J]. Br J Surg, 2017, 104(13): 1775-1784. DOI:10.1002/bjs.10677 |
| [23] |
DUAN C Y, LIU M Y, ZHANG Z H, et al. Radiofrequency ablation versus hepatic resection for the treatment of early-stage hepatocellular carcinoma meeting Milan criteria: a systematic review and meta-analysis[J]. World J Surg Oncol, 2013, 11(1): 190. DOI:10.1186/1477-7819-11-190 |
| [24] |
YOUNG J L, ROFFERS S D, RIES L A G, et al. SEER summary staging manual 2000: codes and coding instructions[M]. Bethesda: National Cancer Institute, 2001.
|
| [25] |
KIM Y, PARK H C, YOON S M, et al. Prognostic group stratification andnomogram for predicting overall survival in patients who received radiotherapy for abdominal lymph node metastasis from hepatocellular carcinoma: a multi-institutional retrospective study (KROG 15-02)[J]. Oncotarget, 2017, 8(55): 94450-94461. DOI:10.18632/oncotarget.21775 |
| [26] |
SHEN J Y, LIU J Y, LI C, et al. The impact of tumor differentiation on the prognosis of HBV-associated solitary hepatocellular carcinoma followinghepatectomy: a propensity score matching analysis[J]. Dig Dis Sci, 2018, 63(7): 1962-1969. DOI:10.1007/s10620-018-5077-5 |
| [27] |
ZHAO S, SU G, YANG W K, et al. Identification and comparison of differentiation-related proteins in hepatocellular carcinoma tissues by proteomics[J]. Technol Cancer Res Treat, 2017, 16(6): 1092-1101. DOI:10.1177/1533034617732426 |
| [28] |
NICCOLI T, PARTRIDGE L. Ageing as a risk factor for disease[J]. Curr Biol, 2012, 22(17): R741-752. DOI:10.1016/j.cub.2012.07.024 |
| [29] |
OISHI K, ITAMOTO T, KOHASHI T, et al. Safety of hepatectomy for elderly patients with hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(41): 15028-15036. DOI:10.3748/wjg.v20.i41.15028 |
| [30] |
TSILIMIGRAS D I, BAGANTE F, MORIS D, et al. Defining the chance of cure after resection for hepatocellular carcinoma within and beyond the Barcelona Clinic Liver Cancer Guidelines: a multi-institutional analysis of 1, 010 patients[J]. Surgery, 2019, 166(6): 967-974. DOI:10.1016/j.surg.2019.08.010 |
| [31] |
HUANG W J, JENG Y M, LAI H S, et al. Tumor size is a major determinant of prognosis of resected stage I hepatocellularcarcinoma[J]. Langenbecks Arch Surg, 2015, 400(6): 725-734. DOI:10.1007/s00423-015-1329-4 |
| [32] |
LU X Y, XI T, LAU W Y, et al. Pathobiological features of small hepatocellular carcinoma: correlation between tumor size and biological behavior[J]. J Cancer Res Clin Oncol, 2011, 137(4): 567-575. DOI:10.1007/s00432-010-0909-5 |
| [33] |
FENG L H, DONG H, LAU W Y, et al. Novel microvascular invasion-based prognostic nomograms to predict survival outcomes in patients after R0 resection for hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2017, 143(2): 293-303. DOI:10.1007/s00432-016-2286-1 |
| [34] |
罗治文, 陈晓, 张业繁, 等. 机器学习算法和COX列线图在肝细胞癌术后生存预测中的应用价值[J]. 中华消化外科杂志, 2020, 19(2): 166-178. LUO Z W, CHEN X, ZHANG Y F, et al. Application value of machine learning algorithms and COX nomogram in the survival prediction of hepatocellular carcinoma after resection[J]. Chin J Dig Surg, 2020, 19(2): 166-178. DOI:10.3760/cma.j.issn.1673-9752.2020.02.009 |
| [35] |
ZHU W, XIE L X, HAN J Y, et al. The application of deep learning in cancer prognosisprediction[J]. Cancers (Basel), 2020, 12(3): E603. DOI:10.3390/cancers12030603 |
| [36] |
FINN R S, ZHU A X, FARAH W, et al. Therapies for advanced stage hepatocellular carcinoma with macrovascular invasion or metastatic disease: a systematic review and meta-analysis[J]. Hepatol Baltim Md, 2018, 67(1): 422-435. DOI:10.1002/hep.29486 |



