咖啡因不仅是许多如咖啡和茶等饮料的主要成分,还是广泛使用的精神活性药物(生理兴奋剂),其容易穿过血脑屏障到达大脑从而提高警觉性和注意力,稳定情绪和认知表现[1]。咖啡因的广泛应用,尤其是通过饮用的方式摄取咖啡因,引起了人们对其有益作用和副作用的探索和关注。如在损伤方面,对于咖啡因作用的研究比较多,发现其作用也不尽相同:因咖啡因具有抗氧化和抗炎作用而对一些损伤导致的神经退行性疾病发挥着保护作用[2-3],尤其咖啡因是一种有效的自由基清除剂和腺苷受体拮抗剂,具有抗氧化、抗炎和抗凋亡的特性,是一种多效性的神经保护药物[4];而且,咖啡因还可以减弱高氧诱导的环氧合酶-2激活和凋亡标志物的产生,从而对新生大鼠高氧肺损伤有保护作用[5];不过,也有研究发现咖啡因可加重脊髓损伤后继发性退行性变[6],减慢骨缺损愈合的速度[7]和拔牙后的骨愈合率[8]等有害作用。因此,明确咖啡因的各种不同作用,不仅对饮用含咖啡因的饮品或将其作为药物使用都具有积极的指导意义,还可为开发其药用价值奠定基础。
然而,在皮肤损伤愈合方面,咖啡因的作用研究仍然不足。虽然,一方面咖啡因及其代谢物可可碱和黄嘌呤具有抗氧化特性,且一些研究表明抗氧化剂能促进伤口愈合[9];另一方面,咖啡因是腺苷受体拮抗剂,研究表明其与腺苷受体激动剂作用相反,咖啡因可通过抑制血管生成、降低细胞外基质的产生等而延迟伤口愈合[10-11]。这两方面都表明了咖啡因具有调节伤口愈合作用,但导致的作用不同。由此,有研究采用原代人角质形成细胞、HaCaT细胞系和人皮肤离体模型进行研究,发现咖啡因会阻碍角质形成细胞的增殖和迁移,表明咖啡因可能对伤口愈合和上皮化有抑制作用[12]。但是,利用在体动物模型研究咖啡因对皮肤损伤愈合的影响尚少见报道。有研究发现咖啡因可抑制酒精性肝纤维化[13],且可通过抑制肝星状细胞的粘附和活化而减轻肝纤维化的进程[14]。同时,咖啡因是腺苷受体拮抗剂,而腺苷受体拮抗剂具有抗皮肤伤口愈后瘢痕形成作用[11, 15]。由此,推测咖啡因对皮肤伤口愈后瘢痕形成也具有调节作用。
因此,本研究采用前期已经建立的通过饮用的方式摄取咖啡因慢性干预小鼠模型[16],该模型中动物的咖啡因饮用量与人类通常饮用的实际用量相近,皮肤损伤采用前期建立的背部全层切割伤方法[17],探讨咖啡因对小鼠皮肤伤口愈合和愈后瘢痕的影响。
1 材料与方法 1.1 实验动物昆明种小鼠(雄性,体质量25~28 g,2~3个月龄)由陆军军医大学实验动物中心提供,生产许可证号为SCXK(PLA)20120011,使用许可证号为SYXK(PLA)20120031。所有实验程序严格按照美国国立卫生研究院《实验动物护理和使用指南》(NIH出版物编号86-23,1985年修订)执行,并经陆军军医大学实验动物福利伦理审查委员会批准。
1.2 小鼠伤口愈合模型与咖啡因干预与前期采用的大鼠伤口愈合模型制作相似[17],只是切割伤口大小为直径1 cm。待麻醉清醒过后,小鼠分成单笼饲养。实验动物分为两组,一组为咖啡因组,采取我们以前的处理方式[16],即在制作切割模型前3周,小鼠的饮用水中加入0.25 g/L的咖啡因,并一直饮用到杀死动物取标本为止;另一组为对照组,饮用普通小鼠饮用水。咖啡因从西格玛化学公司(德国斯坦海姆)购买。为保持适当的咖啡因浓度,每周更换3次新配置的咖啡因饮用水。
1.3 创面愈合及瘢痕面积的观察处理及观察方法与前期研究相同[17],并分别于伤后0、3、6、9、12、15 d和愈合后30 d,用透明膜追踪各组创面愈合和瘢痕情况。确定愈合率的公式如下:[1-(当前未愈合创面面积/原始创面面积)]×100%。面积计算采用图像处理软件计算一次瘢痕面积。
1.4 组织病理学分析于损伤后3、6、9 d和愈合后30 d处死小鼠并取全层皮肤标本。取材时,整个伤口组织和瘢痕组织连带周围正常皮肤整体取材。经过4%多聚甲醛固定后,进行石蜡包埋。在石蜡包埋前的标本处理中,将伤口(一般为圆形)标本从中间切开(伤口最大直径),而瘢痕标本(一般为长条形)从条形中间横断(瘢痕最大宽度),都做成两块包埋,以保证后续观察和免疫组化定量分析时条件相对一致。对获得的组织石蜡块进行切片,切片厚度为5 μm。切片进行HE染色,观察伤口组织上皮爬行、肉芽组织厚度、瘢痕组织上皮薄厚比及瘢痕宽度(切片上)等,Masson染色分析胶原变化。评估伤口愈合和瘢痕形成的定量指标的处理同前期发表的研究[17],并采用Labwork 4.0软件进行采集。平均值由至少6个不同的小鼠皮肤切片计算得出,而每个动物伤口组织中随机选择3个切片,计算平均值。所有组织学测量均由不了解应用条件的观察者独立进行。
1.5 免疫组织化学观察与图像定量分析用鼠单克隆CD11B(Invitrogen, ThermoFisher, MA)、兔多克隆CD31(Abcam, Cambridge, MA)进行免疫组化实验。应用鼠/兔链霉卵白素-生物素法检测系统(中杉金桥生物技术有限公司, 北京)检测。具体操作步骤同前期研究[18]。使用显微镜照相(Leica, 德国),且用于定量分析的为40×视野照片。定量分析中,从每个动物伤口组织切片中选取两侧伤口边缘及中间3个区域照相(×40),并使用Image-Pro Plus image analysis system(6.0版)测定阳性染色区域的积分光密度,取平均值,每组至少6只小鼠。所有组织学测量均由不了解应用条件的观察者独立进行。
1.6 统计学分析数据以x±s表示。使用SigmaPlot统计软件11.0版本对两组间进行student's t检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 咖啡因对创面愈合及愈后瘢痕面积的影响咖啡因组小鼠伤口愈合减慢(图 1A),且与对照组相比,伤口愈合时间延长了28.3%[(12±0.89) vs (15.4±1.56) d, P < 0.05]。从伤口愈合速度上,在伤口愈合的3~9 d差异最明显(图 1B)。不过,咖啡因组明显减少了创伤后瘢痕面积的愈合(图 1C),比对照相比缩小56.8%[(0.38±0.13) vs (0.16±0.03) cm2, P < 0.01]。
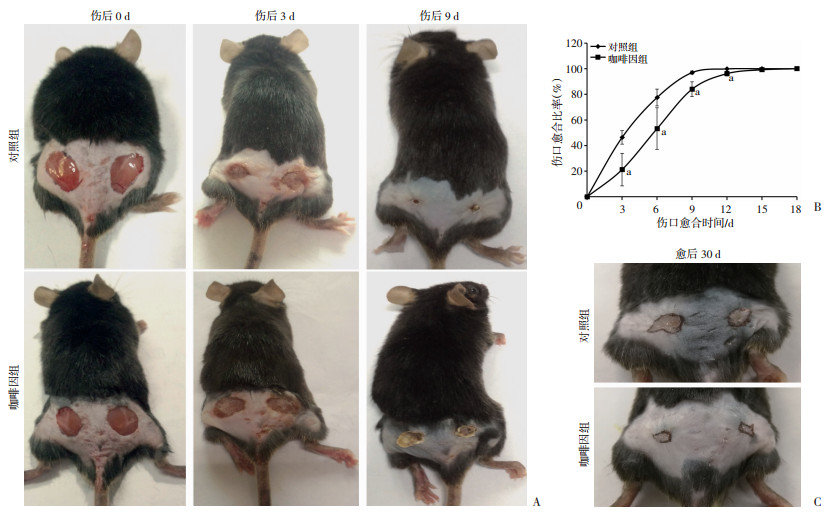
|
| A:两组小鼠伤后0、3、9 d伤口愈合情况;B:两组小鼠在伤口愈合比率a:P < 0.01,与对照组比较;C:两组小鼠伤口愈合后30 d瘢痕情况 图 1 咖啡因对小鼠创面愈合及愈后瘢痕面积的影响 |
2.2 咖啡因干预后创面的组织病理学变化
伤后3 d可见上皮细胞向伤口中心的爬行(黑色箭头示,图 2A),并在伤后6~9 d爬行速度加快(图 2B);而伤后3 d可见少量的肉芽组织(图 2A,绿色箭头示肌肉组织),伤后6 d大量增生,9 d覆盖整个创面(图 2C)。另外,伤后6 d,咖啡因组的上皮爬行长度与对照组相差最大,约占对照的70%(图 2B);而在肉芽组织厚度方面,咖啡因组在伤后9 d与对照组相差最大,约占对照的60%(图 2C)。同时,还发现在肉芽组织中,咖啡因组的血管样结构(红色箭头)明显少于对照组(图 2A)。

|
| A:两组小鼠在伤后3、6、9 d伤口愈合情况红色箭头示血管样结构;绿色箭头示肌肉;黑色箭头示上皮;黑色横线示未闭合伤口的长度;B:两组小鼠伤口爬行长度a:P < 0.05,b:P < 0.01,与对照组比较;C:两组小鼠伤口肉芽组织厚度b:P < 0.01与对照组比较 图 2 HE染色观察咖啡因干预后小鼠创面组织病理学变化 |
2.3 咖啡因干预后创面的CD31和CD11b表达及胶原含量变化
伤后6 d,与对照组相比,咖啡因组的CD31阳性细胞(红色箭头示)数量减少(图 3A),其光密度值显著下降(6 786.88±940.01 vs 2 488.19±374.04,P < 0.01)。同时,CD11b阳性细胞数量增多(红色箭头示,4 825.99±592.63 vs 10 263.94±1 181.75,P < 0.01,图 3B)。另外,Masson染色分析显示:虽然两组在损伤周边(黑色箭头,图 3C)中胶原染色都为深蓝色,但是在伤口中,咖啡因组小鼠的胶原含量显著下降(19 628.50±973.51 vs 9 438.72±1 311.00,P < 0.01, 图 3C)。

|
| A:免疫组化S-P染色观察伤后6 d两组小鼠伤口组织CD31表达红色箭头示CD31阳性细胞;B:免疫组化S-P染色观察伤后6 d两组小鼠伤口组织CD11b表达红色箭头示CD11b阳性细胞;C:伤后6 d两组小鼠伤口组织Masson染色黑色箭头示Masson染色阳性区域 图 3 咖啡因干预后创面的CD31和CD11b表达及胶原含量变化 |
2.4 咖啡因干预后瘢痕的组织病理学变化
伤口愈合后30 d,咖啡因组小鼠瘢痕宽度要显著小于对照组[(2.18±0.20) vs (1.29±0.200) mm,P < 0.01, 图 4A],而瘢痕组织上皮厚度均匀且与损伤周边皮肤的上皮组织(黑色箭头示,图 4A)相似,同时瘢痕组织上皮薄厚比也显著大于对照组(0.35±0.10 vs 0.92±0.02,P < 0.01, 图 4A)。Masson染色显示:对照组瘢痕中胶原染色较浅于周边未损伤皮下胶原染色(红色箭头示,图 4B),而咖啡因组小鼠瘢痕中胶原染色较与周边未损伤皮下胶原染色相近(红色箭头示,图 4B),且胶原含量显著高于对照组(99 639.91±111 878.51 vs 198 078.06±9 566.52,P < 0.01, 图 4B)。
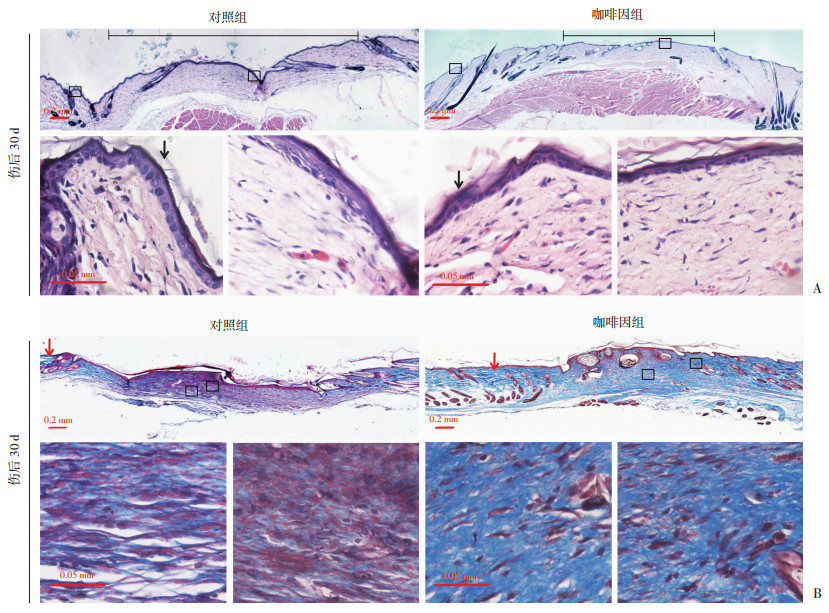
|
| A:HE染色观察两组小鼠愈合后30 d瘢痕情况黑色箭头示上皮组织;黑色横线示瘢痕宽度;B:两组小鼠在愈合后30 d瘢痕组织Masson染色比较红色箭头示瘢痕周围组织Masson染色 图 4 咖啡因干预后瘢痕的组织病理学变化 |
3 讨论
本研究发现通过饮用的方式摄取咖啡因不仅延长了伤口愈合时间,而且降低了伤口愈合的速度,从动物实验研究的角度证实了咖啡因可以抑制伤口愈合。这个结果也是对OJEH等[12]的细胞研究(提示咖啡因可以抑制伤口愈合)的进一步动物实验的验证。有研究表明腺苷受体的拮抗剂可通过抑制血管生成和降低细胞外基质的产生等而延迟伤口愈合[10-11],据此可推测咖啡因作为腺苷受体的拮抗剂应具有这种作用。同时,有研究发现咖啡因对骨损伤愈合具有抑制作用[7],提示其具有抑制类似病理过程的皮肤伤口愈合的作用。在其他损伤,尤其是颅脑损伤中,咖啡因具有保护作用[4],这可能是由于其作用于中枢神经和外周神经有差异所导致。与腺苷A2AR受体在中枢神经和外周神经具有相反作用[19]的原因相似,作为其拮抗剂,咖啡因也可能具有这种相反作用。此外,还有局部应用咖啡因的研究,如局部应用咖啡因对吻合口重塑有额外的有益作用[20],即吻合口边缘内膜增生减少,术野抗纤维化,而1.5%含咖啡因Bio-Oss应用于犬骨缺损修复可促进新骨形成[21],这可能与应用方式、使用时间不同有关。另外,本研究只用1个剂量来研究该效应是一个重要的不足,我们也将在今后的研究中增加剂量数,以便能更好地阐述咖啡因影响伤口修复这个问题。
在探索通过饮用的方式摄取咖啡因延迟伤口愈合可能作用的细胞组织学机制中发现,咖啡因可提高炎性细胞的浸润,使肉芽组织形成减少,再上皮化减慢(上皮爬行)。恰恰这些也是影响伤口愈合的重要病理过程[22-24]。从分子机制方面分析,受咖啡因抑制的腺苷受体剂在上述过程中的作用可解释这一发现,已有研究表明:不同的腺苷受体亚型通过不同方式调节,如中性粒细胞、巨噬细胞、淋巴细胞等炎性细胞及炎性因子的分泌、炎性细胞的粘附[25],从而发挥一定的抗炎作用;同时,腺苷受体对于适当的肉芽组织形成和适当的伤口愈合是必需的,且A2A和A2B腺苷受体刺激肉芽组织形成(即新基质的产生和血管生成),A1腺苷受体也可促进新血管的形成[11],而且许多研究报道了腺苷在调节胶原合成和血管生成中的促进作用[25-26]。本研究发现:在损伤后6 d,咖啡因组小鼠伤口中胶原含量降低(Masson染色结果分析),血管生成减少(CD31组化分析),这是对此很好的说明。另外,对于减慢再上皮化,虽然还没有直接证据,但是有体外研究发现咖啡因会阻碍角质形成细胞的增殖和迁移[12],这也支持咖啡因可能对上皮化有抑制作用的结论。同时,炎症减轻和肉芽组织生成来填补伤口是再上皮化的基础,而咖啡因对前两个过程有影响,则必然对再上皮化有作用。但是,咖啡因是直接还是间接对上皮细胞作用,还需要后续研究进一步探索。
炎症加重、再上皮化延迟、过度胶原沉积和低胶原成熟度都可促进瘢痕形成,特别是导致过度瘢痕形成[27]。然而,本研究发现咖啡因组小鼠伤口愈合后瘢痕面积显著减小,同时HE组化结果也显示咖啡因组小鼠瘢痕宽度要显著小于对照组,这表明饮用咖啡因可减轻瘢痕的形成。尤其是本研究Masson染色发现咖啡因组小鼠瘢痕中胶原染色较与周边未损伤皮下胶原染色相近,比对照小鼠颜色更深,表明咖啡因小鼠瘢痕中胶原的成熟度更好,说明其对瘢痕构成也有改善作用。同时,有研究提示咖啡因具有抑制肝纤维化[14, 28]和肺纤维化[29]等作用,这为其具有抑制皮肤瘢痕作用的推论提供了文献支持。腺苷受体参与了纤维化的形成[30],抗腺苷受体也是重要的抗纤维化途径,如抑制A2AR受体可减轻瘢痕形成[31]。因此,作为腺苷受体抑制剂的咖啡因也应该具有抑制瘢痕作用。虽然炎症加重、再上皮化延迟表明咖啡因加剧了瘢痕形成,但其也以减少伤口胶原生成和增加愈合后胶原成熟度来抑制瘢痕形成。表明并不是伤口愈合延迟就会加剧瘢痕形成,恰恰相反,这对瘢痕有治疗作用。最为典型的就是糖皮质激素,其本身可应用于瘢痕治疗,但同时可导致愈合延迟[32]。不过,咖啡因抑制瘢痕作用的细胞组织学及分子机制还需要今后进行深入探索。另外,本研究中Masson染色显示咖啡因组小鼠愈后瘢痕的胶原含量也高于对照组,这与愈合过程中胶原含量降低相反,其中的原因尚不清楚。不过,小鼠的瘢痕属于扁平瘢痕(非病理性瘢痕)[17],并不存在过度胶原沉积的特点,这从本研究发现的对照组瘢痕中胶原染色浅于周边未损伤皮下胶原染色也可以看出。因此,咖啡因组小鼠愈后瘢痕的胶原含量高于对照组并不代表着胶原过度沉积。
综上所述,本研究明确了通过饮用的方式摄取咖啡因可延缓小鼠皮肤伤口愈合,但可减小瘢痕形成;咖啡因抑制伤口愈合可能与其增加炎症反应、抑制血管生成、减少胶原合成从而减少肉芽组织形成、减慢上皮爬行有关;咖啡因的抑制瘢痕作用可能与其促进胶原成熟、维护上皮薄厚均匀等促进瘢痕结构重构有关。本研究不仅为进一步探索咖啡因对伤口愈合作用机制研究奠定了基础,也为含咖啡因饮品的饮用或作为药物使用具有积极的指导意义。
| [1] |
LOPES J P, PLIASSOVA A, CUNHA R A. The physiological effects of caffeine on synaptic transmission and plasticity in the mouse hippocampus selectively depend on adenosine A1 and A2A receptors[J]. Biochem Pharmacol, 2019, 166: 313-321. DOI:10.1016/j.bcp.2019.06.008 |
| [2] |
HOSNY E N, SAWIE H G, ELHADIDY M E, et al. Evaluation of antioxidant and anti-inflammatory efficacy of caffeine in rat model of neurotoxicity[J]. Nutr Neurosci, 2019, 22(11): 789-796. DOI:10.1080/1028415X.2018.1446812 |
| [3] |
NING Y L, YANG N, CHEN X, et al. Caffeine attenuates brain injury but increases mortality induced by high-intensity blast wave exposure[J]. Toxicol Lett, 2019, 301: 90-97. DOI:10.1016/j.toxlet.2018.11.004 |
| [4] |
ENDESFELDER S, WEICHELT U, STRAUSS E, et al. Neuroprotection by caffeine in hyperoxia-induced neonatal brain injury[J]. Int J Mol Sci, 2017, 18 (1): 10. DOI: 3390/ijms18010187.
|
| [5] |
JING X, HUANG Y W, JARZEMBOWSKI J, et al. Caffeine ameliorates hyperoxia-induced lung injury by protecting GCH1 function in neonatal rat pups[J]. Pediatr Res, 2017, 82(3): 483-489. DOI:10.1038/pr.2017.89 |
| [6] |
YANG C C, JOU I M. Caffeine treatment aggravates secondary degeneration after spinal cord injury[J]. Brain Res, 2016, 1634: 75-82. DOI:10.1016/j.brainres.2015.12.053 |
| [7] |
BASTOS M F, MENEZES D J, BEZERRA J P, et al. Impact of caffeine and/or estrogen deficiency on trabecular bone area and healing: a study in rats[J]. Int J Oral Maxillofac Implants, 2014, 29(1): 221-231. DOI:10.11607/jomi.3186 |
| [8] |
BEZERRA J P, DE SIQUEIRA A, PIRES A G, et al. Effects of estrogen deficiency and/or caffeine intake on alveolar bone loss, density, and healing: a study in rats[J]. J Periodontol, 2013, 84(6): 839-849. DOI:10.1902/jop.2012.120192 |
| [9] |
AHMADI M, KHALILI H. Potential benefits of pentoxifylline on wound healing[J]. Expert Rev Clin Pharmacol, 2016, 9(1): 129-142. DOI:10.1586/17512433.2016.1109443 |
| [10] |
BONYANIAN Z, WALKER M, DU TOIT E, et al. Multiple adenosine receptor subtypes stimulate wound healing in human EA.hy926 endothelial cells[J]. Purinergic Signal, 2019, 15(3): 357-366. DOI:10.1007/s11302-019-09668-z |
| [11] |
FEOKTISTOV I, BIAGGIONI I, CRONSTEIN B N. Adenosine receptors in wound healing, fibrosis and angiogenesis[J]. Handb Exp Pharmacol, 2009(193): 383-397. DOI:10.1007/978-3-540-89615-9_13 |
| [12] |
OJEH N, STOJADINOVIC O, PASTAR I, et al. The effects of caffeine on wound healing[J]. Int Wound J, 2016, 13(5): 605-613. DOI:10.1111/iwj.12327 |
| [13] |
WANG Q, DAI X, YANG W, et al. Caffeine protects against alcohol-induced liver fibrosis by dampening the cAMP/PKA/CREB pathway in rat hepatic stellate cells[J]. Int Immunopharmacol, 2015, 25(2): 340-352. DOI:10.1016/j.intimp.2015.02.012 |
| [14] |
SHIM S G, JUN D W, KIM E K, et al. Caffeine attenuates liver fibrosis via defective adhesion of hepatic stellate cells in cirrhotic model[J]. J Gastroenterol Hepatol, 2013, 28(12): 1877-1884. DOI:10.1111/jgh.12317 |
| [15] |
CORREIA-SA I, PAIVA A, CARVALHO C M, et al. Cutaneous endocannabinoid system: Does it have a role on skin wound healing bearing fibrosis?[J]. Pharmacol Res, 2020, 159: 104862. DOI:10.1016/j.phrs.2020.104862 |
| [16] |
LI W, DAI S, AN J, et al. Chronic but not acute treatment with caffeine attenuates traumatic brain injury in the mouse cortical impact model[J]. Neuroscience, 2008, 151(4): 1198-1207. DOI:10.1016/j.neuroscience.2007.11.020 |
| [17] |
LI P, LIU P, XIONG R P, et al. Ski, a modulator of wound healing and scar formation in the rat skin and rabbit ear[J]. J Pathol, 2011, 223(5): 659-671. DOI:10.1002/path.2831 |
| [18] |
PENG Y, LI P, ZHAO Z A, et al. Comparative evaluation of the wound-healing potency of recombinant bFGF and ski gene therapy in rats[J]. Growth Factors, 2016, 34(3/4): 119-127. DOI:10.1080/08977194.2016.1200570 |
| [19] |
DAI S S, ZHOU Y G. Adenosine 2A receptor: a crucial neuromodulator with bidirectional effect in neuroinflammation and brain injury[J]. Rev Neurosci, 2011, 22(2): 231-239. DOI:10.1515/RNS.2011.020 |
| [20] |
SAKARYA A H, UZUN H, TURKKANI A, et al. Effects of systemic and local caffeine on vessel diameter, anastomosis patency, and intimal hyperplasia in the rat[J]. J Reconstr Microsurg, 2019, 35(4): 244-253. DOI:10.1055/s-0038-1672130 |
| [21] |
SAMIEIRAD S, MIANBANDI V, SALARI SEDIGH H, et al. Is impregnation of xenograft with caffeine effective on bone healing rate in mandibular defects? A pilot histological animal study[J]. J Maxillofac Oral Surg, 2020, 19(1): 85-92. DOI:10.1007/s12663-019-01221-0 |
| [22] |
OISHI Y, MANABE I. Macrophages in inflammation, repair and regeneration[J]. Int Immunol, 2018, 30(11): 511-528. DOI:10.1093/intimm/dxy054 |
| [23] |
YANG Y, LEVINE H. Role of the supracellular actomyosin cable during epithelial wound healing[J]. Soft Matter, 2018, 14(23): 4866-4873. DOI:10.1039/c7sm02521a |
| [24] |
TAKAHASHI Y, NAGAI Y, KANOH H, et al. Polypoid granulation tissue in pressure ulcers: Significance of describing individual ulcers[J]. J Tissue Viability, 2018, 27(4): 217-220. DOI:10.1016/j.jtv.2018.07.002 |
| [25] |
EFFENDI W I, NAGANO T, KOBAYASHI K, et al. Focusing on adenosine receptors as a potential targeted therapy in human diseases[J]. Cell, 2020, 9(3): 785. DOI:10.3390/cells9030785 |
| [26] |
BAHREYNI A, KHAZAEI M, RAJABIAN M, et al. Therapeutic potency of pharmacological adenosine receptor agonist/antagonist in angiogenesis, current status and perspectives[J]. J Pharm Pharmacol, 2018, 70(2): 191-196. DOI:10.1111/jphp.12844 |
| [27] |
TAKEO M, LEE W, ITO M. Wound healing and skin regeneration[J]. Cold Spring Harb Perspect Med, 2015, 5(1): a023267. DOI:10.1101/cshperspect.a023267 |
| [28] |
ARAUZ J, ZARCO N, HERNANDEZ-AQUINO E, et al. Coffee consumption prevents fibrosis in a rat model that mimics secondary biliary cirrhosis in humans[J]. Nutr Res, 2017, 40: 65-74. DOI:10.1016/j.nutres.2017.03.008 |
| [29] |
FEHRHOLZ M, GLASER K, SPEER CP, et al. Caffeine modulates glucocorticoid-induced expression of CTGF in lung epithelial cells and fibroblasts[J]. Respir Res, 2017, 18(1): 51. DOI:10.1186/s12931-017-0535-8 |
| [30] |
CRONSTEIN B N. Adenosine receptors and fibrosis: a translational review[J]. F1000 Biol Rep, 2011, 3: 21. DOI:10.3410/B3-21 |
| [31] |
PEREZ-ASO M, CHIRIBOGA L, CRONSTEIN BN. Pharmacological blockade of adenosine A2A receptors diminishes scarring[J]. FASEB J, 2012, 26(10): 4254-4263. DOI:10.1096/fj.12-209627 |
| [32] |
MESZAROS K, PATOCS A. Glucocorticoids influencing Wnt/beta-catenin pathway; Multiple sites, heterogeneous effects[J]. Molecules, 2020, 25(7): 1489. DOI:10.3390/molecules25071489 |




