胃癌是消化系统恶性肿瘤,化疗是其主要治疗方式之一。紫杉醇是胃癌化疗常用药物,耐药性的产生会严重限制其疗效,是治疗失败的重要原因。研究胃癌的耐药机制,降低化疗药物的多药耐性,对胃癌患者治疗和预后具有重要意义[1-2]。研究发现,长链非编码RNA和微小RNA均与胃癌的诊断、预后及耐药密切相关[3-4]。研究报道抑制lncRNA UCA1通过上调miR-27b表达增强了胃癌细胞对阿霉素、顺铂、5-氟尿嘧啶的敏感性[5]。过表达lncRNA MEG3可降低胃癌细胞活力并诱导细胞凋亡,增加顺铂的化疗敏感性[6]。长基因非蛋白质编码RNA 525(long intergenic non-protein coding RNA 525,LINC00525)是一种lncRNA,在非小细胞肺癌组织中上调表达,可作为非小细胞肺癌预后的有价值的生物标志物[7]。LINC00525高表达与结直肠癌患者预后不良有关,LINC00525通过靶向miR-507/ELK3轴增强了干细胞特性,并增强了结直肠癌细胞对奥沙利铂的敏感性[8]。然而LINC00525对胃癌细胞凋亡及紫杉醇耐药性的影响及机制尚不清楚。有研究报道miR-338-3p在胃癌组织中低表达预示胃癌的不良预后[9]。miR-338-3p过表达减弱了胃癌细胞的迁移并促进了细胞凋亡,起到抑癌作用[10]。且有研究通过microRNA阵列鉴定胃癌患者敏感组和非敏感组之间差异表达的miRNA和miR-338-3p可作为鉴定敏感性的预测生物标志物[11]。miR-338-3p与结肠癌细胞的5-氟尿嘧啶耐药性有关[12]。本实验旨在研究LINC00525对胃癌细胞凋亡及紫杉醇耐药性的影响及其机制是否与miR-338-3p有关。
1 材料与方法 1.1 材料人胃癌细胞(HGC-27)购自广州弗尔博生物科技有限公司;胎牛血清、RPMI-1640培养基购自广州硕恒生物科技有限公司;细胞计数试剂盒8(cell counting kit 8, CCK-8)购自北京利维平生物科技有限公司;Trizol试剂、cDNA合成试剂盒购自北京百奥创新科技有限公司;SYBR Green荧光定量试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒购自上海臻诺生物科技有限公司;Lipofectamine TM 2000转染试剂购自上海伯易生物科技有限公司;RIPA蛋白裂解液、二辛可宁酸(BCA)试剂盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶快速配制试剂盒购自上海经科化学科技有限公司;Transwell小室、Matrigel胶购于上海翊圣生物科技有限公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司。
1.2 细胞培养及紫杉醇耐药胃癌细胞的建立实验利用浓度为10%的胎牛血清RPMI-1640培养基,针对人类胃癌细胞开展培养。具体环境为5%二氧化碳、温度设定为37 ℃。用逐步递增紫杉醇浓度、间歇作用体外诱导法建立紫杉醇耐药胃癌细胞。取对数生长期细胞HGC-27,用紫杉醇初始浓度为1 nmol/L培养,存活细胞用增加浓度的紫杉醇培养,同时每一浓度连续传代3次以稳定耐药特征,直至HGC-27细胞在紫杉醇浓度为150 nmol/L的培养基中可稳定传代培养,将该细胞命名为HGC-27/PTX。
1.3 细胞转染与分组将si-NC、si-LINC00525、miR-NC、miR-338-3p转染至HGC-27/PTX细胞中分别记为si-NC组、si-LINC00525组、miR-NC组、miR-338-3p组;将si-LINC00525分别与anti-miR-NC、anti-miR-338-3p共转染至HGC-27/PTX细胞中,记为si-LINC00525+anti-miR-NC组、si-LINC00525+ anti-miR-338-3p组。
1.4 细胞存活率检测分别用0、1、2、4、8、16 nmol/L浓度的紫杉醇处理HGC-27和HGC-27/PTX细胞,检测其细胞存活率,将培养48 h的细胞,每孔中加入10 μL CCK-8试剂,孵育2 h后,应用酶标仪,于490 nm位置的D(490)值进行测定,测量细胞存活率,实验进行共计3次。其他各组细胞存活率按上述方法检测。
1.5 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测LINC00525和miR-338-3p表达水平提取细胞总RNA,反转录成cDNA。LINC00525和miR-338-3p分别以GAPDH和U6为内参进行PCR,LINC00525上游引物序列:5′-AGACCCTATGACTCC-CG-3′,下游引物序列:5′-TTGGCAAGAAGCAAATC-3′;GAPDH上游引物序列:5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物序列:5′-GCCATCACGCCACAG-TTTC-3′;miR-338-3p上游引物序列:5′-ACACTCCAG-TGGGTCCAGCATCAGTGATTTT-3′,下游引物序列:5′-CTCAACTGGTGTCGTGGA-3′;U6上游引物序列:5′-CGCTTCGGCAGCACATATACTA-3′,下游引物序列:5′-CGCTTCACGAATTTGCGTGTCA-3′。
1.6 蛋白质印迹法测定P21、caspase-3、E-cadherin、MMP-2蛋白表达情况针对各个组的细胞总蛋白进行提取处理,使用BCA试剂盒实施蛋白定量,每组蛋白进样量设定在40 μg。完成SDS-PAGE处理之后,将蛋白转移到PVDF之上,利用脱脂后牛奶室温环境下封闭处理,时间在90 min左右。后加入一抗,利用PBS洗涤共计3次,在4 ℃环境下孵育过夜处理。加入二抗,孵育处理2 h,利用PBS洗涤处理共计3次。显影定影之后,使用相关软件对于蛋白条带灰度值加以测定,后把GAPDH条带、目的条带之比视为蛋白表达最终水平。
1.7 Annexin V-FITC/PI双染法检测细胞凋亡小组细胞培养48 h之后使用事先预冷处理的PBS完成漂洗,共计2次。与500 μL的结合缓冲液混匀。先放入剂量为10 μL Annexin V-FITC。在此之后放入剂量为5 μL的PI,避光处理、混合均匀之后孵育处理,时间为10 min。后对细胞凋亡率完成测定。每组设3个复孔,实验重复3次。
1.8 细胞迁移以及侵袭测定细胞侵袭实验步骤:在Transwell小室上室加入100 μL稀释好的Matrigel胶,加完后十字摇匀,在37 ℃培养箱放置40 min使之凝固。在Transwell小室上室加100 μL细胞悬液,下室加500 μL含血清培养液,37 ℃培养24 h,取出培养板,利用浓度为0.1%的结晶紫染色处理30 min,后应用PBS开展漂洗工作共计2次,去掉上层没有穿透基底膜细胞,择取5个视野,计数,进行3次实验。细胞迁移实验:除不用Matrigel胶包被Transwell小室的上室,其余与细胞侵袭实验操作相同。
1.9 双荧光素酶报告实验验证LINC00525和miR-338-3p靶向关系情况应用PCR扩增法,全面处理LINC00525序列片段,并将其构建于荧光素酶表达载体以内,取得LINC00525野生型载体(WT-LINC00525),将LINC00525序列GATGCTGG突变为CCAAGACA,获得LINC00525突变型载体(MUT-LINC00525),将WT-LINC00525、MUT-LINC00525分别与miR-NC、miR-338-3p共转染到HGC-27细胞之内,经转染48 h之后,依照试剂盒中的说明,全面测定荧光素酶活性度详情。将si-NC、si-LINC00525、pcDNA3.1、pcDNA3.1-LINC00525转染至HGC-27细胞中,按1.5中方法检测miR-338-3p表达水平。
1.10 统计学分析实验数据经SPSS 20.0分析,计量资料用x±s表示,两组比较行t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果 2.1 HGC-27及HGC-27/PTX对紫杉醇的敏感性与未经紫杉醇处理组相比,不同浓度紫杉醇浓度处理组HGC-27细胞存活率均显著降低(P < 0.05);而不同浓度紫杉醇浓度的HGC-27/PTX细胞存活率无显著变化(P>0.05, 表 1)。说明HGC-27/PTX对紫杉醇不敏感,为紫杉醇耐药细胞。
| 紫杉醇浓度(nmol/L) | 存活率(%) | |
| HGC-27 | HGC-27/PTX | |
| 0 | 100.00±10.00 | 99.89±10.01 |
| 1 | 91.13±9.26a | 99.07±9.85 |
| 2 | 81.31±8.37a | 98.46±9.78 |
| 4 | 63.04±6.11a | 97.23±9.66 |
| 8 | 40.41±4.28a | 96.10±9.51 |
| 16 | 33.06±3.25a | 90.01±9.00 |
| F | 125.522 | 1.255 |
| P | < 0.001 | 0.2987 |
| a: P < 0.05,与0 nmol/L组比较 | ||
2.2 LINC00525、miR-338-3p在HGC-27、HGC-27/PTX和GES-1中的表达
与人胃黏膜细胞GES-1相比,HGC-27和HGC-27/PTX细胞中LINC00525表达水平升高,miR-338-3p表达水平降低(P < 0.05);与HGC-27细胞相比,紫杉醇耐药细胞HGC-27/PTX中LINC00525表达水平升高,miR-338-3p表达水平降低(P < 0.05, 表 2)。
| 细胞 | LINC00525 | miR-338-3p |
| GES-1 | 1.00±0.10 | 1.01±0.10 |
| HGC-27 | 1.98±0.21a | 0.36±0.03a |
| HGC-27/PTX | 3.55±0.35ab | 0.11±0.01ab |
| F | 258.986 | 529.773 |
| P | < 0.001 | < 0.001 |
| a: P < 0.05,与GES-1组比较; b: P < 0.05,与HGC-27组比较 | ||
2.3 敲除LINC00525对细胞HGC-27/PTX的细胞存活率、凋亡的影响
与si-NC组相比,si-LINC00525组HGC-27/PTX细胞中LINC00525表达水平降低,caspase-3、P21表达水平升高,细胞存活率降低,细胞凋亡率升高(P < 0.05,图 1,表 3)。
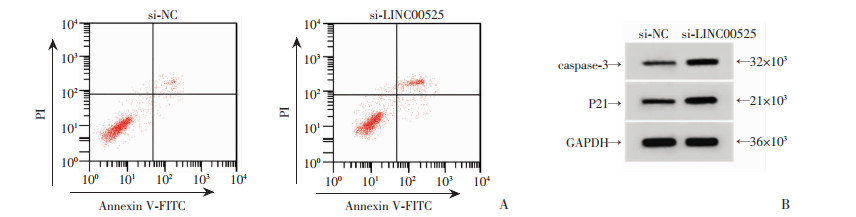
|
| A:敲除LINC00525促进细胞HGC-27/PTX凋亡;B:敲除LINC00525促进P21、caspase-3蛋白的表达 图 1 敲除LINC00525对细胞HGC-27/PTX凋亡及P21、caspase-3蛋白表达的影响 |
| 组别 | LINC00525 | caspase-3 | P21 | 存活率(%) | 凋亡率(%) |
| si-NC | 0.98±0.10 | 0.10±0.01 | 0.20±0.02 | 100.01±10.02 | 8.91±1.01 |
| si-LINC00525 | 0.31±0.03a | 0.52±0.05a | 0.61±0.06a | 54.68±5.39a | 23.26±1.68a |
| t | 19.252 | 24.711 | 19.448 | 11.952 | 21.962 |
| P | < 0.05 | < 0.05 | < 0.05 | < 0.001 | < 0.001 |
| a: P < 0.05,与si-NC组比较 | |||||
2.4 敲除LINC00525对细胞HGC-27/PTX的细胞迁移、侵袭的影响
与si-NC组相比,si-LINC00525组HGC-27/PTX细胞中E-cadherin表达水平升高,MMP-2表达水平降低,细胞迁移、侵袭数降低(P < 0.05,图 2,表 4)。
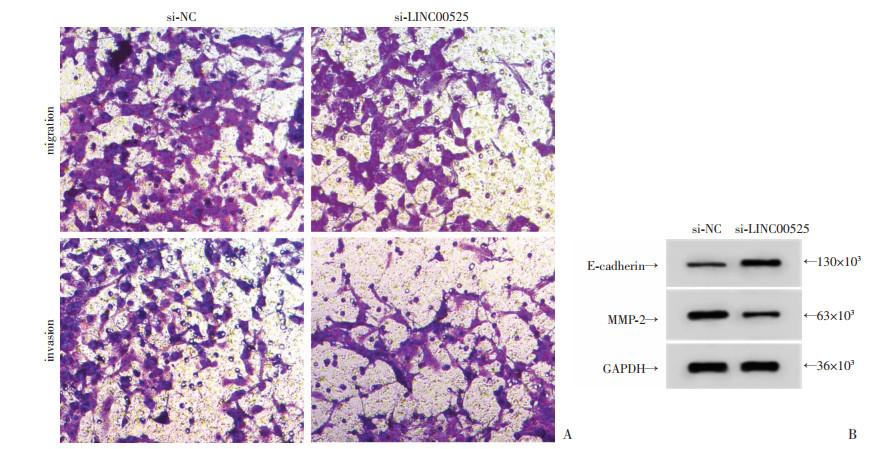
|
| A:敲除LINC00525抑制细胞HGC-27/PTX的细胞迁移、侵袭(×200);B:敲除LINC00525促进E-cadherin、抑制MMP-2蛋白的表达 图 2 敲除LINC00525对细胞HGC-27/PTX的细胞迁移、侵袭及E-cadherin、MMP-2蛋白表达的影响 |
| 分组 | E-cadherin | MMP-2 | 迁移细胞数(个) | 侵袭细胞数(个) |
| si-NC | 0.13±0.01 | 0.71±0.07 | 226.15±21.31 | 145.21±13.72 |
| si-LINC00525 | 0.59±0.06a | 0.19±0.02a | 124.23±12.30a | 69.12±7.02a |
| t | 22.687 | 21.428 | 12.437 | 14.794 |
| P | < 0.05 | < 0.05 | < 0.001 | < 0.001 |
| a: P < 0.05,与si-NC组比较 | ||||
2.5 过表达miR-338-3p对细胞HGC-27/PTX的细胞存活率、凋亡的影响
相较于miR-NC组而言,miR-338-3p组的细胞内HGC-27/PTX细胞中miR-338-3p表达显著上升,P21以及caspase-3表达水平明显偏高,细胞存活率下降(P < 0.05,图 3,表 5)。
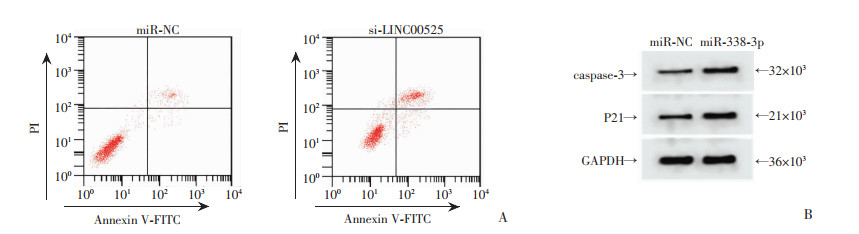
|
| A:过表达miR-338-3p促进细胞HGC-27/PTX凋亡;B:过表达miR-338-3p促进P21、caspase-3蛋白的表达 图 3 过表达miR-338-3p对细胞HGC-27/PTX凋亡及P21、caspase-3蛋白表达的影响 |
| 分组 | miR-338-3p | caspase-3 | P21 | 存活率(%) | 凋亡率(%) |
| miR-NC | 1.01±0.10 | 0.11±0.01 | 0.21±0.02 | 100.00±10.03 | 8.84±1.00 |
| miR-338-3p | 3.44±0.31a | 0.58±0.05a | 0.76±0.07a | 47.68±4.92a | 25.16±1.94a |
| t | 22.381 | 27.652 | 22.665 | 14.047 | 22.432 |
| P | < 0.05 | < 0.05 | < 0.05 | < 0.001 | < 0.001 |
| a: P < 0.05,与miR-NC组比较 | |||||
2.6 过表达miR-338-3p对细胞HGC-27/PTX的迁移、侵袭的影响
与miR-NC组相比,miR-338-3p组HGC-27/PTX细胞中E-cadherin表达水平升高,MMP-2表达水平降低,细胞迁移、侵袭数降低(P < 0.05,图 4,表 6)。
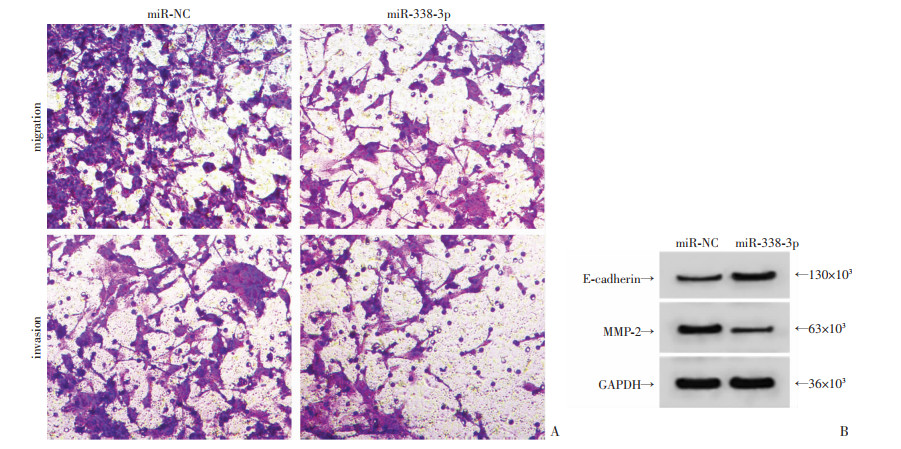
|
| A:过表达miR-338-3p抑制细胞HGC-27/PTX的迁移、侵袭(×200);B:过表达miR-338-3p促进E-cadherin、抑制MMP-2蛋白的表达 图 4 过表达miR-338-3p对细胞HGC-27/PTX的迁移、侵袭及E-cadherin、MMP-2蛋白表达的影响 |
| 分组 | E-cadherin | MMP-2 | 迁移细胞数/个 | 侵袭细胞数/个 |
| miR-NC | 0.14±0.01 | 0.70±0.07 | 228.31±22.47 | 147.08±14.25 |
| miR-338-3p | 0.66±0.06a | 0.11±0.01a | 110.24±11.03a | 61.20±6.11a |
| t | 25.646 | 25.032 | 14.142 | 16.640 |
| P | <0.05 | <0.05 | <0.001 | <0.05 |
| a: P < 0.05,与miR-NC组比较 | ||||
2.7 LINC00525靶向、调控miR-338-3p
Starbase数据库预测显示LINC00525与miR-338-3p存在结合位点(图 5)。荧光素酶报告实验显示,与miR-NC组比较,miR-338-3p组中转染野生型表达载体WT-LINC00525的细胞荧光素酶活性显著降低[(0.95±0.09) vs (0.16±0.01),P < 0.05];而转染突变型表达载体MUT-LINC00525的细胞荧光素酶活性无显著差异[(0.97±0.09) vs (0.99±0.09),P>0.05]。与si-NC组比较(1.01±0.10),si-LINC00525组miR-338-3p表达水平(2.21±0.22)显著升高(P < 0.05);与pcDNA3.1组(1.00±0.10)比较,pcDNA3.1-LINC00525组miR-338-3p表达水平(0.29±0.03)显著降低(P < 0.05)。

|
| 图 5 LINC00525靶向miR-338-3p |
2.8 抑制miR-338-3p能减弱敲除LINC00525对细胞HGC-27/PTX的细胞存活率、迁移、侵袭及凋亡的影响
与si-LINC00525+anti-miR-NC组相比,si-LINC00525+ anti-miR-338-3p组GC-27/PTX细胞中miR-338-3p表达水平降低,细胞迁移、侵袭数升高,细胞存活率升高,细胞凋亡率降低,caspase-3、P21、E-cadherin表达水平降低,MMP-2表达水平升高(P < 0.05,图 6,表 7、8)。
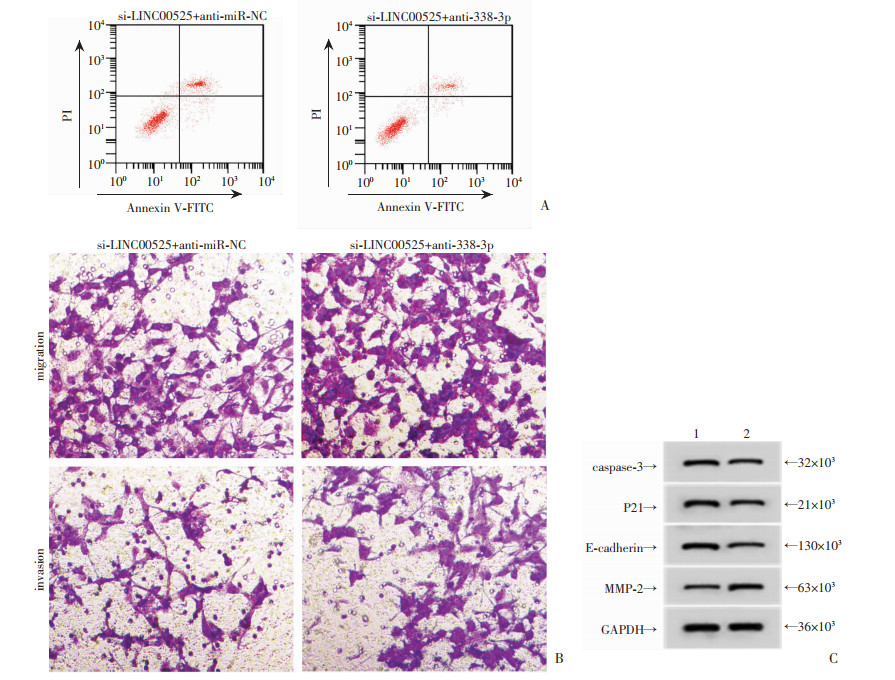
|
| A:抑制miR-338-3p能减弱敲除LINC00525对细胞HGC-27/PTX凋亡的作用;B:抑制miR-338-3p能减弱敲除LINC00525对细胞HGC-27/PTX迁移、侵袭的作用(×200);C:抑制miR-338-3p能减弱敲除LINC00525对细胞HGC-27/PTX中caspase-3、P21、E-cadherin、MMP-2蛋白的表达, 1:si-LINC00525+anti-miR-NC组,2:si-LINC00525+anti-miR-338-3p组 图 6 抑制miR-338-3p能减弱敲除LINC00525对细胞HGC-27/PTX迁移、侵袭、凋亡的影响及相关蛋白的表达 |
| 分组 | miR-338-3p | 迁移细胞数(个) | 侵袭细胞数(个) | 存活率(%) | 凋亡率(%) |
| si-LINC00525+anti-miR-NC | 0.99±0.10 | 122.21±12.03 | 70.15±7.02 | 54.73±5.36 | 23.19±1.66 |
| si-LINC00525+anti-miR-338-3p | 0.28±0.03a | 195.14±19.27a | 121.27±12.03a | 91.02±9.07a | 11.07±1.10a |
| t | 20.402 | 9.640 | 10.985 | 10.334 | 18.259 |
| P | < 0.05 | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| a:P < 0.05,与si-LINC00525+anti-miR-NC组比较 | |||||
| 分组 | caspase-3 | P21 | E-cadherin | MMP-2 |
| si-LINC00525+anti-miR-NC | 0.53±0.05 | 0.62±0.06 | 0.60±0.06 | 0.21±0.02 |
| si-LINC00525+anti-miR-338-3p | 0.20±0.02a | 0.28±0.03a | 0.21±0.02a | 0.64±0.06a |
| t | 18.384 | 15.205 | 18.499 | 20.397 |
| P | < 0.05 | < 0.001 | < 0.05 | < 0.05 |
| a:P < 0.05,与si-LINC00525+anti-miR-NC组比较 | ||||
3 讨论
lncRNA不仅参与调节肿瘤细胞的增殖、凋亡、侵袭及迁移等生物学过程,还可参与肿瘤耐药机制,可为治疗恶性肿瘤提供潜在靶点[13]。研究报道LINC00525在结直肠癌组织和细胞系中明显上调表达,其过表达与临床分期和肿瘤大小呈正相关,敲低LINC00525可以抑制癌细胞增殖并诱导细胞凋亡[14]。LINC00525还增强了结直肠癌细胞对奥沙利铂的敏感性[8]。本实验通过用紫杉醇诱导胃癌细胞HGC-27建立紫杉醇耐药胃癌细胞HGC-27/PTX,经不同浓度紫杉醇处理HGC-27/PTX细胞活性无显著变化,表明耐药细胞建立成功。本实验结果显示,LINC00525在HGC-27和HGC-27/PTX细胞中表达上调,且在HGC-27/PTX细胞中表达更高。敲除LINC00525后HGC-27/PTX细胞中caspase-3、P21、E-cadherin表达水平以及细胞凋亡率显著上升,细胞存活率以及MMP-2表达水平下降。细胞迁移、侵袭数降低。说明敲除LINC00525可抑制HGC-27/PTX细胞增殖、迁移和侵袭,并促进细胞凋亡。表明敲除LINC00525可促进紫杉醇耐药胃癌细胞,降低胃癌细胞对紫杉醇的耐药性。
已有研究报道miR-338-3p与胃癌进展相关,miR-338-3p过表达抑制胃癌细胞的增殖和克隆形成,并诱导G1/S阻滞和细胞凋亡[15]。miR-338-3p通过靶向ADAM17抑制胃癌细胞的增殖和迁移[16]。本实验结果显示,HGC-27和HGC-27/PTX细胞中miR-338-3p表达水平降低。过表达miR-338-3p可抑制HGC-27/PTX细胞增殖、迁移和侵袭,并促进细胞凋亡。且有研究报道miR-338-3p可抑制肝癌细胞肿瘤生长并使肝癌细胞对索拉非尼敏感[17]。miR-338-3p高表达抑制细胞增殖,运动性和上皮-间质转化(EMT)和促进细胞凋亡,增强卵巢癌细胞对顺铂的敏感性[18]。说明miR-338-3p高表达可增强部分肿瘤对化疗药物的敏感性。本实验中过表达miR-338-3p促进紫杉醇耐药胃癌细胞凋亡,说明其降低了胃癌细胞对紫杉醇的耐药性。且本实验还发现,LINC00525可靶向调控miR-338-3p,而抑制mi-R-338-3p减弱了敲除LINC00525对细胞HGC-27/PTX的增殖、迁移、侵袭及凋亡的影响。
综上所述,敲除LINC00525可能通过上调miR-338-3p表达抑制HGC-27/PTX细胞增殖、迁移和侵袭,促进胃癌细胞凋亡,降低胃癌细胞对紫杉醇的耐药性。
| [1] |
关露露, 赵青芳, 陈小兵. 胃癌多药耐药研究进展[J]. 肿瘤研究与临床, 2017, 29(6): 422-425. GUAN L L, ZHAO Q F, CHEN X B. Progress in multidrug resistance of gastric cancer[J]. Cancer Res Clin, 2017, 29(6): 422-425. DOI:10.3760/cma.j.issn.1006-9801.2017.06.018 |
| [2] |
沈丽平, 范理宏. 紫杉醇耐药的研究进展[J]. 现代肿瘤医学, 2014, 22(8): 1975-1978. SHEN L P, FAN L H. Research progress of neoplasms resistance[J]. J Mod Oncol, 2014, 22(8): 1975-1978. DOI:10.3969/j.issn.1672-4992.2014.08.72 |
| [3] |
黄世庆, 韦忠恒. 长链非编码RNA在胃癌预后和耐药中的研究进展[J]. 中国癌症防治杂志, 2017, 9(5): 404-408. HUANG S Q, WEI Z H. Research progress of long-chain non-coding RNA in the prognosis and drug resistance of gastric cancer[J]. Chin J Oncol Preu Treat, 2017, 9(5): 404-408. DOI:10.3969/j.issn.1674-5671.2017.05.15 |
| [4] |
张弛, 张雷. 微RNA在胃癌中的相关机制及诊断治疗的研究进展[J]. 医学综述, 2019, 25(1): 55-59. ZHANG C, ZHANG L. Research progress in microRNA-associated mechanism, diagnosis and treatment of gastriccancer[J]. Me Recapitulate, 2019, 25(1): 55-59. DOI:10.3969/j.issn.1006-2084.2019.01.011 |
| [5] |
房群. LncRNA UCA1通过下调miR-27b表达增强胃癌多药耐药性的研究[D].济南: 山东大学, 2017. FANG Q. LncRNA UCA1 enhances multidrug resistance of gastric cancer by down-regulating the expression of miR-27b[D]. Jinan: Shandong University, 2017. |
| [6] |
郭苹, 程鹏, 王鹏飞, 等. LncRNA-MEG3对胃癌生物学特性及铂类化疗敏感性的研究[J]. 中国现代医学杂志, 2019, 29(6): 16-21. GUO P, CHENG P, WNAG P F, et al. Effect of LncRNA-MEG3 on proliferation and apoptosis of gastric cancer and chemosensitivity of cisplatin[J]. Chin J Mod Med, 2019, 29(6): 16-21. |
| [7] |
WANG X W, GUO Q Q, WEI Y, et al. Construction of a competing endogenous RNA network using differentially expressed lncRNAs, miRNAs and mRNAs in non-small cell lung cancer[J]. Oncol Rep, 2019, 42(6): 2402-2415. DOI:10.3892/or.2019.7378 |
| [8] |
WANG S S, LI J, YANG X P. Long non-coding RNA LINC00525 promotes the stemness and chemoresistance of colorectal cancer by targeting miR-507/ELK3 axis[J]. Int J Stem Cells, 2019, 12(2): 347-359. DOI:10.15283/ijsc19041 |
| [9] |
LIU S N, SUO J, WANG C X, et al. Downregulation of tissue miR-338-3p predicts unfavorable prognosis of gastric cancer[J]. Cancer Biomark, 2017, 21(1): 117-122. DOI:10.3233/cbm-170339 |
| [10] |
SUN F, YU M C, YU J, et al. miR-338-3p functions as a tumor suppressor in gastric cancer by targeting PTP1B[J]. Cell Death Dis, 2018, 9(5): 522. DOI:10.1038/s41419-018-0611-0 |
| [11] |
LIU X W, CAI H, SHENG W Q, et al. microRNAs expression profile related with response to preoperative radiochemotherapy in patients with locally advanced gastric cancer[J]. BMC Cancer, 2018, 18(1): 1-8. DOI:10.1186/s12885-018-4967-4 |
| [12] |
HAN J, LI J, TANG K J, et al. miR-338-3p confers 5-fluorouracil resistance in p53 mutant colon cancer cells by targeting the mammalian target of rapamycin[J]. Exp Cell Res, 2017, 360(2): 328-336. DOI:10.1016/j.yexcr.2017.09.023 |
| [13] |
周浩泽, 李梦玮, 徐寒梅. 长链非编码RNA参与肿瘤耐药机制的研究进展[J]. 药物生物技术, 2018, 25(1): 75-80. ZHOU H Z, LI M W, XU H M. Recent progress in molecular mechanism of tumor drug resistance regulated by long non-coding RNA[J]. Pharm Biotechnol, 2018, 25(1): 75-80. |
| [14] |
PENG P, ZHENG Q. Long non-coding RNA Linc00525 as a prognostic factor to regulate proliferation and apoptosis in colorectalcancer[J]. J Clin Oncol, 2019, 37(15_suppl): e15085. DOI:10.1200/jco.2019.37.15_suppl.e15085 |
| [15] |
GUO B, LIU L Y, YAO J Y, et al. miR-338-3p suppresses gastric cancer progression through a PTEN-AKT axis by targeting P-REX2a[J]. Mol Cancer Res, 2014, 12(3): 313-321. DOI:10.1158/1541-7786.MCR-13-0507 |
| [16] |
XU H T, ZHAO L, FANG Q J, et al. MiR-338-3p inhibits hepatocarcinoma cells and sensitizes these cells to sorafenib by targeting hypoxia-induced factor 1α[J]. PLoS ONE, 2014, 9(12): e115565. DOI:10.1371/journal.pone.0115565 |
| [17] |
NIU Q, LIU Z H, GAO J, et al. MiR-338-3p enhances ovarian cancer cell sensitivity tocisplatin by downregulating WNT2B[J]. Yonsei Med J, 2019, 60(12): 1146-1156. DOI:10.3349/ymj.2019.60.12.1146 |



