2. 401320 重庆,重庆市巴南区人民医院手术麻醉科
2. Department of Surgical Anesthesiology, Banan District People's Hospital, Chongqing, 401320, China
鉴于多个引起肺动脉高压的病因都与5-羟色胺(5-HT)有关[1],探讨其相关的下游信号通路就显得尤为重要。既往研究表明5-HT刺激肺动脉平滑肌细胞(PASMCs)增殖过程中伴随活性氧(ROS)增多,而ROS的具体来源尚不明确[2]。在本研究中,我们首先探讨活性氧的具体来源,发现ROS的增加主要与NOX活性增强相关。既往研究表明[3],NOX通过产生活性氧簇(ROS)介导了多种细胞内的信号转导, 如通过激活细胞外信号调节激酶(ERK)以及活化蛋白-1(AP-1)和核因子(NF)-κB等转录因子, 我们在随后的研究中发现细胞内ROS增多可引起ERK1/2的磷酸化水平升高。进一步研究明确了5-HT刺激平滑肌细胞使NOX活性增高,致使ROS水平上升,进而导致ERK1/2的磷酸化激活,最终促进PASMCs异常增殖。本文研究证实了NOX/ROS/ERK1/2通路对5-HT介导的PASMCs异常增殖的影响,为肺动脉高压的防治寻找到一个潜在的新的靶点。
1 材料与方法 1.1 主要试剂与仪器低糖DMEM培养基(PAA,美国),D-Hanks液(hyclone,美国),NADPH、ROS检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天), 5-羟色胺、DPI、Tempol(sigma,美国),兔单克隆抗磷酸化细胞外信号调节蛋白激酶(p-ERK1/2)、HRP标记的羊抗兔IgG(Santa,美国),其余试剂均为国产分析纯。Alpha Imager凝胶成像分析系统(Alpha Innotech,美国),流式细胞仪(BD,美国)。
1.2 PASMC的培养及分组人肺动脉平滑肌细胞(human pulmonary arterial smooth muscle cell,hPASMC)的原代培养、传代、纯化、鉴定实验步骤见参考文献[4]。第4~6代PASMC细胞用于实验。相同密度(106/cm2)接种后待细胞长至瓶底80%左右换含0.1%胎牛血清DMEM培养基同步生长48 h,随后分别设置正常对照组,不加任何药物; 5-羟色胺组,给予5-羟色胺(1 μmol/L)刺激细胞;各干预组分别给予ROS清除剂Tempol(100 μmol/L)、NOX抑制剂DPI(20 μmol/L)、ERK抑制剂PD98059(30 μmol/L)预处理30 min后,再加入5-羟色胺刺激不同时间。进行上述各组处理后,分别测定DNA合成,NOX活性,ROS含量,ERK1/2磷酸化情况。
1.3 [3H]胸苷掺入测定在加入5-羟色胺(1 μmol/L)孵育16 h后,各处理组与[3H]标记的胸腺嘧啶核苷(1 μCi/孔)孵育12 h。随后,冷PBS液终止掺入,加入0.25%胰酶消化细胞,使之脱离孔壁,用多头细胞样品收集器收集细胞于玻璃纤维膜上,生理盐水冲洗3次,然后用10%三氯乙酸固定,无水乙醇脱色,80 ℃干烤30 min,放入闪烁液中,于液体闪烁计数仪计数(counts/min, cpm)。
1.4 NOX活性测定NOX活性测定采用NADPH消耗测定法:5-羟色胺处理10 min(NOX活性达峰时间)后,细胞经胰酶消化后,在4 ℃,2 500×g离心5 min,然后以PBS再悬浮,随后加入250 μmol/L NADPH孵育,在λ=340 nm下观察5 min,通过吸光率的减少来探测NADPH的消耗量。为了标准化,取等量的细胞加入SDS溶解,浓缩蛋白后通过考马斯亮蓝法测定。用来计算NADPH消耗总量的吸收消光系数(absorption extinction coefficient)是6.22 mmol-1·cm-1,结果以pmol NADPH/min·mg蛋白表示[5]。
1.5 细胞内ROS含量检测按1 :1 000用无血清IMDM培养基稀释DCFH-DA,使其终浓度为10 μmol/L。5-羟色胺处理10 min(ROS含量达峰时间)后,收集各实验组的细胞,用无血清IMDM培养基清洗3次,将细胞悬浮于已稀释的DCFH-DA中,37 ℃细胞培养箱内孵育20 min,取出后用无血清IMDM培养基清洗3次,收集细胞制备成单细胞悬液,流式细胞仪检测DCF荧光(激发波长:488 nm,发射波长:525 nm)。
1.6 磷酸化ERK1/2的测定5-羟色胺处理10 min(ERK1/2磷酸化达峰时间)后,RIPA裂解液(含蛋白酶抑制剂磷酸酶抑制剂)提取细胞总蛋白,BCA法进行蛋白含量测定。配制10%的分离胶和5%浓缩胶。蛋白样品加入SDS上样缓冲液,100 ℃变性5 min。聚丙烯酰胺凝胶电泳分离蛋白后将蛋白转移至硝酸纤维素膜(NC膜)上,用5%的脱脂牛奶封闭1 h,NC膜与稀释成1 :1 000的p-ERK1/2一抗4 ℃孵育过夜; 洗膜后将NC膜置入1 :10 000的二抗中孵育4~5 h; 洗膜后,采用化学发光液显影,使用凝胶图像成像系统和Quality One软件进行扫描分析,以目的蛋白p-ERK1/2与相应的β-actin蛋白灰度值比作为蛋白的相对表达量。
1.7 统计统计学分析采用SPSS13.0软件包进行数据分析。实验数据以均数±标准差表示, 计量资料组间比较采用单因素方差分析(One-way ANOVA),组间多重比较采用Tukey post hoc检验。P < 0.05为差异有统计学意义。
2 结果 2.1 3H-TdR掺入量法检测结果结果见图 1。相比于对照组,5-羟色胺组3H-TdR掺入量是其2.71倍(P < 0.05),DPI干预组、Tempol干预组、PD98059干预组3H-TdR掺入量分别是其1.22、1.37、1.16倍。相比于5-羟色胺组,各干预组3H-TdR掺入量均显著减少(P < 0.05),其中尤以DPI干预组、PD98059干预组最为明显。
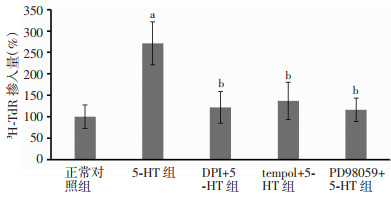
|
| a:P < 0.05, 与正常对照组比较;b:P < 0.05, 与5-HT组比较 图 1 3H-TdR掺入量测定结果(x±s,n=6) |
2.2 NOX活性测定结果
结果见图 2。相比于对照组,5-羟色胺组、Tempol干预组、PD98059干预组NOX活性均显著升高(P < 0.05)。相比于5-羟色胺组,DPI干预组NOX活性显著降低(P < 0.05)。

|
| a:P < 0.05,与正常对照组比较;b:P < 0.05,与5-HT组比较 图 2 各组NOX活性检测结果(x±s,n=6) |
2.3 细胞内ROS水平检测结果
结果见图 3。相比于对照组,5-羟色胺组、Tempol干预组、PD98059干预组DCF荧光强度均显著升高(P < 0.05),相比于5-羟色胺组,DPI干预组、Tempol干预组DCF荧光强度均显著减弱(P < 0.05)。
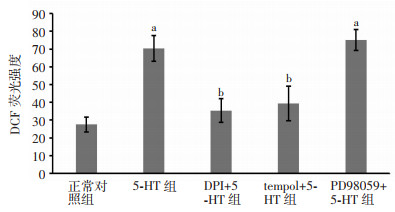
|
| a:P < 0.05,正常对照组比较;b:P < 0.05,5-HT组比较 图 3 各组DCF荧光强度检测结果(x±s,n=6) |
2.4 磷酸化ERK1/2水平测定结果
结果见图 4。相比于对照组,5-羟色胺组ERK1/2蛋白磷酸化水平显著升高(P < 0.05)。相比于5-羟色胺组,各干预组ERK1/2蛋白磷酸化水平均显著减少(P < 0.05)。
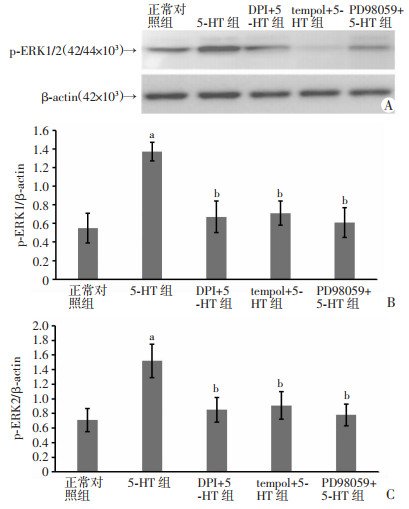
|
| A:各组p-ERK1/2蛋白表达;B、C:蛋白表达的半定量分析,a:P < 0.05,与正常对照组比较;b:P < 0.05,与5-HT组比较 图 4 各组ERK1/2磷酸化水平测定结果(x±s,n=6) |
3 讨论
在本研究中,我们首先发现5-HT增加了PASMCs DNA的合成。随后证实5-HT刺激增加了细胞内NOX活性、ROS水平以及ERK1/2活化水平。接下来我们进一步探索了NOX来源的ROS在PASMCs增殖中的作用及具体机制。我们发现NOX抑制剂有效抑制NOX活性的同时显著降低5-HT刺激增加的ROS、ERK1/2活化及PASMCs增殖水平的;ROS清除剂显著降低5-HT刺激导致的ROS水平的同时显著降低ERK1/2活化水平及PASMCs增殖水平;ERK抑制剂显著抑制5-HT刺激导致的ERK1/2活化水平的同时显著降低PASMCs增殖水平。研究结果表明,NOX及其催化产生的ROS介导了5-HT刺激导致的PASMCs增殖,ROS通过影响ERK1/2的磷酸化水平发挥作用。
5-HT已在多种动物模型及临床患者中被证实与肺动脉高压的发生发展相关,其主要机制是5-HT通过细胞内受体(5-HTR,属于G蛋白耦合受体家族,GPCR)和转运体(SERT)激活多个信号通路[1, 2, 6]。近些年来,越来越多的研究发现ROS在许多血管性疾病的病理生理进程中发挥着重要作用。相关研究表明,低氧、AngⅡ、5-羟色胺等在引起PASMCs增殖的过程中伴随着ROS含量的增加[7]。通过抑制Cu/Zn SOD活性增加细胞内ROS水平刺激了PASMCs的增殖,而抗氧化剂则抑制了其增殖并在一定程度上促进其凋亡[8]。细胞内的线粒体和NOX均可催化产生ROS,而在血管类组织中,NOX被认为是ROS的主要来源[9]。
在PASMCs过表达5-HT转运体的转基因小鼠上诱导了经典的肺动脉高压模型[10]。另一方面,通过敲低色氨酸羟化酶(5-HT的生物合成的限速酶)表达或敲除5-HT转运体减轻了缺氧引发的肺动脉高压和右心室肥大[11]。通过药物抑制5-HT转运体也表现出类似的治疗效果[12]。另外,5-HT转运体基因多态性也被发现与肺动脉高压有关[13]。ROS在细胞信息传递、基因转录、细胞生长和凋亡等事件的调节中发挥着重要作用,其过量产生可能是PASMCs增殖的重要因素。体内有多种酶参与ROS的生成, 而NOX目前被认为是血管内生成ROS的主要酶体[9]。NOX是多种蛋白酶的复合物, 可通过催化电子从NADPH转移至分子氧而产生超氧化物。根据催化亚基的不同NOX分为5种亚型,分别是Nox1~Nox5。其中,在心血管细胞表达的有Nox1、Nox2和Nox4。与其他来源(如线粒体、黄嘌呤氧化酶和解耦联的NO合酶)的ROS相比较,NOX主要被特异的激动剂刺激后产生活性氧,特别是和AngⅡ、ET-1、TNF-α、TGF-β等[14]。本研究发现5-HT可上调NOX活性,使PASMCs内ROS生成过多。
丝裂原活化蛋白激酶(mitogen- activatedproteinkinase, MAPK)是生物体内一种重要的信号传导系统, ERK是MAPK家族中的成员之一, 它能被多种因子激活, 主要介导细胞增殖和分化的信号转导。ERK1/2相关的激酶的激活导致的PASMCs的增殖常可在多种条件如缺氧[15],家族性肺动脉高压[16],G蛋白耦联受体激动剂色胺(血清素,内皮素-1)和生长因子存在的情况下观察到。在各种静息态细胞中,ERK1/2主要存在于细胞质,但在后续某些激动剂作用下磷酸化ERK1/2并转位到胞核,在核内磷酸化(激活)若干转录因子如GATA-4和ETS(26)家族成员Elk-1(ETS样激酶1)等调控基因的表达[17]。本实验的结果表明,5-HT通过NOX-ROS通路显著地促进了ERK1/2活化,进而促进了PASMCs的增殖。
综上,肺动脉高压作为一类以肺血管重塑为主要病变特点的慢性疾病,5-HT在其发生发展过程中起着重要作用。本研究表明NOX及其催化产生的ROS介导了5-HT刺激PASMCs增殖的过程,增进了我们对5-HT介导的肺动脉高压机制的了解, 为抗肺动脉高压治疗研究提供了新的思路。
| [1] |
HAN J L, TIAN H Y, LIU Y, et al. 5-HT promotes pulmonary arterial smooth muscle cell proliferation through the TRPC channel[J]. Cell Mol Biol (Noisy-le-grand), 2018, 64(13): 89. DOI:10.14715/cmb/2018.64.13.17 |
| [2] |
HOOD K Y, MAIR K M, HARVEY A P, et al. Serotonin signaling through the 5-HT 1B receptor and NADPH oxidase 1 in pulmonary arterial hypertension[J]. Arterioscler Thromb Vasc Biol, 2017, 37(7): 1361-1370. DOI:10.1161/atvbaha.116.308929 |
| [3] |
LI T, LUO X J, WANG E L, et al. Magnesium lithospermate B prevents phenotypic transformation of pulmonary arteries in rats with hypoxic pulmonary hypertension through suppression of NADPH oxidase[J]. Eur J Pharmacol, 2019, 847: 32-41. DOI:10.1016/j.ejphar.2019.01.020 |
| [4] |
GOLOVINA V A, BLAUSTEIN M P. Preparation of primary cultured mesenteric artery smooth muscle cells for fluorescent imaging and physiological studies[J]. Nat Protoc, 2006, 1(6): 2681-2687. DOI:10.1038/nprot.2006.425 |
| [5] |
HERRERA B, MURILLO M M, ÁLVAREZ-BARRIENTOS A, et al. Source of early reactive oxygen species in the apoptosis induced by transforming growth factor-β in fetal rat hepatocytes[J]. Free Radic Biol Med, 2004, 36(1): 16-26. DOI:10.1016/j.freeradbiomed.2003.09.020 |
| [6] |
BOPP C, AUGER C, DIEMUNSCH P, et al. The effect of urapidil, an alpha-1 adrenoceptor antagonist and a 5-HT1A agonist, on the vascular tone of the porcine coronary and pulmonary arteries, the rat aorta and the human pulmonary artery[J]. Eur J Pharmacol, 2016, 779: 53-58. DOI:10.1016/j.ejphar.2016.03.012 |
| [7] |
ZIMMER A, TEIXEIRA R B, BONETTO J H P, et al. Role of inflammation, oxidative stress, and autonomic nervous system activation during the development of right and left cardiac remodeling in experimental pulmonary arterial hypertension[J]. Mol Cell Biochem, 2020, 464(1/2): 93-109. DOI:10.1007/s11010-019-03652-2 |
| [8] |
YOU B Y, LIU Y B, CHEN J, et al. Vascular peroxidase 1 mediates hypoxia-induced pulmonary artery smooth muscle cell proliferation, apoptosis resistance and migration[J]. Cardiovasc Res, 2018, 114(1): 188-199. DOI:10.1093/cvr/cvx234 |
| [9] |
PETRY A, GÖRLACH A. Regulation of NADPH oxidases by G protein-coupled receptors[J]. Antioxid Redox Signal, 2019, 30(1): 74-94. DOI:10.1089/ars.2018.7525 |
| [10] |
GUIGNABERT C, IZIKKI M, TU L I, et al. Transgenic mice overexpressing the 5-hydroxytryptamine transporter gene in smooth muscle develop pulmonary hypertension[J]. Circ Res, 2006, 98(10): 1323-1330. DOI:10.1161/01.res.0000222546.45372.a0 |
| [11] |
IZIKKI M, HANOUN N, MARCOS E, et al. Tryptophan hydroxylase 1 knockout and tryptophan hydroxylase 2 polymorphism: effects on hypoxic pulmonary hypertension in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(4): L1045-L1052. DOI:10.1152/ajplung.00082.2007 |
| [12] |
DELANEY C, SHERLOCK L, FISHER S, et al. Serotonin 2A receptor inhibition protects against the development of pulmonary hypertension and pulmonary vascular remodeling in neonatal mice[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(5): L871-L881. DOI:10.1152/ajplung.00215.2017 |
| [13] |
JIAO Y R, WANG W, LEI P C, et al. 5-HTT, BMPR2, EDN1, ENG, KCNA5 gene polymorphisms and susceptibility to pulmonary arterial hypertension: a meta-analysis[J]. Gene, 2019, 680: 34-42. DOI:10.1016/j.gene.2018.09.020 |
| [14] |
MAGNANI F, MATTEVI A. Structure and mechanisms of ROS generation by NADPH oxidases[J]. Curr Opin Struct Biol, 2019, 59: 91-97. DOI:10.1016/j.sbi.2019.03.001 |
| [15] |
ZHANG L X, MA C, GU R, et al. Paeonol regulates hypoxia-induced proliferation of pulmonary artery smooth muscle cells via EKR 1/2 signalling[J]. Eur J Pharmacol, 2018, 834: 257-265. DOI:10.1016/j.ejphar.2018.07.017 |
| [16] |
YANG X D, LONG L, SOUTHWOOD M, et al. Dysfunctional smad signaling contributes to abnormal smooth muscle cell proliferation in familial pulmonary arterial hypertension[J]. Circ Res, 2005, 96(10): 1053-1063. DOI:10.1161/01.res.0000166926.54293.68 |
| [17] |
KOVACS L, HAN W H, RAFIKOV R, et al. Activation of calpain-2 by mediators in pulmonary vascular remodeling of pulmonary arterial hypertension[J]. Am J Respir Cell Mol Biol, 2016, 54(3): 384-393. DOI:10.1165/rcmb.2015-0151oc |




