2013年一项包含中国大陆170 287名参与者的横断面调查结果显示中国成人2型糖尿病患病率为10.9%,而糖尿病前期患病率高达35.7%[1]。糖尿病前期(pre-diabetes mellitus,PDM),包括空腹血糖受损(impaired fasting glucose,IFG)、糖耐量异常(impaired glucose tolerance,IGT)以及空腹血糖受损合并糖耐量异常(IFG/IGT)3种状态,是介于正常糖耐量和糖尿病之间的糖代谢异常状态。糖尿病前期人群转归糖尿病的风险明显高于正常糖代谢人群。
肥胖,尤其是内脏脂肪型肥胖,与多种代谢相关性疾病,如糖代谢异常、高脂血症、高血压以及心血管疾病密切相关[2-3]。磁共振成像(magnetic resonance imaging, MRI)和计算机断层扫描(computed tomography, CT)是诊断内脏脂肪蓄积型肥胖的金标准[4]。然而,由于价格昂贵、消耗时间长、有辐射、基层医院设备限制等原因,它们并不适合使用于大多数糖尿病前期患者。为响应将糖尿病防治在基层的号召,寻找一些简易指标用于评估患者内脏脂肪蓄积情况以及转归糖尿病的风险,对于指导糖尿病前期患者进行适宜的干预,从而降低转归糖尿病的风险尤为重要。传统肥胖指标体质指数(body mass index, BMI)以及腰围(waist circumference, WC)等已经被证实与糖尿病发病风险增加相关[5],然而BMI及腰围并不能反映与糖尿病发病更为密切的内脏型肥胖。内脏脂肪指数(visceral adiposity index, VAI)是一个根据BMI、腰围、甘油三酯及高密度脂蛋白胆固醇计算的一种新的性别特异性内脏脂肪功能指数,对于内脏脂肪的评估优于BMI、WC等[6]。为此,本研究通过队列研究, 分析VAI与糖尿病前期对象5年转归糖尿病的相关性, 并比较VAI、BMI、WC、腰臀比等肥胖指标预测糖尿病前期患者转归糖尿病的能力,以期寻找一个能够反映内脏型肥胖的简易指标,为基层临床医师防治糖尿病工作提供数据支撑。
1 对象与方法 1.1 研究对象研究对象均选自2011年4-11月参与泸州地区2型糖尿病危险因素的动态监测与社区综合防治的流行病学调查研究,对泸州地区普通居民采用整群随机抽样法,先随机抽取泸州市社区,再从社区随机抽取到街道,最后随机抽取到户。选出个体进行问卷调查、生化检测,从1万人基线调查中筛选出符合标准并自愿接受随访的糖尿病前期人群1 125名,非干预性随访5年。纳入标准:①在本地居住时间≥5年;②自愿接受随访;③符合《2007年版中国2型糖尿病防治指南》[7]中糖尿病前期诊断标准。排除标准:①行动不便;②不愿接受随访者;③近期服用过影响血糖的药物者;④既往明确糖尿病史者;⑤资料不全者。本研究经西南医科大学附属医院伦理委员会批准[审批号:(2014)临伦审第(52)号],受试者均签署知情同意书。
1.2 方法 1.2.1 基线调查① 问卷调查:记录研究对象的性别,年龄,有无高血压、糖尿病、高脂血症病史,有无糖尿病家族史,有无吸烟、饮酒史等;②体格检查:测量身高、体质量、腰围、臀围、血压;③实验室检查:检测空腹血糖(FPG,禁饮禁食8 h以上)、OGTT 2 h血糖(OGTT 2 h PG,75 g无水葡萄糖溶于300 mL水中,5 min内饮完,2 h后抽取静脉血送检)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。血糖测定采用葡萄糖氧化酶法,血脂送往上海市内分泌代谢病研究所进行检测。
1.2.2 随访调查对纳入研究的对象进行非干预性随访5年,于2016年6-11月再次对纳入研究的糖尿病前期人群进行随访,随访内容包括问卷调查、体格检查、实验室检查,对少部分不能参与现场随访的对象进行电话随访。
1.3 参考标准糖尿病前期诊断依据《2007年版中国2型糖尿病防治指南》[7]:①正常糖耐量:FPG<6.1 mmol /L且OGTT 2 h PG<7.8 mmol/L;②糖尿病前期:FPG 6.1~<7.0 mmol/L和/或OGTT 2 h PG 7.8~<11.1 mmol/L; ③糖尿病: FPG≥7.0 mmol/L和/或OGTT 2 h PG≥11.1 mmol/L。
1.4 计算公式及分组 1.4.1 计算公式① VAI男=[WC/(39.68+1.88×BMI)]×(TG/1.03)×(1.31/HDL-c),VAI女=[WC/ (36.58 +1.89×BMI)]×(TG/0.81)×(1.52/HDL-c)[8]。②BMI=体质量/身高2。③腰臀比(waist-to-hip ratio,WHR)=腰围/臀围。本研究中根据以上公式计算所得的VAI、BMI、WHR进行不同四分位数分组。
1.4.2 分组根据四分位数法将研究对象分为4组:第1组(第1四分位数组)、第2组(第2四分位数组)、第3组(第3四分位数组),第4组(第4四分位数组)。
1.5 统计学分析采用SPSS 17.0统计软件进行分析。正态分布的计量资料以x±s表示,两组间比较采用t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用秩和检验;计数资料的比较采用χ2检验;等级资料比较采用秩和检验;影响因素的分析采用多因素Logistic回归分析。不同肥胖指标对预测糖尿病前期对象随访5年转归糖尿病的比较采用ROC曲线下面积。以P<0.05为差异有统计学意义。
2 结果 2.1 基本情况因电话改变等原因失访61人,完成随访共1 064人,其中男性424人,女性640人,年龄(59.24±9.78)岁,身高158(152.2,163.5)cm,体质量60(54.0,66.5)kg,BMI 24.2 (22.2,26.0)kg/m2, WC(84.79±8.56)cm,臀围95(91.0,99.1)cm,WHR 0.89(0.85, 0.93),收缩压125(110,139)mmHg,舒张压76(69, 84)mmHg,TC(4.69± 1.09)mmol/L,TG 1.47(1.01, 2.08)mmol/L,HDL-C (1.23±0.33)mmol/L,LDL-C (2.66±0.82)mmol/L。
2.2 各组的研究对象的基线资料比较根据VAI四分位数将研究对象分为4组,4组基线资料比较结果显示(表 1):研究对象的性别、身高、体质量、BMI、WC、臀围、WHR、舒张压、FPG、TC、TG、HDL-C、LDL-C、吸烟、饮酒之间差异有统计学意义(P<0.05);年龄、收缩压、高血压病史、糖尿病家族史、饮茶之间差异无统计学意义(P>0.05)。
| 变量 | 第1组(0.37~1.29) | 第2组(1.30~2.01) | 第3组(2.02~3.28) | 第4组(3.29~36.12) | 检验统计量值 | P值 |
| 性别(男/女) | 266(161/105) | 266(104/162) | 266(86/180) | 266(73/193) | 70.86 | <0.001 |
| 年龄/岁 | 59.79±10.04 | 59.29±10.19 | 58.68±9.43 | 59.20±9.44 | 0.573 | 0.633 |
| 身高/cm | 160(155, 164) | 158(152, 164) | 157(152, 163) | 156(152, 163) | 12.413 | 0.006 |
| 体质量/kg | 57.55(52.25, 64.00) | 59.45(54.10, 66.50) | 61.05(54.80, 68.43) | 61.10(55.43, 67.95) | 23.846 | <0.001 |
| BMI/kg·m-2 | 23.00(20.80, 24.80) | 24.30(22.50, 25.98) | 24.60(22.63, 26.40) | 24.60(23.00, 26.60) | 63.001 | <0.001 |
| WC/cm | 81.13±8.49 | 84.13±8.35 | 86.80±8.70 | 87.11±7.27 | 30.55 | <0.001 |
| 臀围/cm | 93.10(88.20, 97.00) | 95.00(91.00, 100.00) | 96.00(91.45, 100.28) | 95.30(92.00, 100.00) | 33.131 | <0.001 |
| WHR | 0.87(0.83, 0.92) | 0.88(0.84, 0.93) | 0.90(0.86, 0.94) | 0.90(0.87, 0.94) | 38.828 | <0.001 |
| 收缩压/mmHg | 122(107, 137) | 127(112, 140) | 124(110, 138) | 127(113, 142) | 6.813 | 0.078 |
| 舒张压/mmHg | 74(67, 82) | 77(70, 85) | 76(69, 84) | 77(69, 85) | 8.171 | 0.043 |
| FPG/mmol·L-1 | 5.60±0.56 | 5.65±0.54 | 5.89±0.54 | 5.65±0.51 | 0.972 | 0.405 |
| OGTT 2 h PG/mmol·L-1 | 8.56±1.36 | 8.80±1.11 | 8.89±1.14 | 9.04±1.12 | 7.596 | <0.001 |
| TC/mmol·L-1 | 4.47±1.01 | 4.69±1.15 | 4.74±1.10 | 4.86±1.08 | 5.915 | 0.001 |
| TG/mmol·L-1 | 0.86(0.71, 0.97) | 1.28(1.07, 1.47) | 1.75(1.48, 2.03) | 2.70(2.12, 3.56) | 794.975 | <0.001 |
| HDL-C/mmol·L-1 | 1.46±0.35 | 1.28±0.29 | 1.16±0.27 | 1.02±0.23 | 108.954 | <0.001 |
| LDL-C/mmol·L-1 | 2.51±0.78 | 2.78±0.89 | 2.77±0.82 | 2.56±0.76 | 7.55 | <0.001 |
| VAI | 0.92(0.70, 1.12) | 1.63(1.47, 1.78) | 2.57(2.29, 2.88) | 4.35(3.65, 6.11) | 996.563 | <0.001 |
| 高血压[n(%)] | 40(15.0) | 54(20.3) | 57(21.4) | 49(18.4) | 4.089 | 0.252 |
| 糖尿病家族史[n(%)] | 18(6.8) | 21(7.9) | 21(7.9) | 34(12.8) | 7.142 | 0.068 |
| 吸烟[n(%)] | 60(22.6) | 31(11.7) | 32(12.0) | 36(13.5) | 16.585 | 0.001 |
| 饮茶[n(%)] | 153(57.5) | 147(55.3) | 127(47.7) | 138(51.9) | 5.808 | 0.121 |
| 饮酒[n(%)] | 113(42.5) | 91(34.2) | 65(24.4) | 63(23.7) | 29.561 | <0.001 |
2.3 各组研究对象转归糖尿病情况
完成随访的1 064人中,转归为糖尿病者237人,占总随访人数的22.3%;4组对象转归糖尿病的比较结果显示(表 2):第4组(94人)>第3组(68人)>第2组(46人)>第1组(29人),差异有统计学意义(χ2=51.566,P<0.001)。
| 转归糖尿病 | 第1组 | 第2组 | 第3组 | 第4组 | χ2值 | P值 |
| 是 | 29(10.9) | 46(17.3) | 68(25.6) | 94(35.3) | 51.566 | <0.001 |
| 否 | 237(89.1) | 220(82.7) | 198(74.4) | 172(64.7) |
2.4 影响糖尿病前期对象转归糖尿病的单因素分析
以是否转归糖尿病为因变量(是=1,否=0),以年龄、性别、身高、体质量、BMI、WC、臀围、WHR、收缩压、舒张压、TC、TG、HDL-C、LDL-C、VAI、高血压病史、糖尿病家族史、吸烟、饮茶、饮酒为自变量行单因素分析。结果显示(表 3):年龄(t=-2.097, P=0.036)、性别(χ2=12.477,P<0.001)、身高(Z=-2.74, P=0.006)、BMI(Z=-2.171, P=0.03)、腰围(t=-3.194, P=0.001)、腰臀比(Z=-2.134, P=0.033)、收缩压(Z=-3.419, P=0.001)、TG(Z=-4.86, P<0.001)、HDL-C(t=3.836, P<0.001)、吸烟(χ2= 5.566,P=0.017)、饮茶(χ2= 4.182,P=0.046)、VAI(Z=-7.791, P<0.001)、VAI分组(χ2= 51.566,P<0.001)是影响糖尿病前期对象转归为糖尿病的影响因素。
| 变量 | 糖尿病 | 检验统计量值 | P值 | |
| 是 | 否 | |||
| 性别(男/女) | 237(71/166) | 827(353/474) | 12.477 | <0.001 |
| 年龄/岁 | 60.41±9.85 | 58.91±9.74 | -2.097 | 0.036 |
| 身高/cm | 156.0(150.5,163.0) | 158.0(153.0,164.0) | -2.74 | 0.006 |
| 体质量/kg | 61.0(54.0,67.5) | 60.0(54.0,66.5) | -0.80 | 0.425 |
| BMI/kg·m-2 | 24.4(22.7,26.4) | 24.1(22.2,25.9) | -2.171 | 0.03 |
| WC/cm | 86.35±8.12 | 84.35±8.63 | -3.194 | 0.001 |
| 臀围/cm | 95.0(91.0,100.5) | 95.0(90.4,99.0) | -1.618 | 0.106 |
| WHR | 0.89(0.86,0.93) | 0.89(0.85,0.93) | -2.134 | 0.033 |
| 收缩压/mmHg | 130.00(115.50,142.58) | 124.00(109.67,136.67) | -3.419 | 0.017 |
| 舒张压/mmHg | 77.83(70.08,85.00) | 75.67(68.50,84.00) | -1.439 | 0.15 |
| TC/mmol·L-1 | 4.77±1.20 | 4.67±1.06 | -1.252 | 0.211 |
| TG/mmol·L-1 | 1.83(1.30,2.49) | 1.38(0.96,1.99) | -4.86 | <0.001 |
| HDL-C/mmol·L-1 | 1.16±0.31 | 1.25±0.33 | 3.836 | <0.001 |
| LDL-C/mmol·L-1 | 2.67±0.93 | 2.65±0.79 | -0.254 | 0.800 |
| VAI | 2.85(1.77,4.19) | 1.20(1.81,2.94) | -7.791 | <0.001 |
| 高血压[n(%)] | 52(21.9) | 148(17.9) | 1.975 | 0.159 |
| 糖尿病家族史[n(%)] | 20(8.4) | 74(8.9) | 0.059 | 0.897 |
| 吸烟[n(%)] | 24(10.1) | 135(16.3) | 5.566 | 0.017 |
| 饮茶[n(%)] | 112(47.3) | 453(54.8) | 4.182 | 0.046 |
| 饮酒[n(%)] | 62(26.2) | 270(32.6) | 3.612 | 0.067 |
2.5 不同肥胖指标对糖尿病前期对象转归糖尿病的Logistic回归分析
分别将BMI、腰围、腰臀比及VAI 4个在单因素分析中与糖尿病前期对象转归糖尿病相关的肥胖指标进行四分位数分组,并对比各指标不同四分位数组对糖尿病前期对象转归糖尿病的影响。结果显示(表 4):在未调整任何变量的情况下,VAI与糖尿病前期对象转归糖尿病的相关性最强;与第1组对象比较,第4组糖尿病前期对象发生糖尿病的风险是第1组对象的4.466(95%CI:2.819~7.077,P<0.001)倍,第3组对象发生糖尿病的风险是第1组对象的2.807(95%CI:1.747~4.508,P<0.001)倍,第2组对象发生糖尿病的风险是第1组对象的1.709(95%CI:1.037~2.816,P=0.036)倍。而BMI对糖尿病前期转归糖尿病的风险在第2、3组与第1组之间的差异无统计学意义。WC对糖尿病前期转归糖尿病的风险在第2组与第1组之间的差异无统计学意义。
| 组别 | VAI | BMI | WC | WHR | |||||||||||
| OR | 95%CI | P值 | OR | 95%CI | P值 | OR | 95%CI | P值 | OR | 95%CI | P值 | ||||
| Model 1 | |||||||||||||||
| 1 | 1 | 1 | 1 | 1 | |||||||||||
| 2 | 1.709 | (1.037, 2.816) | 0.036 | 1.182 | (0.773, 1.805) | 0.440 | 1.466 | (0.951, 2.258) | 0.083 | 2.080 | (1.339, 3.230) | 0.001 | |||
| 3 | 2.807 | (1.747, 4.508) | <0.001 | 1.114 | (0.721, 1.722) | 0.627 | 1.622 | (1.064, 2.473) | 0.025 | 1.875 | (1.206, 2.918) | 0.005 | |||
| 4 | 4.466 | (2.819, 7.077) | <0.001 | 1.568 | (1.032, 2.382) | 0.035 | 1.802 | (1.185, 2.739) | 0.006 | 1.592 | (1.014, 2.499) | 0.043 | |||
| Model 2 | |||||||||||||||
| 1 | 1 | 1 | 1 | 1 | |||||||||||
| 2 | 1.588 | (0.957, 2.636) | 0.073 | 1.144 | (0.746, 1.755) | 0.538 | 1.461 | (0.944, 2.261) | 0.089 | 2.225 | (1.423, 3.477) | <0.001 | |||
| 3 | 2.599 | (1.602, 4.215) | <0.001 | 1.066 | (0.687, 1.654) | 0.777 | 1.700 | (1.109, 2.608) | 0.015 | 2.150 | (1.363, 3.392) | 0.001 | |||
| 4 | 4.034 | (2.515, 6.471) | <0.001 | 1.647 | (1.077, 2.518) | 0.021 | 2.018 | (1.312, 3.105) | 0.001 | 1.874 | (1.171, 2.999) | 0.009 | |||
| Model 3 | |||||||||||||||
| 1 | 1 | 1 | 1 | 1 | |||||||||||
| 2 | 1.361 | (0.794, 2.335) | 0.262 | 0.936 | (0.595, 1.474) | 0.776 | 1.204 | (0.762, 1.903) | 0.425 | 1.801 | (1.126, 2.88) | 0.014 | |||
| 3 | 2.025 | (1.157, 3.545) | 0.013 | 0.869 | (0.547, 1.382) | 0.554 | 1.282 | (0.814, 2.018) | 0.284 | 1.619 | (0.998, 2.628) | 0.051 | |||
| 4 | 2.593 | (1.306, 5.146) | 0.006 | 1.152 | (0.731, 1.815) | 0.542 | 1.380 | (0.861, 2.212) | 0.180 | 1.369 | (0.832, 2.25) | 0.216 | |||
| Model 1为未调整任何变量;Model 2为调整性别和年龄后;Model 3为进一步调整身高、收缩压、TG、HDL-C、吸烟、饮茶后;1代表第1四分位数组;2代表第2四分位数组;3代表第3四分位数组;4代表第4四分位数组 | |||||||||||||||
在调整年龄、性别后,VAI与糖尿病前期对象转归糖尿病的相关性最强;与第1组对象比较,第4组糖尿病前期对象发生糖尿病的风险是第1组对象的4.034(95%CI:2.515~6.471,P<0.001)倍,第3组对象发生糖尿病的风险是第1组对象的2.599(95%CI:1.602~4.215,P<0.001)倍,第2组对象发生糖尿病的风险与第1组对象的差异无统计学意义(OR=1.588, 95%CI:0.957~2.636,P=0.073)。而BMI对糖尿病前期转归糖尿病的风险在第2、第3组与第1组之间的差异无统计学意义。WC对糖尿病前期转归糖尿病的风险在第2组与第1组之间差异无统计学意义。
在进一步调整身高、收缩压、TG、HDL-C、吸烟、饮茶后,仍然是VAI与糖尿病前期对象转归糖尿病的相关性最强;与第1组对象比较,第4组糖尿病前期对象发生糖尿病的风险是第1组对象的2.593(95%CI:1.306~5.146,P=0.006)倍,第3组对象发生糖尿病的风险是第1组对象的2.025(95%CI:1.157~3.545,P=0.013)倍,第2组对象发生糖尿病的风险与第1组对象的差异无统计学意义(OR=1.361, 95%CI:0.794~ 2.335,P=0.262)。而BMI、WC对糖尿病前期转归糖尿病的风险在第2、3、4组与第1组之间差异无统计学意义。WHR对糖尿病前期转归糖尿病的风险在第3、4组与第1组之间差异无统计学意义。
2.6 不同肥胖指标预测糖尿病前期对象转归糖尿病的ROC曲线下面积用ROC曲线下面积分析VAI与BMI、WC、WHR这4个不同肥胖指标对糖尿病前期对象随访5年转归糖尿病的风险,结果显示(图 1):4个肥胖指标ROC曲线下面积均大于0.5,差异有统计学意义(P<0.05);VAI(曲线下面积0.662,P<0.001)相较于BMI(曲线下面积0.550,P=0.023)、WC(曲线下面积0.557,P=0.009)及WHR(曲线下面积0.546,P=0.033)有较好的预测价值。
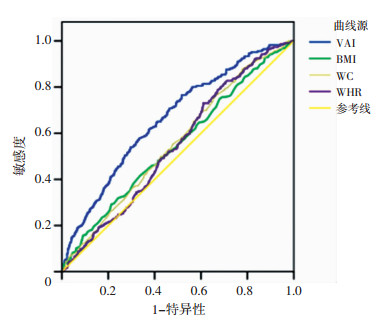
|
| 图 1 VAI及不同肥胖指标预测糖尿病前期对象转归糖尿病的ROC曲线下面积 |
3 讨论
肥胖被认为是导致大量慢性疾病的主要原因,其中中央型肥胖是一个重要的健康问题,与葡萄糖耐受不良、胰岛素抵抗、代谢紊乱、高胰岛素血症和进展为2型糖尿病有关[9]。在中央型肥胖中,内脏型肥胖被认为是发生糖尿病的主要危险因素[10]。由于久坐不动的不健康生活方式以及种族差异,中国人的内脏脂肪堆积比西方人多[11]。中国作为全球最大的发展中国家,糖尿病的患病率随着生活方式的改变日益飙升,而作为糖尿病“生力军”的糖尿病前期患者更是占有很高的比重。因此,研究中国人群中潜在的内脏型肥胖和糖尿病前期转归糖尿病风险的相关性具有重要的临床意义。
既往已经有不少研究证实了传统肥胖相关指标BMI、WC和WHR等与糖尿病、代谢综合征、心血管疾病以及其他疾病之间的相关性[12-13];研究发现:随着BMI、WC和WHR的增加,糖尿病患病率也随之增高[14-15]。BMI是一个反映整体肥胖的指标,对于区分中央型肥胖的能力差;一项涵盖42 918名中国成年人的研究显示:与BMI相比,WC的增加与发生糖尿病的相关性更强[16]。WC和WHR是反映中央型肥胖的指标,研究发现WC比WHR更能反映糖尿病发生风险[17]。本研究结果显示:WC预测糖尿病前期对象5年转归糖尿病的能力优于BMI及WHR,但是当进行多因素回归分析后WC对糖尿病前期转归糖尿病的风险在第2、3、4四分位组与最低四分位组之间差异无统计学意义,说明WC也并非是预测糖尿病前期对象转归糖尿病的良好指标。
虽然WC和WHR是反映中央型肥胖的指标,但是这两项指标都不能区分内脏脂肪和皮下脂肪。有研究结果显示内脏型肥胖被认为是发生糖尿病的主要危险因素[10]。目前,CT和MRI是量化中央型肥胖的先进手段,两者都能识别内脏和皮下脂肪组织的体积[4],然而由于价格、耗时等原因,CT和MRI并没有被常规应用。因此,寻找一个能够反映内脏型肥胖的简易指标,用于指导临床医师的工作尤为重要。
VAI被认为是内脏型肥胖的替代指标[18]。VAI是由AMATO等[18]提出的作为评估健康人群心脏代谢风险的替代指标,它与胰岛素敏感性呈显著负相关。CHEN等[19]的研究显示VAI与糖尿病发生风险呈正相关;与其他身体脂肪测量指标相比,VAI是一种更好、更方便的内脏脂肪测量替代指标,可用于大规模流行病学研究中糖尿病风险的识别。WANG等[20]一项随访15年的研究发现:随着VAI增加,进展至糖尿病的风险逐渐增加。本研究结果与之相似,但本研究以糖尿病前期对象为基础,探讨VAI与糖尿病前期对象5年转归糖尿病的相关性。本研究结果显示,VAI是影响糖尿病前期人群转归糖尿病的独立危险因素,在调整年龄、性别、身高、收缩压、TG、HDL-C、吸烟、饮茶的影响后,与最低VAI四分位数组对象比较,最高VAI四分位数组糖尿病前期对象发生糖尿病的风险是最低VAI四分位数组对象的2.593倍,第3 VAI四分位数组对象发生糖尿病的风险是最低VAI四分位数组对象的2.025倍,差异有统计学意义。进一步用ROC曲线下面积分析VAI与BMI、WC、WHR 4个不同肥胖指标对预测糖尿病前期对象随访5年转归糖尿病的能力,结果显示在4个不同肥胖指标中,VAI相较于BMI、WC及WHR有较好的预测价值。
国外有研究显示:内脏脂肪增加与胰岛素抵抗和β细胞功能障碍的风险增加相关[21]。腹型肥胖通过刺激脂肪、激素和细胞因子等代谢产物的形成导致胰岛素抵抗。胰岛素抵抗可能导致内皮细胞功能障碍和胰岛素信号通路的改变[22]。此外,一项研究发现,在调整胰岛素敏感性后,内脏脂肪和胰岛素分泌呈负相关[23-24]。进一步的研究报道内脏脂肪积累有助于降低脂联素水平,尽管其潜在的机制尚不完全清楚[25-26]。然而,一些研究表明:抑制脂联素合成或分泌的因子是由内脏脂肪分泌的[27],如肿瘤坏死因子α是一种强烈的脂联素启动子活性抑制因子[28]。所以,我们推测VAI通过影响胰岛素抵抗、胰岛β细胞功能以及脂联素水平等影响糖尿病前期对象转归为糖尿病。
目前国内有部分关于VAI与糖尿病前期、糖脂代谢疾病等的研究[29],鲜见VAI与糖尿病前期人群转归糖尿病风险的相关性研究;本研究分别使用了单因素分析、二元Logistic回归分析以及ROC曲线下面积等不同统计学方法,从不同角度分析了不同肥胖指标对糖尿病前期人群转归糖尿病的影响,并对3个指标作了对比分析。本研究尚存在一定的不足,如本研究纳入研究对象为40岁以上的人群,缺乏年轻参与者的样本,可能会导致本研究结果对较年轻的糖尿病前期人群参考意义不强,在今后的研究中,将纳入更多不同年龄阶段的对象。
综上所述,肥胖指标VAI、BMI、WC和WHR均为影响糖尿病前期对象转归糖尿病风险的影响因素;VAI在预测泸州地区成人糖尿病前期对象转归糖尿病风险方面优于BMI、WC和WHR。糖尿病前期转归糖尿病的风险随VAI的四分位增加而增加。ROC曲线分析证实,在以上4项肥胖相关指标中,VAI是糖尿病前期转归糖尿病的最佳预测因子。因此,VAI或可成为一项预测糖尿病前期对象转归糖尿病风险的预测因子。
| [1] |
WANG L M, GAO P, ZHANG M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. JAMA, 2017, 317(24): 2515-2523. DOI:10.1001/jama.2017.7596 |
| [2] |
KARLSSON T, RASK-ANDERSEN M, PAN G, et al. Contribution of genetics to visceral adiposity and its relation to cardiovascular and metabolic disease[J]. Nat Med, 2019, 25(9): 1390-1395. DOI:10.1038/s41591-019-0563-7 |
| [3] |
CASANUEVA F F, MORENO B, RODRIGUEZAZEREDO R, et al. Relationship of abdominal obesity with cardiovascular disease, diabetes and hyperlipidaemia in Spain[J]. Clin Endocrinol, 2009, 73(1): 35-40. DOI:10.1111/j.1365-2265.2009.03727.x |
| [4] |
SCHLETT C L, HOFFMANN U. Identifikation und quantifizierung von fettkompartimenten mit CT und MRT und deren stellenwert[J]. Der Radiol, 2011, 51(5): 372. DOI:10.1007/s00117-010-2088-4 |
| [5] |
WEI J, LIU X, XUE H, et al. Comparisons of visceral adiposity index, body shape index, body mass index and waist circumference and their associations with diabetes mellitus in adults[J]. Nutrients, 2019, 11(7): 1580. DOI:10.3390/nu11071580 |
| [6] |
AHN N, BAUMEISTER S E, AMANN U, et al. Visceral adiposity index (VAI), lipid accumulation product (LAP), and product of triglycerides and glucose (TyG) to discriminate prediabetes and diabetes[J]. Sci Rep, 2019, 9(1): 9693. DOI:10.1038/s41598-019-46187-8 |
| [7] |
中华医学会糖尿病分会. 2007年版中国2型糖尿病防治指南[J]. 中华内分泌代谢杂志, 2008, 24(2): 增录1-附录26. Branch of Diabetes of Chinese Medical Association. 2007 edition of Chinese guidelines for the prevention and treatment of type 2 diabetes[J]. Chin J Endocrinol Metab, 2008, 24(2): add.1-26. |
| [8] |
AMATO M C, GIORDANO C, GALIA M, et al. Visceral adiposity index: a reliable indicator of visceral fat function associated with cardiometabolic risk[J]. Diabetes Care, 2010, 33(4): 920-922. DOI:10.2337/dc09-1825 |
| [9] |
HUANG T, QI Q B, ZHENG Y, et al. Genetic predisposition to central obesity and risk of type 2 diabetes: two independent cohort studies[J]. Diabetes Care, 2015, 38(7): 1306-1311. DOI:10.2337/dc14-3084 |
| [10] |
KIM J A, HWANG S Y, CHUNG H S, et al. Proportion and characteristics of the subjects with low muscle mass and abdominal obesity among the newly diagnosed and drug-naïve type 2 diabetes mellitus patients[J]. Diabetes Metab J, 2019, 43(1): 105-113. DOI:10.4093/dmj.2018.0036 |
| [11] |
WAKABAYASHI I, DAIMON T. A strong association between lipid accumulation product and diabetes mellitus in Japanese women and men[J]. J Atheroscler Thromb, 2014, 21(3): 282-288. DOI:10.5551/jat.20628 |
| [12] |
XING Z H, PEI J Y, HUANG J B, et al. Relationship of obesity to adverse events among patients with mean 10-year history of type 2 diabetes mellitus: results of the ACCORD study[J]. J Am Heart Assoc, 2018, 7(22): e010512. DOI:10.1161/JAHA.118.010512 |
| [13] |
CHEONG K C, GHAZALI S M, HOCK L K, et al. The discriminative ability of waist circumference, body mass index and waist-to-hip ratio in identifying metabolic syndrome: Variations by age, sex and race[J]. Diabetes Metab Syndr, 2015, 9(2): 74-78. DOI:10.1016/j.dsx.2015.02.006 |
| [14] |
ALBRECHT S S, MAYER-DAVIS E, POPKIN B M. Secular and race/ethnic trends in glycemic outcomes by BMI in US adults: The role of waist circumference[J]. Diabetes Metab Res Rev, 2017, 33(5). DOI:10.1002/dmrr.2889 |
| [15] |
BA LA, MEENAKSHI, AGGARWAL S. Correlation of body mass index and waist/hip ratio with glycated hemoglobin in prediabetes[J]. EJIFCC, 2019, 30(3): 317-324. |
| [16] |
HOU X H, CHEN S Y, HU G, et al. Stronger associations of waist circumference and waist-to-height ratio with diabetes than BMI in Chinese adults[J]. Diabetes Res Clin Pract, 2019, 147: 9-18. DOI:10.1016/j.diabres.2018.07.029 |
| [17] |
PAJUNEN P, RISSANEN H, LAAKSONEN M A, et al. Sagittal abdominal diameter as a new predictor for incident diabetes[J]. Diabetes Care, 2013, 36(2): 283-288. DOI:10.2337/dc11-2451 |
| [18] |
AMATO M C, GIORDANO C, GALIA M, et al. Visceral adiposity index: a reliable indicator of visceral fat function associated with cardiometabolic risk[J]. Diabetes Care, 2010, 33(4): 920-922. DOI:10.2337/dc09-1825 |
| [19] |
CHEN C, XU Y, GUO Z R, et al. The application of visceral adiposity index in identifying type 2 diabetes risks based on a prospective cohort in China[J]. Lipids Health Dis, 2014, 13: 108. DOI:10.1186/1476-511X-13-108 |
| [20] |
WANG Y, HE S, HE J, et al. Predictive value of visceral adiposity index for type 2 diabetes mellitus: a 15-year prospective cohort study[J]. Herz, 2015, 40(Suppl 3): 277-281. DOI:10.1007/s00059-014-4175-1 |
| [21] |
Moon H U, Ha K H, Han S J, et al. The association of adiponectin and visceral fat with insulin resistance and β-cell dysfunction[J]. J Korean Med Sci, 2018, 34(1): e7. DOI:10.3346/jkms.2019.34.e7 |
| [22] |
BALSAN G A, VIEIRA J L D C, OLIVEIRA A M D, et al. Relationship between adiponectin, obesity and insulin resistance[J]. Rev Assoc Med Bras, 2015, 61(1): 72-80. DOI:10.1590/1806-9282.61.01.072 |
| [23] |
UTZSCHNEIDER K M, CARR D B, HULL R L, et al. Impact of intra-abdominal fat and age on insulin sensitivity and beta-cell function[J]. Diabetes, 2004, 53(11): 2867-2872. DOI:10.2337/diabetes.53.11.2867 |
| [24] |
WAGENKNECHT L E, LANGEFELD C D, SCHERZINGER A L, et al. Insulin sensitivity, insulin secretion, and abdominal fat: the Insulin Resistance Atherosclerosis Study (IRAS) family study[J]. Diabetes, 2003, 52(10): 2490-2496. DOI:10.2337/diabetes.52.10.2490 |
| [25] |
MATSUZAWA Y. Establishment of a concept of visceral fat syndrome and discovery of adiponectin[J]. Proc Jpn Acad, Ser Bphys Biol Sci, 2010, 86(2): 131-141. DOI:10.2183/pjab.86.131 |
| [26] |
ARITA Y. Reprint of "paradoxical decrease of an adipose-specific protein, adiponectin, in obesity"[J]. Biochem Biophys Res Commun, 2012, 425(3): 560-564. DOI:10.1016/j.bbrc.2012.08.024 |
| [27] |
HALLEUX C M, TAKAHASHI M, DELPORTE M L, et al. Secretion of adiponectin and regulation of apM1 gene expression in human visceral adipose tissue[J]. Biochem Biophys Res Commun, 2001, 288(5): 1102-1107. DOI:10.1006/bbrc.2001.5904 |
| [28] |
MAEDA N, TAKAHASHI M, FUNAHASHI T, et al. PPAR ligands increase expression and plasma concentrations of adiponectin, an adipose-derived protein[J]. Diabetes, 2001, 50(9): 2094-2099. DOI:10.2337/diabetes.50.9.2094 |
| [29] |
罗兰, 李欣宇, 高政南. 腰围、腰高比、内脏脂肪指数对大连地区40岁以上新诊断糖尿病前期女性患者的预测价值[J]. 中国糖尿病杂志, 2020, 28(1): 17-22. LUO L, LI X Y, GAO Z N. The value of waist circumference, waist height ratio and visceral adiposity index in predicting new prediabetes in women over 40 years old in Dalian[J]. Chin J Diabetes, 2020, 28(1): 17-22. |
| [30] |
余雪, 李敏谦, 郭姣. 内脏脂肪指数与糖脂代谢病的相关性研究[J]. 世界中医药, 2019, 14(1): 29-32, 38. YU X, LI M Q, GUO J. Correlation between visceral fat index and glycolipid metabolic disease[J]. World J Tradit Chin Med, 2019, 14(1): 29-32, 38. |
| [31] |
张怡, 王禹盈, 徐文迪, 等. 多囊卵巢综合征患者内脏脂肪指数与糖调节受损独立正相关[J]. 中华糖尿病杂志, 2019, 11(4): 265-269. ZHANG Y, WANG Y Y, XU W D, et al. Visceral adiposity index is independently and positively related with impaired glucose regulation in women with polycystic ovary syndrome[J]. Chin J Diabetes Mellit, 2019, 11(4): 265-269. |



