2. 330006 南昌,江西省妇幼保健院:肿瘤科
2. Department of Oncology, Jiangxi Maternal and Child Health Hospital, Nanchang, Jiangxi Province, 330006, China
子痫前期(preeclampsia,PE)是一种发生于妊娠20周后的妊娠并发症,特征是血压升高、尿蛋白质升高,可导致严重的母婴危害。研究发现胎盘滋养层细胞低侵袭能力和上皮间充质转化(epithelial-mesenchymal transition,EMT)功能减弱与PE的发病机制均有关[1-2]。
非编码RNA如长链非编码RNA(long non-coding RNA,lncRNA)和微小RNA(microRNA,miRNA)可能参与调控PE的发生、发展。LncRNA是一类长度大于200 nt的非编码RNA,大量证据证明lncRNA可以通过扮演“分子海绵”的作用吸附miRNA,从而减少miRNA[3];miRNA是一类高度保守的短链的(20~25 nt)非编码RNA,主要通过与靶基因mRNA的3′-非翻译区的碱基对的结合从而负向调控靶基因表达,导致mRNA降解和翻译抑制[4]。越来越多的证据表明,miRNA及lncRNA与多种疾病的发病过程相关。例如,lncRNA和miRNA异常表达可能影响细胞凋亡、增殖、分化、衰老[5];在肿瘤发生、发展过程中,lncRNA和miRNA的表达增高或降低均可通过调节下游抑癌或促癌靶基因调控肿瘤的进展[6];且深入研究表明,癌细胞EMT和转移相关基因如基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、钙黏蛋白(E-cadherin)、神经钙黏附蛋白(N-cadherin)同样可被lncRNA和miRNA所调控[7-8]。
有证据表明,lncRNA及miRNA的异常表达还与PE的发生有关[8-9]。LncRNA和miRNA表达谱均显示PE胎盘组织中存在大量差异表达的lncRNA和miRNA[10-11]。这些差异表达的lncRNA和miRNA可能参与PE的发生。LncRNA缺氧诱导因子-1α-反义链2(hypoxia-inducible factor 1 alpha antisense RNA 2,HIF1A-AS2)已被证实与多种肿瘤的进展相关,包括乳腺癌[12]、结直肠癌[13]、膀胱癌[14]等,其能调节肿瘤细胞的侵袭能力。PE的发病机制与滋养层细胞低侵袭能力和EMT功能减弱相关,然而HIF1A-AS2是否参与调控PE发生相关细胞的侵袭鲜有报道。我们通过生物信息学预测发现,HIF1A-AS2与miRNA miR-138-5p序列存在结合位点,其可能扮演“分子海绵”从而吸附miR-138-5p发挥作用。本研究旨在研究HIF1A-AS2及miR-138-5p在PE胎盘组织中水平的变化,两者变化对滋养层细胞侵袭和EMT的影响,以及滋养层细胞中两者的调控和结合关系,以期为PE的防治提供潜在的研究靶点。
1 材料与方法 1.1 样本来源胎盘组织样本来源于2016年1月至2019年1月在我院生产的40例剖宫产初产妇。基于诊断标准[15],其中有20例产妇患有PE。在剖宫产手术中,从坏死区以外的胎盘裂片中收集胎盘组织,液氮冷冻后保存于-80 ℃。每位受试者无其他妊娠并发症,例如心脏病,妊娠前的高血压,糖尿病和肾病,亦无吸烟史。表 1列出了对照组和PE组初产妇的一般资料和基线数据。本研究所有试验经我院伦理委员会于2015年11月批准。每位研究对象均获得知情同意。
| 组别 | 年龄/岁 | 胎龄/周 | 收缩压/mmHg | 舒张压/mmHg | 蛋白尿/g·24 h-1 |
| 对照组 | 28.37±1.07 | 37.41±1.10 | 110.40±8.28 | 72.50±4.97 | |
| PE组 | 27.96±0.89 | 36.96±0.95 | 145.40±10.10 | 107.65±7.62 | 2.10±0.13 |
| P | 0.196 | 0.175 | <0.05 | <0.05 | <0.05 |
1.2 细胞培养
本研究选用的人绒毛膜滋养层细胞系HTR-8/Svneo是猿猴病毒40大T抗原基因(simian virus 40 large T antigen gene,SV40T)转染人孕早期胎盘的绒毛膜绒毛外植体生长的细胞衍生来的细胞系,细胞形态呈上皮样,贴壁生长,多用于滋养层生物学及胎盘功能研究。在Dulbecco改良的Eagle’s培养基/F12(DMEM/F12, Sigma, St Louis, MO)中培养HTR-8/SVneo细胞(ATCC),内含100 U/mL青霉素以及链霉素抗生素、10%胎牛血清。细胞培养于37 ℃、5% CO2的湿润培养箱中。待细胞达到约90%融合度时,进行传代。
1.3 实时定量PCR(quantitative Real-time PCR,qRT-PCR)根据制造商的说明,RNA提取试剂盒(TaKaRa, Shiga, Japan)用于从细胞和组织中提取总RNA。RNA的质量通过分光光度计(Jenway Ltd,Essex,UK)检测260/280 nm下的光密度值D(260/280)进行检验。2%的琼脂糖凝胶通过电泳用于检查RNA的完整性。采用2-ΔΔCt方法对相对mRNA的水平进行计算,3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因。此外,使用Mir-XTM MirS首链合成和SYBR® RT-qPCR(Clontech Laboratories, Inc., CA, USA)试剂盒检测miRNA,采用2-ΔΔCt方法计算相对水平,使用U6作为miRNA的内参基因。HIF1A-AS2引物:正向5′-TCTGTGGCTCAGTTCCTTTTGT-3′,反向5′-ATGTAGGAAGTGCCAGAGCC-3′;miR-138-5p引物:正向5′-GCTTAAGGCACGCGG-3′,反向,5′-GTGCAGGGTCCGAGG-3′;U6引物:正向5′-CTCGC-TTCGGCAGCACATATACTA-3′,反向5′-ACGAATTTGCGTG-TCATCCTTGCG-3′;GAPDH引物:正向5′-ACCCAC-TCCTCCACCTTTGAC-3′,反向5′-TGTTGCTGTAGCCA-AATTCGTT-3′。
1.4 细胞转染miR-138-5p的拟似物(miR-138-5p拟似物组)和抑制剂(miR-138-5p抑制物组)及二者的阴性对照(拟似物-NC,抑制物-NC)均从Genecopoeia(中国,广州)购买。HIF1A-AS2的真核表达质粒pcDNA3.1-HIF1A-AS2(pcHIF1A-AS2)及其阴性对照pcDNA3.1-Null(pcNull)通过Sangon Biotech(中国,上海)购买。根据制造商的说明,均以Lipofectamine 2000(Invitrogen,Carlsbad,CA,美国)转染到HTR-8/SVneo细胞中。
1.5 Western blot检测使用添加蛋白酶抑制剂的RIPA缓冲液提取细胞总蛋白。以十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质样本,然后将胶上的蛋白条带电转移到聚偏二氟乙烯膜中。经过含5%脱脂牛奶的洗膜缓冲液(Tris Buffered Saline Tween,TBST)封闭后。使用的第一抗体如下:波形蛋白(Vimentin,ab92547,Abcam),N-cadherin(ab18203,Abcam),人Twist相关蛋白1(Twist1,ab175430,Abcam)和GAPDH(ab181602,Abcam)。之后,使用抗小鼠IgG(H+L)-HRP偶联抗体(1 :10 000,Invitrogen)或山羊抗兔抗体(1 :5 000,Invitrogen)进行孵育,并使用凝胶成像系统进行拍照。使用Image J软件分析相对蛋白表达水平。
1.6 CCK-8检测细胞增殖在96孔板中加入细胞,每孔5×103个细胞。在2、8、16 h和24 h进行CCK-8检测。培养时使用含有100 μL的CCK-8培养基(DOJINDO,日本)。使用VarioskanTM闪存微孔板读数器(Thermo Scientific, Waltham, MA, USA)分析培养2 h后在450 nm波长下的光密度值D(450),计算每个时间点下3个重复孔的平均光密度值。
1.7 Transwell侵袭实验将2×104个细胞加入到铺有Martrigel滤膜的Transwell小室中,培养基为含20%胎牛血清的DMEM/ F12。此外,在37 ℃下培养细胞,细胞在24 h内进入Matrigel滤膜屏障。95%的苏木精溶液与乙醇一起用于固定和染色侵袭细胞。此后,使用棉签清除未侵袭的细胞。通过显微镜观察,对染色细胞进行计数用以评估细胞侵袭指数。使用光学显微镜(Nikon, Tokyo, Japan)捕获图像。
1.8 荧光素酶基因报告实验使用Starbase 2.0预测并获取与miR-138-5p相互结合的HIF1A-AS2序列,并预测目标位点内的突变序列(http://starbase.sysu.edu.cn/mirLncRNA.php)。将获得的序列插入到pGL3载体(Promega, Madison, WI, USA)的XbaI/FseI位点。以HIF1A-AS2为模板,扩增HIF1A-AS2及其突变体(HIF1A-AS2-mut)。DharmFECT Duo转染试剂(Thermo Fisher Scientific, Glasgow, UK)用于荧光素酶活性分析。随后,根据制造商的要求,使用双荧光素酶测定系统(Promega)进行荧光素酶测定。
1.9 统计学分析采用SPSS 10.0统计软件进行分析,数据以x±s表示。对照组和PE组两组间的数据比较采用t检验。采用单因素方差分析及SNK-Q(Student-Newman-Keuls Q)检验进行多组间比较。检验水准α=0.05。
2 结果 2.1 两组初产妇一般资料与对照组相比,PE组初产妇的收缩压和舒张压及蛋白尿水平升高(P < 0.05)。其他基线数据两组间差异无统计学意义(P>0.05,表 1)。
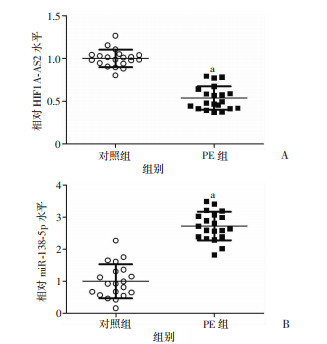
2.2 两组胎盘组织中HIF1A-AS2及miR-138-5p水平比较通过RT-qPCR检测HIF1A-AS2和miR-138-5p在两组胎盘组织中的水平,结果显示与对照组相比,PE组初产妇胎盘组织中HIF1A-AS2相对水平降低(图 1A),miR-138-5p水平升高(图 1B),差异均具有统计学意义(P < 0.05)。
|
| A:相对HIF1A-AS2水平;B:相对miR-138-5p水平a: P < 0.05, 与对照组比较 图 1 PE组和对照组初产妇胎盘组织中HIF1A-AS2和miR-138-5p的表达水平(n=20) |
2.3 HIF1A-AS2上调促进HTR-8/SVneo细胞侵袭和EMT
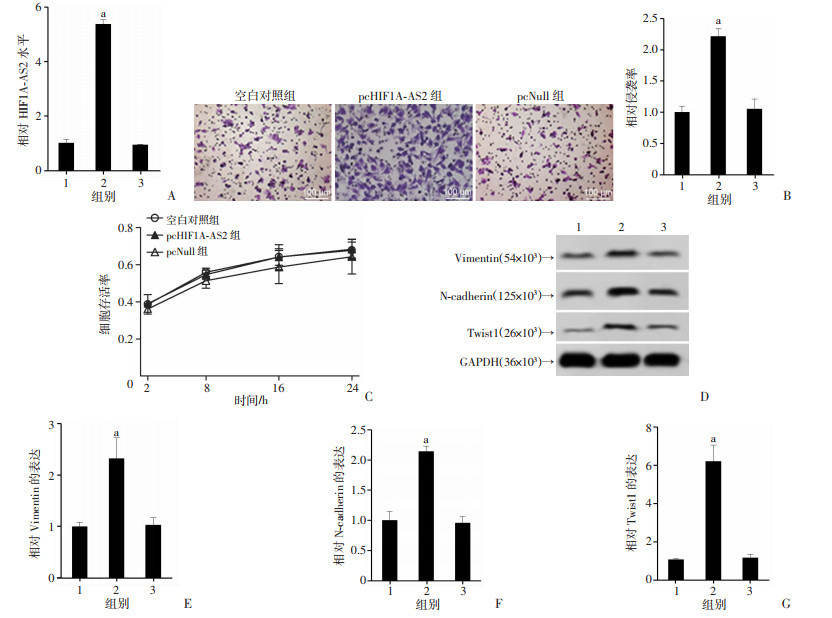
将pcHIF1A-AS2及其阴性对照pcNull转染到HTR-8/SVneo细胞中。转染48 h后,检测结果显示HIF1A-AS2水平在pcHIF1A-AS2组明显增高,证实转染成功(P < 0.05,图 2A)。转染72 h后,以Transwell实验检测细胞侵袭,结果显示pcHIF1A-AS2组中细胞相对侵袭率高于空白对照组及pcNull组(P < 0.05,图 2B)。应用CCK-8实验检测HIF1A-AS2对细胞增殖的影响,结果显示,pcHIF1A-AS2转染后,细胞增殖无变化(P>0.05,图 2C)。Western blot检测结果显示,与空白对照组及pcNull组相比,EMT相关分子Vimentin、N-cadherin及Twist1在pcHIF1A-AS2组中的表达水平升高(P < 0.05,图 2D~G)。上述结果表明,HIF1A-AS2上调能够促进HTR-8/SVneo细胞侵袭和EMT。
|
| 1:空白对照组;2:pcHIF1A-AS2组;3:pcNull组;A:相对HIF1A-AS2水平;B:HTR-8/SVneo细胞侵袭率与统计结果;C:HTR-8/SVneo细胞存活率;D:Western blot检测EMT相关分子表达;E:相对Vimentin的表达;F:相对N-cadherin的表达;G:相对Twist1的表达a:P < 0.05,与空白对照组及pcNull组比较(n=3, x±s) 图 2 HIF1A-AS2对HTR-8/SVneo细胞侵袭和上皮间充质转化(EMT)的影响 |
2.4 miR-138-5p抑制物转染促进HTR-8/SVneo细胞侵袭和EMT
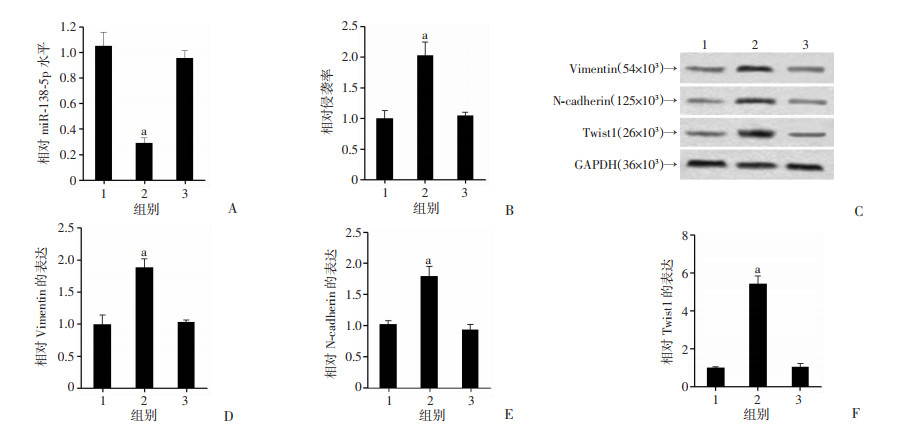
将miR-138-5p抑制物及其阴性对照抑制物-NC转染到HTR-8/SVneo细胞中。转染48 h后,miR-138-5p水平在miR-138-5p抑制物组降低,证实转染成功(P < 0.05,图 3A)。转染72 h后,Transwell实验结果显示miR-138-5p抑制物组中细胞相对侵袭率高于空白对照组及抑制物-NC组(P < 0.05,图 3B)。与空白对照组及抑制物-NC组相比,EMT相关分子Vimentin、N-cadherin及Twist1在miR-138-5p抑制物组中的表达水平升高,差异均具有统计学意义(图 3C~F,P < 0.05)。上述结果显示,miR-138-5p抑制物转染能促进HTR-8/ SVneo细胞侵袭和EMT。
|
| 1:空白对照组;2:miR-138-5p抑制物组;3:抑制物-NC组;A:相对miR-138-5p水平;B:HTR-8/SVneo细胞侵袭率;C:Western blot检测EMT相关分子表达;D:相对Vimentin的表达;E:相对N-cadherin的表达;F:相对Twist1的表达a:P < 0.05,与空白对照组及抑制物-NC组比较(n=3,x±s) 图 3 miR-138-5p抑制物转染对HTR-8/SVneo细胞侵袭和EMT的影响 |
2.5 miR-138-5p拟似物逆转HIF1A-AS2对HTR-8/SVneo细胞侵袭和EMT的促进作用
将HTR-8/SVneo细胞以pcHIF1A-AS2和/或miR-138-5p拟似物共转染。转染48 h后,miR-138-5p水平在miR-138-5p拟似物组升高,证实转染成功(P < 0.05)。同时,pcHIF1A-AS2转染能够导致miR-138-5p水平显著降低(P < 0.05,图 4A),并且该作用在引入miR-138-5p拟似物后得以部分逆转(P < 0.05)。此外,复测结果显示,由pcHIF1A-AS2转染引发的细胞侵袭增加和EMT相关分子(Vimentin、N-cadherin、Twist1)表达增加,在miR-138-5p拟似物+pcHIF1A-AS2组中均得以减弱(P < 0.05,图 4B~F)。上述结果显示,HIF1A-AS2通过抑制miR-138-5p水平促进滋养层细胞的侵袭和EMT。

|
| A:相对miR-138-5p水平1:空白对照组;2:miR-138-5p拟似物组;3:拟似物-NC组;4:pcHIF1A-AS2组;5:miR-138-5p拟似物+pcHIF1A-AS2组;B:HTR-8/SVneo细胞侵袭率1:空白对照组;2:pcHIF1A-AS2组;3:miR-138-5p拟似物+pcHIF1A-AS2组;C:Western blot检测EMT相关分子表达1:空白对照组;2:pcHIF1A-AS2组;3:miR-138-5p拟似物+pcHIF1A-AS2组;D:相对Vimentin的表达1:空白对照组;2:pcHIF1A-AS2组;3:miR-138-5p拟似物+pcHIF1A-AS2组;E:相对N-cadherin的表达1:空白对照组;2:pcHIF1A-AS2组;3:miR-138-5p拟似物+pcHIF1A-AS2组;F:相对Twist1的表达1:空白对照组;2:pcHIF1A-AS2组;3:miR-138-5p拟似物+pcHIF1A-AS2组a:P < 0.05, 与空白对照组或拟似物-NC组比较;b: P < 0.05, 与pcHIF1A-AS2组比较(n=3,x±s) 图 4 miR-138-5p拟似物逆转HIF1A-AS2对HTR-8/SVneo细胞侵袭和EMT的促进作用 |
2.6 HTR-8/Svneo细胞中HIF1A-AS2与miR-138-5p直接结合
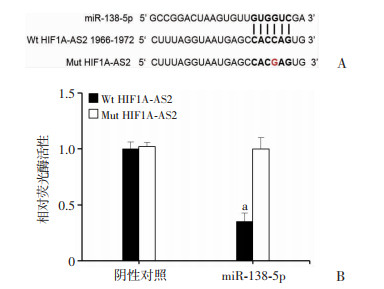
通过生物信息学软件预测发现HIF1A-AS2和miR-138-5p可能存在结合位点(图 5A)。采用荧光素酶基因报告实验研究两者之间的结合关系,发现野生型HIF1A-AS2可以抑制miR-138-5p的荧光素酶活性,差异具有统计学意义(P < 0.05, 图 5B)。结果表明,HIF1A-AS2和miR-138-5p在HTR-8/Svneo细胞中可以直接结合。
|
| A:HIF1A-AS2和miR-138-5p的预测结合序列;B:相对荧光素酶活性a:P < 0.05, 与Mut HIF1A-AS2比较 图 5 HIF1A-AS2和miR-138-5p在HTR-8/Svneo细胞中直接结合(n=3,x±s) |
3 讨论
PE发生初期,滋养层细胞的侵袭和EMT特性异常减弱,这很可能与lncRNA和miRNA的异常表达和功能失调有关[16-17]。本研究中,HIF1A-AS2水平在PE组织中异常降低,且外源性增加HIF1A-AS2水平可显著促进HTR-8/Svneo细胞的侵袭和EMT标志物表达。此外,miR-138-5p拟似物的引入能够减弱HIF1A-AS2水平升高对HTR-8/Svneo细胞侵袭及EMT的促进作用。另外,我们发现HTR-8/Svneo细胞中,HIF1A-AS2能够显著抑制miR-138-5p水平,且两者可以直接结合。因此,本研究得出以下结论,HIF1A-AS2能够通过抑制miR-138-5p水平促进滋养层细胞的侵袭和EMT进程,可能有利于预防PE的发生。
对于哺乳动物而言,胎盘是母胎之间必不可少的纽带,其支持着胎儿的生长和发育。胎盘功能下降会导致各种妊娠并发症,例如PE的发生引起母体高血压、蛋白尿、母体血管功能障碍以及对胎儿生长发育的长期不利影响。目前,尚无法明确PE的发病原因。然而,PE的发病机制存在多种理论假说,例如,滋养层细胞的浸润性下降[18]、胎盘功能下降[19]、滋养层细胞凋亡增加[20]、内皮细胞功能障碍[21]和子宫螺旋动脉重塑受损[22]。在这些假说中,滋养层细胞迁移和侵袭的降低作用可能最令人信服[18]。既往研究中,HIF1A-AS2多被发现能够促进肿瘤细胞的迁移和侵袭能力[12-14],本研究特别发现HIF1A-AS2对滋养层细胞侵袭及EMT也具有调节作用,使HIF1A-AS2有望成为PE防治的潜在研究靶点。
绒毛外滋养层细胞(extrayillous trophoblast,EVTs)在子宫内膜内迁移、浸润子宫蜕膜、螺旋动脉重塑等过程中起重要作用,其在妊娠过程中为胎儿提供适当的营养和氧气供应[23-24]。在增殖、凋亡、迁移和侵袭能力方面,滋养层细胞也表现出与癌细胞非常相似的表型[25],例如滋养层细胞的EMT在迁移和侵袭功能获得过程中同样发挥重要作用[26]。在本研究中,我们探索了其潜在的分子机制,发现与正常妊娠初产妇相比,PE初产妇胎盘组织中HIF1A-AS2水平异常下调。外源性增加HIF1A-AS2水平可有效促进滋养层细胞的侵袭能力,上调EMT标志物Vimentin、N-cadherin以及EMT诱导转录因子Twist1的表达。提示HIF1A-AS2是一种重要的调节分子,其降低可能主要参与调节PE发生过程中滋养层细胞EMT和浸润活性的抑制功能,HIF1A-AS2水平异常降低可能是一种关键的潜在的PE诊断指标。
MiRNA对胎盘的正常发育非常重要[27]。研究表明,胎盘表达的miRNA首先由滋养层细胞产生[28]。这些差异表达的miRNA可以导致胎盘功能受损并导致PE发生。有学者报道miR-138-5p能够抑制多种肿瘤细胞的侵袭功能和EMT[29-30]。在本研究中,我们证实,与正常初产妇胎盘组织相比,PE初产妇胎盘组织中的miR-138-5p水平显著增加。而miR-138-5p拟似物引入对HIF1A-AS2作用的减弱效果,表明miR-138-5p可能是一种关键的促PE miRNA,其水平增加可能会导致PE的发生。
LncRNA发挥功能的关键途径之一是吸附目标miRNA从而发挥“分子海绵”的作用,进一步可能影响下游功能靶基因的表达和功能[31]。例如DLX6-AS1是一种在PE胎盘组织表达上调的lncRNA,且DLX6-AS1的序列可直接与miR-376c结合发挥“分子海绵”的作用,进而下调miR-376c的水平并抑制滋养细胞的迁移和侵袭[32]。HIF1A-AS2能够通过吸附miR-153-3p促进缺氧诱导因子-1α上调,进而促进低氧条件下人脐静脉内皮细胞的血管生成[33]。在脂肪干细胞中,HIF1A-AS2被发现能够通过调节miR-665/IL-6轴而促进该细胞成骨分化过程[34]。本研究发现HIF1A-AS2不仅可以诱导滋养层细胞的侵袭和EMT,而且可以下调miR-138-5p水平。另外,miR-138-5p抑制物对滋养层细胞侵袭和EMT的影响趋势与过表达HIF1A-AS2一致,且miR-138-5p拟似物引入可抑制因HIF1A-AS2过表达所引起的滋养层细胞侵袭和EMT的增加。生物信息学预测显示HIF1A-AS2可能与miR-138-5p序列具有结合位点。本研究使用荧光素酶基因报告实验证实HIF1A-AS2的1966-1972序列“...CACCAG...”与miR-138-5p序列互补结合。表明HIF1A-AS2对miR-138-5p的抑制可能是直接作用。
综上所述,本研究发现,HIF1A-AS2可能通过直接抑制miR-138-5p水平促进滋养层细胞的侵袭和EMT,为PE的防治提供了新的潜在研究靶点。此外,本研究发现的分子调控机制尚缺乏体内相关实验研究证据,我们将在以后的研究中进一步探讨。
| [1] |
JI L, BRKIĆ J, LIU M, et al. Placental trophoblast cell differentiation: physiological regulation and pathological relevance to preeclampsia[J]. Mol Aspects Med, 2013, 34(5): 981-1023. DOI:10.1016/j.mam.2012.12.008 |
| [2] |
GE H S, YIN N L, HAN T L, et al. Interleukin-27 inhibits trophoblast cell invasion and migration by affecting the epithelial-mesenchymal transition in preeclampsia[J]. Reprod Sci, 2019, 26(7): 928-938. DOI:10.1177/1933719118799206 |
| [3] |
郑伟, 董洁, 李少华, 等. LncRNA-GAS5抑制miR-21介导的非完全匹配靶mRNA降解[J]. 生物化学与生物物理进展, 2017, 44(7): 580-590. ZHENG W, DONG J, LI S H, et al. LncRNA-GAS5 inhibits decay of microRNA-21 imperfect complementary target mRNAs[J]. Prog Biochem Biophys, 2017, 44(7): 580-590. DOI:10.16476/j.pibb.2017.0113 |
| [4] |
汤丽莎, 崔毓桂. miRNA与胎盘发育的相互功能调控及其在早期复发性流产中的研究进展[J]. 中国妇幼保健, 2017, 32(15): 3693-3696. TANG L S, CUI Y G. The mutual functional regulation of miRNA and placental development and its research progress in early recurrent abortion[J]. Matern Child Heal Care China, 2017, 32(15): 3693-3696. DOI:10.7620/zgfybj.j.issn.1001-4411.2017.15.100 |
| [5] |
龚勇, 谢海龙. 肿瘤中miRNA异常表达的分子调控机制及研究进展[J]. 临床与实验病理学杂志, 2014, 30(10): 1152-1155. GONG Y, XIE H L. Molecular regulation mechanism and research progress of abnormal miRNA expression in tumors[J]. J Clin Exp Pathol, 2014, 30(10): 1152-1155. DOI:10.13315/j.cnki.cjcep.2014.10.018 |
| [6] |
祝烨, 宋鑫. miRNA与lncRNA的相互调控作用在肿瘤中的研究进展[J]. 基础医学与临床, 2015, 35(11): 1554-1558. ZHU Y, SONG X. The advance of the interaction between miRNA and lncRNA in cancer reseach[J]. Basic Clin Med, 2015, 35(11): 1554-1558. |
| [7] |
LI W L, JIA G T, QU Y W, et al. Long non-coding RNA (LncRNA) HOXA11-AS promotes breast cancer invasion and metastasis by regulating epithelial-mesenchymal transition[J]. Med Sci Monit, 2017, 23: 3393-3403. DOI:10.12659/MSM.904892 |
| [8] |
LI J L, LI R, GAO Y, et al. LncRNA CCAT1 promotes the progression of preeclampsia by regulating CDK4[J]. Eur Rev Med Pharmacol Sci, 2018, 22(5): 1216-1223. DOI:10.26355/eurrev_201803_14461 |
| [9] |
SINGH K, WILLIAMS J Ⅲ, BROWN J, et al. Up-regulation of microRNA-202-3p in first trimester placenta of pregnancies destined to develop severe preeclampsia, a pilot study[J]. Pregnancy Hypertens, 2017, 10: 7-9. DOI:10.1016/j.preghy.2017.04.002 |
| [10] |
GUNEL T, HOSSEINI M K, GUMUSOGLU E, et al. Expression profiling of maternal plasma and placenta microRNAs in preeclamptic pregnancies by microarray technology[J]. Placenta, 2017, 52: 77-85. DOI:10.1016/j.placenta.2017.02.019 |
| [11] |
HE X J, HE Y Y, XI B R, et al. LncRNAs expression in preeclampsia placenta reveals the potential role of LncRNAs contributing to preeclampsia pathogenesis[J]. PLoS ONE, 2013, 8(11): e81437. DOI:10.1371/journal.pone.0081437 |
| [12] |
WANG Y F, ZHANG G C, HAN J. HIF1A-AS2 predicts poor prognosis and regulates cell migration and invasion in triple-negative breast cancer[J]. J Cell Biochem, 2019, 120(6): 10513-10518. DOI:10.1002/jcb.28337 |
| [13] |
LIN J G, SHI Z H, YU Z Y, et al. LncRNA HIF1A-AS2 positively affects the progression and EMT formation of colorectal cancer through regulating miR-129-5p and DNMT3A[J]. Biomed Pharmacother, 2018, 98: 433-439. DOI:10.1016/j.biopha.2017.12.058 |
| [14] |
CHEN M W, ZHUANG C L, LIU Y C, et al. Tetracycline-inducible shRNA targeting antisense long non-coding RNA HIF1A-AS2 represses the malignant phenotypes of bladder cancer[J]. Cancer Lett, 2016, 376(1): 155-164. DOI:10.1016/j.canlet.2016.03.037 |
| [15] |
ACOG practice bulletin. ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia[J]. Int J Gynaecol Obstet, 2002, 77(33): 67-75. DOI:10.1016/S0020-7292(02)80002-9 |
| [16] |
ZUO Q, HUANG S Y, ZOU Y F, et al. The lnc RNA SPRY4-IT1 modulates trophoblast cell invasion and migration by affecting the epithelial-mesenchymal transition[J]. Sci Rep, 2016, 6(1): 37183. DOI:10.1038/srep37183 |
| [17] |
RAHNAMA F, SHAFIEI F, GLUCKMAN P D, et al. Epigenetic regulation of human trophoblastic cell migration and invasion[J]. Endocrinology, 2006, 147(11): 5275-5283. DOI:10.1210/en.2006-0288 |
| [18] |
LIANG W, SONG W, XIE Y, et al. miR-181a-5p suppresses invasion and migration of HTR-8/SVneo cells by directly targeting IGF2BP2[J]. Cell Death Dis, 2018, 9(2): 16. DOI:10.1038/s41419-017-0045-0 |
| [19] |
MA Y, KONG L R, GE Q, et al. Complement 5a-mediated trophoblasts dysfunction is involved in the development of pre-eclampsia[J]. J Cell Mol Med, 2018, 22(2): 1034-1046. DOI:10.1111/jcmm.13466 |
| [20] |
NIU Z R, HAN T, SUN X L, et al. MicroRNA-30a-3p is overexpressed in the placentas of patients with preeclampsia and affects trophoblast invasion and apoptosis by its effects on IGF-1[J]. Am J Obstet Gynecol, 2018, 218(2): 249. DOI:10.1016/j.ajog.2017.11.568 |
| [21] |
GRANGER J P, SPRADLEY F T, BAKRANIA B A. The endothelin system: A critical player in the pathophysiology of preeclampsia[J]. Curr Hypertens Rep, 2018, 20(4): 32. DOI:10.1007/s11906-018-0828-4 |
| [22] |
AHMED A, REZAI H, BROADWAY-STRINGER S. Evidence-based revised view of the pathophysiology of preeclampsia[J]. Adv Exp Med Biol, 2017, 956: 355-374. DOI:10.1007/5584_2016_168 |
| [23] |
PAIVA P, SALAMONSEN L A, MANUELPILLAI U, et al. Interleukin 11 inhibits human trophoblast invasion indicating a likely role in the decidual restraint of trophoblast invasion during placentation[J]. Biol Reprod, 2009, 80(2): 302-310. DOI:10.1095/biolreprod.108.071415 |
| [24] |
CANIGGIA I, WINTER J, LYE S J, et al. Oxygen and placental development during the first trimester: implications for the pathophysiology of pre-eclampsia[J]. Placenta, 2000, 21: S25-S30. DOI:10.1053/plac.1999.0522 |
| [25] |
ZOU Y F, JIANG Z Y, YU X, et al. Upregulation of long noncoding RNA SPRY4-IT1 modulates proliferation, migration, apoptosis, and network formation in trophoblast cells HTR-8SV/neo[J]. PLoS ONE, 2013, 8(11): e79598. DOI:10.1371/journal.pone.0079598 |
| [26] |
KOKKINOS M I, MURTHI P, WAFAI R, et al. Cadherins in the human placenta-epithelial-mesenchymal transition (EMT) and placental development[J]. Placenta, 2010, 31(9): 747-755. DOI:10.1016/j.placenta.2010.06.017 |
| [27] |
CHELOUFI S, DOS SANTOS C O, CHONG M M W, et al. A dicer-independent miRNA biogenesis pathway that requires ago catalysis[J]. Nature, 2010, 465(7298): 584-589. DOI:10.1038/nature09092 |
| [28] |
HROMADNIKOVA I, DVORAKOVA L, KOTLABOVA K, et al. Circulating heat shock protein mRNA profile in gestational hypertension, pre-eclampsia & foetal growth restriction[J]. Indian J Med Res, 2016, 144(2): 229-237. DOI:10.4103/0971-5916.195037 |
| [29] |
LI D D, HE C J, WANG J F, et al. MicroRNA-138 inhibits cell growth, invasion, and EMT of non-small cell lung cancer via SOX4/p53 feedback loop[J]. Oncol Res, 2018, 26(3): 385-400. DOI:10.3727/096504017x14973124850905 |
| [30] |
ZHAO L, YU H B, YI S J, et al. The tumor suppressor miR-138-5p targets PD-L1 in colorectal cancer[J]. Oncotarget, 2016, 7(29): 45370-45384. DOI:10.18632/oncotarget.9659 |
| [31] |
LIZ J, ESTELLER M. lncRNAs and microRNAs with a role in cancer development[J]. Biochim et Biophys Acta, 2016, 1859(1): 169-176. DOI:10.1016/j.bbagrm.2015.06.015 |
| [32] |
TAN Y, XIAO D, XU Y B, et al. Long non-coding RNA DLX6-AS1 is upregulated in preeclampsia and modulates migration and invasion of trophoblasts through the miR-376c/GADD45A axis[J]. Exp Cell Res, 2018, 370(2): 718-724. DOI:10.1016/j.yexcr.2018.07.039 |
| [33] |
LI L J, WANG M Y, MEI Z J, et al. lncRNAs HIF1A-AS2 facilitates the up-regulation of HIF-1α by sponging to miR-153-3p, whereby promoting angiogenesis in HUVECs in hypoxia[J]. Biomed Pharmacother, 2017, 96: 165-172. DOI:10.1016/j.biopha.2017.09.113 |
| [34] |
WU R Y, RUAN J H, SUN Y J, et al. Long non-coding RNA HIF1A-AS2 facilitates adipose-derived stem cells (ASCs) osteogenic differentiation through miR-665/IL6 axis via PI3K/Akt signaling pathway[J]. Stem Cell Res Ther, 2018, 9(1): 1-13. DOI:10.1186/s13287-018-1082-z |



