急性髓系白血病(acute myeloid leukemia,AML)是一种异质性很强的造血系统恶性肿瘤,其特征是造血干祖细胞不受控制增殖和骨髓成熟障碍。它的发病与造血干祖细胞基因突变密切相关[1]。FAB分型将急性髓系白血病按细胞形态学分为M0~M7,而WHO对急性髓系白血病的分类主要以细胞遗传学及分子生物学的异常为基础[2]。亲嗜性病毒整合位点1(ecotropic virus integration site 1,EVI1)基因位于染色体3q26上,能编码一种与DNA结合的锌指蛋白,其过表达与人类造血系统疾病密切相关。据报道,EVI-1的异常表达发生在8%~10%的成人AML中,在儿童MLL基因重排白血病中比例增至27%[3]。在儿童和年轻患者中,有10%~25%的原发性AML和约50%的继发性AML出现了EVI1的高表达,且多个研究发现EVI1过度表达的AML患者预后不良[4-6],单纯化疗的患者复发率较高[7-8],且在2019年的NCCN指南已将其纳入危险度分层[9]。
本研究收集2016年1月至2020年5月本院确诊AML伴EVI1基因阳性的7例患者,结合患者的病史、年龄、性别、初诊时白细胞计数、骨髓原始细胞、免疫分型、细胞遗传学、分子生物学及治疗过程中EVI1基因的表达等情况,回顾性分析EVI1 基因阳性患者基本临床特征、缓解情况、治疗效果及异基因造血干细胞移植对其预后的影响等。
1 资料与方法 1.1 研究对象纳入我院2016年1月至2020年5月确诊为AML且EVI1基因检测为阳性的7例患者,根据FAB分型标准,分别为AML-M2 1例,AML-M4 2例,AML-M5 3例,AML-M7 1例。收集患者初诊时的年龄、性别、血常规、肝肾功、骨髓原始细胞比例、免疫分型、染色体核型及是否出现其他融合基因或突变基因等资料。纳入标准:按WHO 2008标准确诊为急性髓系白血病(非M3型),年龄<60岁,心功能正常,肝、肾功能:血胆红素≤35 μmol/L,AST/ALT在正常值上限2倍以下,血肌肝≤150 μmol/L,ECOG评分0~2级。排除标准:确诊为AML-M3型患者;合并其他恶性肿瘤;活动性结核,HIV阳性;妊娠或哺乳期的妇女。
1.2 EVI1基因检测采用巢式PCR方法检测EVI1基因表达水平。从患者骨髓中的单核细胞中分离纯化RNA,然后逆转录获得cDNA,用特异性PCR引物和探针检测EVI1基因表达。EVI1 引物序列:上游 5′-CCCATGTGCCAGAGGAACTT-3′;下游5′-CAGTGACAGCATCATAGCATATGC-3′;探针5′-FAM-CAGCCGTTACACAGAAAGTCCAAATCGCTAMRA-3′[10]。
目前关于异常EVI1表达量异常的cutoff没有统一的标准。在AML患者中EVI1表达公认的cutoff值仍待确定[7]。本研究参考目前较常用的阈值,以目标转录本/ABL转录本的百分比计算EVI1的转录水平。ABL作为一个对照基因,其相应的引物和探针均基于欧洲抗癌计划的报告。根据研究报道,正常人的表达上限为8%,在AML患者中,≥1.0%为高表达,<1.0%为低表达[3-10]。
1.3 实验室检查治疗前需完善血常规、生化、骨髓细胞形态学、骨髓免疫分型、分子生物学、细胞遗传学等辅助检查。
采用瑞氏染色法对骨髓中的各种细胞形态进行染色,结合细胞化学染色进行FAB 分型。
骨髓免疫分型:用荧光标记的单克隆抗体与细胞表面抗原作用,通过流式细胞仪检测,测定细胞散射光和激发的荧光,通过对细胞表面抗原进行多参数分析,可对细胞进行免疫分型。采样细胞仪检测104个细胞各系免疫表型,利用CD45/SSC设门。初诊急性白血病所用单抗:HLA-DR、CD117、CD34、CD38、CD7、CD15、CD13、CD33、CD16等。
细胞遗传学检查:取骨髓4~5 mL,采用24 h短期培养制备染色体,采用G显带技术分析核型。根据《人类细胞遗传学国际命名体制(ISCN1995)》描述核型[11]。
分子生物学检查:治疗前取骨髓4~8mL,采用多重巢式RT-PCR方法筛选白血病41种融合基因:BCR-ABL、AML1-ETO、MLL-AF4、MLL-AF9、MLL-AF6、MLL-AF10、MLL-ELL、MLL-ENL、WT1等。
AML预后相关基因突变:采用二代测序技术检测ASXL1、DNMT3A、FLT3、RUNX1、TET2、TP53、CEBPA、NPM1、MLL、NRAS、IDH2等。
1.4 治疗方案7例患者在确诊后均给予标准诱导及强化治疗,其中5例在缓解状态行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT),1例在治疗过程中复发后行抢救性移植。诱导及巩固化疗方案见表 1。。
| 病例 | 化疗方案 | 第1疗程诱导治疗后疾病状态 |
| 1 | DA+HA+MA+IA | CR,MRD(-) |
| 2 | DA+MA+MA+IA+IA | CR,MRD(-) |
| 3 | DAE+EA+IA+HD-Ara-C+CIAD+DAC+HAG | CR,MRD(+) |
| 4 | DAE+DAE+HD-Ara-C+HD-Ara-C+EA | CR,MRD(-) |
| 5 | DAE+DAE+EA+IEA | CR,MRD(+) |
| 6 | MA+MA+MA+MA | CR,MRD(-) |
| 7 | DAE+EA+IA+HIA+CDA+PLD+Ara-C+DAC+EA | CR,MRD(-) |
| CR:完全缓解;MRD:微小残留病;DA:柔红霉素+阿糖胞苷;HA:高三尖杉酯碱+阿糖胞苷;MA:米托蒽醌+阿糖胞苷;I:伊达比星;HD-Ara-C:大剂量阿糖胞苷;E:依托泊苷;DAC:地西他滨;C/CDA:克拉屈滨;G:重组人粒细胞刺激因子;PLD:多柔比星脂质体 | ||
1.5 疗效评判
按《血液病诊断及疗效标准》第3版进行评价[12]。完全缓解(complete remission, CR)定义为骨髓增生程度为活跃或明显活跃,骨髓中原始细胞<5%,MRD阴性为<10-4。复发(relapse,RE)是指达到完全缓解后,骨髓中白血病细胞再次≥20%。
1.6 随访随访时间截至2020年5月31日,死亡病例随访至死亡日。通过门诊或电话联系的方式进行随访。
1.7 统计学分析应用SPSS 19.0统计软件分析,非正态分布的定量资料以中位数表示,计量资料以x±s表示,计数资料以例数表示,不同时间点的EVI1表达量比较采用配对t检验,P<0.05表示差异有统计学意义
2 结果 2.1 患者临床资料收集到EVI1阳性AML患者7例,其中男性1例,女性6例,中位年龄8(3~49)岁,AML-M2 1例,AML-M4 2例,AML-M5 3例,AML-M7 1例,按2019年的NCCN指南进行危险度分层,患者均为高危。初诊时 临床表现无特异性,白细胞计数(29.10±45.99)×109/L,血红蛋白(81.42±14.07)g/L,血小板计数(24.0± 5.13)×109/L,骨髓原始细胞百分比(62.78±20.94)%,其中MDS转化1例,1例在发病前有神经母细胞瘤的病史,存在染色体异常的有3例。7例患者基本资料见表 2。
| 病例 | 性别 | 年龄/岁 | FAB分型 | 危险度分层 | 病态造血 | 染色体核型 | AML相关融合基因 |
| 1 | 女 | 3 | AML-M5 | 高危 | 无 | 46, XX, t(9;11)(p22;q23) | MLL-AF9+ |
| 2 | 女 | 49 | AML-M2 | 高危 | 无 | 正常核型 | - |
| 3 | 女 | 10 | AML-M4 | 高危 | 无 | 正常核型 | - |
| 4 | 男 | 6 | AML-M5 | 高危 | 有 | 47, XY, +9, der(9;17)(q10;q10)19/46, XY1 | - |
| 5 | 女 | 3 | AML-M7 | 高危 | 无 | 47, XX, t(9;11)(p22;q23), +1918/46, XX2 | MLL-AF9+ |
| 6 | 女 | 15 | AML-M5 | 高危 | 无 | 正常核型 | SET/CAN+ |
| 7 | 女 | 8 | AML-M4 | 高危 | 无 | 正常核型 | - |
| 病例 | 突变基因 | WBC(×109/L) | 骨髓原始细胞 | 是否移植 | 移植前疗效 | 存活时间/月 | 结局 |
| 1 | NOTCH1+ATRX+ | 37.68 | 87.3% | 是 | CR | 29 | 存活 |
| 2 | ASXL1+ | 3.99 | 59.5% | 是 | CR | 41 | 存活 |
| 3 | - | 6.84 | 80.0% | 是 | NR | 21 | 存活 |
| 4 | DNMT3A+ASXL1+NF1+ | 5.21 | 28.7% | 是 | CR | 57 | 存活 |
| 5 | - | 10.75 | 46.0% | 是 | CR | 66 | 存活 |
| 6 | - | 1.00 | 86.5% | 是 | CR | 24 | 存活 |
| 7 | NRAS+IDH2+ | 138.25 | 50.0% | 否 | NR | 10 | 死亡 |
| CR:完全缓解;NR:未缓解 | |||||||
2.2 血象及骨髓形态学检查
7例患者中1例初诊时为高白细胞(138.25×109/L),1例患者为MDS转化,病态造血以粒系为主。FAB分型M2 1例,M4 2例,M5 3例,M7 1例。
2.3 骨髓免疫分型7例患者骨髓免疫分型均表达HLA-DR、CD117、CD33等髓系标志,5例表达CD34,4例表达CD13,3例表达CD14,3例表达CD15,3例表达CD64,3例表达cMPO,1例表达CD123,另外有4例表达T淋巴标志CD7,2例表达B淋巴标志CD19等。
2.4 细胞遗传学及分子生物学检查7例患者中有4例为正常核型,3例染色体异常的患者均涉及9号染色体异位,其中1例患者为der(9;17)(q10;q10),未出现除EVI1以外的其他融合基因的阳性,其余2例患者为t(9;11)(p22;q23),均为MLL/AF9+。按照NCCN危险度分层,7例患者均为高危。
2.5 EVI1基因的表达分别于初诊时,首次达骨髓细胞学完全缓解(首次CR)时,移植前,移植后3、6、12个月,复发时,采集患者骨髓,以ABL基因为参照,通过RT-PCR定量检测EVI1基因表达量。7例患者在初诊时、首次CR时EVI1均高表达,6例行异基因造血干细胞移植的患者在移植前EVI1也高表达,但移植前的表达水平较初诊时下降,差异有统计学意义(P<0.05)。行异基因造血干细胞移植的6例患者,1例在随访截止时间未到移植后12个月,5例患者在移植后12个月EVI1仍为高表达,但EVI1的表达程度较初诊时明显下降,差异有统计学意义(P<0.05,图 1)。
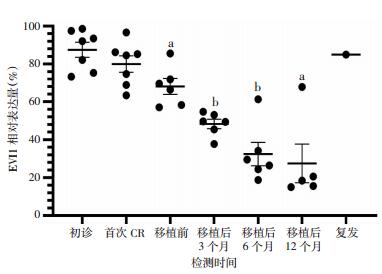
|
| a:P<0.05,b:P<0.01,与初诊比较 图 1 7例患者不同时间点的EVI1表达量 |
2.6 疗效与转归
随访至2020年5月31日,7例患者均在第1疗程诱导化疗后达到骨髓形态学完全缓解,其中5例患者MRD阴性。7例患者中2例患者在定期化疗过程中出现疾病复发,再诱导不能达到完全缓解,其中1例于确诊后10个月死亡。另1例患者行抢救性移植后骨髓形态学达到CR,MRD阴性,至随访截止时间,为移植后10个月余,疾病未复发。余5例患者在行异基因造血干细胞移植前骨髓形态学均达到CR,MRD阴性,移植后骨髓形态学持续缓解,MRD持续阴性,至随访截止时间,6例患者骨髓持续缓解。
3 讨论急性髓系白血病(AML)是一种血液学恶性疾病,预后差,随着细胞遗传学和分子生物学研究的深入,对明确AML的分子机制和完善预后分层,进而提高AML患者的生存率起到了重要的作用。但仍有很多分子标记的确切意义存在一些争议。EVI1被认为是人类白血病中具有侵袭性的原癌基因之一,编码造血干细胞增殖所必需的转录因子,并参与了白血病细胞的分化、凋亡和增殖。有文献报道,EVI1的高表达是AML患者独立的预后不良的因素。在敲除EVI1的白血病模型中,EVI1的缺失会减弱几种白血病细胞的增殖活性。近年来有许多研究评估了EVI1高表达对AML患者预后的影响,2019年的NCCN指南已将EVI1基因纳入危险度分层的高危组[9.13, 17]。
EVI1的异常表达在AML、CML、MDS等骨髓造血系统恶性肿瘤中很常见[18-19 ],临床上约有4.5%的AML患者存在3q重排,其中50%涉及3q26,而典型的inv(3)(q21;q26.2)/t(3;3)(q21;q26.2)突变出现在2.0%~2.5%的AML中[20]。EVI1在几乎所有的inv(3)/t(3;3)AML中都有异常表达[5],而在其他一些没有3q异常或正常核型的成人和儿童AML(AML-NK,acute myeloid leukemia with normal karyotype)中也可能过度表达[21]。涉及染色体3q的异常在儿童AML中很少见,而EVI1基因在约27%的儿童AML中有过度表达。因此认为,EVI1的异常表达可能独立于3q26的改变而驱动AML的侵袭性,这可能与少部分AML-NK患者中存在隐匿的3q26重排有关[22-23]。本研究中有4例患者为正常核型,而3例染色体核型异常的患者均无3号染色体的改变。
EVI1高表达与11q23重排AML密切相关。有报道EVI1在涉及11q23重排的儿童及成人AML中均有高表达[4-24]。以往有观点认为,EVI1是造血干细胞中MLL癌蛋白的转录靶点,同样,MLL-AF9癌蛋白在造血干细胞中维持EVI1表达[3-25]。t(9;11)(p22;q23)易位导致MLL-AF9融合基因阳性和急性单核细胞白血病的发生,这与白血病髓外浸润、频繁复发和生存率低有关[26-27]。因此可以认为,EVI1过表达与MLL癌蛋白之间的相互影响可以促进白血病转化,且这两种异常在AML中常同时出现[28, 29]。国外有研究发现,EVI1主要在伴有MLL重排的儿童AML-M4和M5亚型中高表达,并与预后相关。在M7亚型也有EVI1的高表达,但与其预后关系不大[24]。国内也有报道,在所有AML中,M5中出现MLL重排的发生率最高,且11q23/MLL重排急性白血病患者中EVI1基因高表达的发生率高[30-31]。同样,本研究发现,7例患者中,有5例患者为M4或M5型,2例患者出现t(9;11)(p22;q23)及MLL-AF9+,与国内外的报道相一致,提示EVI1高表达的AML可能存在更明显的单核分化倾向。结合以往的研究报道及本研究的观察结果,可以认为EVI1过度表达与11q23异常存在相关性。
以往有观点认为,EVI1的表达水平不能敏感的监测骨髓MRD[32]。本研究中,死亡的1例患者在首次诱导缓解及MRD阴性后,EVI1仍高表达,且复发时EVI1的表达与首次缓解后的EVI1表达水平相似,低于初诊时的表达。另1例在治疗过程中复发行抢救性移植的患者在移植前的治疗过程中EVI1持续高表达,移植后EVI1较移植前明显降低(P<0.01),但到随访截止时间未转阴。有5例患者经正规化疗后在移植前,EVI1的表达水平仍较高,但低于初诊时的表达,在移植后明显降低,但仍未转阴(P<0.01)。提示EVI1的表达水平与骨髓MRD的水平不同步,与以往的观点相一致。
研究发现,EVI1阳性的AML患者的CR率较EVI1阴性的患者无明显下降,但更易复发,异基因造血干细胞移植可以改善EVI1高表达患者的预后[7-8, 10, 29, 33]。本研究中7例患者经正规诱导1个疗程后,骨髓形态学均达到完全缓解,5例MRD转阴。但2例在正规化疗过程中复发,再诱导不能达到完全缓解。6例患者行异基因造血干细胞移植,其中5例在CR1行移植,1例行抢救性移植,未行移植的复发患者于确诊后10个月死亡。到随访截止时间,6例接受异基因造血干细胞移植的患者均持续缓解,其中5例患者存活时间均已超过2年。因本研究无对照组,结合既往国内外的研究结果可以认为EVI1阳性的AML患者CR率较EVI1阴性患者无降低,异基因造血干细胞移植可以改善患者的预后。
此外,本研究还观察到,7例患者中位年龄为8岁,除1例患者为49岁,其他均为15岁以下的青少年及儿童,提示EVI1基因的过度表达更易出现在年龄更小的急性髓系白血病患者中。从现有的研究结果发现,EVI1基因很少与预后良好的遗传标记同时出现。而我们的研究结果显示,7例患者中均未见RUNX1-RUNX1T1 [AML1-ETO;t(8;21)]、PML-RARA t(15;17) CEBPA双突变FLT3野生型等预后良好的标记。
EVI1是一个较大的MDS1-EVI1复杂基因座(MECOM)的一部分,MECOM产生几个交替剪接的转录本,编码至少3种不同的蛋白质:全长EVI1(145kDa)、EVI1-△324和MDS1-EVI1。目前最为广泛研究的亚型是EVI1全长蛋白,很少有研究区分其他EVI1亚型的表达和功能意义。有研究证实了EVI1和MDS1-EVI1蛋白具有相反作用:EVI1全长蛋白增强了造血干祖细胞的增殖能力,而MDS1-EVI1抑制了造血集落的形成[34]。在未来的工作中有无必要区分检测几种亚型值得继续探讨。
综上所述,对所有初诊的急性髓系白血病患者进行全面的融合基因及突变基因的检测是非常重要的。建议对EVI1阳性的患者,有移植条件的尽可能在CR1期行异基因造血干细胞移植,可显著改善这类患者的预后。限于本研究病例数较少,后续还需要做进一步观察。
| [1] |
DÖHNER H, ESTEY E H, AMADORI S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European Leukemia Net[J]. Blood, 2010, 115(3): 453-474. DOI:10.1182/blood-2009-07-235358 |
| [2] |
ARBER D A, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391-2405. DOI:10.1182/blood-2016-03-643544 |
| [3] |
BINDELS E M, HAVERMANS M, LUGTHART S, et al. EVI1 is critical for the pathogenesis of a subset of MLL-AF9-rearranged AMLs[J]. Blood, 2012, 119(24): 5838-5849. DOI:10.1182/blood-2011-11-393827 |
| [4] |
BALGOBIND B V, LUGTHART S, HOLLINK I H, et al. EVI1 overexpression in distinct subtypes of pediatric acute myeloid leukemia[J]. Leukemia, 2010, 24(5): 942-949. DOI:10.1038/leu.2010.47 |
| [5] |
BARJESTEH VAN WAALWIJK VAN DOORN-KHOSROVANI S, ERPELINCK C, VAN PUTTEN W L, et al. High EVI1 expression predicts poor survival in acute myeloid leukemia: a study of 319 de novo AML patients[J]. Blood, 2003, 101(3): 837-845. DOI:10.1182/blood-2002-05-1459 |
| [6] |
LUGTHART S, VAN DRUNEN E, VAN NORDEN Y, et al. High EVI1 levels predict adverse outcome in acute myeloid leukemia: prevalence of EVI1 overexpression and chromosome 3q26 abnormalities underestimated[J]. Blood, 2008, 111(8): 4329-4337. DOI:10.1182/blood-2007-10-119230 |
| [7] |
MARJANOVIC I, KARAN-DJURASEVIC T, KOSTIC T, et al. Expression pattern and prognostic significance of EVI1 gene in adult acute myeloid leukemia patients with normal karyotype[J]. Indian J Hematol Blood Transfus, 2020, 36(2): 292-299. DOI:10.1007/s12288-019-01227-1 |
| [8] |
HE X F, WANG Q R, CEN J N, et al. Predictive value of high EVI1 expression in AML patients undergoing myeloablative allogeneic hematopoietic stem cell transplantation in first CR[J]. Bone Marrow Transplant, 2016, 51(7): 921-927. DOI:10.1038/bmt.2016.71 |
| [9] |
TALLMAN M S, WANG E S, ALTMAN J K, et al. Acute myeloid leukemia, Version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(6): 721-749. DOI:10.6004/jnccn.2019.0028 |
| [10] |
QIN Y Z, ZHAO T, ZHU H H, et al. High EVI1 expression predicts poor outcomes in adult acute myeloid leukemia patients with intermediate cytogenetic risk receiving chemotherapy[J]. Med Sci Monit, 2018, 24: 758-767. DOI:10.12659/msm.905903 |
| [11] |
MITELMAN F. ISCN 1995: An international system for human cytogenetic nomenclature[M]. Basel: Karger Medical and Scientific Publishers, 1995: 1-114.
|
| [12] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 2008: 106-115. ZHANG Z N, SHEN T. Criteria for diagnosis and treatment of hematological diseases[M]. 3rd. Beijing: Science Press, 2008. |
| [13] |
ZHU Y M, WANG P P, HUANG J Y, et al. Gene mutational pattern and expression level in 560 acute myeloid leukemia patients and their clinical relevance[J]. J Transl Med, 2017, 15: 178. DOI:10.1186/s12967-017-1279-4 |
| [14] |
YAMATO G, YAMAGUCHI H, HANDA H, et al. Clinical features and prognostic impact of PRDM16 expression in adult acute myeloid leukemia[J]. Gene Chromosome Cancer, 2017, 56(11): 800-809. DOI:10.1002/gcc.22483 |
| [15] |
GOYAMA S, YAMAMOTO G, SHIMABE M, et al. Evi-1 is a critical regulator for hematopoietic stem cells and transformed leukemic cells[J]. Cell Stem Cell, 2008, 3(2): 207-220. DOI:10.1016/j.stem.2008.06.002 |
| [16] |
WU X, WANG H F, DENG J L, et al. Prognostic significance of the EVI1 gene expression in patients with acute myeloid leukemia: a meta-analysis[J]. Ann Hematol, 2019, 98(11): 2485-2496. DOI:10.1007/s00277-019-03774-z |
| [17] |
NUCIFORA G, LARICCHIA-ROBBIO L, SENYUK V. EVI1 and hematopoietic disorders: history and perspectives[J]. Gene, 2006, 368: 1-11. DOI:10.1016/j.gene.2005.09.020 |
| [18] |
JOHANSSON B, FIORETOS T, MITELMAN F. Cytogenetic and molecular genetic evolution of chronic myeloid leukemia[J]. Acta Haematol, 2002, 107(2): 76-94. DOI:10.1159/000046636 |
| [19] |
HU Z H, HU S M, JI C S, et al. 3q26/EVI1 rearrangement in myelodysplastic/myeloproliferative neoplasms: an early event associated with a poor prognosis[J]. Leuk Res, 2018, 65: 25-28. DOI:10.1016/j.leukres.2017.12.004 |
| [20] |
LUGTHART S, GRÖSCHEL S, BEVERLOO H B, et al. Clinical, molecular, and prognostic significance of WHO type inv(3)(q21q26.2)/t(3;3)(q21;q26.2) and various other 3q abnormalities in acute myeloid leukemia[J]. J Clin Onco, 2010, 28(4): 3890-3898. DOI:10.1200/jco.2010.29.2771 |
| [21] |
LANGABEER S E, ROGERS J R, HARRISON G, et al. EVI1 expression in acute myeloid leukaemia[J]. Br J Haematol, 2001, 112(1): 208-211. DOI:10.1046/j.1365-2141.2001.02569.x |
| [22] |
STAVROPOULOU V, KASPAR S, BRAULT L, et al. MLL-AF9 expression in hematopoietic stem cells drives a highly invasive AML expressing EMT-related genes linked to poor outcome[J]. Cancer Cell, 2016, 30(1): 43-58. DOI:10.1016/j.ccell.2016.05.011 |
| [23] |
GLASS C, WILSON M, GONZALEZ R, et al. The role of EVI1 in myeloid malignancies[J]. Blood Cells Mol Dis, 2014, 53(1/2): 67-76. DOI:10.1016/j.bcmd.2014.01.002 |
| [24] |
JO A, MITANI S, SHIBA N, et al. High expression of EVI1 and MEL1 is a compelling poor prognostic marker of pediatric AML[J]. Leukemia, 2015, 29(5): 1076-1083. DOI:10.1038/leu.2015.5 |
| [25] |
ARAI S, YOSHIMI A, SHIMABE M, et al. Evi-1 is a transcriptional target of mixed-lineage leukemia oncoproteins in hematopoietic stem cells[J]. Blood, 2011, 117(23): 6304-6314. DOI:10.1182/blood-2009-07-234310 |
| [26] |
MEYER C, HOFMANN J, BURMEISTER T, et al. The MLL recombinome of acute leukemias in 2013[J]. Leukemia, 2013, 27(11): 2165-2176. DOI:10.1038/leu.2013.135 |
| [27] |
TAMAI H, INOKUCHI K. 11q23/MLL acute leukemia: update of clinical aspects[J]. J Clin Exp Hematopathol, 2010, 50(2): 91-98. DOI:10.3960/jslrt.50.91 |
| [28] |
HO P A, ALONZO T A, GERBING R B, et al. High EVI1 expression is associated with MLL rearrangements and predicts decreased survival in paediatric acute myeloid leukaemia: a report from the children’s oncology group[J]. Br J Haematol, 2013, 162(5): 670-677. DOI:10.1111/bjh.12444 |
| [29] |
GRÖSCHEL S, LUGTHART S, SCHLENK R F, et al. High EVI1 Expression predicts outcome in younger adult patients with acute myeloid leukemia and is associated with distinct cytogenetic abnormalities[J]. J Clin Oncol, 2010, 28(12): 2101-2107. DOI:10.1200/jco.2009.26.0646 |
| [30] |
YANG H, CAO T T, GAO L, et al. The incidence and distribution characteristics of MLL rearrangements in Chinese acute myeloid leukemia patients by multiplex nested RT-PCR[J]. Technol Heal Care, 2017, 25(S1): 259-265. DOI:10.3233/THC-171329 |
| [31] |
公艳蕾, 张静人, 张俊, 等. 47例MLL重排急性白血病患者EVI1和BRE基因表达及其临床意义[J]. 中华血液学杂志, 2017, 38(1): 22-27. GONG Y L, ZHANG J R, ZHANG J, et al. Clinical significance of expressions of EVI1 and BRE genes in 47 acute leukemia patients with MLL rearrangement[J]. Chin J Hematol, 2017, 38(1): 22-27. DOI:10.3760/cma.j.issn.0253-2727.2017.01.005 |
| [32] |
SMOL T, NIBOUREL O, MARCEAU-RENAUT A, et al. Quantification of EVI1 transcript levels in acute myeloid leukemia by RT-qPCR analysis: a study by the ALFA Group[J]. Leuk Res, 2015, 39(12): 1443-1447. DOI:10.1016/j.leukres.2015.09.021 |
| [33] |
何雪峰, 王琴荣, 岑建农, 等. 447例急性髓系白血病患者EVI1基因表达、临床和细胞遗传学特征研究[J]. 中华血液学杂志, 2016, 37(11): 936-941. HE X F, WANG Q R, CEN J N, et al. EVI1 expression, clinical and cytogenetical characteristics in 447 patients with acute myeloid leukemia[J]. Chin J Hematol, 2016, 37(11): 936-941. DOI:10.3760/cma.j.issn.0253-2727.2016.11.002 |
| [34] |
MAICAS M, VZQUEZ I, ALIS R, et al. The MDS and EVI1 complex locus (MECOM) isoforms regulate their own transcription and have different roles in the transformation of hematopoietic stem and progenitor cells[J]. Biochim Biophys Acta Gene Regul Mech, 2017, 1860(6): 721-729. DOI:10.1016/j.bbagrm.2017.03.007. |



