2. 510062 广州,南部战区空军医院血管内科;
3. 410000 长沙,长沙血液中心;
4. 410007 长沙,湖南省儿童医院儿科医学研究所
2. Department of Cardiovascular Diseases, Airforce Hospital of Southern Theater Command, Guangzhou, Guangdong Province, 510062;
3. Changsha Blood Center, Changsha, Hunan Province, 410000;
4. Hunan Children's Research Institute, Hunan Provincial Children's Hospital, Changsha, Hunan Province, 410007, China
骨肉瘤(osteosarcoma, OS)是青少年和儿童原发恶性骨肿瘤中发病率最高的肿瘤[1]。骨肉瘤在疾病的早期便很容易发生早期转移,转移和复发是骨肉瘤预后不良和生存率低的主要原因[2]。目前其总体5年生存率约为70%[3],外科手术和化疗是骨肉瘤的主要治疗方法[4]。通过完全手术切除和药物化疗相结合,高达70%的骨肉瘤和局限性四肢肿瘤患者可以成为长期幸存者[5]。然而,约20%的骨肉瘤患者会发生复发和远处转移[6],且转移性或复发性骨肉瘤的患者通常对化疗无反应,导致5年生存率仅有20% [7]。这表明骨肉瘤的异质性需要进行进一步的机制研究。
免疫逃逸是肿瘤转移的关键步骤。在小鼠模型中,细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymp-hocyte-associated protein 4, CTLA-4)和程序性死亡配体1(programmed death-ligand 1, PD-L1)的联合阻断可阻止免疫逃逸并可以完全抑制骨肉瘤的转移[8]。然而,免疫疗法在临床试验中的一致性反应仍然较差,这表明了进一步研究骨肉瘤中恶性肿瘤的生物学、异质性和肿瘤微环境的必要性[9]。
几乎所有生命都存在昼夜节律。如BMAL1、RORα、PER1、PER2、CRY1、CRY2和CLOCK等节律基因,可控制细胞内昼夜节律的振荡。越来越多的研究证实,昼夜节律紊乱可导致各种人类失调和疾病,例如失眠、肥胖、精神疾病、心血管疾病、糖尿病、肿瘤等[10-11]。许多研究表明轮班工作造成的身体节律紊乱会增加患乳腺癌、前列腺癌、子宫内膜癌和结肠癌等癌症的风险[12]。因此,国际癌症研究机构将夜班工作列为癌症的独立危险因素。然而,昼夜节律在骨肉瘤中的作用和机制尚少见报道。
昼夜节律已经成为优化免疫反应的关键因素,由免疫细胞的内在节律性调节与外部环境之间的相互作用所介导。昼夜节律的破坏可以导致自然杀伤(natural killer, NK)细胞效应分子功能的降低。例如,在大鼠中,节律紊乱使得与NK细胞毒性相关的分子穿孔素和颗粒酶B以及干扰素-γ(interferon-γ,IFN-γ)的表达降低[13]。最近,有研究表明多种肿瘤中昼夜节律的核心基因与癌症之间的关系,发现昼夜节律的核心负调节因子(PER1、PER2、PER3、CRY1和CRY2)在许多肿瘤中表达均下调[14]。这些核心昼夜节律负调节分子的表达降低与癌症患者的预后和T细胞衰竭以及免疫抑制分子(包括PD-L1和CTLA-4)的整体上调显著相关[14]。然而,昼夜节律核心分子的表达与骨肉瘤患者的预后以及免疫应答之间的关系仍是未知的。因此,本研究分析了TARGET Data Matrix公共数据库(https://ocg.cancer.gov/programs/target/data-matrix)中85个骨肉瘤样本数据集之间核心节律分子的表达水平与骨肉瘤预后之间的关系,并从肿瘤细胞侵袭和免疫监视方面进一步探讨了相关的节律分子影响骨肉瘤预后的潜在机制。结果发现异位表达的BMAL1对骨肉瘤细胞系U2OS细胞的增殖、侵袭和克隆形成能力无显著影响。但异位表达BMAL1的U2OS细胞与外周血单个核淋巴细胞(peripheral blood mononuclear cell,PBMCs)共培养时,其被PBMCs直接杀伤的细胞明显增加,这表明BMAL1高表达可以增加免疫细胞对骨肉瘤细胞的免疫监视。
1 材料与方法 1.1 材料 1.1.1 细胞人骨肉瘤细胞系U2OS细胞购自中国科学院细胞库(中国上海)。U2OS细胞的培养条件为37 ℃和5% CO2的无菌环境中,DMEM培养基(含10% FBS、100 U/mL青霉素和100 μg/mL链霉素)。
1.1.2 试剂DMEM培养基、RPMI1640培养基、Opti-MEM和胎牛血清(FBS)购自Gibco公司(赛默飞,美国马萨诸塞州沃尔瑟姆)。CD3-PeCy7(25-0038- 42)和CD56-APC(9017-0567-120)抗体购自eBioscience公司(美国加利福尼亚州圣地亚哥)。抗CD107a-PE(555801)抗体购自BD Biosciences公司(美国加利福尼亚州圣地亚哥),Ficoll-Paque Plus购自GE公司(美国马萨诸塞州波士顿)。Calcein AM、Golgi stop和Golgi plug购自BD Bioscience公司(美国加利福尼亚州圣地亚哥)。Matrigel和Lipofectamine3000购自Invitrogen公司(美国加利福尼亚州卡尔斯巴德)。
1.2 方法 1.2.1 昼夜节律分子表达水平与骨肉瘤患者预后的相关性分析首先下载TARGET Data Matrix公共数据库(隶属于美国国立卫生研究院的权威数据库)中85例骨肉瘤样本的临床注释和基因表达数据,并使用Survminer和生存力分析R软件包(版本3.3.3)分析骨肉瘤生存率与核心昼夜节律分子表达水平之间的关联。使用Survminer软件包确定用于将患者分为低风险和高风险组的核心昼夜节律分子表达水平的最佳cut-off值。使用单变量Cox比例风险回归模型分析生存概率与BMAL1、ARNTL2、RORα、PER1、PER2、CRY1、CRY2、CLOCK、GPER1、NR1D1和NR1D2表达水平之间的关联。检验水准α=0.05[15]。
1.2.2 实时荧光定量PCR(qRT-PCR)使用TRIzol根据说明书从BMAL1或载体DNA转染的U2OS细胞中提取总RNA。使用Prime ScriptTM1st Strand cDNA Synthesis Kit(日本,宝生物)将2 μg总RNA反转录。使用TB Green Premix Ex Taq(日本,宝生物)和LightCycler-480(瑞士,罗氏)荧光定量PCR仪检测mRNA表达水平。将Actin mRNA设置为对照,引物序列如下:ACTIN正义链: 5′-GGCATGGGTCAGAAGGATT-3,反义链: 5′-TGGTGCCAGATTTTCTCCA-3′; BMAL1正义链: 5′-CCAAGAAAGTATGGACACAGACAAA-3′,反义链: 5′-GC- ATTCTTGATCCTTCCTTGGT-3′。
1.2.3 PBMCs的分离和培养通过Ficoll-Paque梯度离心(400×g,在室温下20 min)从健康捐献者白细胞中(中国湖南省长沙血液中心)新鲜分离出PBMCs。将分离的人PBMCs放在添加有10% FBS,50 U/mL青霉素和50 μg/mL链霉素的RPMI1640培养基中,并置于5% CO2中于37 ℃静息培养210 min。
1.2.4 细胞转染U2OS细胞接种后贴壁过夜,在其融合度达到70%时按照Lipofectamine3000说明书配制转染体系,质粒与转染试剂的比例为每100 ng质粒中加入0.15 μL lipo3000,0.2 μL P3000,于转染48 h后收取细胞经qPCR检测转染效率,并进行后续实验。
1.2.5 侵袭实验U2OS细胞内BMAL1或载体DNA转染48 h后,用胰蛋白酶-EDTA消化后收取细胞,使用侵袭小室(康宁,美国)进行基质胶侵袭能力检测。将Matrigel(200 μg/mL)加入上室,37 ℃包被2 h。然后,将100 μL用无血清DMEM重悬的2×105个U2OS细胞接种到上室中,而下腔室中则加入600 μL含15% FBS的DMEM。在37 ℃下孵育24 h后,用棉签擦拭小室上表面的未侵袭细胞,将小室下表面上的侵袭细胞固定并用吉姆萨染色。通过计数每孔5个显微镜视野下的细胞来确定细胞的侵袭性,侵袭程度表示为每个显微镜视野中的平均细胞数[16]。
1.2.6 平板克隆形成实验U2OS细胞内BMAL1或载体DNA转染48 h后,用胰蛋白酶-EDTA消化并收取细胞。将细胞以每孔500个细胞接种到6孔板中。2周后,将细胞固定并用吉姆萨染色。通过计数每孔的克隆数来确定克隆形成能力[16]。
1.2.7 通过Calcien AM素释放进行细胞毒性测定Calcien AM是一种活细胞荧光染料,可以标记活细胞而不损害细胞的正常功能。裂解标记的活细胞后,Calcien AM释放到细胞外[17]。通过检测培养基上清中Calcien AM的荧光强度,可以计算出细胞死亡的比例。BMAL1或载体DNA转染48 h后,将U2OS细胞(靶细胞)重悬在含有2% FBS的RPMI1640中,为1×106个/mL,并与1 μmol/L Calcein AM在避光条件下,37 ℃孵育30 min。将细胞洗涤2次后,重悬于RPMI1640完全培养基中。将100 μL靶细胞添加到96孔Ⅴ型平板中,按不同的效应细胞:靶细胞(E :T)比例加入PBMCs(效应细胞)。同时将终浓度为0.2%的Triton X-100裂解缓冲液添加到靶细胞中作为阳性对照,并设置阴性对照空。将96孔板150×g离心5 min,37 ℃的5% CO2中孵育4 h后,以500×g离心5 min,将75 μL上清液转移至平底的黑色96孔板中,并通过荧光酶标仪(PerkinElmer,美国)在490/515 nm处测量上清液的光密度值[D(490/515)]。使用下式计算细胞毒性:细胞毒性=(样品的荧光强度-自发荧光强度)/(阳性对照的荧光强度-自发荧光强度)×100%[17]。
1.2.8 流式细胞术分析T细胞和NK细胞中CD107a的表达CD107a是NK细胞和活化的CD8+ T细胞脱颗粒的标志物[18]。用BMAL1或载体DNA转染48 h后,收集U2OS细胞并在显微镜下计数。然后将细胞与新鲜分离的人PBMCs以10 :1和5 :1的比例共孵育,并在共培养开始时添加CD107a抗体、Golgi-stop和Golgi-plug。共培养6 h后,收集细胞,用CD3和CD56抗体标记,并使用BD FortessaⅡ(BD生物科学,美国)对CD107a表达进行流式细胞分析,每管收取10 000个细胞。将CD3+ CD56-细胞视为T细胞,而将CD3-CD56+细胞视为NK细胞。3次独立重复实验后,用FlowJo软件(10.0版)对数据进行了分析。
1.3 统计学分析采用Prism 8.01(美国加利福尼亚州拉荷亚的GraphPad Software Inc.)软件进行统计分析。Kaplan-Meier曲线用于评估BMAL1表达对总体存活率的影响,P值从对数秩检验获得。两组之间的统计学显著性差异通过单因素方差分析和非配对的t检验确定。检验水准α=0.05。
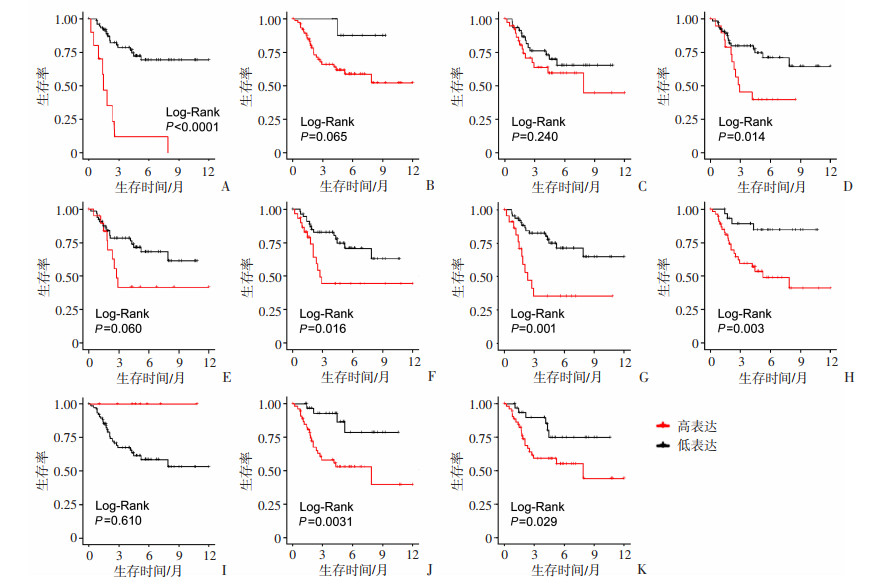
2 结果 2.1 BMAL1的表达水平与骨肉瘤患者预后的关系从TARGET数据公共数据库中下载了85例骨肉瘤样本的mRNA表达和生存率数据集。通过使用单变量Cox比例风险回归模型,分析BMAL1、ARNTL2、RORα、PER1、PER2、CRY1、CRY2、CLOCK、GPER1、NR1D1和NR1D2的表达水平与骨肉瘤患者生存率之间的关系。数据显示,高表达BMAL1(P < 0.000 1)、PER1(P=0.014)、CRY1(P=0.016)、CRY2(P=0.000 92)、CLOCK(P=0.003)、NR1D1(P=0.003 1)和NR1D2(P=0.029)基因的骨肉瘤患者生存率高于低表达这些基因的骨肉瘤患者(图 1)。表明节律基因可能是骨肉瘤的肿瘤抑制因子,其中BMAL1是差异最显著的基因。
|
|
A: BMAL1; B: ARNTL2; C: RORα; D: PER1; E: PER2; F: CRY1; G: CRY2; H: CLOCK; I: GPER1; J: NR1D1; K: NR1D2 红线和黑线分别代表具有高表达和低表达基因的患者 图 1 Kaplan-Meier生存分析骨肉瘤患者中节律分子表达水平与预后之间的关系 |
2.2 BMAL1过表达对骨肉瘤细胞系U2OS细胞侵袭和克隆形成能力的影响
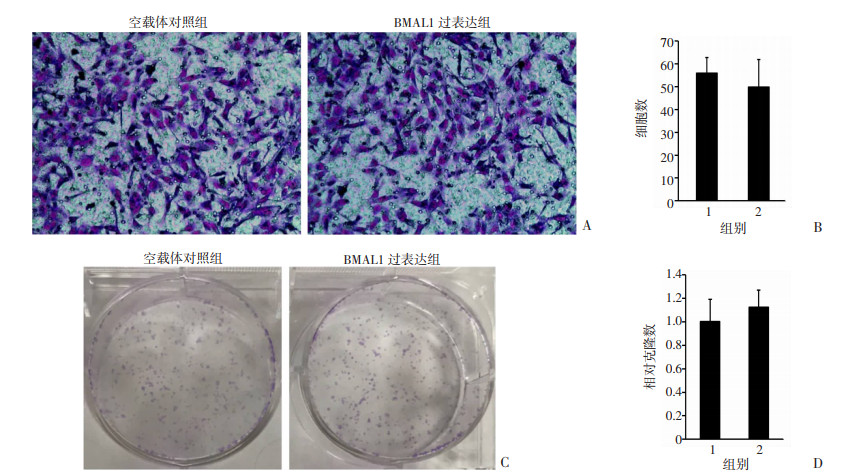
上述数据表明BMAL1 mRNA表达与骨肉瘤患者预后呈正相关,接下来探讨BMAL1在骨肉瘤细胞侵袭和转移中的直接作用。首先,通过侵袭试验和平板克隆形成试验分别检测了BMAL1过表达的U2OS细胞侵袭能力和克隆形成能力。与空载体DNA组相比,BMAL1过表达组U2OS细胞中BMAL1 mRNA显著增加了约400倍,但是BMAL1过表达组的U2OS细胞和空载体DNA对照组之间的侵袭能力差异无统计学意义[(55.93±6.92) vs (49.80±12.09),P=0.35,图 2A、B]。在平板克隆形成实验中,BMAL1过表达组和空载体对照组之间的克隆计数差异也无统计学意义[(1.00±0.19) vs (1.12±0.15),P=0.43,图 2C、D]。这些数据表明,节律分子BMAL1过表达并不影响骨肉瘤细胞的侵袭和克隆形成能力。
|
|
A~B:BMAL1对U2OS细胞侵袭能力的影响(×100)与统计分析结果;C~D:BMAL1对U2OS细胞克隆形成能力的影响与统计分析结果 1:空载体对照组;2:BMAL1过表达组 图 2 BMAL1对U2OS细胞侵袭和集落形成能力的影响 |
2.3 BMAL1过表达促进PBMCs对U2OS细胞的杀伤作用
为进一步探讨BMAL1 mRNA表达较高的骨肉瘤患者预后较好的可能机制,接下来从免疫识别和监视的角度探讨了骨肉瘤细胞中BMAL1表达是否会影响免疫细胞对U2OS细胞的直接杀伤能力。用Calcien AM标记并洗涤后,将BAML1过表达的细胞与具有不同比例的PBMCs共培养4 h。结果显示,与空载体对照组相比,BMAL1过表达组的U2OS细胞在效应细胞(PBMCs) :靶细胞(U2OS)(E :T)比例为5 :1时被PBMCs杀伤的比例显著增加[空载体对照组:(73.33±0.67) vs BAML1过表达组:(81.00±0.58),P=0.01];而E :T为10 :1亦是同样的趋势[空载体对照组:(76.67±0.33) vs BAML1过表达组:(82.67±1.86),P < 0.05,图 3]。

|
| a: P < 0.05, 与空载体对照组比较 图 3 BMAL1增强PBMCs对U2OS细胞的杀伤作用 |
2.4 PBMCs对BMAL1过表达的U2OS细胞杀伤增加不依赖T细胞和NK细胞的脱颗粒作用
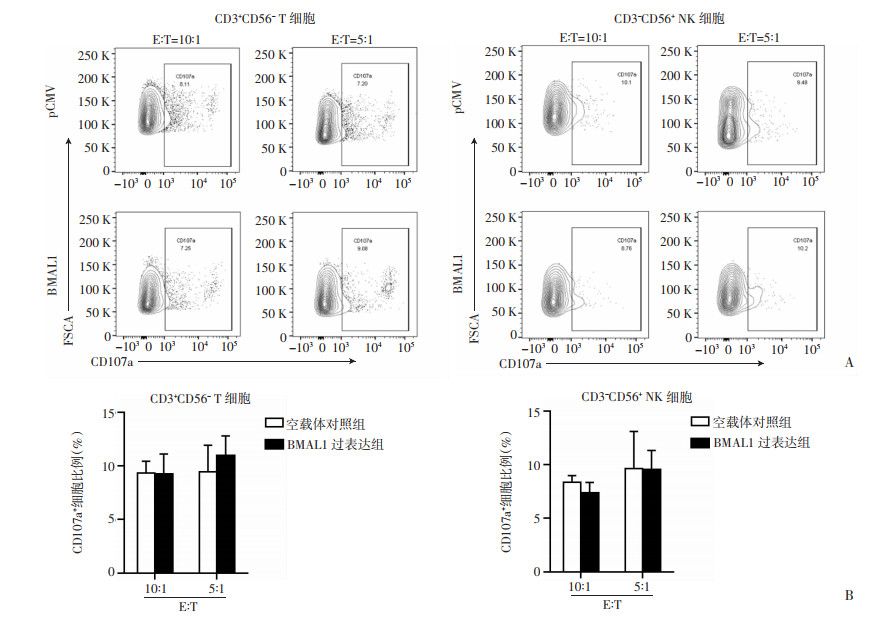
由于CD8+ T细胞和NK细胞是主要的免疫细胞亚群,对肿瘤细胞具有直接的细胞毒性作用。因此检测PBMCs与U2OS细胞共培养6 h后,PBMCs中T细胞和NK细胞脱颗粒水平(CD107a表达)。数据显示,与空载体对照组细胞相比,BAML1过表达组的U2OS细胞与PBMCs共培养6 h后,在E :T比为5 :1时,CD3+ CD56- T细胞和CD3-CD56+ NK细胞表面CD107a表达差异无统计学意义[CD3+ CD56-T细胞:空载体对照组(9.46±0.64) vs BMAL1组(10.93±1.08),P=0.46;CD3-CD56+ NK细胞:空载体对照组(9.63±2.00) vs BMAL1过表达组(9.51±1.05),P=0.96]。而E :T比为10 :1时,两种细胞表面CD107a表达差异也无统计学意义[CD3+ CD56-T细胞:空载体对照组(9.32±0.64) vs BMAL1过表达组(9.21±1.10),P=0.93;CD3-CD56+ NK细胞:空载体对照组(8.35±0.36) vs BMAL1过表达组(7.33±0.59),P=0.21,图 4]。结果显示T细胞和NK细胞脱颗粒不是增强过表达BMAL1的骨肉瘤细胞杀伤的主要原因。
|
| A~B:流式细胞术检测CD3+ CD56- T细胞和CD3- CD56+ NK细胞中CD107a +细胞比例和统计分析结果 图 4 BMAL1过表达的U2OS细胞不通过T细胞和NK细胞脱颗粒作用 |
3 讨论
昼夜节律紊乱已成为多种癌症发展的重要危险因素。GERY等[19]报道,肺癌和乳腺癌患者的PER1表达水平分别比正常组织低70%和46%。此外,在肝细胞癌和乳腺癌中有多个节律分子的表达降低(BMAL1、PER1、PER2、CRY1和RORα)[19]。本研究发现具有较高BMAL1、PER1、CRY1、CRY2、CLOCK、NR1D1和NR1D2表达水平的骨肉瘤患者表现出更好的生存率。进一步研究表明,BMAL1高表达改善了骨肉瘤细胞的重组和杀伤细胞对其直接细胞毒性。这可能是节律基因BMAL1高表达改善骨肉瘤患者生存的主要原因。
多项研究证实核心昼夜节律分子参与肿瘤的发展和治疗反应的临床证据。研究表明,与野生型小鼠相比,Per2基因敲除小鼠的唾液腺增生、淋巴瘤、血管肉瘤和畸胎瘤的发生率增加了。这可能是由于敲除Per2可以促进c-myc的表达,从而在细胞DNA受损的条件下促进细胞周期从G0期过渡到G1期,促进肿瘤发生[14]。节律分子BMAL1的过度表达抑制了结肠癌细胞的增殖和克隆形成[20]。然而,我们发现BMAL1的过表达并没有影响骨肉瘤细胞的侵袭和克隆形成,这表明不同的昼夜节律基因在各种肿瘤中的作用也不尽相同[21-22]。
免疫监视是一个复杂的生物学过程,是肿瘤细胞与特定效应细胞之间的动态平衡。肿瘤细胞可以通过表达免疫抑制性配体以逃避它们对免疫系统的识别和杀伤,还可通过分泌细胞因子以下调免疫激活表面标志物,从而抑制免疫系统对其免疫监视作用[13]。本研究发现U2OS细胞过表达BMAL1后增强了含有各种杀伤细胞的PBMC对其直接杀伤力。但是,当与BMAL1过表达的U2OS细胞共培养时,我们没有观察到PBMC中两个主要杀伤细胞亚群T细胞和NK细胞脱粒现象的增加。一方面这可能是因为T细胞和NK细胞可能使用其他方式杀伤骨肉瘤细胞。例如,细胞毒性T细胞和NK细胞使用CD95L或TNF相关的凋亡诱导配体(TRAIL)将其各自的死亡受体CD95/Fas和TRAIL-R1-R2结合在靶细胞表面,从而激活死亡受体活化诱导靶细胞凋亡[23]。另一方面,我们也不能排除其他类型免疫细胞的作用,如巨噬细胞等吞噬细胞对肿瘤细胞亦具有重要的杀伤作用。例如,PAHL等[24]报道巨噬细胞的极化可以抑制骨肉瘤的生长。
在肿瘤微环境中,免疫细胞昼夜节律分子的高表达是导致骨肉瘤患者生存率提高的重要原因。昼夜节律参与免疫系统的许多生理功能,昼夜节律的变化,例如时钟基因突变或时差反应,可能导致免疫系统疾病[25]。NOBIS等[26]报道,CD8+ T细胞在中午时对小鼠的树突状细胞表现出最强的抗原呈递反应。当使用BMAL1缺陷型树突状细胞刺激BMAL1敲除的T细胞时,CD8+ T细胞对树突状细胞抗原递呈反应的节律性消失。当昼夜节律时钟基因Per2被敲除后,NK细胞中颗粒酶B和穿孔素的蛋白水平降低。因此,免疫细胞在调节骨肉瘤预后中的内在作用值得进一步深入研究。
总之,昼夜节律基因BMAL1与骨肉瘤患者的预后呈正相关,这可能是由于杀伤细胞对具有高表达BMAL1的骨肉瘤细胞的免疫监视作用增强。进一步研究骨肉瘤中BMAL1介导的免疫细胞杀伤力增强的详细机制,将有助于提出新的免疫疗法策略,以改善骨肉瘤患者的生存和预后。
| [1] |
BIERMANN J S, ADKINS D R, AGULNIK M, et al. Bone cancer[J]. J Natl Compr Canc Netw, 2013, 11(6): 688-723. DOI:10.6004/jnccn.2013.0088 |
| [2] |
NG A J, MUTSAERS A J, BAKER E K, et al. Genetically engineered mouse models and human osteosarcoma[J]. Clin Sarcoma Res, 2012, 2(1): 1-14. DOI:10.1186/2045-3329-2-19 |
| [3] |
ALLISON D C, CARNEY S, AHLMANN E R, et al. A meta-analysis of osteosarcoma outcomes in the modern medical era[J]. Sarcoma, 2012, 2012: 704872. DOI:10.1155/2012/704872 |
| [4] |
LONGHI A, ERRANI C, DE PAOLIS M, et al. Primary bone osteosarcoma in the pediatric age: state of the art[J]. Cancer Treat Rev, 2006, 32(6): 423-436. DOI:10.1016/j.ctrv.2006.05.005 |
| [5] |
KAGER L, ZOUBEK A, POTSCHGER U, et al. Primary metastatic osteosarcoma: presentation and outcome of patients treated on neoadjuvant cooperative osteosarcoma study group protocols[J]. J Clin Oncol, 2003, 21(10): 2011-2018. DOI:10.1200/JCO.2003.08.132 |
| [6] |
KAGER L, TAMAMYAN G, BIELACK S. Novel insights and therapeutic interventions for pediatric osteosarcoma[J]. Futur Oncol, 2017, 13(4): 357-368. DOI:10.2217/fon-2016-0261 |
| [7] |
JONES K B. Osteosarcoma genesis: modeling cancer initiation in the mouse[J]. Sarcoma, 2011, 2011: 694136. DOI:10.1155/2011/694136 |
| [8] |
LUSSIER D M, JOHNSON J L, HINGORANI P, et al. Combination immunotherapy with α-CTLA-4 and α-PD-L1 antibody blockade prevents immune escape and leads to complete control of metastatic osteosarcoma[J]. J Immunother Cancer, 2015, 3: 21. DOI:10.1186/s40425-015-0067-z.eCollection2015 |
| [9] |
HEYMANN M F, SCHIAVONE K, HEYMANN D. Bone sarcomas in the immunotherapy era[J]. Br J Pharmacol, 2020, 23. DOI:10.1111/bph.14999 |
| [10] |
BASS J, LAZAR M A. Circadian time signatures of fitness and disease[J]. Science, 2016, 354(6315): 994-999. DOI:10.1126/science.aah4965 |
| [11] |
PANDA S. Circadian physiology of metabolism[J]. Science, 2016, 354(6315): 1008-1015. DOI:10.1126/science.aah4967 |
| [12] |
FU L, PELICANO H, LIU J S, et al. The circadian gene Period2 plays an important role in tumor suppression and DNA damage response in vivo[J]. Cell, 2002, 111(1): 41-50. DOI:10.1016/s0092-8674(02)00961-3 |
| [13] |
LOGAN R W, ZHANG C Q, MURUGAN S, et al. Chronic shift-lag alters the circadian clock of NK cells and promotes lung cancer growth in rats[J]. J Immunol, 2012, 188(6): 2583-2591. DOI:10.4049/jimmunol.1102715 |
| [14] |
WU Y C, TAO B R, ZHANG T Y, et al. Pan-cancer analysis reveals disrupted circadian clock associates with T cell exhaustion[J]. Front Immunol, 2019, 10: 2451. DOI:10.3389/fimmu.2019.02451 |
| [15] |
KIM E, JUNG S, PARK W S, et al. Upregulation of SLC2A3 gene and prognosis in colorectal carcinoma: analysis of TCGA data[J]. BMC Cancer, 2019, 19(1): 302. DOI:10.1186/s12885-019-5475-x |
| [16] |
ZHANG S J, ZHANG J M, DENG Z Y, et al. Circadian clock components RORα and BMAL1 mediate the anti-proliferative effect of MLN4924 in osteosarcoma cells[J]. Oncotarget, 2016, 7(40): 66087-66099. DOI:10.18632/oncotarget.11807 |
| [17] |
GATTI R, BELLETTI S, ORLANDINI G, et al. Comparison of annexin V and calcein-AM as early vital markers of apoptosis in adherent cells by confocal laser microscopy[J]. J Histochem Cytochem, 1998, 46(8): 895-900. DOI:10.1177/002215549804600804 |
| [18] |
AKTAS E, KUCUKSEZER U C, BILGIC S, et al. Relationship between CD107a expression and cytotoxic activity[J]. Cell Immunol, 2009, 254(2): 149-154. DOI:10.1016/j.cellimm.2008.08.007 |
| [19] |
GERY S, KOMATSU N, BALDJYAN L, et al. The circadian gene per1 plays an important role in cell growth and DNA damage control in human cancer cells[J]. Mol Cell, 2006, 22(3): 375-382. DOI:10.1016/j.molcel.2006.03.038 |
| [20] |
ZENG Z L, LUO H Y, YANG J, et al. Overexpression of the circadian clock gene BMAL1 increases sensitivity to oxaliplatin in colorectal cancer[J]. Clin Cancer Res, 2014, 20(4): 1042-1052. DOI:10.1158/1078-0432.CCR-13-0171 |
| [21] |
ZHANG F, SUN H, ZHANG S, et al. Overexpression of PER3 inhibits self-renewal capability and chemoresistance of colorectal cancer stem-like cells via inhibition of notch and β-catenin signaling[J]. Oncol Res, 2017, 25(5): 709-719. DOI:10.3727/096504016X14772331883976 |
| [22] |
PURAM R V, KOWALCZYK M S, DE BOER C G, et al. Core circadian clock genes regulate leukemia stem cells in AML[J]. Cell, 2016, 165(2): 303-316. DOI:10.1016/j.cell.2016.03.015 |
| [23] |
XIA W K, LIU Z L, SHEN D, et al. Prognostic performance of pre-treatment NLR and PLR in patients suffering from osteosarcoma[J]. World J Surg Oncol, 2016, 14(1): 1-8. DOI:10.1186/s12957-016-0889-2 |
| [24] |
PAHL J H, KWAPPENBERG K M, VARYPATAKI E M, et al. Macrophages inhibit human osteosarcoma cell growth after activation with the bacterial cell wall derivative liposomal muramyl tripeptide in combination with interferon-γ[J]. J Exp Clin Cancer Res, 2014, 33(1): 27. DOI:10.1186/1756-9966-33-27 |
| [25] |
LABRECQUE N, CERMAKIAN N. Circadian clocks in the immune system[J]. J Biol Rhythms, 2015, 30(4): 277-290. DOI:10.1177/0748730415577723 |
| [26] |
NOBIS C C, DUBEAU LARAMÉE G, KERVEZEE L, et al. The circadian clock of CD8 T cells modulates their early response to vaccination and the rhythmicity of related signaling pathways[J]. Proc Natl Acad Sci USA, 2019, 116(40): 20077-20086. DOI:10.1073/pnas.1905080116 |



