2. 710061 西安,西安交通大学第一附属医院:肝胆外科
2. Department of Hepatobiliary Surgery, the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an, Shaanxi Province, 710061, China
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的消化系统肿瘤之一,但因其早期多无明显临床症状,大部分患者在初次诊断时已为晚期,失去了手术时机,另外术后高复发率和转移率仍是患者预后差的因素之一[1-3]。因此,探究肝癌侵袭转移的机制,确定有效的作用靶点或预后标志物非常必要。干扰素诱导蛋白5(interferon-induced protein with tetratricopeptide repeats 5, IFIT5)最初是在机体免疫中,当病原体或肿瘤等刺激机体受体,促使免疫细胞表达干扰素后,产生的干扰素刺激因子之一能够抑制病毒复制、抵抗病毒感染[4-6]。近来,HUANG等[7]研究表明IFIT5能够通过下调miR-99a诱导细胞间粘附分子1(ICAM1)的表达,促进膀胱癌上皮间质转化(epithelial-mesenchymal transition, EMT)发生和侵袭转移。LO等[8-9]发现IFIT5通过调控miRNA的降解促进前列腺癌、肾癌的EMT表型改变从而促进其侵袭转移。但IFIT5在肝癌中的表达水平及其临床意义仍不清楚。因此,本研究旨在探讨IFIT5在肝癌组织中的表达及临床意义,及其对肝癌细胞侵袭迁移能力的影响。
1 材料与方法 1.1 临床标本收集并筛选2013年1-12月在西安交通大学第一附属医院肝胆外科手术治疗后经病理证实的肝细胞癌患者97例。年龄28~79岁,平均48岁,其中<60岁者64例(65.98%),≥60岁者33例(34.02%)。按TNM分期,Ⅰ+Ⅱ期72例(74.23%),Ⅲ+Ⅳ期25例(25.77%)。入组患者均签署知情同意书。患者术前均未接受放疗、化疗等其他辅助治疗。癌旁组织为距肿瘤边缘≥2 cm的肝组织,所有组织为术后获得的新鲜标本组织,组织获得后立即转移至液氮及40 g/L多聚甲醛固定并常规石蜡包埋。本研究经西安交通大学第一附属医院伦理委员会审核批准(批准号:2019伦审科字第G-168号)。
1.2 主要耗材和试剂人肝癌细胞株(Hep3B,Huh7,SMMC-7721和HCCLM3)和正常永生化肝细胞株(LO2)购自中国科学院上海生命研究所。DMEM细胞培养基、胰蛋白酶购自HyClone公司;胎牛血清购自杭州四季青公司;兔抗人IFIT5多克隆抗体购自Abcam公司;HRP标记山羊抗鼠IgG、山羊抗兔IgG二抗购自北京中杉金桥公司;E-cadherin、N-cadherin、Vimentin和GAPDH购自Cell signaling technology公司;脂质体(Lipofectamine 2000)购自Invitrogen公司;IFIT5 shRNA及对照shRNA购自上海吉凯公司;Transwell小室购自Millipore公司。BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,ECL化学发光试剂盒购自Milipore公司。
1.3 qRT-PCR检测IFIT5 mRNA的表达水平参照TRIzol说明书提取总RNA。紫外分光光度计检测提取的RNA浓度及纯度。采用TaKaRa公司的逆转录试剂盒将RNA反转录为cDNA。qRT-PCR以GAPDH为内参对照,采用2-ΔΔCt法分析定量PCR的结果。
1.4 Western blot检测IFIT5以及相关蛋白的表达按照RIPA(强)试剂盒说明书提取肝癌组织及相应细胞内的蛋白,经BCA蛋白定量后,用SDS-PAGE制10%分离胶后,每组样品加20 μg,经湿转转膜仪将蛋白移至PVDF膜上。50 g/L脱脂牛奶封闭2 h,加PBS稀释的一抗(1 :1 000),把抗体孵育盒放入4 ℃冰箱孵育最少12 h;TBST洗膜3次,分别加HRP标记的抗兔或抗小鼠二抗(1 :10 000),室温孵育2 h;TBST洗膜3次,再用超敏发光试剂盒显影并进行半定量分析。
1.5 免疫组化组织标本常规脱水、石蜡包埋,制作4 μm切片。切片经二甲苯脱蜡,梯度乙醇水化后,96 ℃微波柠檬酸盐抗原热修复15 min,30 mL/L H2O2灭活内源性过氧化物酶10 min;100 mL/L山羊血清封闭;IFIT5抗体(1 :400),4 ℃孵育过夜;洗涤后,加生物素标记的山羊抗兔二抗工作液(1 :1 000),37 ℃孵育60 min;洗涤后,加辣根过氧化物酶标记的链霉亲和素(1 :500) 37 ℃孵育30 min,洗涤后,DAB显色,苏木精复染,逐级梯度乙醇脱水,二甲苯透明,中性树胶封片。每张切片经2位病理医师,在高倍镜(× 400)下随机选取5个视野,按以下标准单独阅片、评分。染色强度评分:阴性为0分;弱阳性为1分;中度阳性为2分;强阳性为3分。阳性细胞百分比评分:阳性细胞≤ 5%为0分、5%<1分≤25%、25%<2分≤50%、50%<3分≤75%、4分>75%。每视野评分=染色强度评分×阳性肿瘤细胞百分比评分,取平均分作为切片终评分。0~4分为蛋白表达阴性(-),即IFIT5低表达组;>4分为蛋白表达阳性(+),即IFIT5高表达组。
1.6 Transwell侵袭和迁移实验取转染48 h后的HCC细胞,重悬细胞,调整细胞数为1×106个/mL。50 mg/L Matrigel胶1 :8稀释液包被Transwell小室(孔径8 μm)底部(侵袭实验铺胶、迁移实验未铺胶)。取各组细胞悬液200 μL加入Transwell小室,向24孔板下室加650 μL 10% FBS的完全培养基。每组重复3个样本。常规培养24 h后取出小室,用PBS冲洗小室,4%多聚甲醛固定,PBS冲洗,1 g/L结晶紫染色,用棉棒擦去小室内层细胞,在倒置显微镜下观察移至微孔膜下层的细胞数,每个样本随机选取8个200倍视野求细胞计数平均数。
1.7 肺转移模型的建立选取4~6周BALB/c雄性裸鼠(购自西安交通大学医学院动物中心)10只,分为2组,每组5只,分别取对数生长期的Hep3B/EV和Hep3B/IFIT5细胞,胰酶消化离心沉淀后,PBS液清洗细胞2次。于小鼠尾静脉注射1×106个细胞。接种后常规饲养3周处死所有裸鼠,切取肺组织,肺组织经中性福尔马林固定、石蜡包埋后全肺连续切片(厚度4 μm),HE染色,光学显微镜下计数肺转移数目。
1.8 统计学分析使用SPSS 13.0统计软件分析。计量数据以x±s表示,组间进行t检验。采用χ2检验分析IFIT5表达与临床病理资料间的相关性。应用Kaplan-Meier曲线分析IFIT5高、低表达组的生存情况。以P<0.05认为差异具有统计学意义。所有检测实验重复3次。
2 结果 2.1 IFIT5在肝癌组织中的表达通过qRT-PCR检测发现肝癌组织中的IFIT5 mRNA表达明显高于癌旁组织(图 1A)。通过Western blot(图 1B)和免疫组化染色(图 1C)检测发现:相较于癌旁组织,IFIT5蛋白在肝癌组织中的表达明显升高,差异有统计学意义(P<0.05)。
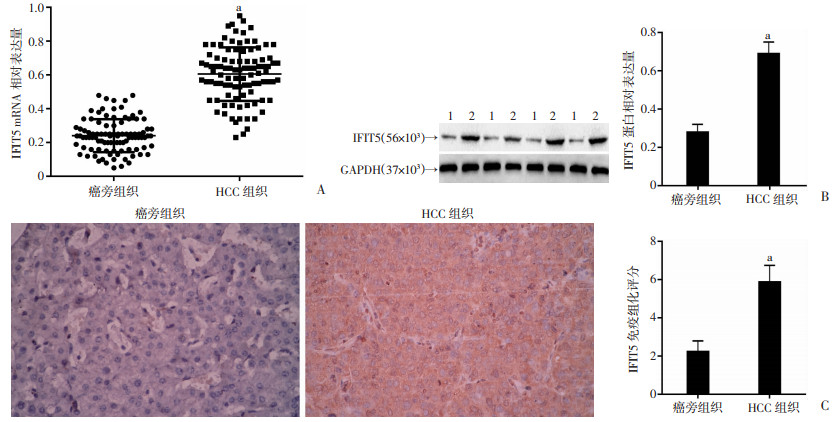
|
| A:qRT-PCR检测IFIT5 mRNA在肝癌组织中的表达显著高于癌旁组织; B:Western blot及免疫组化检测结果1:癌旁组织;2:HCC组织;C:免疫组化检测IFIT5蛋白在肝癌组织中的表达显著高于癌旁组织(×400);a:P<0.05,与癌旁组织比较 图 1 IFIT5在肝癌组织及对应癌旁组织中的表达情况 |
2.2 IFIT5的表达与HCC患者临床病理特征的关系
根据免疫组化结果将HCC患者分为IFIT5高表达组(n=50)和低表达组(n=47), 分析其与HCC患者的临床病理资料关系。结果显示IFIT5高表达与TNM分期(Ⅲ+Ⅳ)和血管侵犯相关(P<0.05,表 1)。
| 临床特征 | 例数 | 高表达(n=50) | 低表达(n=47) | P |
| 年龄/岁 | 0.671 | |||
| <60 | 64 | 32 | 32 | |
| ≥60 | 33 | 18 | 15 | 0.899 |
| 性别 | ||||
| 男性 | 80 | 41 | 39 | |
| 女性 | 17 | 9 | 8 | |
| 肿瘤大小/cm | 0.176 | |||
| <5 | 68 | 32 | 36 | |
| ≥5 | 29 | 18 | 11 | |
| 肿瘤数目 | 0.170 | |||
| 单发 | 84 | 41 | 43 | |
| 多发 | 13 | 9 | 4 | |
| Edmondson分级 | 0.173 | |||
| Ⅰ+Ⅱ | 23 | 9 | 14 | |
| Ⅲ+Ⅳ | 74 | 41 | 33 | |
| TNM分期 | 0.018 | |||
| Ⅰ+Ⅱ | 72 | 32 | 40 | |
| Ⅲ+Ⅳ | 25 | 18 | 7 | |
| 血管浸润 | 0.009 | |||
| 有 | 16 | 13 | 3 | |
| 无 | 81 | 37 | 44 | |
| 甲胎蛋白(AFP) | 0.749 | |||
| <400 ng/mL | 22 | 12 | 10 | |
| ≥400 ng/mL | 75 | 38 | 37 | |
| HBsAg | 0.927 | |||
| 阳性 | 89 | 46 | 43 | |
| 阴性 | 8 | 4 | 4 |
2.3 IFIT5的表达与患者率的关系
通过连续随访,发现IFIT5高表达患者的5年生存率明显低于IFIT5低表达组,差异有统计学意义(P<0.01,图 2)。
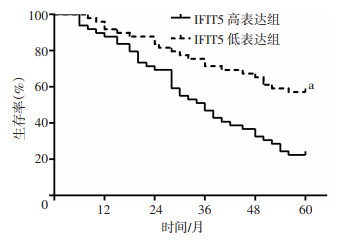
|
| a:P=0.000 4,与IFIT5高表达组比较 图 2 肝癌患者不同IFIT5表达水平的生存率 |
2.4 IFIT5在不同肝癌细胞系中的表达
Western blot检测IFIT5在不同肝癌细胞系和正常肝细胞系中的表达,结果发现,IFIT5在肝癌细胞系中的表达均高于LO2正常肝细胞系,且在HCCLM3细胞系中表达最高,在Hep3B细胞系中表达最低,差异有统计学意义(P<0.05, 图 3)。
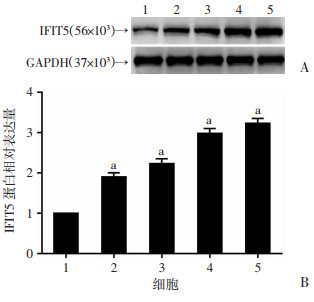
|
| 1:LO2;2:Hep3B;3:Huh7;4:SMMC-7721;5:HCCLM3;A:Western blot检测IFIT5蛋白在肝癌细胞系和正常肝细胞LO2中的表达;B:半定量分析IFIT5的表达水平a:P<0.05,与LO2比较 图 3 Western blot半定量分析IFIT5在不同肝癌细胞系中的表达水平 |
2.5 过表达与沉默IFIT5对肝癌细胞IFIT5表达的影响
为进行后续实验,将IFIT5过表达质粒转染低表达IFIT5的Hep3B细胞,qRT-PCR和Western blot检测发现IFIT5组细胞的IFIT5 mRNA及蛋白水平显著升高(P<0.05, 图 4A、C)。将IFIT5 shRNA转染高表达IFIT5的HCCLM3细胞,qRT-PCR和Western blot检测发现IFIT5 shRNA组细胞的IFIT5 mRNA和蛋白表达水平显著降低(P<0.05, 图 4B、D)。
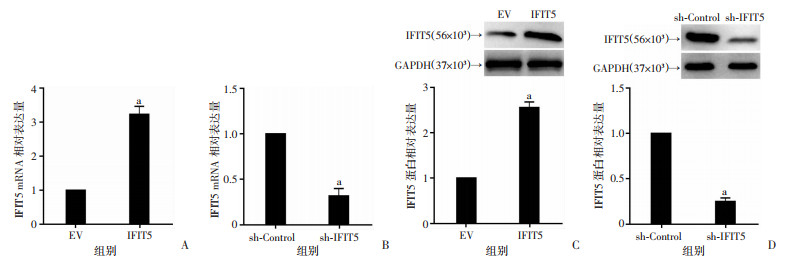
|
| A、C:在Hep3B细胞中过表达IFIT5质粒显著增加IFIT5 mRNA和蛋白表达,a:P<0.05,与EV组比较;B、D:在HCCLM3细胞中,IFIT5 shRNA显著抑制IFIT5 mRNA和蛋白的表达;a:P<0.05,与sh-Control组比较 图 4 过表达或沉默IFIT5后HCC细胞中IFIT5表达 |
2.6 Transwell实验检测过表达或沉默IFIT5对肝癌侵袭迁移能力的影响
Transwell实验证实IFIT5过表达显著促进Hep3B细胞侵袭迁移能力(图 5A),而IFIT5沉默显著降低HCCLM3细胞侵袭迁移能力(图 5B),差异有统计学意义(P<0.05)。

|
| A:Transwell检测过表达IFIT5促进HCC细胞侵袭和迁移能力a:P<0.05,与EV组比较;B:Transwell检测IFIT5敲低后抑制HCCLM3细胞的侵袭和迁移能力a:P<0.05,与sh-Control组比较 图 5 过表达或沉默IFIT5对HCC细胞侵袭及迁移能力的影响 |
2.7 IFIT5促进HCC细胞上皮间质转化(EMT)改变
结果显示,过表达IFIT5促进Hep3B细胞间质表型标志物N-cadherin、Vimentin的表达而抑制上皮表型E-cadherin的表达(图 6A)。敲低HCCLM3细胞中IFIT5表达抑制N-cadherin、Vimentin的表达而促进E-cadherin的表达(图 6B)。说明IFIT5能够调控HCC细胞EMT的发生。
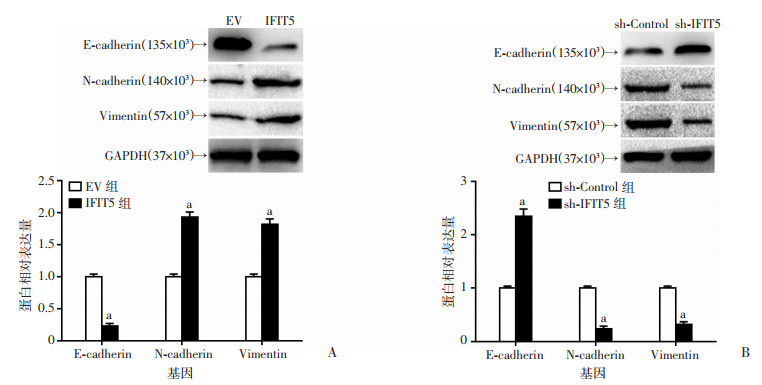
|
| A:IFIT5过表达促进间质上皮标志物N-cadherin、Vimentin而抑制上皮标志物E-cadherin的表达a:P<0.05,与EV组比较;B:IFIT5敲低后抑制间质上皮标志物N-cadherin、Vimentin而促进上皮标志物E-cadherin的表达a:P<0.05,与sh-Control组比较 图 6 IFIT5对EMT相关基因表达的影响 |
2.8 IFIT5过表达促进HCC细胞肺转移
通过建立肺转移模型,我们发现过表达IFIT5促进Hep3B细胞肺转移(图 7)。体内实验说明IFIT5能够促进HCC细胞远处转移。
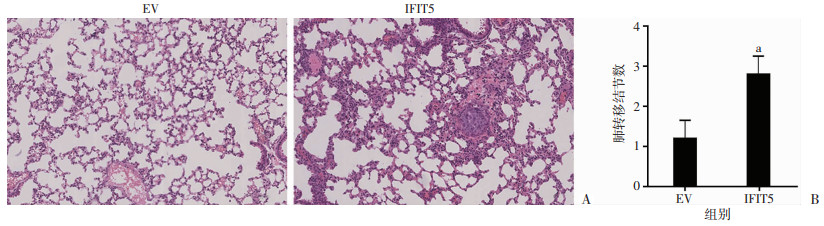
|
| A:肺转移模型HE染色(×200);B:定量分析肺转移结节数量a:P<0.05,与EV组比较 图 7 尾静脉注射肺转移模型检测IFIT5对促进Hep3B细胞肺转移 |
3 讨论
肝癌是我国较常见、预后较差的消化系统肿瘤之一,其起病隐匿,早期浸润生长并远处转移使大部分患者就诊时已失去根治性手术机会,严重影响患者预后[10-11]。因此,研究HCC侵袭转移机制,鉴定新的有效的HCC预后标志物及治疗靶点具有重要意义。
IFITs是由干扰素诱导产生的含TPR结构域的蛋白,在机体抗病毒过程中起着关键作用[12-14]。IFIT5能够调控人机体免疫中IKK磷酸化和NF-κB通路的激活[15]。另外IFIT5在膀胱癌、肾癌、前列腺癌中的表达也有报道[7-8]。本研究证实IFIT5在肝癌中异常高表达,且高表达IFIT5与肿瘤TNM分期、血管侵犯等HCC不良临床病理特征相关。通过随访,发现高表达IFIT5患者的5年生存率明显低于低表达者,提示IFIT5的高表达与患者预后不良相关,说明IFIT5在HCC发展过程中起重要作用。在细胞学水平上,IFIT5在肝癌细胞系中的表达明显低于正常肝细胞,通过过表达和沉默实验证明IFIT5能够调控HCC细胞EMT,从而促进肝癌细胞的侵袭和迁移能力。上皮间质转化(epithelial-mesenchymay transition, EMT)在肿瘤的发生发展、耐药、侵袭转移等进程有密切关系[16-17]。EMT主要指在特定的肿瘤微环境中,极性较强的上皮细胞来源的肿瘤细胞向侵袭性和转移性更强的间质细胞转化的生物学进程。此过程的发生促进肿瘤组织中细胞向远处组织浸润和转移[18-19]。IFIT5能够通过下调成熟miR-99a表达增加ICAM1的表达,从而促进膀胱癌的EMT和侵袭转移[7]。IFIT5能够通过上调Slug和ZEB1的表达从而促进肾癌的EMT和侵袭转移[8]。本研究表明IFIT5能够促进HCC细胞EMT的发生,与HUANG等[7]在膀胱癌中的研究一致。以上结果表明,在HCC中IFIT5可能通过调控EMT发生促进肝癌侵袭转移。
综上,本研究证实IFIT5在HCC中异常高表达,并且与HCC患者的不良临床病理特征及预后密切相关。可能通过调控EMT发生促进肝癌侵袭转移发挥致癌基因的作用。这表明IFIT5可能成为肝癌诊断的生物标志物和防治新靶点。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
EL-SERAG H B, RUDOLPH K L. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7): 2557-2576. DOI:10.1053/j.gastro.2007.04.061 |
| [3] |
JAFRI W, KAMRAN M. Hepatocellular carcinoma in Asia: a challenging situation[J]. Euroasian J Hepatogastroenterol, 2019, 9(1): 27-33. DOI:10.5005/jp-journals-10018-1292 |
| [4] |
KATIBAH G E, QIN Y D, SIDOTE D J, et al. Broad and adaptable RNA structure recognition by the human interferon-induced tetratricopeptide repeat protein IFIT5[J]. Proc Natl Acad Sci USA, 2014, 111(33): 12025-12030. DOI:10.1073/pnas.1412842111 |
| [5] |
KATIBAH G E, LEE H J, HUIZAR J P, et al. tRNA binding, structure, and localization of the human interferon-induced protein IFIT5[J]. Mol Cell, 2013, 49(4): 743-750. DOI:10.1016/j.molcel.2012.12.015 |
| [6] |
ROHAIM M A, SANTHAKUMAR D, NAGGAR R F E, et al. Chickens expressing IFIT5 ameliorate clinical outcome and pathology of highly pathogenic avian influenza and velogenic Newcastle disease viruses[J]. Front Immunol, 2018, 9: 2025. DOI:10.3389/fimmu.2018.02025 |
| [7] |
HUANG J, LO U G, WU S Q, et al. The roles and mechanism of IFIT5 in bladder cancer epithelial-mesenchymal transition and progression[J]. Cell Death Dis, 2019, 10(6): 437. DOI:10.1038/s41419-019-1669-z |
| [8] |
LO U G, BAO J M, CEN J J, et al. Interferon-induced IFIT5 promotes epithelial-to-mesenchymal transition leading to renal cancer invasion[J]. Am J Clin Exp Urol, 2019, 7(1): 31-45. DOI:10.11648/j.ajcem.20190701.14 |
| [9] |
LO U G, PONG R C, YANG D E, et al. IFNγ-induced IFIT5 promotes epithelial-to-mesenchymal transition in prostate cancer via miRNA processing[J]. Cancer Res, 2019, 79(6): 1098-1112. DOI:10.1158/0008-5472.CAN-18-2207 |
| [10] |
FAIVRE S, RIMASSA L, FINN R S. Molecular therapies for HCC: Looking outside the box[J]. J Hepatol, 2020, 72(2): 342-352. DOI:10.1016/j.jhep.2019.09.010 |
| [11] |
LIU Z K, WANG Y F, DOU C W, et al. Hypoxia-induced up-regulation of VASP promotes invasiveness and metastasis of hepatocellular carcinoma[J]. Theranostics, 2018, 8(17): 4649-4663. DOI:10.7150/thno.26789 |
| [12] |
PIDUGU V K, PIDUGU H B, WU M M, et al. Emerging functions of human IFIT proteins in cancer[J]. Front Mol Biosci, 2019, 6: 148. DOI:10.3389/fmolb.2019.00148 |
| [13] |
ZHANG B H, LIU X Y, CHEN W, et al. IFIT5 potentiates anti-viral response through enhancing innate immune signaling pathways[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(10): 867-874. DOI:10.1093/abbs/gmt088 |
| [14] |
MIEDZIAK B, DOBIEŻYŃSKA A, DARZ·YNKIEWICZ Z M, et al. Kinetic analysis of IFIT1 and IFIT5 interactions with different native and engineered RNAs and its consequences for designing mRNA-based therapeutics[J]. RNA, 2020, 26(1): 58-68. DOI:10.1261/rna.073304.119 |
| [15] |
ZHENG C S, ZHENG Z H, ZHANG Z F, et al. IFIT5 positively regulates NF-κB signaling through synergizing the recruitment of IκB kinase (IKK) to TGF-β-activated kinase 1 (TAK1)[J]. Cell Signal, 2015, 27(12): 2343-2354. DOI:10.1016/j.cellsig.2015.08.018 |
| [16] |
GIANNELLI G, KOUDELKOVA P, DITURI F, et al. Role of epithelial to mesenchymal transition in hepatocellular carcinoma[J]. J Hepatol, 2016, 65(4): 798-808. DOI:10.1016/j.jhep.2016.05.007 |
| [17] |
SCHEAU C, BADARAU I A, COSTACHE R, et al. The role of matrix metalloproteinases in the epithelial-mesenchymal transition of hepatocellular carcinoma[J]. Anal Cell Pathol (Amst), 2019, 2019: 9423907. DOI:10.1155/2019/9423907 |
| [18] |
GURZU S, KOBORI L, FODOR D, et al. Epithelial mesenchymal and endothelial mesenchymal transitions in hepatocellular carcinoma: a review[J]. Biomed Res Int, 2019, 2019: 2962580. DOI:10.1155/2019/2962580 |
| [19] |
MIR N, JAYACHANDRAN A, DHUNGEL B, et al. Epithelial-to-mesenchymal transition: a mediator of sorafenib resistance in advanced hepatocellular carcinoma[J]. Curr Cancer Drug Targets, 2017, 17(8): 698-706. DOI:10.2174/1568009617666170427104356 |



