2. 330092 南昌,南昌市第三医院消化科;
3. 330006 南昌,南昌大学第一附属医院:药学部;
4. 330006 南昌,南昌大学第一附属医院:病理科;
5. 330006 南昌,南昌大学第一附属医院:内分泌科
2. Department of Gastroenterology, Nanchang Third Hospital, Nanchang, Jiangxi Province, 330092, China;
3. Department of Pharmacy, the First Affiliated Hospital of Nanchang University, Nanchang, Jiangxi Province, 330006;
4. Department of Pathology, the First Affiliated Hospital of Nanchang University, Nanchang, Jiangxi Province, 330006;
5. Department of Endocrinology, the First Affiliated Hospital of Nanchang University, Nanchang, Jiangxi Province, 330006
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是指无过量饮酒史,以肝脏脂肪变性和脂肪贮积为特征的临床病理综合征,其疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、非酒精性脂肪性肝纤维化、肝硬化和肝细胞癌。目前该病在全球成年人患病率约为25%,且NASH患病率为3%~5%,已成为发达国家的第一大慢性肝病。在我国该病发病率逐年升高,且发病呈年轻化趋势,也已经成为慢性肝病的最常见原因之一[1-2]。NAFLD发病机制尚不未完全阐明,目前考虑是多因素共同作用所致,如胰岛素抵抗、氧化应激、遗传决定因素、营养和生活方式、内质网应激、炎症和肠道微生物群和免疫相关炎症等[3],且尚缺乏有效且安全的治疗药物。
白介素25(interleukin 25,IL-25)是新发现的一种细胞因子,主要来源于Th2型细胞、肥大细胞、嗜酸性或嗜碱性粒细胞、肺泡巨噬细胞、树突状细胞和乳腺上皮细胞等,作用于基质细胞、先天免疫细胞和适应性免疫细胞,协调Th2型免疫反应。IL-25可诱导固有淋巴样2型细胞产生IL-4、IL-5、IL-13等Th2型细胞因子,还可在CD4+ T细胞簇的参与下诱导Th细胞分化为Th2细胞[4-5]。研究表明IL-25可抑制Th1和Th17细胞因子的促炎作用,调节脂肪代谢[6],诱导巨噬细胞向M2型转化,增强巨噬细胞对脂肪的摄取,促进脂肪分解,抑制脂肪合成,也能改变脂滴相关蛋白的表达和调节脂质代谢[7]。我们前期动物实验发现IL-25可通过IL25/IL13/STAT6轴促进NAFLD小鼠体内M2a型巨噬细胞的分化,并促进肝细胞脂质分解,抑制脂质合成[8-9]。IL-25还可通过减少小鼠肠道内分节丝状菌的含量抑制小鼠肝脂肪变[10]。但IL-25与NAFLD肝脂肪变及肝内M2型巨噬细胞的关系在人体内尚未得到证实。本研究拟观察和比较NAFLD和对照组患者体内白介素25及其相关细胞因子和M2型巨噬细胞表达水平,为未来开发IL-25作为NAFLD新型药物提供参考。
1 资料与方法 1.1 研究对象选择2017年9月至2019年2月南昌大学第一附属医院经B超或CT检查诊断、符合现行NAFLD诊断标准[11]患者,并同时纳入本院肝胆外科拟行部分肝切除的肝血管瘤或肝囊肿患者作为对照组。NAFLD组排除标准:①需要放化疗或最近1年服用过免疫调节药物、自身免疫性疾病、结缔组织疾病等影响体内IL-25水平的疾病;②存在肝活检禁忌证(血小板低下、凝血功能障碍、孕妇等);③拒绝加入研究。对照组患者除在临床上排除NAFLD诊断外,其余排除标准同NAFLD组。本研究通过南昌大学第一附属医院医学伦理委员会审批(2015-007),患者均签署知情同意书。
1.2 资料收集所有患者在空腹时抽静脉血4 mL,离心后取血清备用。选取肝功能异常的NAFLD患者行肝活检,采用16号肝活检针,B超引导活检术,获取的肝组织其中一条立即置于10%中性甲醛溶液内固定,改良法脱水、包埋、切片后保存。另一条立即置于RNA保护液中并液氮保存,随后立即转存于-80 ℃低温冰箱。在对照组中选择肝巨大血管瘤或肝巨大囊肿行手术切除的患者血管瘤前或囊肿病变周边正常肝组织2块(直径1~2 cm),一块在离体后立即置于RNA保护液中并液氮保存,随后立即转存于-80 ℃低温冰箱。另一块立即以10%中性甲醛浸泡,改良法脱水、包埋、切片后保存。
1.3 方法 1.3.1 主要试剂IL-25、IL-13、IL-10、IL-5、IL-4 ELISA试剂盒购于Elabscience公司;IL-25、CD68、TGM2、CD206抗体试剂盒购于英国Abcam公司;Polymer双染检测试剂盒购于北京中杉金桥生物技术公司;HE染色试剂盒购于北京索莱宝科技有限公司;浓缩型正常山羊血清(封闭)及荧光(CY3)标记羊抗兔IgG均购于武汉博士德生物工程有限公司。
1.3.2 血清IL-25、IL-13、IL-10、IL-5、IL-4水平检测采用ELISA法检测,严格按说明书操作进行,并用用酶标仪在450 nm波长测量每孔光密度值D(450)。
1.3.3 肝组织病理学检查将石蜡固定的肝组织切片,行HE染色;根据Kleiner系统对载玻片进行肝脏脂肪变性分级[12]。根据脂质在肝细胞中的积累程度(< 5%计0分,5%~33%计1分,34%~66%计2分,>66%计3分)来评定肝脏脂肪变性的程度。根据评分将NAFLD分为轻度脂肪变(0~1分)和中重度脂肪变(2~3分)。
1.3.4 免疫组化或免疫荧光检测肝内IL-25、CD68,CD206和谷氨酰胺酶转氨酶(glutaminase transaminase,TGM)2蛋白水平免疫组化:将石蜡固定的肝组织脱蜡水化,通过柠檬酸液(pH=6.0)高压锅内抗原修复,0.3%H2O2和80%甲醇溶液阻断内源性过氧化物酶封闭非特异性抗原,一抗,二抗,DAB显色,苏木精复染,以PBS代替一抗作阴性对照,通过CD68检测枯否细胞[13],使用Image J软件评估肝内枯否细胞(CD68阳性细胞)数量。
免疫双染(CD206、TGM2):按上述步骤完成二抗后,失活第一重染色,再进行一抗,二抗,Polymer双染检测试剂显色、复染及分化、观察。本研究通过CD206及TGM2检测M2型巨噬细胞数量[13],采用Image J软件评估肝内M2型巨噬细胞(CD206/TGM2双染阳性细胞)数量。
免疫荧光:将石蜡固定的肝组织脱蜡水化,通过0.01 mol/L枸橼酸缓冲液微波抗原修复:进行血清封闭,加一抗。暗处加荧光(FITC)二抗及复染核,荧光显微镜下观察,并采集图像。采用Image J软件评估IL-25阳性区域。
1.3.5 实时荧光定量PCR检测肝内IL-25、IL-13、IL-10、IL-5、IL-4、CD68、CD206、TGM2细胞因子mRNA表达通过TRIzol法提取肝组织总RNA,并进行RNA样品的检测。按照反转录及荧光定量试剂盒说明书,将提取的mRNA逆转录成cDNA,将IL-25、IL-13、IL-10、IL-5、IL-4、CD68、CD206和TGM2进行PCR扩增,采用2-ΔΔCt法对定量结果进行分析,获得上述基因mRNA的相对表达量。PCR条件为50 ℃ 2 min,95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,共40个循环。实验引物及内参β-actin的设计与合成由武汉巴菲尔生物科技有限公司完成。引物序列如表 1所示。
| 基因 | 引物序列 | 产物长度/bp |
| IL-10 | 正向:5′-TGCTGGAGGACTTTAAGGGT-3′ | 208 |
| 反向:5′-ACGGCCTTGCTCTTGTTTTC-3′ | ||
| IL-4 | 正向:5′-TCTCACCTCCCAACTGCTTC-3′ | 183 |
| 反向:5′-GTGTTCTTGGAGGCAGCAAA-3′ | ||
| IL-5 | 正向:5′-GAGACCTTGGCACTGCTTTC-3′ | 238 |
| 反向:5′-TCCGTCTTTCTTCTCCACACT-3′ | ||
| IL-13 | 正向:5′-ATGGTATGGAGCATCAACCT-3′ | 106 |
| 反向:5′-TCAGCATCCTCTGGGTCTT-3′ | ||
| IL-25 | 正向:5′-TTGGCAATGGTCATGGGAAC-3′ | 170 |
| 反向:5′-CCATCTTCACTGGCCCTACA-3′ | ||
| CD68 | 正向:5′-ATGGCGGTGGAGTACAATG-3′ | 256 |
| 反向:5′-TGATGAGAGGCAGCAAGATG-3′ | ||
| TGM2 | 正向:5′-GCCGAGAAGGAGGAGACAGG-3′ | 105 |
| 反向:5′-AGCGGTGTTGTTGGTGATGTG-3′ | ||
| CD206 | 正向:5′-GCTACTGAACCCCCACAAC-3′ | 159 |
| 反向:5′-GGAAACCAGAGAGGAACCC-3′ | ||
| β-actin | 正向:5′-AGCGAGCATCCCCCAAAGTT-3′ | 286 |
| 反向:5′-GGGCACGAAGGCTCATCATT-3′ |
1.4 统计学分析
采用SPSS 23.0统计软件。符合正态分布的计量资料以x±s表示,两组间比较采用Student's t检验,多组间采用单因素方差分析,方差齐时采用F检验,随后用最小显著性差异法(least-significant difference,LSD法)进行两两比较,方差不齐时采用Welch检验,随后用Dunnett' T3法进行两两比较,不符合正态分布的资料采用秩和检验。计数资料组间比较采用χ2检验。分类作图采用Prism Graphpad 6.0软件完成,P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料于2017年9月至2019年2月连续纳入南昌大学第一附属医院符合NAFLD诊断标准的患者和对照组患者。其中NAFLD患者50例,包括男性28例,女性22例,年龄(47±13)岁。对照组纳入20例,男性11例,女性9例,年龄(48±13)岁,两组平均年龄(t=-0.24,P=0.786)及性别比例(χ2= 0.01,P=0.939)差异无统计学意义。
2.2 两组患者血清IL-25水平与对照组相比,NAFLD组患者血清IL-25(P=0.003)、IL-13(P=0.007)及IL-4(P=0.001)水平明显降低;IL-10及IL-5血清水平偏低,但差异无统计学意义(表 2)。
| 组别 | n | IL-25 | IL-13 | IL-10 | IL-5 | IL-4 |
| 对照组 | 20 | 26.51±5.84 | 16.84±3.03 | 8.39±2.26 | 15.75±6.44 | 45.43±11.15 |
| NAFLD组 | 50 | 22.82±3.91 | 13.88±4.34 | 7.59±1.49 | 14.18±4.39 | 35.96±9.48 |
| t值 | -3.07 | -2.79 | -1.74 | -1.17 | -3.59 | |
| P值 | 0.003 | 0.007 | 0.086 | 0.246 | 0.001 |
2.3 NAFLD患者和对照组患者肝组织IL-25 mRNA水平
与对照组(n=6)相比,NAFLD组(n=12)肝组织IL-13和IL-4 mRNA表达明显降低(P=0.007、0.003),而CD68 mRNA表达明显增高(P < 0.001);肝组织IL-25、IL-5、IL-10和TGM2的mRNA表达比对照组降低,但差异无统计学意义(图 1)。
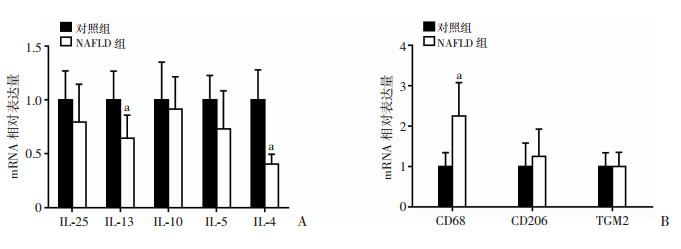
|
| a: P < 0.01,与对照组比较 图 1 两组患者肝组织中IL-25、Th2型免疫相关细胞因子(A)和巨噬细胞标志物(B)mRNA表达 |
2.4 两组患者肝脏组织学形态及肝组织IL-25表达、枯否细胞数量、M2型巨噬细胞数量
获取我院肝胆外科拟行部分肝切除的肝血管瘤或肝囊肿患者正常肝组织作为对照组6例,根据肝脏脂肪变性分级将NAFLD组12例患者分为轻度脂肪变6例和中重度脂肪变6例。轻度脂肪变组和中度脂肪变组评分比较差异有统计学意义[(1.50±0.55) vs (2.67±0.52)分,95%CI:0.93~2.07 vs 2.12~3.21,P=0.004];肝组织免疫组化分析显示(图 2):3组间肝内枯否细胞、M型巨噬细胞比较差异有统计学意义(F=302.57、802.47,P < 0.001)。NAFLD组患者肝内枯否细胞数量百分比明显高于对照组,M2型巨噬细胞数量百分比(CD206/TGM2双染阳性细胞)低于对照组;与轻度脂肪变NAFLD患者相比,中重度脂肪变NAFLD患者肝内枯否细胞数量百分比更高[(3.51±0.21)% vs(6.87±0.84)% vs(10.92±1.03)%,95%CI:3.30%~3.73%、6.00%~7.75%、9.84%~12.00%,P < 0.001],M2型巨噬细胞数量百分比更低[(8.69±0.23)% vs(5.78±0.31)% vs(2.75±0.22)%,95%CI:8.44%~8.93%、5.46%~6.11%、2.52%~2.97%,P < 0.001]。

|
| CD68是巨噬细胞表面标记物,TGM2和CD206是M2巨噬细胞的表面标记物;红色箭头示阳性染色区域 图 2 免疫组化观察各组患者肝脏组织学形态 |
免疫荧光分析显示(图 3):3组间IL-25蛋白水平比较差异有统计学意义(F=170.85,P < 0.001)。与对照组相比,NAFLD患者肝内IL-25蛋白水平下降;与轻度脂肪变NAFLD患者相比,中重度脂肪变NAFLD患者IL-25蛋白水平减少更为明显[(3.24±0.41)% vs(1.82±0.12)% vs(0.49±0.09)%,95%CI:2.81%~3.67%、1.69%~1.94%、0.40%~0.59%,P < 0.001]。
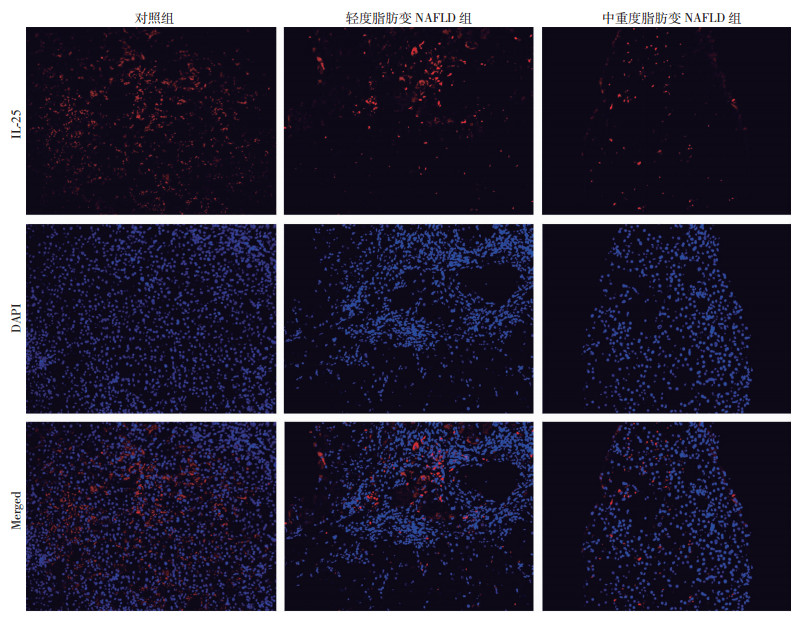
|
| 红色为IL-25阳性区域 图 3 免疫荧光检测各组患者肝脏中IL-25蛋白水平(×200) |
3 讨论
NAFLD逐渐成为全世界慢性肝病的主要病因之一,特别是在西方发达国家。NAFLD全球患病率具有上升趋势,且和糖尿病、血管粥样硬化、心血管疾病、慢性肾脏病、结肠腺瘤、肝癌、骨质疏松等其他疾病发病有密切关系[14-15]。NAFLD发病机制及新型药物开发是当前的研究热点。目前进入临床试验的NAFLD新型治疗安全有效的药物有Elafibranor、Aramchol、奥贝胆酸、利拉鲁肽等,但长期有效性和安全性仍有待进一步证实[16]。
IL-17家族包括6个成员,包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F。其中IL-17E也称IL-25,其分子结构和生物学功能明显不同于家族中的其他成员。IL-25在调节炎症和肿瘤生长中有一定作用[17],我们既往动物实验发现IL-25具有缓解NAFLD小鼠肝脂肪变的作用[8]。有研究显示高脂饮食(HFD)诱导的NAFLD小鼠肝内IL-25表达减少;外源性给予IL-25可通过增加体内IL-13表达,激活核转录因子信号传导及转录激活因子6(STAT6),诱导分化M2a型巨噬细胞,促进肝细胞脂质分解且抑制肝细胞脂质合成,从而改善NAFLD[8-9]。IL-25还可通过减少小鼠肠道内分节丝状菌的含量,提高体内抗菌肽的水平,减少体内IL-17A水平并拮抗其促炎作用,从而抑制小鼠肝脂肪变[10]。虽然既往多项研究也发现NAFLD患者较非NAFLD患者肝内及(或)血清内IL-25表达减少[7-8, 18],但均未从转录水平探讨IL-25与脂肪肝的关系,且样本量极少。本研究不仅增加了样本量,而且同时从血清和肝组织标本中检测了IL-25的mRNA及蛋白水平,探讨了肝内IL-25水平和NAFLD肝脂肪变严重程度的关系。在血清中观察到与对照组相比,NAFLD患者血清IL-25水平降低,在肝组织中虽未观察两组IL-25 mRNA表达差异,但NAFLD患者肝组织IL-25 mRNA表达是呈下降趋势的,且随着肝脏脂肪变的加重,减少更为明显。结合我们既往动物研究发现,与非高脂饮食小鼠相比,高脂饮食喂养的小鼠肝组织IL-25表达减少。因本研究人体肝组织样本量少,或许增加样本量也能得出动物实验相似的结果。因此,根据本次临床研究和前期动物研究的结果,我们发现,无论在人体还是小鼠体内,体内IL-25水平和肝脂肪变严重程度呈负相关。结合动物实验中探讨的IL-25抑制NAFLD的机制,未来IL-25有希望开发成为治疗NAFLD肝脂肪变的新型药物。由于本研究的样本量仍然较少,该研究结论需进一步扩大样本量或在未来多中心研究中得到证实。
巨噬细胞在肝脏免疫中发挥着重要作用,主要分为两种表型,即M1型及M2型巨噬细胞。M1型巨噬细胞主要表达CD80、CD86、IL-1R、Toll样受体(TLR)2、TLR4和诱导型一氧化氮合酶(iNOS),由IL-12、干扰素-γ (IFN-γ)和脂多糖(LPS)诱导活化,参与Th1及Th17型免疫反应,从而发挥清除细菌病毒、促进炎症等效应;M2型巨噬细胞主要表面标志物为ARGINASE-1、CD260和TGM2,主要由IL-4和IL-13诱导活化,促进Th2型免疫反应,分泌抗炎因子(如IL-10、IL-4、IL-13、IL-5等),发挥防御寄生虫感染、抑制炎症、参与组织重塑和调节免疫等效应[19]。M1型巨噬细胞释放各种炎症因子促进肝细胞的凋亡和炎症细胞聚集。M2型巨噬细胞通过释放IL-10促进M1型巨噬细胞凋亡,从而缓解NAFLD[20]。体外研究发现,M2型巨噬细胞活化能增加肝细胞脂质分解基因的表达,抑制脂质合成酶活性,减少肝细胞内脂滴蛋白合成,缓解肝脏脂肪变性[21]。ZHAO等[22]发现脂肪源性干细胞可向M2型巨噬细胞分化并促进M2型巨噬细胞活化,从而缓解了HFD喂养的小鼠诱导的肥胖和代谢紊乱。M2型巨噬细胞能分泌Th2型细胞因子促进脂肪动员,释放游离脂肪酸,增强巨噬细胞的脂质摄取,改善线粒体呼吸能力,并减轻肝脏和脂肪组织中的脂质积累,从而改善NAFLD [7]。我们的动物实验也发现:移植小鼠肝内M2型巨噬细胞至NAFLD小鼠体内,能有效抑制NAFLD肝脂肪变[9]。可见M2型巨噬细胞对NAFLD有抑制作用。但上述现象均在动物或细胞实验中发现,本研究从人体肝组织标本探讨NAFLD患者体内M2型巨噬细胞水平变化,发现NAFLD患者肝内M2型巨噬细胞水平下降,且随肝脂肪变程度加重,肝内M2型巨噬细胞水平下降更为明显,这与上述动物和细胞研究结果相符。虽然本研究无法在临床研究中进一步探讨M2型巨噬细胞抑制NAFLD脂肪肝变的作用机制,但结合动物及细胞研究中探讨的M2型巨噬细胞抑制NAFLD肝脂肪变的相关机制,推测未来可能将M2型巨噬细胞的输注治疗开发为新型细胞治疗,从而治疗NAFLD肝脂肪变。
Th2型免疫反应在寄生虫感染和组织损伤修复中发挥着重要作用。Th2型反应主要细胞因子包括IL-4、IL-5、IL-9、IL-13、IL-25、IL-33等,效应细胞包括嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞、T辅助2细胞、2型先天淋巴细胞和M2型巨噬细胞等[23]。IL-25具有刺激Th2型免疫反应和促进Th2细胞因子增加的功能。动物实验结果表明:外源性IL-25干预高脂饮食诱导NAFLD小鼠后,2型先天淋巴样细胞(ILC2)数量增加,小鼠肝内IL-13表达上调,M2型巨噬细胞极化增加并伴随着小鼠脂质调节相关蛋白Cidea、Cidec表达下调、小鼠肝脏体积减小和肝脏脂肪变性缓解,然而IL-25对NAFLD的上述抑制作用在IL-13基因敲除小鼠中明显减弱[8],而ILC2是肝脏中主要的IL-25反应性及IL-13产生细胞[24],IL-4/IL-13可以诱导M2型巨噬细胞极化[19],说明IL-25是通过促进ILC2分泌Th2型细胞因子IL-13,进而诱导M2巨噬细胞极化调节脂质代谢抑制了肝脂肪变。上述研究也仅在动物实验中发现IL-25可通过诱导Th2型免疫反应,促进IL-13增加,从而诱导M2巨噬细胞极化缓解肝脏脂肪变。本研究在人体内验证了上述结果,NAFLD患者血清及肝内IL-13、IL-4明显减少,而且其他的Th2型细胞因子IL-10及IL-5也呈下降趋势,并伴随着M2巨噬细胞数量的减少。故猜测IL-25可以通过增加人体内Th2型免疫反应细胞因子、诱导Th2型免疫反应效应细胞M2型巨噬细胞活化,进而调节脂质代谢,对NAFLD肝脂肪变有一定的治疗作用。
综上所述,本研究在NAFLD患者体内分别从mRNA转录水平和蛋白水平验证了IL-25、Th2型细胞因子及M2巨噬细胞的水平明显减少。结合既往动物实验和细胞实验中探讨的机制,外源性补充IL-25和M2型巨噬细胞,激活人体内Th2型免疫反应可能对NAFLD肝脂肪变有治疗作用。
| [1] |
MANTOVANI A, SCORLETTI E, MOSCA A, et al. Complications, morbidity and mortality of nonalcoholic fatty liver disease[J]. Metabolism, 2020, 154170. DOI:10.1016/j.metabol.2020.154170.[publishedonlineaheadofprint |
| [2] |
YOUNOSSI Z M, KOENIG A B, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease: Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64(1): 73-84. DOI:10.1002/hep.28431 |
| [3] |
TILG H, MOSCHEN A R. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis[J]. Hepatology, 2010, 52(5): 1836-1846. DOI:10.1002/hep.24001 |
| [4] |
BARLOW J L, MCKENZIEB A N J. Nuocytes: expanding the innate cell repertoire in type-2 immunity[J]. J Leukoc Biol, 2011, 90(5): 867-874. DOI:10.1189/jlb.0311160 |
| [5] |
TAMACHI T, MAEZAWA Y, IKEDA K, et al. IL-25 enhances allergic airway inflammation by amplifying a TH2 cell-dependent pathway in mice[J]. J Allergy Clin Immunol, 2006, 118(3): 606-614. DOI:10.1016/j.jaci.2006.04.051 |
| [6] |
THOMAS J A, POPE C, WOJTACHA D, et al. Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis, regeneration, and function[J]. Hepatology, 2011, 53(6): 2003-2015. DOI:10.1002/hep.24315 |
| [7] |
FENG J, LI L, OU Z, et al. IL-25 stimulates M2 macrophage polarization and thereby promotes mitochondrial respiratory capacity and lipolysis in adipose tissues against obesity[J]. Cell Mol Immunol, 2018, 15(5): 493-505. DOI:10.1038/cmi.2016.71 |
| [8] |
WANG A J, YANG Z, GRINCHUK V, et al. IL-25 or IL-17-E protects against high-fat diet-induced hepatic steatosis in mice dependent upon IL-13 activation of STAT6[J]. J Immunol, 2015, 195(10): 4771-4780. DOI:10.4049/jimmunol.1500337 |
| [9] |
ZHENG X L, WU J P, GONG Y, et al. IL-25 protects against high-fat diet-induced hepatic steatosis in mice by inducing IL-25 and M2a macrophage production[J]. Immunol Cell Biol, 2019, 97(2): 165-177. DOI:10.1111/imcb.12207 |
| [10] |
FRICKE W F, SONG Y, WANG A J, et al. Type 2 immunity-dependent reduction of segmented filamentous bacteria in mice infected with the helminthic parasite Nippostrongylus brasiliensis[J]. Microbiome, 2015, 3: 40. DOI:10.1186/s40168-015-0103-8 |
| [11] |
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018更新版)[J]. 中华肝脏病杂志, 2018, 26(3): 195-203. Fatty Liver and Alcoholic Liver Disease Group of Chinese Medical Association, Expert Committee of Fatty Liver Disease of Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: a 2018 update[J]. Chin J Hepatol, 2018, 26(3): 195-203. DOI:10.3969/j.issn.1672-5069.2018.02.007 |
| [12] |
KLEINER D E, BRUNT E M, VAN N M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. DOI:10.1002/hep.20701 |
| [13] |
BELJAARS L, SCHIPPERS M, REKER-SMIT C, et al. Hepatic localization of macrophage phenotypes during fibrogenesis and resolution of fibrosis in mice and humans[J]. Front Immunol, 2014, 5: 430. DOI:10.3389/fimmu.2014.00430 |
| [14] |
MIKOLASEVIC I, MILIC S, TURK WT, et al. Nonalcoholic fatty liver disease—a multisystem disease?[J]. World J Gastroenterol, 2016, 22(43): 9488-9505. DOI:10.3748/wjg.v22.i43.9488 |
| [15] |
ADAMS L A, ANSTEE Q M, TILG H, et al. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases[J]. Gut, 2017, 66(6): 1138-1153. DOI:10.1136/gutjnl-2017-313884 |
| [16] |
肖海英, 郑雪莲, 汪安江. 非酒精性脂肪性肝病治疗进展[J]. 中国实用内科杂志, 2017, 37(12): 1069-1073. XIAO H Y, ZHENG X L, WANG A J. Advance in treatment of non-nalcoholic fatty liver disease[J]. Chin J Pract Med, 2017, 37(12): 1069-1073. |
| [17] |
LIU Y, SHAO Z, SHANG G G, et al. Biological properties and the role of IL-25 in disease pathogenesis[J]. J Immunol Res, 2018, 6519465. DOI:10.1155/2018/6519465 |
| [18] |
BERNAL W, AUZINGER G, DHAWAN A, et al. Acute liver failure[J]. Lancet, 2010, 376(9736): 190-201. DOI:10.1016/S0140-6736(10)60274-7 |
| [19] |
SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425-6440. DOI:10.1002/jcp.26429 |
| [20] |
WAN J, BENKDANE M, TEIXEIRA-CLERC F, et al. M2 Kupffer cells promote M1 Kupffer cell apoptosis: a protective mechanism against alcoholic and nonalcoholic fatty liver disease[J]. Hepatology, 2014, 59(1): 130-142. DOI:10.1002/hep.26607 |
| [21] |
王祺, 许钦瑜, 吴惠敏, 等. 脂质诱导的巨噬细胞M1/M2型极化对肝细胞脂质代谢的影响[J]. 中华肝脏病杂志, 2018, 26(4): 276-281. WANG Q, XU Q Y, WU H M, et al. Effect of lipid-induced macrophage M1/M2 polarization on lipid metabolism in hepatocytes[J]. Chin J Hepatol, 2018, 26(4): 276-281. DOI:10.3760/cma.j.issn.1007-3418.2018.04.009 |
| [22] |
ZHAO H, SHANG Q W, PAN Z Z, et al. Exosomes from adipose-derived stem cells attenuate adipose inflammation and obesity through polarizing M2 macrophages and beiging in white adipose tissue[J]. Diabetes, 2018, 67(2): 235-247. DOI:10.2337/db17-0356 |
| [23] |
GIESECK R L, WILSON M S, WYNN T A. Type 2 immunity in tissue repair and fibrosis[J]. Nat Rev Immunol, 2018, 18(1): 62-76. DOI:10.1038/nri.2017.90 |
| [24] |
HAMMAD H, LAMBRECHT B N. Barrier epithelial cells and the control of type 2 immunity[J]. Immunity, 2015, 43(1): 29-40. DOI:10.1016/j.immuni.2015.07.007 |




