2. 225003 江苏 扬州,武警江苏省总队医院:门诊部;
3. 225003 江苏 扬州,武警江苏省总队医院:特色专业一科
2. Department of Outpatient, Jiangsu Provincial General Hospital of Armed Police, Yangzhou, Jiangsu Province, 225003, China;
3. First Department of Characteristic Specialities, Jiangsu Provincial General Hospital of Armed Police, Yangzhou, Jiangsu Province, 225003, China
皮肤鳞癌是一种常见的皮肤恶性肿瘤,主要起源于皮肤以及皮肤附属器,老年人好发,男性发病率高于女性,皮肤鳞癌的恶性程度较高,破坏范围更广,其可以沿着淋巴组织转移至邻近组织或全身[1]。研究显示:皮肤鳞癌的发生、发展可能与参与调控肿瘤细胞的生长、转移、凋亡的基因异常表达紧密相关,靶向基因治疗皮肤鳞癌已经成为目前的研究方向[2]。长链非编码RNA(long non-coding RNA, lncRNA)是在真核生物体内广泛表达的非编码RNA,其在人体组织中的表达具有特异性、时序性等特点,lncRNA参与胚胎发育、细胞分化、细胞稳态维持等生理过程[3]。lncRNA在肿瘤中异常表达,其可以调控肿瘤的转移和恶性生长,lncRNA可能是肿瘤治疗的有效靶点[4]。lncRNA HOXA-AS2是近年来发现的与肿瘤进展有关的调控因子,已知其在胃癌、非小细胞肺癌等肿瘤中表达上调,并且下调其表达可以降低肿瘤细胞恶性程度[5-6]。前期的预实验发现miR-20a和HOXA-AS2有互补结合位点。既往研究显示:miR-20a在皮肤鳞癌中低表达,并且上调miR-20a能够抑制皮肤鳞癌细胞生长和侵袭能力[7]。现阶段对于HOXA-AS2在皮肤鳞癌细胞增殖、凋亡、侵袭、迁移中的作用还不明确。本实验以皮肤鳞癌细胞A431为研究对象,探讨HOXA-AS2对皮肤鳞癌细胞生长、凋亡、迁移能力的影响和机制,为寻找有效的分子标记物来治疗皮肤鳞癌提供思路。
1 材料与方法 1.1 材料选取2016年2月至2019年12月在武警江苏总队医院手术切除的皮肤鳞癌组织和对应的癌旁正常组织各50例,组织采集经过患者和家属知情同意,组织标本保存在液氮中。HOXA-AS2 siRNA、HOXA-AS2 siRNA由生工生物工程(上海)股份有限公司合成;MMP-2抗体购自上海科顺生物科技有限公司;miR-20a inhibitor、inhibitor control、miR-20a mimics、mimics control购自广州复能基因有限公司;MUT、WT由上海伯易生物科技有限公司合成;MMP-9、C-Caspase-3抗体购自上海歌凡生物科技有限公司;皮肤鳞癌细胞A431购自通派(上海)生物科技有限公司。
1.2 qRT-PCR检测皮肤鳞癌组织中HOXA-AS2、miR-20a表达变化用TRIzol试剂提取皮肤鳞癌组织以及对应的癌旁正常组织中的总RNA,RNA经过紫外分光光度计检测浓度和纯度以后,放在-80 ℃的冰箱中保存。mRNA检测的逆转录体系包括:2 μL的PrimeSLiPt mix、8 μL的RNA提取液+DEPC水。miRNA检测的逆转录体系为:2 μL的5×g DNA Eraser Buffer、200 μg的RNA、1 μL的gDNA Eraser、1 μL的Primer Script RT Enzyme Mix Ⅰ、3 μL的miRNA RT primer、4 μL的5×PrimeScript Buffer,添加DEPC水至20 μL。逆转录反应条件为:在37 ℃孵育15 min,85 ℃孵育5 s,4 ℃保存。mRNA检测的PCR反应体系包括:2 μL的cDNA、0.4 μL的上下游引物、5 μL的SYBR Ⅱ、2.2 μL的DEPC水。miRNA PCR反应体系包括:1 μL的cDNA、0.4 μL的上下游引物、5 μL的SYBR primer Ex Taq,添加DEPC水至20 μL。PCR反应条件为:放在95 ℃孵育5 min,95 ℃孵育30 s,60 ℃孵育1 min,72 ℃孵育1 min,40个循环。HOXA-AS2以GAPDH作为内参,miR-20a以U6作为内参,按照2-△△Ct法计算目的基因表达变化。
1.3 细胞分组皮肤鳞癌细胞接种到12孔板内,细胞密度为60%时,用Lipofectamine 2000将HOXA-AS2 siRNA和siRNA control分别转染到细胞中,命名为si-HOXA-AS2和si-NC组,将未转染干预的皮肤鳞癌细胞作为Control组。细胞培养24 h,采用qRT-PCR检测HOXA-AS2、miR-20a表达变化,步骤同1.2。
1.4 MTT检测细胞增殖在96孔板中接种皮肤鳞癌细胞,每个孔中添加100 μL的细胞培养液(含有约3 000个细胞),按照Control、si-NC、si-HOXA-AS2组分组方法处理细胞,放在37 ℃、5 % CO2培养箱中培养24、48、72、96 h以后,取出培养板,吸取MTT工作溶液添加到96孔板中,每孔10 μL,于37 ℃继续孵育4 h。去上清,加入DMSO溶液150 μL,孵育10 min,置于酶标仪上(检测波长为450 nm)测定每孔的光密度值D(450),以该值表示细胞增殖能力。
1.5 克隆形成实验检测细胞克隆将Control、si-NC、si-HOXA-AS2组细胞接种到10 cm的细胞培养皿中,每个培养皿接种1 000个细胞,放在37 ℃、5 % CO2培养箱中培养21 d。取出细胞培养皿,用4 %的多聚甲醛固定15 min以后,用吉姆萨染色液染色,放在显微镜下观察细胞克隆形成数目(细胞数目>50个的克隆团)。
1.6 流式细胞仪检测细胞凋亡收集培养24 h以后的Control、si-NC、si-HOXA-AS2组细胞,将细胞悬浮在PBS溶液中,调整细胞浓度为每毫升含106个细胞。吸取细胞培养液1 mL,1 000×g离心10 min,去上清,加入Binding Buffer 400 μL,充分混合,分别加入Annexin V-FITC和PI染液各5 μL,加入到悬浮细胞溶液中,放在避光条件下孵育15 min。采用流式细胞仪检测各组细胞凋亡。
1.7 Transwell小室实验检测细胞侵袭和迁移侵袭实验步骤:吸取5 mg/mL的Matergel添加到Transwell小室的上室中,在室温条件下风干1 h。取Control、si-NC、si-HOXA-AS2组细胞,采用无血清的细胞培养液重悬细胞浓度为1×105/mL,吸取200 μL添加到上室中,然后在下室中添加500 μL的含血清的细胞培养液,放在37 ℃、5 % CO2培养箱中培养24 h。PBS洗涤小室,甲醛固定,0.1%的结晶紫染色,镜下记录细胞侵袭数目即细胞穿膜数目。细胞迁移实验同侵袭实验,无Matergel包被步骤。
1.8 Western blot检测MMP-2、MMP-9、C-Caspase-3蛋白表达收集培养24 h以后的Control、si-NC、si-HOXA- AS2组细胞,添加RIPA裂解液,冰浴20 min。12 000×g、4 ℃离心10 min,收集上清即为细胞总蛋白。以BCA方法检测蛋白浓度。在蛋白中添加5×Loading Buffer混合煮沸反应5 min。常规方法制备5%的浓缩胶和10%的分离胶,60 V恒压在浓缩胶中电泳,80 V恒压在分离胶中电泳。将NC膜裁剪成合适大小,浸泡在转移缓冲液中10 min。以400 mA恒流转膜1 h。将NC膜放在封闭液(5%牛血清白蛋白)中,在室温条件下孵育2 h,再将NC膜放在一抗稀释液中,在4 ℃环境中结合过夜,最后把NC膜置于二抗稀释液中,室温结合2 h。滴加ECL显色试剂,静置1 min。用Image J分析条带的光密度值,GAPDH作为内参,分析目的蛋白表达变化。
1.9 HOXA-AS2靶基因预测和鉴定用生物信息学软件starbase(http://starbase.sysu.edu.cn/starbase2/)分析HOXA-AS2靶基因,HOXA-AS2与miR-20a有互补结合位点,用荧光素酶报告系统鉴定二者的靶向关系。把MUT、WT分别与miR-20a mimics、mimics control共转染至皮肤鳞癌细胞,转染24 h,严格按照试剂盒的要求检测荧光素酶活性。MUT、WT分别为含有突变以后的HOXA-AS2结合位点、含没有突变的HOXA-AS2结合位点的荧光素酶报告载体。
1.10 miR-20a inhibitor对HOXA-AS2 siRNA影响皮肤鳞癌细胞增殖、克隆、凋亡、侵袭、迁移的作用检测在皮肤鳞癌细胞中分别将HOXA-AS2 siRNA、inhibitor control和HOXA-AS2 siRNA、miR-20a inhibitor共转染,命名为si-HOXA-AS2+anti-NC和si-HOXA-AS2+anti-miR-20a组,利用MTT方法检测细胞增殖(步骤同1.4),克隆形成实验检测细胞克隆能力(步骤同1.5),流式细胞仪检测细胞凋亡(步骤同1.6),Transwell小室检测细胞侵袭和迁移(步骤同1.7),Western blot检测MMP-2、MMP-9、C-Caspase-3蛋白表达(步骤同1.8)。
1.11 统计学分析利用SPSS 21.0统计软件,计量资料采用x±s表示,两组数据间比较用独立样本t检验,多组数据比较用单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 HOXA-AS2在皮肤鳞癌组织中的表达上调皮肤鳞癌组织中HOXA-AS2表达高于癌旁正常组织(P < 0.05,图 1)。HOXA-AS2在皮肤鳞癌组织中表达上调。
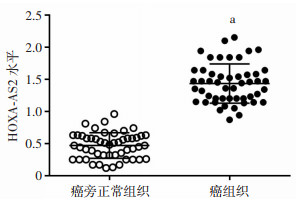
|
| a: P < 0.05,与癌旁正常组织比较 图 1 qRT-PCR检测皮肤鳞癌组织中HOXA-AS2的表达 |
2.2 HOXA-AS2 siRNA对皮肤鳞癌细胞增殖、克隆和凋亡的影响
与si-NC组比较,si-HOXA-AS2组皮肤鳞癌细胞中HOXA-AS2表达下降,细胞增殖能力降低,细胞克隆形成数目减少,凋亡率升高,C-Caspase-3蛋白表达增多(P < 0.05,图 2)。结果表明:HOXA-AS2 siRNA下调皮肤鳞癌细胞中HOXA-AS2表达,降低细胞增殖、克隆能力,诱导细胞凋亡。
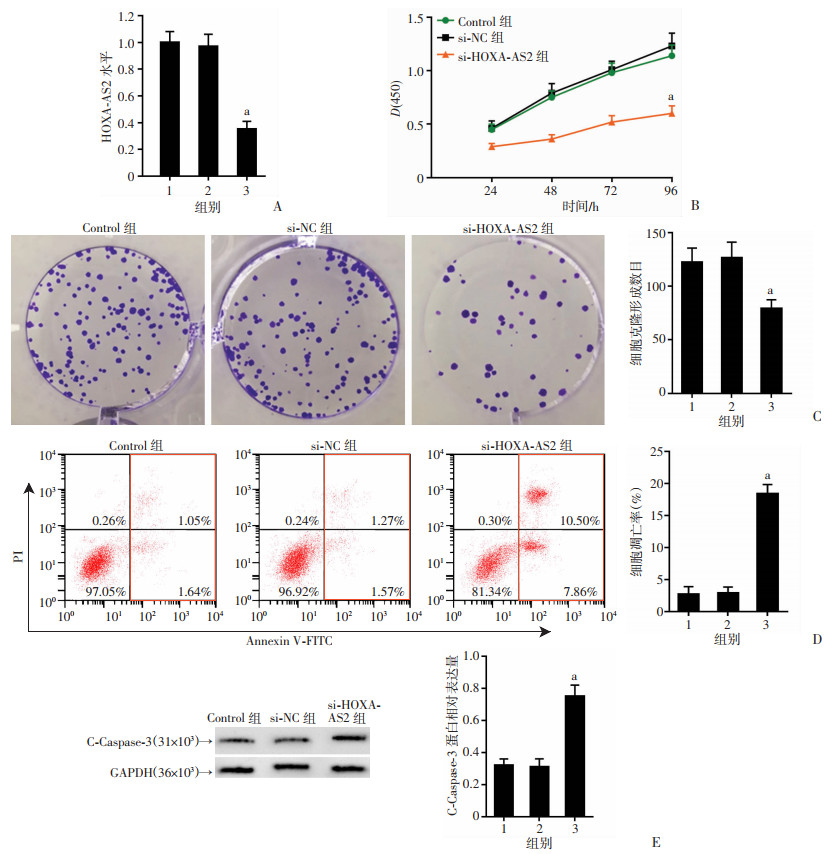
|
|
1: Control组;2:si-NC组; 3: si-HOXA-AS2组;a:P < 0.05,与si-NC组比较 A:qRT-PCR检测HOXA-AS2表达;B:MTT检测细胞增殖能力;C:克隆形成实验检测细胞克隆形成数目;D:流式细胞仪检测细胞凋亡;E:Western blot检测C-Caspase-3蛋白表达 图 2 HOXA-AS2 siRNA对皮肤鳞癌细胞增殖、克隆、凋亡和C-Caspase-3蛋白表达影响 |
2.3 HOXA-AS2 siRNA对皮肤鳞癌细胞侵袭和迁移的影响
与si-NC组比较,si-HOXA-AS2组皮肤鳞癌细胞侵袭数目和迁移数目减少,MMP-2、MMP-9蛋白表达减少(P < 0.05,图 3)。结果表明:HOXA-AS2 siRNA抑制皮肤鳞癌细胞侵袭和迁移。

|
|
1:Control组;2:si-NC组; 3: si-HOXA-AS2组;a:P < 0.05,与si-NC组比较 A:Transwell小室实验检测细胞侵袭(×200);B:Transwell小室实验检测细胞迁移(×200);C:Western blot检测MMP-2、MMP-9蛋白表达 图 3 HOXA-AS2 siRNA对皮肤鳞癌细胞侵袭、迁移和MMP-2、MMP-9蛋白表达的影响 |
2.4 HOXA-AS2和miR-20a互为靶向关系
生物信息学软件预测HOXA-AS2和miR-20a有互补结合位点,并且WT和miR-20a mimics共转染后的细胞荧光素酶活性降低(P < 0.05,图 4)。结果表明:HOXA-AS2和miR-20a互为靶向关系。
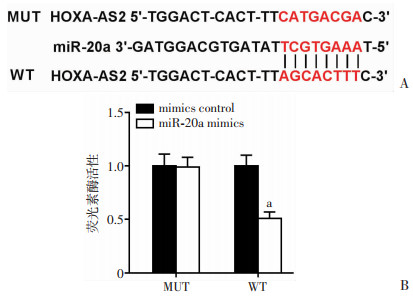
|
| A:生物信息学软件预测HOXA-AS2和miR-20a结合位点;B:荧光素酶报告系统鉴定二者的靶向关系 a:P < 0.05,与mimics control比较 图 4 HOXA-AS2和miR-20a互为靶向关系 |
2.5 HOXA-AS2 siRNA对皮肤鳞癌细胞中miR-20a表达的影响
皮肤鳞癌组织中miR-20a表达低于正常组织(P < 0.05,图 5A);皮肤鳞癌组织中miR-20a表达与HOXA- AS2负相关(图 5B);与si-NC组比较,si-HOXA-AS2组皮肤鳞癌细胞中miR-20a表达升高(P < 0.05,图 5C)。结果表明:皮肤鳞癌组织中miR-20a和HOXA-AS2负相关,HOXA-AS2 siRNA促进皮肤鳞癌细胞中miR-20a表达。
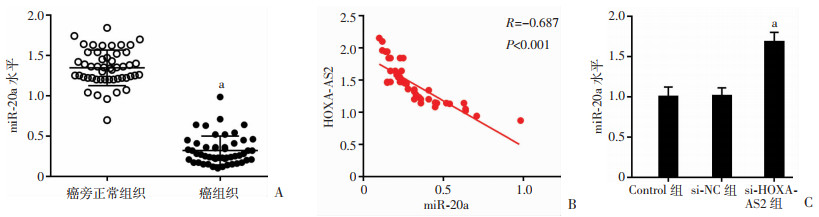
|
| A:qRT-PCR检测皮肤鳞癌组织中miR-20a的表达a:P < 0.05,与癌旁正常组织比较;B:皮肤鳞癌组织中miR-20a与HOXA-AS2表达的相关性分析;C:下调HOXA-AS2后,皮肤鳞癌细胞中miR-20a的表达 a:P < 0.05,与si-NC组比较 图 5 皮肤鳞癌组织中miR-20a表达变化及下调HOXA-AS2对皮肤鳞癌细胞中miR-20a表达的影响 |
2.6 miR-20a inhibitor对HOXA-AS2 siRNA影响皮肤鳞癌细胞增殖、克隆、凋亡、侵袭、迁移的作用
与si-HOXA-AS2+anti-NC组比较,si-HOXA-AS2+anti-miR-20a组皮肤鳞癌细胞中miR-20a表达降低,细胞增殖能力、克隆形成数目升高,凋亡率降低,细胞中C-Caspase-3蛋白表达减少,细胞侵袭数目、迁移数目增加,细胞中MMP-2、MMP-9蛋白表达升高(P < 0.05,图 6、7)。结果表明:miR-20a inhibitor逆转HOXA-AS2 siRNA对皮肤鳞癌细胞增殖、克隆、侵袭、迁移抑制作用和凋亡促进作用。
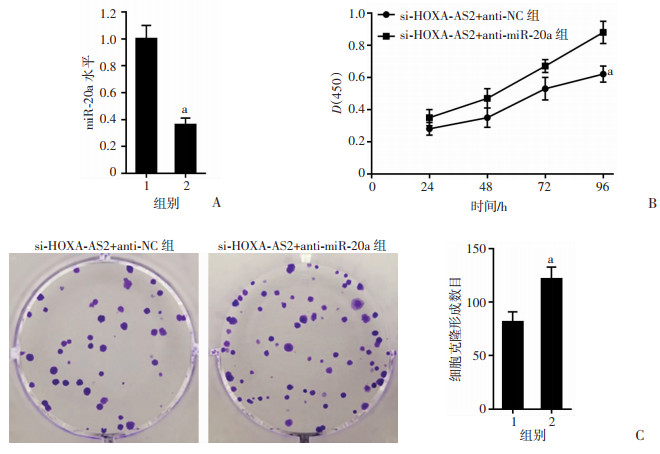
|
|
1:si-HOXA-AS2+anti-NC组;2:si-HOXA-AS2+anti-miR-20a组;a:P < 0.05,与si-HOXA-AS2+anti-NC组比较 A:qRT-PCR检测细胞中miR-20a表达;B:MTT检测两组细胞增殖能力;C:克隆形成实验检测细胞克隆形成数目 图 6 HOXA-AS2 siRNA和miR-20a inhibitor共转染后皮肤鳞癌细胞增殖和克隆能力变化 |

|
|
1:si-HOXA-AS2+anti-NC组;2:si-HOXA-AS2+anti-miR-20a组;a:P < 0.05,与si-HOXA-AS2+anti-NC组比较 A:流式细胞仪检测细胞凋亡;B:Transwell小室实验检测细胞侵袭(×200);C:Transwell小室实验检测细胞迁移(×200);D:Western blot检测细胞中MMP-2、MMP-9、C-Caspase-3蛋白表达 图 7 HOXA-AS2 siRNA和miR-20a inhibitor共转染后皮肤鳞癌细胞凋亡、侵袭、迁移和细胞中MMP-2、MMP-9、C-Caspase-3蛋白表达 |
3 讨论
lncRNA是一类长度大于200 nt的非编码RNA,在人体组织中均有表达[8]。绝大多数的lncRNA没有编码蛋白质的功能,但其可以通过复杂的调控网络,影响下游基因表达,参与如细胞凋亡、细胞衰老、细胞分化等多种生理病理过程[9]。lncRNA还与人类多种疾病如胃炎、糖尿病、阿尔茨海默病等有关,lncRNA可能是疾病治疗的分子靶点[10]。HOXA-AS2是近年来研究发现的与肿瘤发生和转移关系密切的lncRNA,其在肿瘤组织中表达改变,参与肿瘤细胞的生长、转移等过程[11]。在非小细胞肺癌中发现HOXA-AS2高表达,并且HOXA-AS2具有促进肺癌进展和转移的作用[5]。下调HOXA-AS2降低甲状腺乳头状癌细胞侵袭和迁移能力[12]。本研究结果显示:HOXA-AS2在皮肤鳞癌组织中表达上调,并且下调HOXA-AS2可以降低皮肤鳞癌细胞增殖、克隆、侵袭、迁移能力,诱导细胞凋亡,HOXA-AS2在皮肤鳞癌进展中可能发挥类似癌基因的作用,这与以前的研究报道相符合,均说明HOXA-AS2在肿瘤中发挥促进作用。
细胞凋亡是机体内多种因素共同作用的结果,受细胞内多种基因共同调控。Caspase是一个与细胞凋亡关系密切的蛋白家族,其含有多个蛋白成员,这些蛋白成员在正常情况下多以没有活性的形式存在,当受到细胞凋亡信号刺激以后,细胞内的Caspase蛋白成员被激活,共同诱导细胞凋亡发生[13]。Caspase-3是Caspase凋亡级联反应中的下游因子,在细胞凋亡过程中发挥凋亡执行的作用,其活化后被认为是细胞凋亡的不可逆标志[14-15]。肿瘤细胞转移与细胞外基质降解相关,肿瘤细胞合成的细胞外基质降解酶可促进细胞的侵袭和迁移[16]。基质金属蛋白酶家族具有分解细胞外基质的功能[17],MMP-2、MMP-9是目前发现的与肿瘤转移关系最密切的基质金属蛋白酶家族成员,表达升高后可以诱导肿瘤转移[18-19]。本研究结果表明:下调HOXA-AS2后的皮肤鳞癌细胞中C-Caspase-3蛋白表达升高,MMP-2、MMP-9蛋白表达下降,提示下调HOXA-AS2诱导皮肤鳞癌细胞凋亡,抑制细胞侵袭和迁移,这与细胞凋亡、迁移、侵袭检测结果一致。
lncRNA的功能多样与其复杂的调控机制有关,其可以通过与miRNA结合影响miRNA的表达,发挥生物学作用[20-21]。本研究结果表明:HOXA-AS2与miR-20a互为靶向关系,并且皮肤鳞癌组织中HOXA-AS2、miR-20a负相关,这可能提示HOXA-AS2作用机制与miR-20a有关。miR-20a是一个与肿瘤有关的调控子,miR-20a在乳腺癌中低表达,并且其可以通过靶向负调控高迁移率族蛋白A2(high mobility group A2, HMGA2)的表达抑制乳腺癌细胞侵袭和迁移,诱导细胞凋亡[22]。子宫内膜癌中miR-20a低表达,miR-20a通过靶向抑制信号转录和激活因子3(signal transducer and activators of transcription 3, STAT3)表达降低子宫内膜癌细胞转移能力[23]。在皮肤鳞癌中的研究表明:miR-20a可以抑制皮肤鳞癌细胞的生长、侵袭等恶性生物学行为,机制与miR-20a靶向下调LIM激酶1(LIM kinase 1, LIMK1)表达有关,miR-20a在皮肤鳞癌进展中发挥抑制作用[7]。本研究结果显示:下调miR-20a可以逆转下调HOXA-AS2对皮肤鳞癌细胞增殖、克隆、侵袭、迁移和凋亡的作用,这证实HOXA-AS2作用机制与miR-20a有关。
综上所述,HOXA-AS2在皮肤鳞癌发生和转移中可能发挥类似癌基因的作用,下调其表达可以降低皮肤鳞癌细胞生长、迁移、侵袭能力,诱导细胞凋亡,作用机制与靶向促进miR-20a的表达有关。本研究结果为靶向基因治疗皮肤鳞癌提供了新思路,为研究皮肤鳞癌分子发生机制提供了研究数据。本研究没有分析皮肤鳞癌患者临床病理特征与HOXA-AS2表达的关系,没有在体内以及多株皮肤鳞癌细胞中进行验证,在以后的实验中将对上述问题进行深入探讨。
| [1] |
BANDER T S, NEHAL K S, LEE E H. Cutaneous squamous cell carcinoma: updates in staging and management[J]. Dermatol Clin, 2019, 37(3): 241-251. DOI:10.1016/j.det.2019.03.009 |
| [2] |
HU G L, LIANG L L, LIU Y L, et al. TWEAK/Fn14 interaction confers aggressive properties to cutaneous squamous cell carcinoma[J]. J Investig Dermatol, 2019, 139(4): 796-806. DOI:10.1016/j.jid.2018.09.035 |
| [3] |
CAI C B, YANG L, TANG Y L, et al. Prediction of overall survival in gastric cancer using a nine-lncRNA[J]. DNA Cell Biol, 2019, 38(9): 1005-1012. DOI:10.1089/dna.2019.4832 |
| [4] |
WANG D, WAN X C, ZHANG Y L, et al. A novel androgen-reduced prostate-specific lncRNA, PSLNR, inhibits prostate-cancer progression in part by regulating the p53-dependent pathway[J]. Prostate, 2019, 79(12): 1362-1377. DOI:10.1002/pros.23840 |
| [5] |
CUI T J, LIN G S, DAI Y M, et al. LncRNA HOXA-AS2 regulates microRNA-216a-5p to promote malignant progression of non-small cell lung cancer[J]. Eur Rev Med Pharmacol Sci, 2019, 23(3): 264-273. DOI:10.26355/eurrev_201908_18656 |
| [6] |
XIE M, SUN M, ZHU Y N, et al. Long noncoding RNA HOXA-AS2 promotes gastric cancer proliferation by epigenetically silencing P21/PLK3/DDIT3 expression[J]. Oncotarget, 2015, 6(32): 33587-33601. DOI:10.18632/oncotarget.5599 |
| [7] |
ZHOU J D, LIU R, LUO C Q, et al. MiR-20a inhibits cutaneous squamous cell carcinoma metastasis and proliferation by directly targeting LIMK1[J]. Cancer Biol Ther, 2014, 15(10): 1340-1349. DOI:10.4161/cbt.29821 |
| [8] |
YANG Q, WAN Q, ZHANG L T, et al. Analysis of LncRNA expression in cell differentiation[J]. RNA Biol, 2018, 15(3): 413-422. DOI:10.1080/15476286.2018.1441665 |
| [9] |
WANG J, WANG Z P, YAO W, et al. The association between lncRNA LINC01296 and the clinical characteristics in neuroblastoma[J]. J Pediatr Surg, 2019, 54(12): 2589-2594. DOI:10.1016/j.jpedsurg.2019.08.032 |
| [10] |
SCHMITZ S U, GROTE P, HERRMANN B G. Mechanisms of long noncoding RNA function in development and disease[J]. Cell Mol Life Sci, 2016, 73(13): 2491-2509. DOI:10.1007/s00018-016-2174-5 |
| [11] |
DONG X Y, FANG Z G, YU M X, et al. Knockdown of long noncoding RNA HOXA-AS2 suppresses chemoresistance of acute myeloid leukemia via the miR-520c-3p/S100A4 axis[J]. Cell Physiol Biochem, 2018, 51(2): 886-896. DOI:10.1159/000495387 |
| [12] |
XIA F D, CHEN Y, JIANG B, et al. Long noncoding RNA HOXA-AS2 promotes papillary thyroid cancer progression by regulating miR-520c-3p/S100A4 pathway[J]. Cell Physiol Biochem, 2018, 50(5): 1659-1672. DOI:10.1159/000494786 |
| [13] |
YAO Q, WANG W M, JIN J, et al. Synergistic role of Caspase-8 and Caspase-3 expressions: prognostic and predictive biomarkers in colorectal cancer[J]. Cancer Biomark, 2018, 21(4): 899-908. DOI:10.3233/CBM-170967 |
| [14] |
YANG J, MENG X L, YU Y, et al. LncRNA POU3F3 promotes proliferation and inhibits apoptosis of cancer cells in triple-negative breast cancer by inactivating caspase 9[J]. Biosci Biotechnol Biochem, 2019, 83(6): 1117-1123. DOI:10.1080/09168451.2019.1588097 |
| [15] |
BOUDREAU M W, PEH J, HERGENROTHER P J. Procaspase-3 overexpression in cancer: a paradoxical observation with therapeutic potential[J]. ACS Chem Biol, 2019, 14(11): 2335-2348. DOI:10.1021/acschembio.9b00338 |
| [16] |
JELENIEWICZ W, CYBULSKI M, NOWAKOWSKI A, et al. MMP-2 mRNA expression in ovarian cancer tissues predicts patients' response to platinum-taxane chemotherapy[J]. Anticancer Res, 2019, 39(4): 1821-1827. DOI:10.21873/anticanres.13289 |
| [17] |
BAKAR F, KILIC-KURT Z, CAGLAYAN M G, et al. The effects of 1, 3, 5-trisubstitutedindole derivatives on cell growth, apoptosis and MMP-2/9 mRNA expression of MCF-7 human breast cancer cells[J]. Anti-Cancer Agents Med Chem, 2017, 17(5): 762-767. DOI:10.2174/1871520616666160802115737 |
| [18] |
HUNG C Y, LEE C H, CHIOU H L, et al. Praeruptorin-B inhibits 12-O-tetradecanoylphorbol-13-acetate-induced cell invasion by targeting AKT/NF-κB via matrix metalloproteinase-2/-9 expression in human cervical cancer cells[J]. Cell Physiol Biochem, 2019, 52(6): 1255-1266. DOI:10.33594/000000088 |
| [19] |
LOU C H, ZHU Z H, ZHAO Y P, et al. Arctigenin, a lignan from Arctium lappa L., inhibits metastasis of human breast cancer cells through the downregulation of MMP-2/-9 and heparanase in MDA-MB-231 cells[J]. Oncol Rep, 2017, 37(1): 179-184. DOI:10.3892/or.2016.5269 |
| [20] |
HUANG Y. The novel regulatory role of lncRNA-miRNA-mRNA axis in cardiovascular diseases[J]. J Cell Mol Med, 2018, 22(12): 5768-5775. DOI:10.1111/jcmm.13866 |
| [21] |
QIAN Y, MAO Z D, SHI Y J, et al. Comprehensive analysis of miRNA-mRNA-lncRNA networks in non-smoking and smoking patients with chronic obstructive pulmonary disease[J]. Cell Physiol Biochem, 2018, 50(3): 1140-1153. DOI:10.1159/000494541 |
| [22] |
ZHAO W Y, GENG D H, LI S Q, et al. LncRNA HOTAIR influences cell growth, migration, invasion, and apoptosis via the miR-20a-5p/HMGA2 axis in breast cancer[J]. Cancer Med, 2018, 7(3): 842-855. DOI:10.1002/cam4.1353 |
| [23] |
HUANG Y, YANG N. MicroRNA-20a-5p inhibits epithelial tomesenchymal transition and invasion of endometrial cancer cells by targeting STAT3[J]. Int J Clin Exp Pathol, 2018, 11(12): 5715-5724. |



