失血性休克、海水浸泡是海上军事训练和作战中的重要问题。近年来,随着海上军事活动的增加,由于船舰上空间狭小,在遭到攻击后易落水,致死率明显增加。海战中失血性休克伤员合并海水浸泡极为常见,据报道,海战中休克发生率为陆战中的2倍,病死率为陆战的5~10倍[1-2]。由于海水温度低,且含有大量细菌,具有高渗等特点,海水浸泡合并失血性休克患者具有病死率高、致残率高及救治难度大等问题。
液体复苏是休克救治的基础措施,常规环境的复苏液体有晶体液、胶体液、等渗性溶液等。由于海水浸泡后,病理生理特点不同,适当的低渗性溶液能否改善海水浸泡合并失血性休克的治疗效果不清楚。因此,本研究利用海水浸泡合并失血性休克大鼠模型,探讨不同渗透压的盐水对海水浸泡合并失血性休克大鼠血压、存活、致死三联征以及肝脏、肾脏功能的影响,为海水浸泡战创伤休克的救治提供液体选择。
1 材料与方法 1.1 实验动物及模型建立取SPF级SD大鼠128只,雄性,10周龄,体质量(220±20)g,由陆军特色医学中心实验动物中心提供。实验当天用3%戊巴比妥钠行腹腔麻醉,待麻醉后固定,经颈动脉和颈静脉插管,同时放置温度探头,与颈动脉伴行,颈动脉插管用于监测血压和抽血,颈静脉插管用于输液治疗,温度探头用于监测核心体温。插管后稳定30 min浸泡入15 ℃的人工海水中,海水浓度为2.535%。从大鼠浸泡入海水中开始放血,40 min内放血到40 mmHg,并维持40 mmHg 2 h,完成海水浸泡合并失血性休克模型[3]。
1.2 实验方案128只成年雄性SD大鼠按随机数字表法分为4组:乳酸林格氏液LR对照组、0.3%盐水组、0.6%盐水组和0.9%生理盐水组,每组32只。大鼠海水浸泡合并失血性休克模型建立后,从海水中取出,立即放置于温控箱中复温、复苏治疗,输注3倍失血量的液体,输注速度为25 mL/h。根据前期实验结果,复温方案采用阶梯复温方式,即大鼠浸泡出水入温箱后,维持核心温度34 ℃ 2 h,再通过环境复温到37 ℃ 2 h。
1.3 检测指标及方法实验分成3批,第1批各组取16只大鼠用于观察存活率和存活时间,实验完成后肌注青霉素和链霉素,记录存活时间至72 h,计算72 h动物的存活率;第2批各组取8只大鼠用于体温和平均动脉压监测,每10分钟记录1次体温和血压,直到实验结束,在不同时间点取血用生化分析仪(BXC800,Beckman,美国)测定肝脏功能(AST、ALT)和肾脏功能(BUN、Crea),同时用血气分析仪测定pH值;第3批实验各组在复温末取8只大鼠用于测定凝血功能。
1.4 统计学分析采用SPSS 19.0统计软件,所有数据用x±s表示。包括体温、凝血功能、肝脏、肾脏功能、pH均用重复测量单因素或双因素方差分析,动物存活时间组间比较采用Kaplan-Meier法和Log-rank检验。检验水准α=0.05。
2 结果 2.1 不同渗透压盐水对海水浸泡合并失血性休克大鼠平均动脉压的影响海水浸泡合并失血性休克后大鼠的MAP显著降低,降至30 mmHg左右,随着大鼠进入温箱并输注液体40 min,不同渗透压的盐水和LR均可升高平均动脉压至80 mmHg左右;在输液完毕后,各组大鼠的MAP均有不同程度的下降,0.3%盐水组MAP降得最低,基本降至休克水平,0.6%盐水组、0.9%生理盐水组和LR组的MAP在输液完毕后下降得少,比较平稳地维持在60~70 mmHg(图 1)。
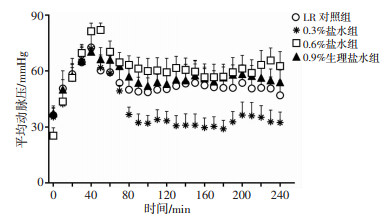
|
| 图 1 不同渗透压盐水对海水浸泡合并失血性休克大鼠平均动脉压的影响 |
2.2 不同渗透压盐水对海水浸泡合并失血性休克大鼠存活的影响
LR复苏后,海水浸泡合并失血性休克大鼠72 h存活数为3/16,存活时间为(29.4±29.1)h;0.3%盐水组、0.6%盐水组和0.9%生理盐水组72 h存活数分别为2/16、7/16和3/16,存活时间为(16.6±25.1)h、(35.4±34.0)h和(23.2±28.8)h。0.6%盐水组效果明显优于LR对照组组,差异有统计学意义(P<0.01,图 2)。
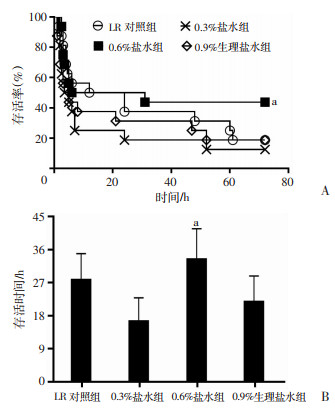
|
| A:存活率;B:存活时间;a:P<0.01,与LR对照组比较 图 2 不同渗透压盐水对海水浸泡合并失血性休克大鼠存活的影响 |
2.3 不同渗透压盐水对海水浸泡合并失血性休克大鼠致死三联征的影响
严重创伤合并大出血的患者,往往出现低体温、酸中毒和创伤性凝血病。这三者可相互促进,形成恶性循环,被称为“致死三联征”。分别观察不同渗透压盐水对海水浸泡合并失血性休克大鼠核心温度、pH值和凝血功能的影响。
2.3.1 不同渗透压盐水对海水浸泡合并失血性休克大鼠核心温度的影响海水浸泡合并失血性休克后,大鼠的核心温度显著降低,各组均降至33 ℃左右,浸泡出水后放置于温控箱中复温、复苏治疗,大鼠的核心体温均可有效恢复,但各组间差异无统计学意义(P>0.05,图 3)。
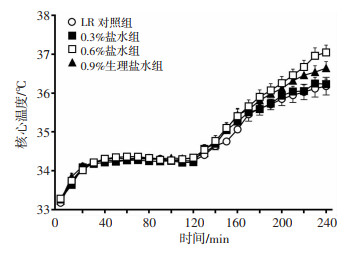
|
| 图 3 不同渗透压盐水对海水浸泡合并失血性休克大鼠核心温度的影响 |
2.3.2 不同渗透压盐水对海水浸泡合并失血性休克大鼠血气的影响
海水浸泡合并失血性休克后,大鼠的pH值显著降低,发生严重的酸中毒,pH、p(CO2)、HCO3-和BE分别降至7.08、27.91 mmHg、12.05 mmol/L和12.85 mmol/L;用液体复苏后可不同程度改善大鼠的酸中毒状态。LR复苏后大鼠的血气指标包括pH、p(CO2)、HCO3-和BE分别为7.27、26.5 mmHg、15.78 mmol/L和-7.1 mmol/L,0.9%生理盐水组与LR变化趋势一致,两者间差异无统计学意义;0.6%盐水组的pH、p(CO2)、HCO3-和BE有显著改善,与LR对照组比较,差异有统计学意义(P<0.05,表 1)。
| 组别 | 休克前 | 海水浸泡合并休克 | 输液末 | 低温维持末 | 复温末 |
| pH | |||||
| LR对照组 | 7.37±0.02 | 7.06±0.04 | 7.05±0.06 | 7.12±0.06 | 7.27±0.11 |
| 0.3%盐水组 | 7.35±0.03 | 7.08±0.07 | 7.10±0.05 | 7.17±0.09 | 7.31±0.07 |
| 0.6%盐水组 | 7.37±0.03 | 7.08±0.08 | 7.13±0.04 | 7.21±0.06 | 7.36±0.06a |
| 0.9%生理盐水组 | 7.37±0.02 | 7.08±0.04 | 7.08±0.07 | 7.17±0.05 | 7.29±0.07 |
| 二氧化碳分压 | |||||
| LR对照组 | 38.13±2.48 | 27.91±2.26 | 33.63±9.5 | 35.18±8.43 | 26.50±6.08 |
| 0.3%盐水组 | 38.36±3.58 | 28.79±1.40 | 31.30±5.19 | 33.23±5.44 | 24.48±4.03 |
| 0.6%盐水组 | 38.16±3.04 | 26.83±3.50 | 35.03±3.65 | 35.54±3.33 | 31.95±5.34 |
| 0.9%生理盐水组 | 39.95±2.56 | 26.06±4.47 | 33.89±5.12 | 36.08±4.54 | 26.14±3.38 |
| 碳酸氢根离子(HCO3-,mmol/L) | |||||
| LR对照组 | 21.65±2.53 | 12.05±2.49 | 13.23±1.34 | 12.56±1.88 | 15.78±1.92 |
| 0.3%盐水组 | 22.44±2.15 | 12.69±1.69 | 16.49±1.93 | 12.59±2.23 | 13.21±4.27 |
| 0.6%盐水组 | 21.75±1.69 | 12.23±1.47 | 13.38±0.99 | 15.30±2.09 | 16.56±1.38 |
| 0.9%生理盐水组 | 21.10±8.82 | 11.49±3.69 | 11.41±3.30 | 12.04±4.34 | 15.05±1.23 |
| 剩余碱(BE,mmol/L) | |||||
| LR对照组 | 2.14±1.81 | -12.85±2.23 | -6.45±1.11 | -5.94±2.82 | -7.10±2.04 |
| 0.3%盐水组 | 2.23±1.59 | -13.15±1.50 | -14.95±2.19 | -14.78±6.81 | -10.43±1.65 |
| 0.6%盐水组 | 2.14±0.66 | -13.94±2.54 | -12.23±1.92 | -10.85±7.66 | 5.41±1.54 |
| 0.9%生理盐水组 | 2.05±0.64 | -12.33±2.90 | -12.06±4.65 | -13.35±5.09 | -7.93±7.16 |
| LR:乳酸林格液,低温末为34 ℃维持结束这个点;复温末为37 ℃继续维持2 h点;a:P<0.01,与LR对照组比较 | |||||
2.3.3 不同渗透压盐水对海水浸泡合并失血性休克大鼠凝血功能的影响
海水合并失血性休克后,大鼠的凝血功能障碍,表现为活化部分凝血活酶时间、血浆凝血酶原时间和国际标准化比值显著升高和纤维蛋白原显著降低;液体复苏后可不同程度改善大鼠的凝血功能。LR复苏后大鼠的凝血功能指标包括活化部分凝血活酶时间、血浆凝血酶原时间、国际标准化比值和纤维蛋白原分别为66.3 s、28.1 s、1.71和0.39 mg/mL,不同渗透压盐水复苏后,凝血功能发生变化,0.9%生理盐水组与LR变化趋势一致,两者间差异无统计学意义;0.6%盐水组的活化部分凝血活酶时间、血浆凝血酶原时间和国际标准化比值显著降低,分别降低了28.7%、48.4%和25.7%,纤维蛋白原显著升高了102.6%,与LR对照组比较,差异有统计学意义(P<0.05,P<0.01,图 4)。
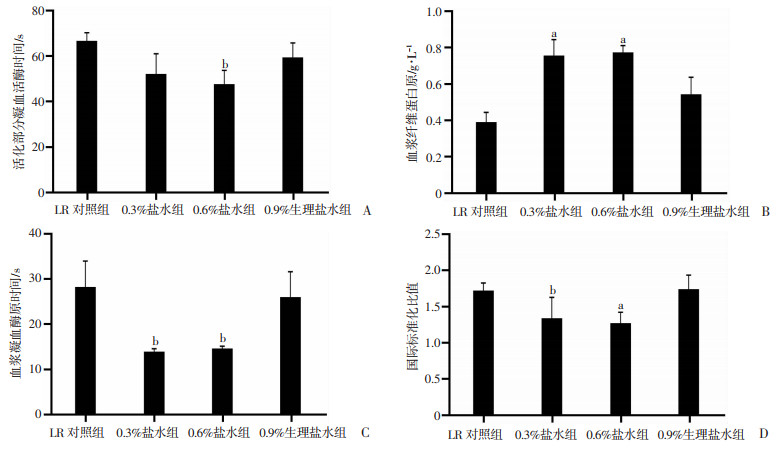
|
| A:活化部分凝血活酶时间;B:血浆纤维蛋白原;C:血浆凝血酶原时间;D:国际标准化比值;a:P<0.01,b:P<0.05,与LR对照组比较 图 4 不同渗透压盐水对海水浸泡合并失血性休克大鼠凝血功能的影响 |
2.4 不同渗透压盐水对海水浸泡合并失血性休克大鼠肝脏和肾脏功能的影响
海水浸泡合并失血性休克后,大鼠的肝脏和肾脏功能明显受损,表现在谷草转氨酶、谷丙转氨酶、尿素氮和血肌酐显著升高;各液体复苏可部分改善大鼠的肝脏和肾脏功能。LR对照组大鼠的谷草转氨酶、谷丙转氨酶、尿素氮和血肌酐分别为326.7 U/L、135.9 U/L、10.2 mmol/L和51.6 μmol/L;0.3%盐水组、0.9%生理盐水组与LR组效果一致,两者间差异无统计学意义;0.6%盐水组的谷草转氨酶、谷丙转氨酶、尿素氮和血肌酐显著降低,与LR对照组比较,分别降低了32.5%、29.9%、22.5%和19.6%,差异有统计学意义(P<0.05,P<0.01,图 5)。
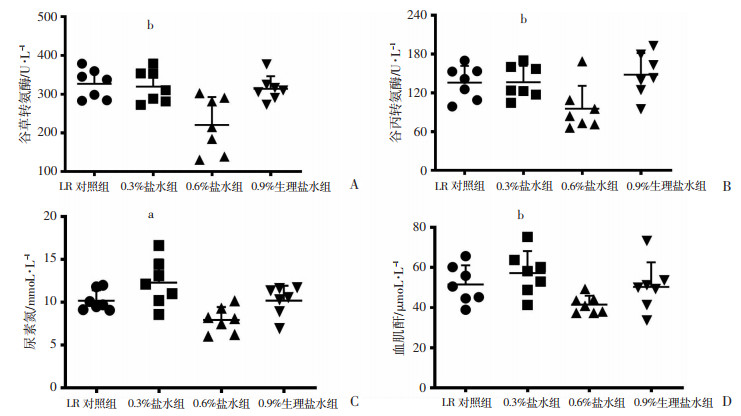
|
| A:谷草转氨酶;B:谷丙转氨酶;C:尿素氮;D:血肌酐;a:P<0.01,b:P<0.05,与LR对照组比较 图 5 不同渗透压盐水对海水浸泡合并失血性休克大鼠肝脏和肾脏功能的影响 |
3 讨论
失血性休克是战、创伤重要的死亡原因[4],创伤失血和海水浸泡所致的低温是导致致死三联征、器官功能严重受损和死亡率增高的重要原因[5-6]。及时有效地给予液体复苏和纠正低温可有效降低死亡率。然而,目前对于海水浸泡合并失血性休克患者的救治措施研究缺乏,本研究发现了不同渗透压的盐水对低温海水浸泡合并失血性休克大鼠有明显的影响。海水浸泡合并失血性休克后,适当低渗的盐水复苏可以减轻酸中毒和凝血功能障碍,保护器官功能,延长动物的存活时间,提高存活率。适度的低渗液体有利于海水浸泡合并失血性休克的救治。
本研究证实3个浓度的盐水均可在短时间内升高大鼠的平均动脉压。0.9%生理盐水组和LR对照组对海水浸泡合并失血性休克有很好的复苏效果。但4组比较,0.6%盐水组血压最高,并且稳压的时间更长,动物的存活时间更长。另有研究报道,0.9%生理盐水可导致代谢性酸中毒[7]。同时本研究也发现,与0.6%盐水组比较,0.9%生理盐水组pH下降得更多,治疗后恢复得更慢,器官功能损伤更重。休克时,因过度通气导致p(CO2)降低,而海水浸泡时的低体温造成CO2潴留,HCO3-下降,双重打击使酸中毒更加严重,用不同渗透压的盐水治疗后p(CO2)和HCO3-有所升高,说明不同渗透压的盐水对纠正海水浸泡合并失血性休克导致的酸中毒具有益处。
本研究中海水浸泡合并失血性休克大鼠的肝、肾功能指标显著升高,器官功能严重损害,不同渗透压的盐水治疗后,肝、肾功能指标有所降低,其中0.6%盐水组的效果最好。可能是因为海水浸泡合并失血性休克大鼠呈高钠、高钾和高氯血症。有研究认为,等渗(0.9%)生理盐水会引起溶血,增加器官功能损伤的风险,同时导致高氯酸代谢性酸中毒,进而引起肾脏功能受损[7]。又有学者认为等渗比低渗溶液排泄慢,氯离子潴留增多,引起高氯血症,加重肾脏负担[8]。预孵育或腹腔注射低渗溶液可防止胃癌细胞播散性结节的发生[9]。我们的结果也显示适当的低渗可以改善海水浸泡合并失血性休克大鼠的肝脏和肾脏功能。而且,本研究发现在改善器官功能损伤的过程中,凝血功能也发挥了很重要的作用,二者相互影响。海水浸泡合并失血性休克后,发生酸中毒、低体温和凝血功能障碍,引起纤维蛋白大量沉积,血管内弥漫性凝血;当休克时微循环灌注不足,酸中毒引起肠屏障功能减弱,从而导致多器官功能障碍[10-11]。同时当肝脏和肾脏功能受损后,机体能量产生减少,核心温度降低;而且蛋白质合成减少使凝血酶原缺乏;酸性产物堆积无法代谢,使“致死三联征”更严重[6]。
海水浸泡后机体的电解质和血浆渗透压受到明显影响,是造成高死亡率的重要原因[12]。本研究配置的人工海水中,渗透压为(1 250.00±1.52) mmol/L,钠离子浓度0.625~0.635 mol/L,pH 8.2,属高渗、高碱性液体。机体海水浸泡合并失血后,出现低血容量和高渗血症等严重的病理生理学改变。因此,我们认为补充血容量及有效纠正机体的高渗状态是救治的关键。本实验应用适当的低渗性液体来扩充血容量。李辉等[13]研究发现,输注适当的低渗氯化钠可减轻肺、脑水肿,对胸腔海水浸泡伤有很好的纠正高渗血症的作用。又有研究表明,过低渗透压的液体复苏可造成胶质细胞不同程度的损伤,导致细胞的功能和代谢发生改变[14]。本研究结果也证实了适当的低渗可以改善致死三联征,保护器官功能。低渗性液体对器官功能的保护作用可能是因为所含氯化钠浓度可以缓慢地降低渗透压,从而避免渗透压下降过低引发组织水肿和细胞水肿。
以往认为,应该对海水浸泡的低温患者实行快速复温,但是快速复温易导致复温性休克,更加重患者的损伤。奂剑波等[15]研究发现,在体温过低症患者的热水浴复温过程中,使用37 ℃复温1 h,大鼠的器官功能显著改善,但是37 ℃热水浴复温需要严格控制时长,并且体温恢复正常后仍有并发症发生。在前期实验中,比较了快速复温和阶梯式复温,发现阶梯式复温大鼠的存活明显高于快速复温(数据未列出)。因此,本实验采用阶梯式复温,即当大鼠脱离低温海水后,立即置于37 ℃环境箱中,当核心温度达到34 ℃时,立即停止加热,将环境温度降到25 ℃,此时大鼠的核心温度可以在34 ℃维持2 h,随后加热环境温度到37 ℃,维持2 h。
虽然本研究结果显示适当的低渗盐水对海水浸泡合并失血性休克大鼠有很好的治疗效果,但是仍存在不足。第一,本实验未观察低渗盐液的血浆渗透压;第二,本实验仅观察了不同渗透压的盐水对肝脏和肾脏的影响,未观察其他脏器的变化;第三,本实验仅仅观察了不同渗透压的盐水对海水浸泡合并失血性休克大鼠的治疗效果,并未阐明其机制,这将是我们以后工作的方向。
利益冲突声明 该论文不存在利益冲突,无学术纷争,所有作者知晓并且参与该论文的实验过程
| [1] |
张鸿祺, 周国泰, 张愈. 灾难医学[M]. 北京: 北京医科大学、中国协和医科大学联合出版社, 1993: 717-747. ZHANG H Q, ZHOU G T, ZHANG Y. Disaster medicine[M]. Beijing: Joint Publishing House of Beijing Medical College and Beijing Union Medical University, 1993: 717-747. |
| [2] |
陈强, 赖西南, 葛衡江. 海水浸泡对犬弹烧复合伤伤情特点的影响[J]. 中华航海医学与高气压医学杂志, 2004, 11(4): 193-197. CHEN Q, LAI X N, GE H J. Influence of seawater immersion on the characteristics of projectile-burn combined wound in dogs with seawater immersion[J]. Chin J Naut Med Hyperb Med, 2004, 11(4): 193-197. DOI:10.3760/cma.j.issn.1009-6906.2004.04.001 |
| [3] |
刘建仓, 陆松敏, 贾后军. 低温海水浸泡失血性休克大鼠血液动力学变化[J]. 创伤外科杂志, 2000, 2(2): 93. LIU J C, LU S M, JIA H J. The hemodynamic changes of hemorrhagic shock in rats with cold seawater immersion[J]. J Traum Surg, 2000, 2(2): 93. DOI:10.3969/j.issn.1009-4237.2000.02.010 |
| [4] |
刘良明.战创伤休克早期救治研究进展[J].创伤外科杂志, 2013, 15(2): 100-103. DOI:CNKI:SUN:CXWK.0.2013-02-003. LIU L M. Research progress of early care and treatment in war wound and traumatic shock[J]. J Traum Surg, 2013, 15(2): 100-103. DOI:CNKI:SUN:CXWK.0.2013-02-003. |
| [5] |
程浩, 奂剑波, 陈丽娜, 等. 长时程海水浸泡体温过低大鼠的病理学和血液学观察[J]. 中华航海医学与高气压医学杂志, 2018, 25(5): 281-288. CHENG H, HUAN J B, CHEN L N, et al. Observation on the pathological and hematological parameters of the rats with hypothermia induced by prolonged seawater immersion[J]. Chin J Naut Med Hyperb Med, 2018, 25(5): 281-288. DOI:10.3760/cma.j.issn.1009-6906.2018.05.002 |
| [6] |
刘艳丽, 田昆仑, 朱娱, 等. 低温海水浸泡合并失血休克对大鼠致死三联征及器官功能的影响[J]. 第三军医大学学报, 2020, 42(8): 752-757. LIU Y L, TIAN K L, ZHU Y, et al. Lethal triad and multi-organ dysfunction in rats following cold seawater bath and hemorrhagic shock[J]. J Third Mil Med Univ, 2020, 42(8): 752-757. DOI:10.16016/j.1000-5404.201912181 |
| [7] |
BLUMBERG N, CHOLETTE J M, PIETROPAOLI A P, et al. 0.9% NaCl (normal saline)—Perhaps not so normal after all?[J]. Transfus Apher Sci, 2018, 57(1): 127-131. DOI:10.1016/j.transci.2018.02.021 |
| [8] |
VAN REGENMORTEL N, DE WEERDT T, VAN CRAENENBROECK A H, et al. Effect of isotonic versus hypotonic maintenance fluid therapy on urine output, fluid balance, and electrolyte homeostasis: a crossover study in fasting adult volunteers[J]. Br J Anaesth, 2017, 118(6): 892-900. DOI:10.1093/bja/aex118 |
| [9] |
SHIOZAKI A, ICHIKAWA D, TAKEMOTO K, et al. Efficacy of a hypotonic treatment for peritoneal dissemination from gastric cancer cells: an in vivo evaluation[J]. Biomed Res Int, 2014, 2014: 707089. DOI:10.1155/2014/707089 |
| [10] |
RAE L, FIDLER P, GIBRAN N. The physiologic basis of burn shock and the need for aggressive fluid resuscitation[J]. Crit Care Clin, 2016, 32(4): 491-505. DOI:10.1016/j.ccc.2016.06.001 |
| [11] |
海霖, 余姣. 失血性休克致死性三联征的筛查及救治[J]. 中国急救医学, 2019, 39(7): 700-703. HAI L, YU J. Screening and treatment for hemorrhagic shock lethal triad of death[J]. Chin J Crit Care Med, 2019, 39(7): 700-703. DOI:10.3969/j.issn.1002-1949.2019.07.018 |
| [12] |
庄永敬, 谢培增, 陈大军, 等. 海上环境下海战伤救治的实验研究[J]. 华南国防医学杂志, 2010, 24(2): 141-144, 153. ZHUANG Y J, XIE P Z, CHEN D J, et al. Experimental study of treatment on sea warfare wound in marine environment[J]. Mil Med J South China, 2010, 24(2): 141-144, 153. DOI:10.13730/j.1009-2595.2010.02.024 |
| [13] |
李辉, 鹿尔驯, 虞积耀, 等. 快速输注低张液体在治疗胸外伤后海水浸泡致高渗血症中的作用[J]. 中国危重病急救医学, 2001, 13(7): 433-435. LI H, LU E X, YU J Y, et al. Preliminary study of fluid therapy in the management of plasma hyperosmolarity due to seawater immersion after open chest injury[J]. Chin Crit Care Med, 2001, 13(7): 433-435. DOI:10.3760/j.issn:1003-0603.2001.07.015 |
| [14] |
李燕华, 孙善全. 低渗液对星形胶质细胞水通道蛋白-4表达的影响[J]. 中华医学杂志, 2004, 84(6): 496-501. LI Y H, SUN S Q. Effect of hypotonic medium on expression of aquaporin-4 in astrocytes[J]. Natl Med J China, 2004, 84(6): 496-501. DOI:10.3760/j:issn:0376-2491.2004.06.018 |
| [15] |
奂剑波, 陈丽娜, 韩志海, 等. 大鼠海水浸泡体温过低症水浴复温的实验研究[J]. 第二军医大学学报, 2018, 39(4): 443-449. HUAN J B, CHEN L N, HAN Z H, et al. Experimental study on water bath rewarming in rats with hypothermia by seawater immersion[J]. Acad J Second Mil Univ, 2018, 39(4): 443-449. DOI:10.16781/j.0258-879x.2018.04.0443 |



