放射性肠病(radiation enteritis,RE)是指位于腹腔、盆腔等部位的恶性肿瘤经放疗后,对肠道产生一定损害所引起的疾病,主要表现为腹痛、腹泻和血便,少部分病情较重者甚至可能造成肠管狭窄、肠梗阻或肠瘘等[1],主要病理改变是组织结构被破坏、产生隐窝细胞坏死和黏膜上皮细胞脱落等。迄今为止,临床上治疗RE多采用细胞因子、激素类药物和巯基类化合物等辐射防护剂,但却有副作用多、价格高昂和毒性较大等使用条件限制[2]。
枸杞是被中医使用数千年的传统中草药,枸杞多糖(lycium barbarum polysaccharides,LBP)是枸杞的主要活性成分之一[3]。研究认为枸杞多糖具有多种生物学效应[4-8],特别是在消化系统,LBP能够调节肠道菌群、维持肠道微生态系统健康[9]和提高肠道细胞抗氧化能力[10]。在调控细胞凋亡方面,LBP可以通过上调Bcl-2、下调Bax表达来抑制人晶状体上皮细胞及大鼠角膜上皮细胞凋亡[11-12]。
本研究通过建立小鼠放射性肠损伤模型,初步探讨LBP抑制X射线所致小肠上皮细胞(intestinal epithelial cells,IECs)凋亡中关键分子Bcl-2和Bax的作用,探究LBP对放射损伤小鼠小肠上皮的保护机制,为将来临床中进一步研究LBP防治电离辐射损伤提供科学依据。
1 材料与方法 1.1 实验动物昆明小鼠36只(SPF级),雌雄各半,6~8周龄,体质量(20±2)g,由重庆医科大学实验动物中心提供。
1.2 试剂与仪器枸杞多糖(纯度>950 mg/g)购自上海康舟真菌多糖有限公司(批号KZ20160812);Percoll细胞分离液购自重庆蒙博生物科技有限公司(批号17-0891-09);CCK-8溶液购自上海东仁化学科技有限公司(批号KL700);AnnexinV-FITC/PI细胞凋亡检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒及细胞裂解液均购自上海碧云天生物技术公司(批号分别为C1062S、S1010、S0131、P0012AC、P0010S、P0013);SDS-PAGE蛋白上样缓冲液购自联科生物技术公司(批号81701014);PVDF膜购自美国Bio-Rad公司(批号1620177);化学发光液购自赛默飞世尔科技公司(批号SC249361);Bcl-2抗体和Bax抗体购自Cell Signaling Technology公司(批号分别为3498S、2772T);β-actin抗体购自三箭生物有限公司(批号KM9001)。
主要仪器:直线加速器(Varian公司,型号2300CD),超净台(美国Baker公司),恒温摇床(上海智诚分析仪器有限公司),电子天平(美国Mettler Toledo集团),全自动酶标仪(基因有限公司,型号Symergy HT),流式细胞仪(Becton-Dickinson公司,型号CytoFLEX),Chemi-Touch化学发光仪(成都百乐科技有限公司),离心机(美国Thermo Fisher Scientific公司)。
1.3 方法 1.3.1 小鼠放射性肠损伤模型的建立参考文献[13-14],使用昆明小鼠行一次性腹部6 MV X线照射,上界为剑突以下,下界为耻骨联合以上(其他部位用铅砖屏蔽),吸收剂量率为300 cGy/min,皮源距100 cm,照射野25 cm×25 cm,照射时间2 min,剂量为6 Gy,以观察到小鼠明显的RE症状及小肠病理切片中典型的RE表现为实验模型建立成功的标志。
1.3.2 实验分组及给药按随机数字表法将小鼠分为6组,每组6只,分别为正常组、辐射组、低剂量LBP(200 mg/kg)+辐射组、中剂量LBP(400 mg/kg)+辐射组、高剂量LBP(800 mg/kg)+辐射组和LBP组(800 mg/kg),正常组和LBP组不照射,其余各组行X线照射建立小鼠放射性肠损伤模型,2 h后灌胃给药,辐射组给予等量生理盐水,每天1次,每次0.5 mL,连续7 d。
1.3.3 小鼠大体情况与小肠组织病理观察观察各组小鼠的一般情况,1周后,在无菌条件下采用水合氯醛麻醉加高浓度二氧化碳窒息后处死小鼠,取近十二指肠肠段用10%甲醛溶液冲洗并浸泡,常规病理固定,石蜡包埋切片,HE染色,光镜下观察IECs数量与分布、隐窝细胞形态及数量、小肠绒毛长度和密度。
1.3.4 小鼠IECs的分离处死小鼠后,无菌条件下取出回盲部至幽门的全部小肠,用4 ℃预冷的Hanks液(含有双抗:青霉素100 U/mL,链霉素0.1 mg/mL)冲洗小肠,翻转肠黏膜,置于预热的30 mL消化液中(含1 mmol/L EDTA、1 mmol/L DTT的Hanks液)37 ℃水浴箱中孵育20 min,然后放入恒温振荡箱中,37 ℃,120 r/min,振荡40 min。然后经200目细胞筛过滤,收集的细胞重悬于30% Percoll分离液,1 350 r/min(离心半径13.5 cm),离心20 min。沿着试管壁边缘小心吸取白膜层IECs细胞,移入另一个清洁的离心管中,清洗液洗3次备用。
1.3.5 CCK-8法检测小鼠IECs活力,流式细胞仪检测IECs凋亡率加细胞悬液100 μL (约1×106个细胞)到96孔板(边缘孔用PBS填充)。每组设定3个复孔。置于37 ℃、5% CO2孵箱过夜,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,测定波长450 nm处各孔的光密度值[D(450)],以样品光密度与空白对照光密度差值代表IECs细胞活性。使用预冷的PBS冲洗IECs 2次并计数,离心后弃去上清,取1×105个细胞加入195 μL Annexin V-FITC结合液轻轻混匀,随后依次加入5 μL Annexin V-FITC,10 μL PI染色液,轻轻混匀,室温下(25 ℃)避光孵育10 min,使用双参数分析法在流式细胞仪上计算凋亡率。
1.3.6 IECs中SOD活性及MDA含量检测取适量IECs悬液加入细胞裂解液500 μL,于冰上裂解30 min,12 000 r/min、4 ℃离心10 min(离心半径6.5 cm),取上清,采用BCA法测定蛋白浓度,并根据SOD、MDA检测试剂盒说明书测定。
1.3.7 Western blot检测Bcl-2与Bax的表达取适量细胞,用4 ℃预冷的PBS冲洗2次,加入适量含有PMSF的细胞裂解液(按每1毫升细胞裂解液混合10 μL PMSF)混匀,置于冰上裂解30 min,每隔5 min摇匀1次,随后将样品放入4 ℃预冷的高速离心机中(离心半径为6.5 cm),12 000 r/min,离心5 min,取上清,BCA蛋白定量法测定蛋白浓度后,加入SDS-PAGE蛋白上样缓冲液,100 ℃,煮沸10 min,每孔加入15 μg蛋白,以5%的浓缩胶、12%的分离胶电泳,PVDF膜湿法电转膜。转膜结束后将条带放入TBST稀释的5%脱脂奶粉中摇床封闭3 h,洗膜4次,每次8 min,加入Bax、Bcl-2及β-actin一抗(均1 :1 000稀释)4 ℃孵育过夜,洗膜4次,每次8 min,二抗在室温条件下孵育60 min,洗膜4次,每次8 min,加入显影液进行曝光,β-actin为内参,各灰度值与其比值为Bax及Bcl-2蛋白相对表达量。
1.4 统计学分析采用SPSS 22.0统计软件,数据以x±s表示,采用单因素方差分析,两两比较采用LSD检验。检验水准:α=0.05。
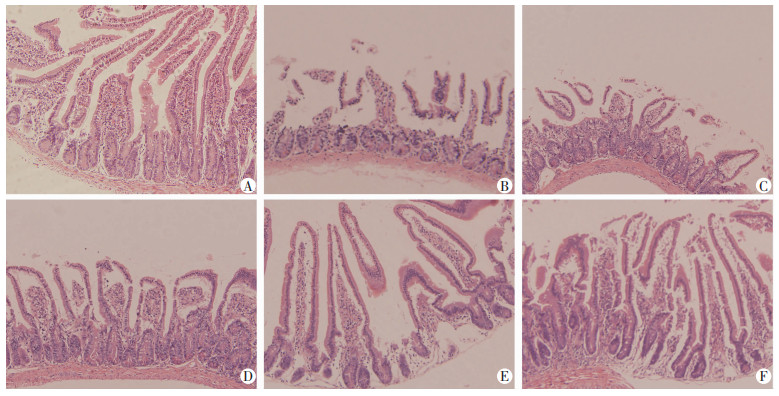
2 结果 2.1 小鼠大体情况与小肠组织病理观察经照射后的各组小鼠,出现了反应迟钝、活动减少、毛发脏乱、缺少光泽的表现,排便为黄色稀便,体质量减轻不明显。给予LBP干预后,小鼠一般状况逐渐恢复,而辐射对照组小鼠精神状态极差,长时间呈蜷缩状,毛发竖立,体质量减轻。使用显微镜观察小鼠受照射后7 d各组肠绒毛和肠隐窝形态改变。与正常对照组相比,辐射组肠绒毛呈现出稀疏缺损、固有层隐窝稍减少、炎症细胞浸润,表明成功构建小鼠放射性肠损伤模型。低剂量LBP+辐射组肠绒毛短而稀少,却能发现隐窝结构增多。当LBP到达400 mg/kg时,虽然肠绒毛较为短小且排列不够整齐,但隐窝腔内细胞增多。高剂量LBP+辐射组肠绒毛长而整齐,腺体结构完整。LBP组与正常组相比肠绒毛无明显差异(图 1)。
|
| A:正常组;B:辐射组;C:低剂量LBP+辐射组;D:中剂量LBP+辐射组;E:高剂量LBP+辐射组;F: LBP组 图 1 各组小鼠照射后7 d肠绒毛和肠隐窝形态改变(HE ×100) |
2.2 LBP对辐射损伤后小鼠IECs细胞活力及细胞凋亡的影响
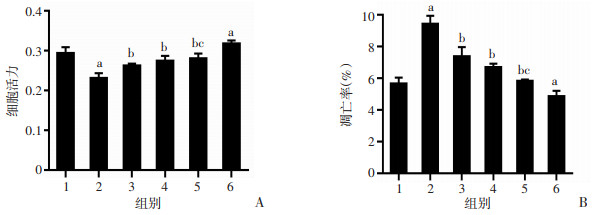
X线照射小鼠后7 d,采用CCK-8检测IECs细胞活力(图 2A)。与辐射组相比,正常组和低剂量LBP+辐射组、中剂量LBP+辐射组、高剂量LBP+辐射组细胞活力均较高(P < 0.01),表明LBP能够提高辐射损伤IECs细胞活力。此外,LBP组细胞活力稍高于正常组(P < 0.05),说明在正常情况下LBP也能增强IECs细胞活力。随着LBP剂量增加,细胞活力呈上升趋势。
|
| 1:正常组;2:辐射组;3:低剂量LBP+辐射组;4:中剂量LBP+辐射组;5:高剂量LBP+辐射组;6: LBP组;a:P < 0.05, 与正常组比较;b: P < 0.05, 与辐射组比较;c: P < 0.05, 与低剂量LBP+辐射组比较 图 2 LBP对辐射损伤后小鼠IECs活力(A)及IECs凋亡率(B)的影响(n=6) |
采用流式细胞仪检测IECs细胞凋亡情况,将细胞早期凋亡率和细胞晚期凋亡率的总和作为IECs细胞凋亡率进行评估(图 2B)。与辐射组相比,低剂量LBP+辐射组、中剂量LBP+辐射组、高剂量LBP+辐射组细胞凋亡率均下降(P < 0.01),随着枸杞多糖剂量增加,凋亡率出现逐渐降低趋势,表明LBP有效减弱了辐射所致的IECs细胞凋亡。
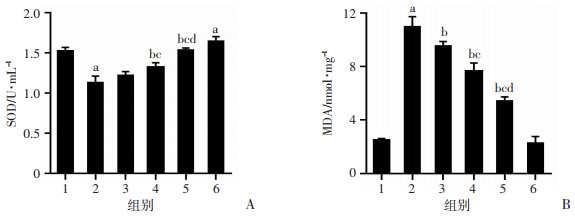
2.3 LBP对辐射损伤后小鼠IECs细胞SOD活性及MDA含量的影响辐射后7 d,测定IECs细胞中MDA含量和抗氧化酶SOD活性。结果显示:辐射组MDA含量显著升高,但经过LBP处理的各组MDA含量上升受到了一定程度的抑制。与辐射组相比,正常组和中剂量LBP+辐射组、高剂量LBP+辐射组SOD活性均较高,与正常组相比,LBP组(仅给予800 mg/kg LBP,不进行X线照射) SOD活性也较高(P < 0.05)。与辐射组相比,低剂量LBP+辐射组、中剂量LBP+辐射组、高剂量LBP+辐射组MDA含量呈逐渐下降趋势。表明LBP可能通过提高SOD活性、降低MDA含量来增强小鼠IECs细胞抗氧化能力(图 3)。
|
| 1:正常组;2:辐射组;3:低剂量LBP+辐射组;4:中剂量LBP+辐射组;5:高剂量LBP+辐射组;6:LBP组;a:P < 0.05, 与正常组比较;b: P < 0.05, 与辐射组比较;c: P < 0.05, 与低剂量LBP+辐射组比较;d:P < 0.05, 与中剂量LBP+辐射组比较 图 3 LBP对辐射损伤后小鼠IECs细胞SOD活性(A)和MDA含量(B)的影响(n=6) |
2.4 LBP对辐射损伤后小鼠IECs细胞Bcl-2与Bax表达的影响
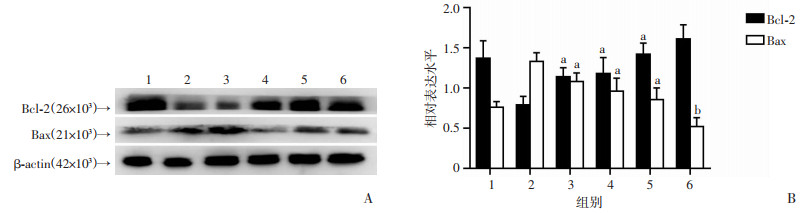
与辐射组相比,低剂量LBP+辐射组、中剂量LBP+辐射组、高剂量LBP+辐射组Bcl-2表达量明显增加(P < 0.05,P < 0.01),Bax表达量降低(P < 0.05,P < 0.01),与正常组相比,LBP组Bax表达量降低(P < 0.05,图 4)。这些结果进一步表明:LBP对辐射诱导的IECs细胞凋亡的保护作用涉及线粒体途径。
|
|
1:正常组;2:辐射组;3:低剂量LBP+辐射组;4:中剂量LBP+辐射组;5:高剂量LBP+辐射组;6:LBP组 A:Western blot检测;B:半定量分析 a:P < 0.05, 与辐射组比较;b:P < 0.05, 与正常组比较 图 4 Western blot检测各组小鼠IECs细胞辐射损伤凋亡相关蛋白Bcl-2、Bax的表达(n=6) |
3 讨论
根据既往研究报道,选择6 Gy和10 Gy剂量照射小鼠腹部[13-14],从症状体征和病理表现都能观察到放射性肠炎改变,但10 Gy剂量会造成小鼠骨髓抑制、肝功损害且死亡过多,不能成为理想的实验模型,所以本研究使用6MV X线一次性照射6 Gy剂量建立小鼠放射性肠损伤模型,并参考既往报道,扩大LBP剂量范围,设立不同剂量LBP干预组[15-16],观察小鼠小肠病理切片,检测了IECs细胞活力、凋亡率、抗氧化能力及凋亡相关蛋白的表达。本研究发现:首先,放射性肠损伤小鼠IECs细胞活力降低、凋亡率显著增加,经枸杞多糖干预后,与辐射组相比,小肠上皮黏膜损伤减轻,细胞凋亡率均有所减低,表明枸杞多糖能够有效减轻辐射所致的细胞凋亡;其次,辐射后小鼠IECs细胞SOD活性明显下降,MDA含量显著上升,给予LBP的各组小鼠IECs细胞SOD活性均上升,MDA含量均下降,表明LBP能起到抗氧化的作用;最后,LBP干预各组Bcl-2蛋白表达明显高于辐射组,促凋亡基因Bax表达随LBP剂量增加而逐渐减少, 表明枸杞多糖可能通过作用于线粒体通路上调Bcl-2和下调Bax的表达来抑制辐射损伤细胞的凋亡。
本研究结果显示:辐照后给予LBP干预的各组小鼠小肠组织较辐射组有一定恢复,但并不能因此而忽略机体随着时间的延长同样可以自行修复6 Gy辐照剂量所致的放射性肠炎,使用LBP虽然加快了机体本身的修复,但这只是在单一剂量和单一时相点下的观察结果,有待于设立更多的检测时间点,以及在更大范围内运用不同剂量的LBP处理,进行动态观察,来证实LBP的疗效。
本研究通过测定IECs细胞SOD活性和多不饱和脂肪酸作用所产生的终产物MDA的含量,发现各LBP干预组小鼠IECs细胞SOD活性均上升,MDA含量均下降,而辐射组小鼠IECs细胞SOD活性下降,MDA含量显著上升。其原因可能是由于电离辐射通过诱导机体氧自由基的产量增加,高浓度的活性氧(reactive oxygen species,ROS)引起细胞氧化应激,导致细胞凋亡,使生物大分子遭到破坏,并引发严重的脂质过氧化反应。这些结果最后均会导致组织的损伤[5]。而LBP可以通过增强抗氧化酶SOD活性来加快过量自由基及ROS的清除,减少MDA产生来保护细胞。还有研究表明:LBP可通过清除自由基和抑制含半胱氨酸的Caspase-3的激活来降低ROS水平,从而防止ROS诱导细胞凋亡[16-17]。迄今为止,在人体中也发现LBP具有抗氧化活性,连续摄入LBP 1个月可提高机体抗氧化功效[18]。综上所述,LBP可以增加放射性肠损伤小鼠IECs细胞抗氧化酶的活性并降低MDA的蓄积,从而减弱ROS和自由基引起的氧化应激反应,提高机体的抗氧化能力,但其具体调控方式还有待进一步研究。
接受辐射处理后,小鼠IECs细胞凋亡率都有不同程度的升高,但使用LBP干预的各组较辐射对照组凋亡率明显减低。目前,已经发现多种分子对细胞凋亡具有抑制作用,包括P53基因、细胞因子反应调节剂A(CrmA)、FLICE抑制蛋白(FLIP)和Bcl-2家族等。辐射及其产生的ROS诱导DNA链断裂可以促进P53的激活[19],这会使细胞更为敏感,即使少量的DNA损伤也会促使凋亡的发生。P53激活后能够下调抗凋亡蛋白Bcl-2表达,使凋亡效应因子Bax或Bak被激活,导致线粒体外膜损伤和细胞凋亡。已有研究表明:LBP可通过调节Bcl-2/ Bax比值[17, 20]、线粒体膜电位[21]及Caspase表达[20-22]来减少细胞凋亡。本研究使用Western blot检测了IECs辐射损伤凋亡相关蛋白的表达,结果发现LBP各干预组Bcl-2蛋白表达明显高于辐射组,促凋亡基因Bax表达随LBP剂量增加而逐渐减少,这表明减弱放射性肠损伤所致的DNA损伤及抑制线粒体凋亡途径可能是LBP发挥抗辐射作用的重要机制之一。
本研究还存在以下几点不足。首先,只设立了7 d一个时间观察点,正常情况下,肠干细胞可以通过增殖分化使小肠上皮细胞得到补充更新,在小鼠体内的转化周期约为3~5 d[23],小肠黏膜的完整性依赖于对IECs细胞的不断更新,这是一个变化的过程。经过辐射后,机体能够通过自行修复的方式使肠道组织得到恢复,然而仅选取7 d一个时间点,观察到的结果是有限的,选取多时相进行动态监测将更能证实其疗效。我们选择7 d作为一个实验周期,是考虑到IECs增殖分化以及LBP发挥作用所需时间,但设立不同时间点的确会使研究更加客观全面。其次,设立一个临床上常用并与LBP作用机制相似的抗辐射药物组,对其疗效进行比较,也是十分有意义的。我们纳入了未受辐射只接受LBP处理的LBP组,在一定程度上增加了LBP效果的可靠性。最后,LBP对IECs细胞凋亡的抑制作用除通过作用于线粒体通路发挥效应外,是否还有其他信号通路联合发挥抗辐射功能,其具体方式、作用靶点、有效部位尚不明确,但我们选择线粒体凋亡途径是结合现有研究,LBP最有可能发挥其抗凋亡作用的方式。
LBP作为传统中药枸杞的重要活性成分,可以通过辅酶、微波及超声波提取法获得,具有价廉、广效、无明显毒副作用等优点,在辐射防护领域有广大应用前景。已有研究发现LBP可以提高肠道抗氧化酶水平,减弱大鼠肠道缺血再灌注损伤[24],LBP能够保护人视网膜色素上皮细胞抑制氧化应激诱导的凋亡作用[17],经过LBP预处理可有效减少小鼠脑缺血再灌注损伤引起的细胞凋亡[25],LBP还对辐射引起的造血系统损伤有一定保护作用[26]。本研究结果表明:LBP对辐射损伤小鼠IECs具有抗氧化、增强细胞活力及抑制细胞凋亡的特点,它能够促进自由基代谢产物的清除、增强抗凋亡蛋白Bcl-2的表达及抑制促凋亡蛋白Bax的表达,LBP在未来或可成为治疗小肠辐射损伤的新型防护剂。但在将来的研究中,要最终确定其疗效,还需选择一些临床上常用并且与LBP抗辐射作用机制相近的药物进行多方面比较,以进一步证实LBP的功效。
| [1] |
张亮, 龚剑峰, 倪玲, 等. 放射性肠炎合并肠梗阻行病变肠管切除术后远期随访分析[J]. 中华外科杂志, 2014, 52(2): 94-98. ZHANG L, GONG J F, NI L, et al. Operative and long term results after rdiseased bowel resection for chronic radiation enteritis complicated with intestinal obstruction[J]. Chin J Surg, 2014, 52(2): 94-98. DOI:10.3760/cma.j.issn.0529-5815.2014.02.004 |
| [2] |
王伟, 陈翰翰, 曹志群, 等. 放射性肠炎的中医药治疗研究进展[J]. 中国临床研究, 2020, 33(1): 118-119. WANG W, CHEN H H, CAO Z Q, et al. Research progress in traditional Chinese medicine treatment of radiation enteritis[J]. Chin J Clin Res, 2020, 33(1): 118-119. DOI:10.13429/j.cnki.cjcr.2020.01.029 |
| [3] |
TIAN X J, LIANG T S, LIU Y L, et al. Extraction, structural characterization, and biological functions of Lycium barbarum polysaccharides: a review[J]. Biomolecules, 2019, 9(9): 389. DOI:10.3390/biom9090389 |
| [4] |
LI Q J, ZHANG Z W, LI H, et al. Lycium barbarum polysaccharides protects H9c2 cells from hypoxia-induced injury by down-regulation of miR-122[J]. Biomed Pharmacother, 2019, 110: 20-28. DOI:10.1016/j.biopha.2018.11.012 |
| [5] |
GAO Y J, WEI Y F, WANG Y Q, et al. Lycium barbarum: a traditional Chinese herb and a promising anti-aging agent[J]. Aging Dis, 2017, 8(6): 778-791. DOI:10.14336/ad.2017.0725 |
| [6] |
TANG H L, CHEN C, WANG S K, et al. Biochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L[J]. Int J Biol Macromol, 2015, 77: 235-242. DOI:10.1016/j.ijbiomac.2015.03.026 |
| [7] |
DENG X L, LUO S, LUO X, et al. Polysaccharides from Chinese herbal Lycium barbarum induced systemic and local immune responses in H22 tumor-bearing mice[J]. J Immunol Res, 2018, 2018: 3431782. DOI:10.1155/2018/3431782 |
| [8] |
HU X Y, QU Y D, CHU Q B, et al. Investigation of the neuroprotective effects of Lycium barbarum water extract in apoptotic cells and Alzheimer's disease mice[J]. Mol Med Rep, 2018, 17(3): 3599-3606. DOI:10.3892/mmr.2017.8310 |
| [9] |
ZHU W, ZHOU S X, LIU J H, et al. Prebiotic, immuno-stimulating and gut microbiota-modulating effects of Lycium barbarum polysaccharide[J]. Biomed Pharmacother, 2019, 121: 109591. DOI:10.1016/j.biopha.2019.109591 |
| [10] |
HUANG C, YAO R Y, ZHU Z K, et al. Apectic poly-saccharide from water decoction of Xinjiang Lycium barbarum fruit protects against intestinal endoplasmic reticulum stress[J]. Int J Biol Macromol, 2019, 130: 508-514. DOI:10.1016/j.ijbiomac.2019.02.157 |
| [11] |
DU S B, HAN B, LI K, et al. Lycium barbarum polysaccharides protect rat corneal epithelial cells against ultraviolet B-induced apoptosis by attenuating the mitochondrial pathway and inhibiting JNK phosphorylation[J]. Biomed Res Int, 2017, 2017: 5806832. DOI:10.1155/2017/5806832 |
| [12] |
QI B, JI Q S, WEN Y C, et al. Lycium barbarum polysaccharides protect human lens epithelial cells against oxidative stress-induced apoptosis and senescence[J]. PLoS ONE, 2014, 9(10): e110275. DOI:10.1371/journal.pone.0110275 |
| [13] |
徐伟, 金晶. 直线加速器诱发大鼠急性放射性肠炎模型的建立[J]. 实用临床医药杂志, 2013, 17(11): 9-11. XU W, JIN J. Establishing a rat model for acute radiation enteritis induced by linearaccelerator[J]. J Clin Med Pract, 2013, 17(11): 9-11. DOI:10.7619/jcmp.201311003 |
| [14] |
罗银星, 王笑民, 富琦, 等. 小鼠放射性肠炎的建立[J]. 中华放射医学与防护杂志, 2008, 28(4): 339-342. LUO Y X, WANG X M, FU Q, et al. Comparison of radiation enteritis mouse models established at different dose[J]. Chin J Radiol Med Protect, 2008, 28(4): 339-342. DOI:10.3760/cma.j.issn.0254-5098.2008.04.007 |
| [15] |
TANG L J, BAO S Y, DU Y, et al. Antioxidant effects of Lycium barbarum polysaccharides on photoreceptor degeneration in the light-exposed mouse retina[J]. Biomed Pharmacother, 2018, 103(7): 829-837. DOI:10.1016/j.biopha.2018.04.104 |
| [16] |
CHEN L, LI W, QI D, et al. Lycium barbarum polysaccharide protects against LPS-induced ARDS by inhibiting apoptosis, oxidative stress, and inflammation in pulmonary endothelial cells[J]. Free Radic Res, 2018, 52(4): 480-490. DOI:10.1080/10715762.2018.1447105 |
| [17] |
LIU L, LAO W, JI Q S, et al. Lycium barbarum polysaccharides protected human retinal pigment epithelial cells against oxidative stress-induced apoptosis[J]. Int J Ophthalmol, 2015, 8(1): 11-16. DOI:10.3980/j.issn.2222-3959.2015.01.02 |
| [18] |
AMAGASE H, SUN B, BOREK C. Lycium barbarum (goji) juice improves in vivo antioxidant biomarkers in serum of healthy adults[J]. Nutr Res, 2009, 29(1): 19-25. DOI:10.1016/j.nutres.2008.11.005 |
| [19] |
MING L, YUE L, MENG M G, et al. Vanillin derivative VND3207 activates DNA-PKcs conferring protection against radiation-induced intestinal epithelial cells injury in vitro and in vivo[J]. Toxicol Appl Pharmacol, 2020, 387: 114855. DOI:10.1016/j.taap.2019.114855 |
| [20] |
WANG T F, LI Y X, WANG Y S, et al. Lycium barbarum polysaccharide prevents focal cerebral ischemic injury by inhibiting neuronal apoptosis in mice[J]. PLoS ONE, 2014, 9(3): e90780. DOI:10.1371/journal.pone.0090780 |
| [21] |
LUO Q, LI J J, CUI X Y, et al. The effect of Lycium barbarum polysaccharides on the male rats' reproductive system and spermatogenic cell apoptosis exposed to low-dose ionizing irradiation[J]. J Ethnopharmacol, 2014, 154(1): 249-258. DOI:10.1016/j.jep.2014.04.013 |
| [22] |
ZHU Y F, ZHAO Q P, GAO H, et al. Lycium barbarum polysaccharides attenuates N-methy-N-nitrosourea-induced photoreceptor cell apoptosis in rats through regulation of poly (ADP-ribose) polymerase and caspase expression[J]. J Ethnopharmacol, 2016, 191: 125-134. DOI:10.1016/j.jep.2016.05.037 |
| [23] |
POTTEN C S. Radiation, the ideal cytotoxic agent for studying the cell biology of tissues such as the small intestine[J]. Radiat Res, 2004, 161(2): 123-136. DOI:10.1667/rr3104 |
| [24] |
YANG X K, BAI H, CAI W X, et al. Lycium barbarum polysaccharides reduce intestinal ischemia/reperfusion injuries in rats[J]. Chem-Biol Interactions, 2013, 204(3): 166-172. DOI:10.1016/j.cbi.2013.05.010 |
| [25] |
吴彩霞, 王腾飞, 余建强. 枸杞多糖预处理对小鼠脑缺血-再灌注损伤的保护作用[J]. 中药材, 2015, 38(7): 1454-1459. WU C X, WANG T F, YU J Q. Lycium barbarum polysaccharide pretreatment attenuates cerebral ischemic reperfusion injury by inhibiting apoptosis in mice[J]. J Chin Med Mat, 2015, 38(7): 1454-1459. DOI:10.13863/j.issn1001-4454.2015.07.030 |
| [26] |
ZHOU J, PANG H, LI W B, et al. Effects of Lycium barbarum polysaccharides on apoptosis, cellular adhesion, and oxidative damage in bone marrow mononuclear cells of mice exposed to ionizing radiation injury[J]. Biomed Res Int, 2016, 2016(6): 4147879. DOI:10.1155/2016/4147879 |



