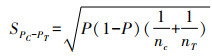白内障术后感染性眼内炎占术后眼内炎(postoperative endophthalmitis, POE)的90%[1]。全世界每年有超过1 000万例白内障手术[2-3],故而有效预防POE至关重要。目前,被广泛接受的预防POE的措施包括[4-6]:聚维酮碘冲洗结膜囊、术毕前房注射抗生素、局部抗生素滴注、结膜下给药和口服抗生素。
术毕前房注射抗生素作为一种有效预防POE的方式,注射抗生素的种类、剂量目前国际上并无确论,被普遍接受的药物包括头孢菌素类、万古霉素、氟喹诺酮类等[7]。头孢呋辛的前房制剂在欧洲已经上市,但很多国家尚没有成品[3]。美国有52%的医师在白内障术毕前房注射万古霉素,使用浓度为10 mg/mL,0.1 mL[8],但其安全性尚有争议,有报道该浓度万古霉素与出血性闭塞性视网膜血管炎(hemorrhagic occlusive retinal vasculitis,HORV)相关[9]。我院使用万古霉素浓度为0.01 mg/mL,0.1 mL,为上述浓度的1/1 000,但仍超过前房注射万古霉素的最低抑菌浓度0.004 mg/mL[10],理论上有预防眼内炎效果,但对于临床实际应用效果方面目前尚需研究探明。本研究旨在通过回顾性病例研究,对比分析低浓度万古霉素与头孢呋辛用于白内障术毕前房注射预防感染性眼内炎的临床预防效果。
1 资料与方法 1.1 一般资料收集2016-2019年我院行白内障手术患者16 253人共28 845眼,其中术毕前房注射低浓度万古霉素(0.01 mg/mL,0.1 mL)患者7 318人13 068眼,年龄(66.98±7.57)岁。术毕前房注射头孢呋辛患者8 935人15 777眼,年龄(66.38±8.06)岁。所有患者手术方式为白内障超声乳化+人工晶体植入术,手术过程及围手术期各环节均遵守无菌操作,手术过程中未发现任何异常。该研究已通过我院伦理审查委员会审批并备案[医研伦审(2019)第153号]。
1.2 纳入与排除标准纳入标准:①2016-2019年于我院行白内障超声乳化+人工晶体植入术者;②白内障患者且未合并其他眼部疾病(葡萄膜炎、青光眼、角膜炎、神经性眼病);③患者术毕前房注射低浓度万古霉素(0.01 mg/mL,0.1 mL)或头孢呋辛(10 mg/mL,0.1 mL)。
排除标准:①外院白内障手术后发生眼内炎患者;②其他眼部疾病或手术造成的感染性眼内炎(如青光眼术后、外伤性白内障术后、玻璃体切割术及玻璃体注药术后等)。
1.3 方法 1.3.1 病例分组根据白内障术毕前房注射药物情况分为两组:低浓度万古霉素组(0.01 mg/mL,0.1 mL)、头孢呋辛组(10 mg/mL,0.1 mL)。分析所有纳入病历中于术后1周内出现感染性眼内炎的患者(若患者致病菌为真菌则延长随访至术后1个月),并回顾该部分患者眼内炎治疗方案及预后。
1.3.2 病例诊断筛选随访中出现视力下降患者,观察患者视力、角膜、前房、人工晶状体、玻璃体腔混浊情况,行裂隙灯检查角膜、前房、人工晶体情况,眼部B超检查玻璃体混浊情况,实验室检查房水及玻璃体液涂片及培养细菌真菌检查情况。
白内障术后感染性眼内炎诊断标准:①白内障术后无明显诱因出现视力下降;②伴或不伴眼痛、对光反射迟钝、畏光流泪、结膜混合充血、前房脓性渗出物、角膜水肿、玻璃体中/重度混浊;③房水及玻璃体液细菌/真菌培养阳性;④无外伤史、无其他部位感染。
1.3.3 治疗及预后对于诊断为眼内炎的患者,收集其入院后治疗方案:所有患者给予前房冲洗+玻璃体腔注射(万古霉素0.1 mL+头孢他啶0.1 mL+注射用地塞米松磷酸钠0.1 mL),玻璃体切除,静脉输注地塞米松磷酸钠4~6 d,万古霉素4~6 d、头孢他啶2~6 d,其中2人2眼行降眼压治疗。观察记录患者病情变化(包括患者视力、眼压、结膜、角膜、前房、瞳孔对光反射及玻璃体、眼底等变化)。
1.4 统计学分析采用SAS 9.4统计软件。计数资料以百分比描述,用χ2检验比较两组白内障术后感染性眼内炎的发生率。用两组率的非劣效性检验进行统计学分析,非劣效性界值取对照组发生率的10%。取单侧检验水准α=0.025。率的非劣性检验用单侧z检验,统计量z服从标准正态分布,计算公式如下。
SPC-PT为两组率差值的标准误,计算方法为两组率合并法(平均)法,计算公式如下。
2 结果 2.1 两组术后眼内炎发病情况共发现感染性眼内炎患者5例5眼(表 1),低浓度万古霉素组3例3眼,术后感染性眼内炎发生率为0.022 9%;头孢呋辛组2例2眼,术后感染性眼内炎发生率为0.012 7%。χ2分析两组差异无统计学意义(χ2=0.045, P=0.833),进行非劣效检验,两组术后感染性眼内炎发病率差异有统计学意义(P < 0.025),即低浓度万古霉素预防白内障术后眼内炎效果不劣于头孢呋辛。
| 组别 | 患者编号 | 性别 | 年龄/岁 | 眼别 | 术前视力 |
| 低浓度万古霉素组 | 1 | 男 | 70 | 右 | HM/眼前 |
| 2 | 男 | 86 | 右 | 0.09 | |
| 3 | 男 | 74 | 左 | 0.30 | |
| 头孢呋辛组 | 4 | 女 | 29 | 右 | 0.12 |
| 5 | 男 | 63 | 右 | HM/眼前 |
2.2 两组术后眼内炎患者临床表现
低浓度万古霉素组3例患者出现感染性眼内炎,时间为术后4、4、6 d,头孢呋辛组2例患者发病时间为术后1、30 d,两组临床表现见表 2。
| 组别 | 患者编号 | 发病时间/d | 症状及体征 | 超声表现 | 致病菌培养结果 |
| 低浓度万古霉素组 | 1 | 4 | 视力:HM/10 cm,角膜中度水肿,前房积脓,Tyn(+++), 浮游细胞(++) | 玻璃体重度混浊 | 铜绿假单胞菌 |
| 2 | 4 | 视力:HM/10 cm,角膜轻度水肿,前房积脓,Tyn(++), 浮游细胞(++) | 玻璃体中度混浊 | 表皮葡萄球菌 | |
| 3 | 6 | 视力:0.15, 角膜轻度水肿,尘状KP+,前房未见絮状漂浮物,Tyn(++),浮游细胞(+) | 玻璃体中度混浊 | 表皮葡萄球菌 | |
| 头孢呋辛组 | 4 | 30 | 视力:0.5, 角膜轻度水肿,前房Tyn(++),浮游细胞(+) | 玻璃体中度混浊 | 真菌 |
| 5 | 1 | 视力:HM/眼前,角膜中度水肿,前房积脓(++),Tyn(+++), 浮游细胞(++) | 玻璃体中度混浊 | 缓症链球菌 |
头孢呋辛组与低浓度万古霉素组出现术后眼内炎患者的临床表现无明显差异,表现为视力下降,裂隙灯下角膜不同程度水肿,前房浮游细胞、丁达尔征(Tyn)阳性,前房絮状渗出,部分患者前房积脓(图 1),人工晶体表面渗出膜附着。眼部超声均提示:玻璃体中、重度混浊(图 2)。
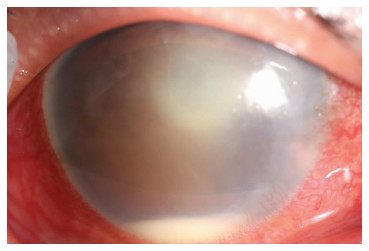
|
| 图 1 1号眼内炎患者前房积脓 |
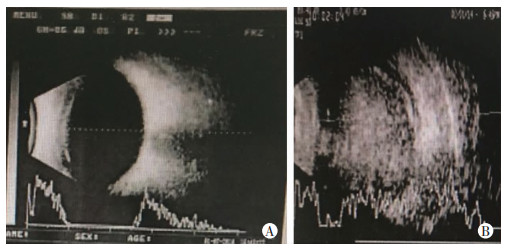
|
| A:术前;B:术后眼内炎 图 2 1号眼内炎患者眼部B超表现 |
低浓度万古霉素组3例患者致病菌培养结果为1例铜绿假单胞菌、2例表皮葡萄球菌;头孢呋辛组培养结果为真菌、缓症链球菌各1例。
2.3 术后眼内炎患者治疗及愈后两组术后眼内炎患者采用的治疗方案包括:前房冲洗+注药术(万古霉素1 mg+头孢他啶1 mg);玻璃体腔注药(万古霉素1 mg+头孢他啶1 mg);人工晶体取出术;全身输注头孢他啶、万古霉素;局部行醋酸泼尼松龙滴眼液、左氧氟沙星眼液、妥布霉素眼液、典必殊眼膏。
两组患者治疗后视力变化情况见表 3:低浓度万古霉素组3例患者治疗后视力均较前好转;头孢呋辛组2例患者中1例视力恶化,1例视力无变化。所有眼内炎患者角膜水肿较前减轻,丁达尔征(Tyn)±,前房未见积脓,未行晶体取出患者人工晶体表面渗出减少,玻璃体混浊减轻。
| 组别 | 患者编号 | 治疗前视力 | 出院视力 |
| 低浓度万古霉素组 | 1 | HM/10 cm | HM/30 cm |
| 2 | HM/10 cm | 0.12 | |
| 3 | HM/10 cm | 0.05 | |
| 头孢呋辛组 | 4 | 0.5 | HM/40 cm |
| 5 | HM/眼前 | HM/眼前 |
3 讨论
感染性眼内炎是白内障术后严重的并发症,有研究表明,白内障术后并发感染性眼内炎的患者,即使功能视力恢复,其视网膜的形态也较其他未发生眼内炎的患者差[11]。白内障术后感染性眼内炎最常见的病原菌是革兰阳性菌,特别是表皮葡萄球菌。该细菌是革兰阳性、凝固酶阴性的细菌[1]。目前为预防眼内感染,白内障术毕前房注射最常用的抗生素为头孢呋辛、万古霉素和莫西沙星[7]。
2005年欧洲白内障和屈光外科医师协会(European Society of Cataract and Refractory Surgeons,ESCRS)进行了一项随机对照试验,该项研究纳入了欧洲24个医学中心13 698名患者,证实了白内障术毕前房注射头孢呋辛、万古霉素和莫西沙星可以有效降低术后感染性眼内炎的发病率[12]。预防性前房注射抗生素可以将术后感染性眼内炎的发病率降低5倍(0.33% vs 0.07%)。此后,许多回顾性研究也证明了前房预防性注射抗生素的有效性[13]。在美国,约有47%的眼科医师正在使用这一预防方式[14]。
头孢呋辛是第2代头孢菌素,它通过阻止细菌细胞壁肽聚糖层的合成,从而破坏细胞壁的完整性。其作用具有时间依赖性,即只要药物浓度大于最小抑菌浓度,就具有杀菌活性。来自加拿大、法国、南非和瑞典等国家的回顾性研究发现,使用头孢呋辛显著降低白内障术后感染性眼内炎的发生率[2-3, 8, 15]。头孢呋辛的前房用药制剂(Aprokam®, Thea Pharmaceuticals, Newcastle Under Lyme, UK)目前已在欧洲上市。白内障术毕前房注射头孢呋辛(10 mg/mL, 0.1 mL)已被广泛认可,虽常规剂量的头孢呋辛是有效且安全的,但对于头孢过敏的白内障患者,过敏性休克随时可能发生并威胁生命。
万古霉素是通过时间依赖性的方式抑制细菌细胞壁的合成。它对几乎所有的链球菌和葡萄球菌都有效,包括耐甲氧西林金黄色葡萄球菌(MRSA)[16]。目前国际上用于白内障术毕前房注射的万古霉素浓度为10 mg/mL, 0.1 mL[17]。一项纳入17项研究的Meta分析对比了万古霉素、头孢呋辛和莫西沙星预防眼内炎的有效性,三者白内障术后感染性眼内炎的发生率分别为0.010 6%、0.033 2%和0.015 3%[18]。12.1%的澳大利亚眼科医师将万古霉素作为预防白内障术后感染性眼内炎的首选药物[19]。但是随着万古霉素预防眼内炎的广泛使用,2017年报道的万古霉素相关的HORV这一致盲的灾难性的并发症,引起了国际上的广泛关注。最近对眼球摘除者病理学检查提示,HORV可能是一种原发性脉络膜疾病,其次波及视网膜[20-21]。根据美国视网膜专家协会(American Society of Retina Specialists,ASRS)和美国视网膜协会(ASCRS)报道,HORV预后不良,61%的患者(22/36)视力低于20/200,22%的患者(8/36)失去所有光感[20]。
本中心分别在白内障术毕前房注射低浓度万古霉素(0.01 mg/mL,0.1 mL)或头孢呋辛(10 mg/mL,0.1 mL)预防术后感染性眼内炎。其中在头孢呋辛组中有1例患者术后1个月发生真菌性眼内炎,虽真菌不在头孢呋辛的抗菌谱范围,但确为在使用头孢呋辛预防期间出现的白内障术后感染病例,故纳入本研究。本研究中低浓度万古霉素组术后感染性眼内炎发生率0.022 9%,虽高于常规浓度万古霉素,但该浓度已超过万古霉素前房注射的最低抑菌浓度,所以在理论上预防是有效的。而在临床实际应用中,经统计其预防感染效果不差于头孢呋辛。
本中心随访2014年1月至2017年11月间白内障术毕前房注射低浓度万古霉素的患者[22],未出现HORV的病例。标准剂量的头孢呋辛安全性可靠,只有在大剂量使用后可能会发生前节毒性综合征、黄斑水肿等并发症。我院使用头孢呋辛期间也并未发现并发症患者。由于我院使用头孢呋辛时间较短,后续将继续观察其使用后的并发症情况。
本研究的不足之处在于:由于为回顾性研究,研究对象不是同时间评估的,随着时间的推移和手术技术的改进,可能导致选择偏倚。本研究对低浓度万古霉素在预防白内障术后感染性眼内炎的使用前景进行了初步探索,为头孢呋辛过敏的患者提供一个有效且相对安全的选择。
| [1] |
DURAND M L. Bacterial and fungal endophthalmitis[J]. Clin Microbiol Rev, 2017, 30(3): 597-613. DOI:10.1128/CMR.00113-16 |
| [2] |
CREUZOT-GARCHER C, BENZENINE E, MARIET A S, et al. Incidence of acute postoperative endophthalmitis after cataract surgery[J]. Ophthalmology, 2016, 123(7): 1414-1420. DOI:10.1016/j.ophtha.2016.02.019 |
| [3] |
SÜL S, KARALEZLI A. Development of retinal infarct due to intracameral cefuroxime injection following complicated cataract surgery[J]. Turk J Ophthalmol, 2018, 48(6): 317-319. DOI:10.4274/tjo.61580 |
| [4] |
GALVIS V, TELLO A, SÁNCHEZ M A, et al. Cohort study of intracameral moxifloxacin in postoperative endophthalmitis prophylaxis[J]. Ophthalmol Eye Dis, 2014, 6: 1-4. DOI:10.4137/OED.S13102 |
| [5] |
DUAN F, WU K, LIAO J, et al. Causative microorganisms of infectious endophthalmitis: a 5-year retrospective study[J]. J Ophthalmol, 2016, 2016: 6764192. DOI:10.1155/2016/6764192 |
| [6] |
RÖCK T, BRAMKAMP M, BARTZ-SCHMIDT K U, et al. Using intracameral cefuroxime reduces postoperative endophthalmitis rate: 5 years experience at the University Eye Hospital Tübingen[J]. Klin Monbl Augenheilkd, 2014, 231(10): 1023-1028. DOI:10.1055/s-0034-1383013 |
| [7] |
RUDNISKY C J, WAN D, WEIS E. Antibiotic choice for the prophylaxis of post-cataract extraction endophthalmitis[J]. Ophthalmology, 2014, 121(4): 835-841. DOI:10.1016/j.ophtha.2013.08.046 |
| [8] |
BARREAU G, MOUNIER M, MARIN B, et al. Intracameral cefuroxime injection at the end of cataract surgery to reduce the incidence of endophthalmitis: French study[J]. J Cataract Refract Surg, 2012, 38(8): 1370-1375. DOI:10.1016/j.jcrs.2012.03.024 |
| [9] |
WITKIN A J, CHANG D F, JUMPER J M, et al. Vancomycin-associated hemorrhagic occlusive retinal vasculitis: clinical characteristics of 36 eyes[J]. Ophthalmology, 2017, 124(5): 583-595. DOI:10.1016/j.ophtha.2016.11.042 |
| [10] |
SHARMA S, SAHU S K, DHILLON V, et al. Reevaluating intracameral cefuroxime as a prophylaxis against endophthalmitis after cataract surgery in India[J]. J Cataract Refract Surg, 2015, 41(2): 393-399. DOI:10.1016/j.jcrs.2014.05.038 |
| [11] |
SOLBORG BJERRUM S, PRAUSE J U, FUCHS J, et al. Morphological features in eyes with endophthalmitis after cataract surgery—histopathology and optical coherence tomography assessment[J]. Acta Ophthalmol, 2016, 94(1): 26-30. DOI:10.1111/aos.12858 |
| [12] |
TRANOS P, DERVENIS N, VAKALIS A N, et al. Current perspectives of prophylaxis and management of acute infective endophthalmitis[J]. Adv Ther, 2016, 33(5): 727-746. DOI:10.1007/s12325-016-0307-8 |
| [13] |
DAIEN V, VILLAIN M, CREUZOT-GARCHER C. Comparison of recent studies of postoperative endophthalmitis from the same national database-reply[J]. JAMA Ophthalmol, 2017, 135(2): 174-175. DOI:10.1001/jamaophthalmol.2016.5107 |
| [14] |
CHANG D F, BRAGA-MELE R, HENDERSON B A, et al. Antibiotic prophylaxis of postoperative endophthalmitis after cataract surgery: Results of the 2014 ASCRS member survey[J]. J Cataract Refract Surg, 2015, 41(6): 1300-1305. DOI:10.1016/j.jcrs.2015.01.014 |
| [15] |
VAN DER MERWE J, MUSTAK H, COOK C. Endophthalmitis prophylaxis with intracameral cefuroxime in South Africa[J]. J Cataract Refract Surg, 2012, 38(11): 2054. DOI:10.1016/j.jcrs.2012.09.004 |
| [16] |
YANNUZZI N A, PATEL N A, RELHAN N, et al. Clinical features, antibiotic susceptibilities, and treatment outcomes of endophthalmitis caused by Staphylococcus epidermidis[J]. Ophthalmol Retina, 2018, 2(5): 396-400. DOI:10.1016/j.oret.2017.08.025 |
| [17] |
HARIPRIYA A, CHANG D F. Intracameral antibiotics during cataract surgery: evidence and barriers[J]. Curr Opin Ophthalmol, 2018, 29(1): 33-39. DOI:10.1097/ICU.0000000000000445 |
| [18] |
BOWEN R C, ZHOU A X, BONDALAPATI S, et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis[J]. Br J Ophthalmol, 2018, 102(9): 1268-1276. DOI:10.1136/bjophthalmol-2017-311051 |
| [19] |
AU C P, WHITE A J, HEALEY P R. Efficacy and cost-effectiveness of intracameral vancomycin in reducing postoperative endophthalmitis incidence in Australia[J]. Clin Experiment Ophthalmol, 2016, 44(9): 803-811. DOI:10.1111/ceo.12789 |
| [20] |
TODORICH B, FAIA L J, THANOS A, et al. Vancomycin-associated hemorrhagic occlusive retinal vasculitis: a clinical-pathophysiological analysis[J]. Am J Ophthalmol, 2018, 188: 131-140. DOI:10.1016/j.ajo.2018.01.030 |
| [21] |
NICHOLSON L B, KIM B T, JARDON J, et al. Severe bilateral ischemic retinal vasculitis following cataract surgery[J]. Ophthalmic Surg Lasers Imaging Retina, 2014, 45(4): 338-342. DOI:10.3928/23258160-20140605-01 |
| [22] |
陶栗, 孙敏, 陈春林, 等. 白内障术后万古霉素相关的眼内非感染性炎性反应的回顾研究[J]. 眼科, 2019, 28(2): 90-95. TAO L, SUN M, CHEN C L, et al. A retrospective study of vancomycin-related non-infectious inflammation after cataract surgery[J]. Ophthalmol CHN, 2019, 28(2): 90-95. DOI:10.13281/j.cnki.issn.1004-4469.2019.02.004 |